Betaine·HCl-6EG-nNiCl2·6H2O低共熔离子液体的黏度和电导率
龚凯,华一新,徐存英,李坚,李艳,周忠仁(昆明理工大学冶金与能源工程学院复杂有色金属资源清洁利用国家重点实验室,云南 昆明 650093)
Betaine·HCl-6EG-nNiCl2·6H2O低共熔离子液体的黏度和电导率
龚凯,华一新,徐存英,李坚,李艳,周忠仁
(昆明理工大学冶金与能源工程学院复杂有色金属资源清洁利用国家重点实验室,云南 昆明 650093)
摘要:在常压下303~353 K和303~348 K温度范围分别测定了低共熔溶剂盐酸甜菜碱-乙二醇(Betaine·HCl-6EG)中加入不同浓度NiCl2·6H2O形成的Betaine·HCl-6EG-nNiCl2·6H2O低共熔离子液体的黏度和电导率,研究了温度、NiCl2·6H2O浓度对其黏度、电导率的影响规律。结果表明,在所研究的温度和NiCl2·6H2O浓度范围内低共熔离子液体Betaine·HCl-6EG-nNiCl2·6H2O都具有较低的黏度和良好的导电性。随着温度的升高,黏度减小,电导率增大,温度对黏度的影响更显著;黏度、电导率与温度的关系均可以用Arrhenius经验公式描述,由此计算得到其黏滞活化能和电导活化能。随着NiCl2·6H2O浓度的增加,黏滞活化能和电导活化能均会增大;NiCl2·6H2O的加入使得离子液体形成尺寸较大的络合离子,导电离子的有效浓度降低、离子半径增大,导致其电导率减小、黏度增大。
关键词:盐酸甜菜碱-乙二醇低共熔溶剂;黏度;电导率;六水合氯化镍;离子液体;数值分析
2015-08-07收到初稿,2015-12-14收到修改稿。
联系人:华一新。第一作者:龚凯(1985—),男,博士研究生。
Received date: 2015-08-07.
Foundation item: supported by the National Natural Science Foundation of China (51274108,21263007).
引 言
近年来,离子液体以其独特的物理化学性能,如低的饱和蒸气压、高的电导率、良好的化学热稳定性等,广泛应用于电沉积等领域[1-9]。但目前合成出的离子液体仍存在诸多缺点,如合成制备工艺烦琐、生产成本高、黏度大、生物降解困难等[10],极大地限制了离子液体的实际应用。寻找合成简单、生产成本低廉、性能优良的离子液体成为当前研究的主要热点。Abbott课题组[11-18]制备出一系列由2种或3种组分通过简单机械混合的、通过氢键相互作用缔合形成的低共熔溶剂,并研究了“卤代盐+氢键供体”型低共熔离子液体的组成对其凝固温度、黏度和电导率的影响。Zhang等[19]系统地对低共熔离子液体的合成、性质及应用进行了归纳和总结。卢海君等[20]合成了尿素-甜菜碱盐酸盐低共熔溶剂,并研究了尿素与甜菜碱盐酸盐的配比对该体系熔点、黏度和电导率的影响。龚凯等[21]用乙二醇代替尿素合成了摩尔比为1:6的盐酸甜菜碱-乙二醇低共熔溶剂,对比研究了Ni(Ⅱ)在玻碳电极和碳钢电极上的电化学行为,并在碳钢基体上获得了致密光亮的金属镍镀层。尽管低共熔离子液体有着优于传统离子液体的优点,如对空气和水不敏感、可生物降解等,但关于低共熔离子液体物理化学性能(如密度、黏度和电导率等)的基础数据仍显匮乏,而黏度和电导率是考量溶液增溶性和化学变化的重要参数[22-23],因而对低共熔离子液体黏度和电导率的研究对于学术探讨和工业应用有着至关重要的意义。就目前所查阅的文献资料来看,对低共熔离子液体性质的研究多以氯化胆碱基低共熔离子液体为主[12,15-17,19],而关于盐酸甜菜碱-乙二醇低共熔离子液体性质方面的研究尚未见报道。
本文在文献[21-22]的基础上,以摩尔比为1:6的盐酸甜菜碱-乙二醇低共熔溶剂(Betaine·HCl-6EG IL)为基质,在常压下303~353 K和303~348 K温度范围分别测定了溶解有不同浓度六水合氯化镍(NiCl2·6H2O)的Betaine·HCl-6EG- nNiCl2·6H2O低共熔离子液体的黏度和电导率,并研究了温度、NiCl2·6H2O浓度对该离子液体黏度和电导率的影响规律,为Betaine·HCl-6EG-nNiCl2·6H2O低共熔离子液体性质的研究和工业应用提供基础数据。
1 实验部分
1.1材料与仪器
盐酸甜菜碱(Betaine·HCl,≥98%,杭州万景新材料有限公司);乙二醇(EG,≥98%,四川西陇化工有限公司);六水合氯化镍(NiCl2·6H2O,≥ 98%,国药集团化学试剂有限公司);无水乙醇(C2H6O,≥98%,天津风船化学试剂科技有限公司);溴化钾(KBr,光谱纯,德国Merck公司);氯化钾(KCl,≥98%,国药集团化学试剂有限公司)。实验用水为台湾艾柯公司Exceed-Bd-08型超纯水机制备的超纯水,电阻为16 MΩ。
真空干燥箱,DZF-6090型,上海精宏实验设备有限公司;电子微量天平(精度为0.1 mg),FA1004N 型,上海精密科学仪器有限公司;磁力加热搅拌器,RET型,广州仪科实验室技术有限公司。
1.2分析测试仪器
雷磁电导率仪,DDSJ-308A型,上海精密科学仪器有限公司;数字旋转黏度计,SNB-2型,上海地学仪器研究所;0#旋转黏度计转子[需搭配超低黏度适配器(ULA)使用]和6系列-1#旋转黏度计转子,上海地学仪器研究所。
1.3低共熔离子液体的制备
乙二醇具有较强的吸水性,使用前需进行真空干燥处理。结合文献[24-25],参照专利[26-28],对盐酸甜菜碱进行纯化,纯化后的盐酸甜菜碱置于358 K真空干燥箱里干燥24 h备用。
取一定量的盐酸甜菜碱和乙二醇,控制它们的摩尔比为1:6,将其加入平底烧瓶中均匀混合,在358 K下用恒温油浴加热,在回流装置中搅拌至盐酸甜菜碱完全溶解,即得到透明的淡黄色Betaine·HCl-6EG低共熔溶剂,置于353 K真空干燥箱里保存。
分别量取一定质量干燥好的Betaine·HCl-6EG低共熔溶剂,各加入适量的六水合氯化镍,353 K恒温油浴加热搅拌至镍盐完全溶解,即得到绿色透明的Betaine·HCl-6EG-nNiCl2·6H2O低共熔离子液体。其中,n值可由式(1)求得
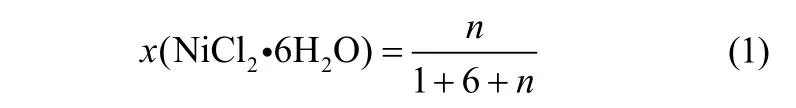
式中,n为Betaine·HCl-6EG-nNiCl2·6H2O低共熔离子液体中Betaine·HCl与EG的摩尔比为1:6时对应的NiCl2·6H2O的量,mol;x(NiCl2·6H2O) 为BetaineHCl-6EG-nNiCl2·6H2O低共熔离子液体中NiCl2·6H2O的摩尔分数。
1.4黏度、电导率的测定
用黏度计和电导率仪分别测量Betaine·HCl-6EG-nNiCl2·6H2O低共熔离子液体常压下303~353 K和303~348 K温度范围内的黏度和电导率。
具体操作为:黏度低于15 mPa·s时选用0#转子,黏度高于15 mPa·s时选用1#转子。采用自动测量方式,在油浴控温条件下采用降温方式测定黏度,测试前用浓度为1 mol·L-1的KCl溶液进行校正。选用DJS-10C型铂黑电极,电极常数为9.107,温度补偿系数为0.02,在油浴控温条件下采用降温方式测定电导率,测试前用浓度为0.1 mol·L-1的KCl溶液进行校正。
2 实验结果与讨论
2.1离子液体的黏度
实验测定了常压下303~353 K温度范围内不同n值条件下的Betaine·HCl-6EG-nNiCl2·6H2O低共熔离子液体的黏度(η),其结果见表1。表1实验数据表明,Betaine·HCl-6EG-nNiCl2·6H2O低共熔离子液体的黏度与温度、x(NiCl2·6H2O)均有十分密切的关系。
2.1.1温度的影响由表1可以看出,各n值下的Betaine·HCl-6EG-nNiCl2·6H2O低共熔离子液体的黏度均随温度升高而急剧减小。这是因为,流体的黏度是由流体间的内摩擦产生的,形式上表现为流体流动时的阻力,主要由其中的氢键和范德华力决定[29]。升高温度,导电离子的运动加快,其动能相应增加,异号导电离子间的作用力削弱,离子运动的阻力减小,黏度随之减小。
为了研究Betaine·HCl-6EG-nNiCl2·6H2O低共熔离子液体的黏度随温度变化的规律,对表1中黏度(η)的实验数据取自然对数,以lnη对1/T作图,其结果如图1所示。
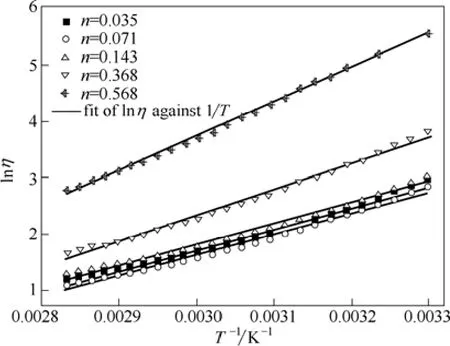
图1 Betaine·HCl-6EG-nNiCl2·6H2O低共熔离子液体黏度的自然对数与温度倒数的关系Fig. 1 Plots of lnη vs 1/T for Betaine·HCl-6EG-nNiCl2·6H2O deep eutectic ionic liquid
对图1中的实验数据拟合分析发现,lnη与1/T表现为线性相关(r[a]=0.981~0.998)[30],黏度与温度之间的关系可用Arrhenius经验公式[15]描述
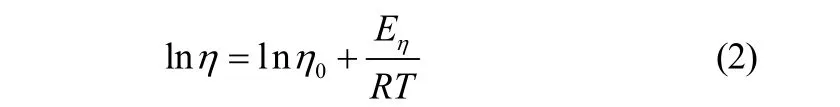
式中,η0为常数,mPa·s;Eη为黏滞活化能[15],kJ·mol-1;R为气体常数,8.3145 J·mol-1·K-1;T为温度,K。
结合式(2),得到如表2所示的拟合系数。当x(NiCl2·6H2O)=0.010,即n=0.071时,对应的最小黏滞活化能为29.83 kJ·mol-1。
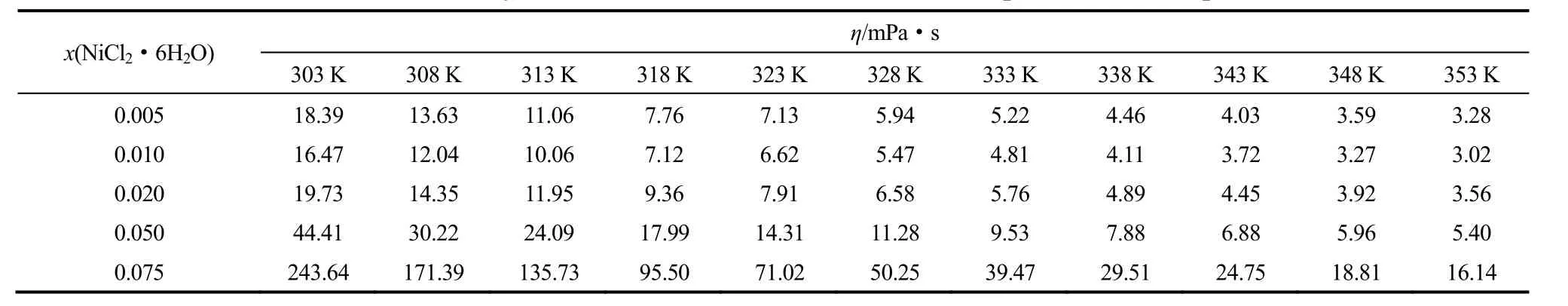
表1 Betaine·HCl-6EG-nNiCl2·6H2O低共熔离子液体的黏度Table 1 Viscosity of Betaine·HCl-6EG-nNiCl2·6H2O deep eutectic ionic liquid
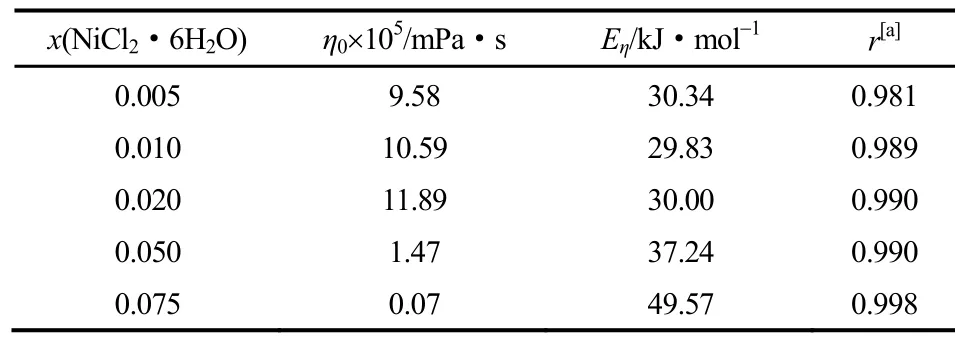
表2 对图1中实验数据进行拟合得到的相关参数Table 2 Corresponding parameters obtained from Fig. 1
2.1.2x(NiCl2·6H2O)的影响从表1还可以看出,Betaine·HCl-6EG-nNiCl2·6H2O低共熔离子液体的黏度除了受温度影响外,受x(NiCl2·6H2O)的影响也是非常明显的。如在303 K,n=0.035时,Betaine·HCl-6EG-nNiCl2·6H2O低共熔离子液体的黏度为18.39 mPa·s;而在303 K,n=0.568时,Betaine·HCl-6EG-nNiCl2·6H2O低共熔离子液体的黏度则为243.64 mPa·s。由表1实验数据可以得到Betaine·HCl-6EG-nNiCl2·6H2O低共熔离子液体的黏度与x(NiCl2·6H2O)的关系,其结果如图2所示。
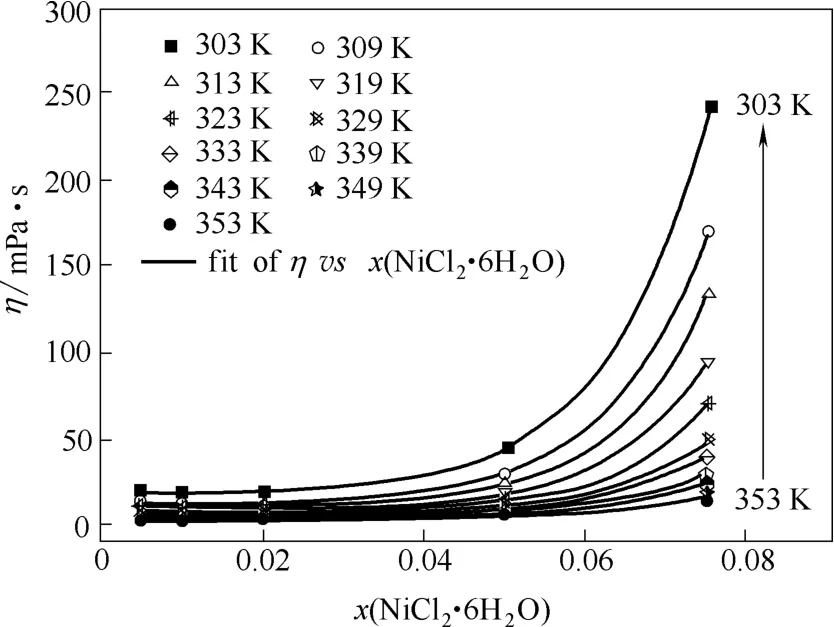
图2 Betaine·HCl-6EG-nNiCl2·6H2O离子液体的黏度随x(NiCl2·6H2O)的变化Fig.2 Effect of x(NiCl2·6H2O) on viscosity of Betaine·HCl-6EG-nNiCl2·6H2O deep eutectic ionic liquid
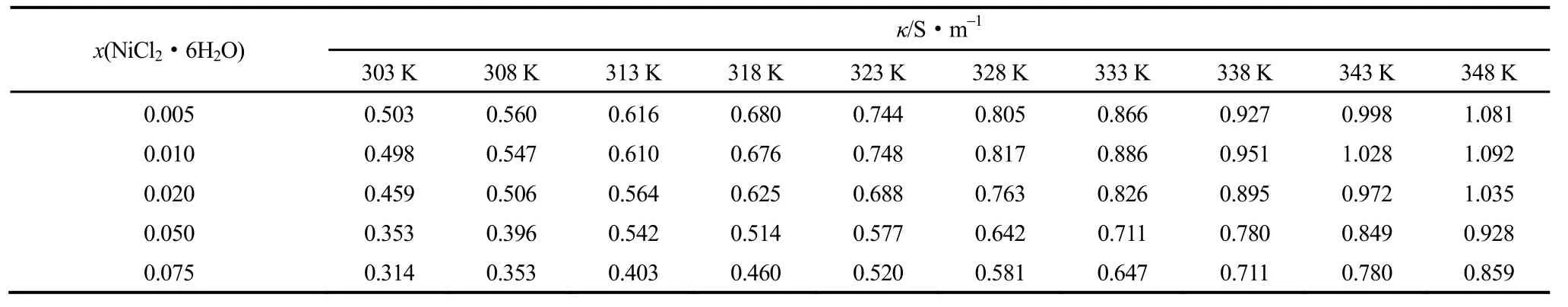
表3 Betaine·HCl-6EG-nNiCl2·6H2O低共熔离子液体的电导率Table 3 Electrical conductivity of Betaine·HCl-6EG-nNiCl2·6H2O deep eutectic ionic liquid
结合表1和图2可知,当x(NiCl2·6H2O)≤ x(NiCl2·6H2O)增加在各温度下变化幅度不大(从353 K的0.26~0.54 mPa·s到303 K的1.92~3.26 mPa·s),这是由于随NiCl2·6H2O的加入,离子间作用力的大小并未因氢键的受体Cl-部分被离子液体中由于缔合效应形成的体积较大的Ni(Ⅱ)的络合阴离子取代而发生明显变化。当x(NiCl2·6H2O) >0.020,即n>0.143时,Betaine·HCl-6EG-nNiCl2·6H2O低共熔离子液体的黏度均随x(NiCl2·6H2O)增加在各温度下显著增加(从353 K 的10.74 mPa·s到303 K的199.23 mPa·s),这是因为随着NiCl2·6H2O浓度的继续增加,离子间的作用力因氢键的受体Cl-基本被离子液体中由于缔合效应形成的体积更大的Ni(Ⅱ)的络合阴离子取代而显著增大,离子的运动变得愈发困难,导致离子液体的黏度急剧增大。
黏滞活化能(Eη)的大小可以用来衡量流体流动性的好坏[31],而流体流动性的好坏表现为流体黏度(η)的大小。黏滞活化能越大,流体的流动性越差,流体的黏度越大。将表2中的η0和Eη值分别对x(NiCl2·6H2O)作图,其结果如图3所示。
从式(2)的表达形式可以发现,η0为指前因子,η随Eη按指数规律呈正增大趋势,η0和Eη的综合效应影响η值的大小。结合表2和图3可知,当x(NiCl2·6H2O)≤0.020,即n≤0.143时,随着x(NiCl2·6H2O)的增加,Eη的数值变化幅度很小(变化幅度小于1 kJ·mol-1),η0的数值增加幅度不大(增加幅度在1×10-5mPa·s左右),η0和Eη的共同作用使得η值变化不明显。当x(NiCl2·6H2O)>0.020,即n>0.143时,随着x(NiCl2·6H2O)的继续增加,Eη与η0的变化趋势相反,Eη的数值显著增大(增加幅度为7.24~12.33 kJ·mol-1),η0的数值急剧减小(由1.189×10-5mPa·s减小为7×10-7mPa·s),η00.020,即n≤0.143时,Betaine·HCl-6EG-nNiCl2·6H2O低共熔离子液体的黏度随和Eη的共同作用使得η值明显增大。
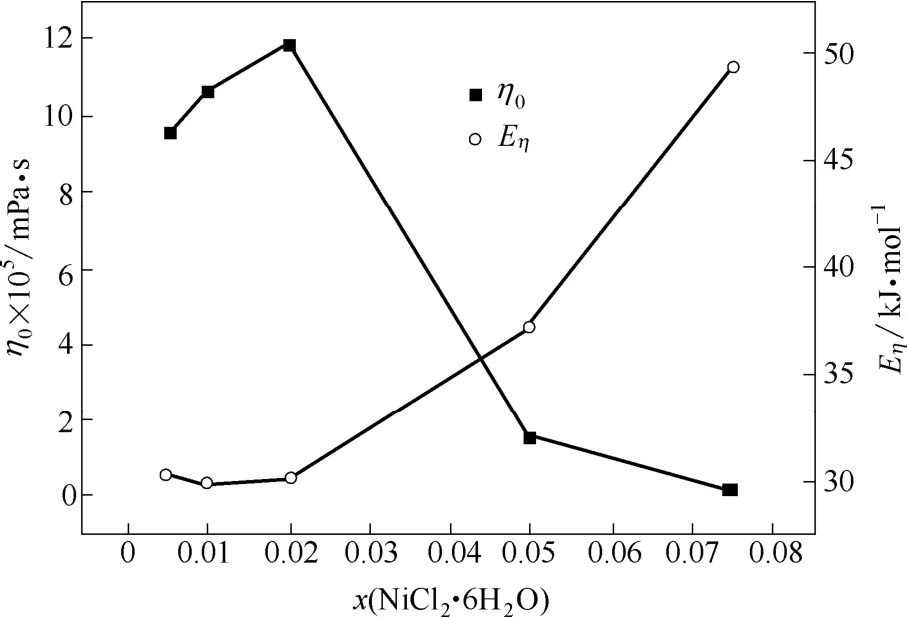
图3 η0和Eη随x(NiCl2·6H2O)的变化Fig.3 Effect of x(NiCl2·6H2O) on values of η0and Eη
2.2离子液体的电导率
实验测定了常压下303~348 K温度范围内不同n值条件下的Betaine·HCl-6EG-nNiCl2·6H2O低共熔离子液体的电导率(κ),其结果见表3。表3实验数据表明,Betaine·HCl-6EG-nNiCl2·6H2O低共熔离子液体的电导率与温度、x(NiCl2·6H2O)均有十分密切的关系。
2.2.1温度的影响由表3可以看出,各n值下的Betaine·HCl-6EG-nNiCl2·6H2O低共熔离子液体的电导率均随温度升高而增大。这是因为,升高温度,Betaine·HCl-6EG-nNiCl2·6H2O低共熔离子液体的黏度降低,使得带电离子运动的阻力减小,带电离子的迁移速度加快,离子液体的电导率随之增大。
为了研究Betaine·HCl-6EG-nNiCl2·6H2O低共熔离子液体的电导率随温度变化的规律,对表3中的电导率(κ)实验数据取自然对数,以lnκ对1/T作图,其结果如图4所示。
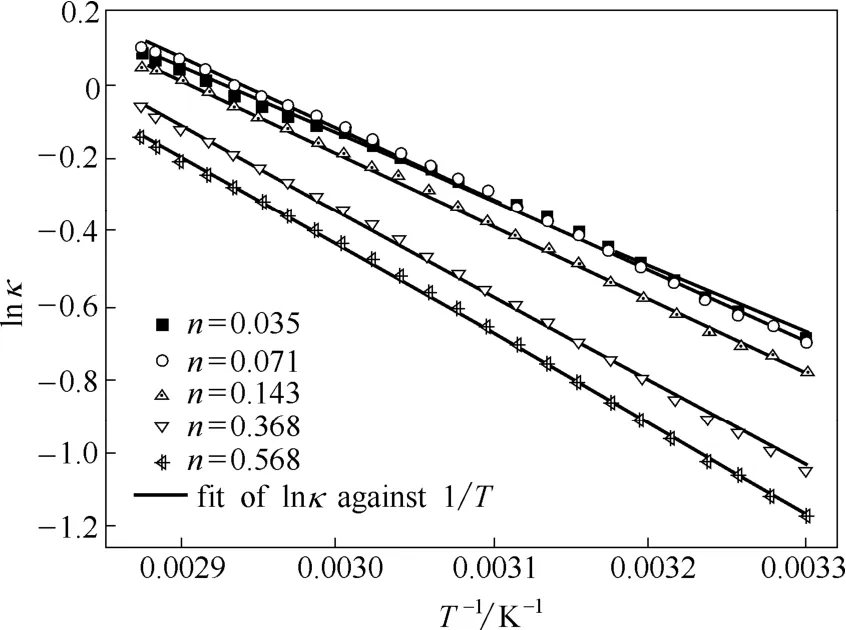
图4 Betaine·HCl-6EG-nNiCl2·6H2O低共熔离子液体电导率的自然对数与温度倒数的关系Fig. 4 Plots of lnκ vs 1/T for Betaine·HCl-6EG-nNiCl2·6H2O deep eutectic ionic liquid
对图4中的实验数据进行拟合分析发现,lnκ 与1/T表现出良好的线性相关性(r[b]=0.998~0.999),电导率与温度的关系可以用Arrhenius经验式[13]描述
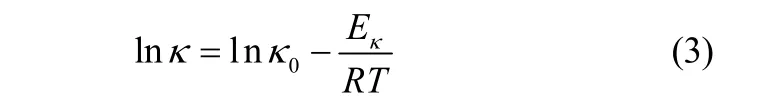
式中,κ0为常数,S·m-1;Eκ为电导活化能[13],kJ·mol-1。
结合式(3),计算得到的拟合参数见表4。
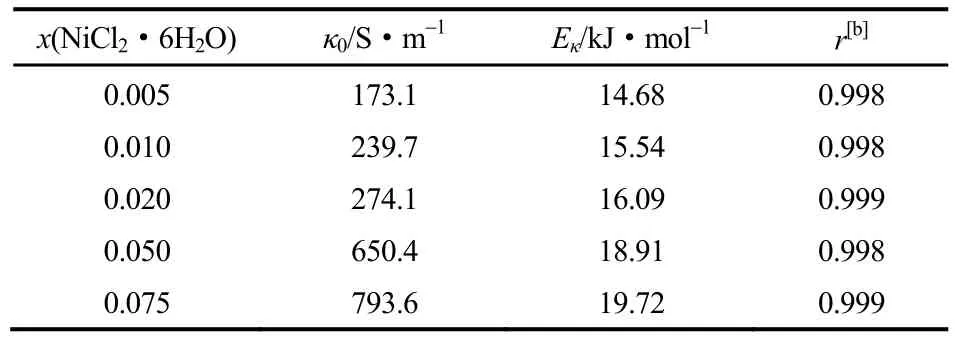
表4 对图4中实验数据进行拟合得到的相关参数Table 4 Corresponding parameters obtained from Fig. 4
2.2.2x(NiCl2·6H2O)的影响从表3还可以看出,Betaine·HCl-6EG-nNiCl2·6H2O低共熔离子液体的电导率除了受温度影响外,还受x(NiCl2·6H2O)的影响。如在303 K,x(NiCl2·6H2O)=0.005,即n=0.035时,Betaine·HCl- 6EG-nNiCl2·6H2O低共熔离子液体的电导率为0.503 S·m-1;而在303 K,x(NiCl2·6H2O)=0.075,即n=0.568时,Betaine·HCl-6EG-nNiCl2·6H2O低共熔离子液体的电导率则为0.314 S·m-1。由表3实验数据可以得到Betaine·HCl-6EG- nNiCl2·6H2O低共熔离子液体的电导率与x(NiCl2·6H2O)的关系,其结果如图5所示。
结合表3和图5可知,温度较低(T<323 K)时,Betaine·HCl-6EG-nNiCl2·6H2O离子液体在各温度下的电导率均随x(NiCl2·6H2O)增加而减小。温度较高(T≥323 K),x(NiCl2·6H2O)=0.010,即n=0.071时,离子液体Betaine·HCl-6EG-nNiCl2·6H2O在各温度下的电导率值均最大(见表3)。当x(NiCl2·6H2O)>0.010,即n>0.071时,随着x(NiCl2·6H2O)的继续增加,Betaine·HCl-6EG-nNiCl2·6H2O低共熔离子液体在各温度下的电导率均逐渐减小。这是因为,离子液体电导率的大小不仅与导电离子的有效浓度和离子的半径有关,也与其流动性有关[1]。温度较低(T<323 K)时,Betaine·HCl-6EG-nNiCl2·6H2O低共熔离子液体中离子的迁移速率较为缓慢;当x(NiCl2·6H2O)<0.020,即n<0.143时,Betaine·HCl-6EG-nNiCl2·6H2O低共熔离子液体的黏度在各温度下均逐渐减小;同时,NiCl2·6H2O的加入使得离子液体形成体积更大的络合离子,导致Betaine·HCl-6EG-nNiCl2·6H2O低共熔离子液体中导电离子的有效浓度降低、离子半径增大,黏度的减小使电导率增加的程度小于因导电离子有效浓度降低、离子半径增大而引起的电导率减小的程度,因而电导率随之减小。当x(NiCl2·6H2O)=0.010,即n=0.071时,Betaine·HCl-6EG-nNiCl2·6H2O低共熔离子液体在各温度下的黏度值均最小,在温度较高(T≥323 K)的区域离子的迁移速率较快,黏度的减小使电导率增加的程度大于因导电离子有效浓度降低、离子半径增大而引起的电导率减小的程度,因而电导率随之增大。随着x(NiCl2·6H2O)的继续增加,Betaine·HCl-6EG-nNiCl2·6H2O低共熔离子液体的黏度急剧增大(图2),而且离子液体因缔合效应形成体积更大的配合离子而使得导电离子有效浓度持续降低、离子半径持续增大,黏度、导电离子有效浓度和离子半径的变化使得Betaine·HCl-6EG-nNiCl2·6H2O低共熔离子液体在各温度下的电导率均逐渐减小。
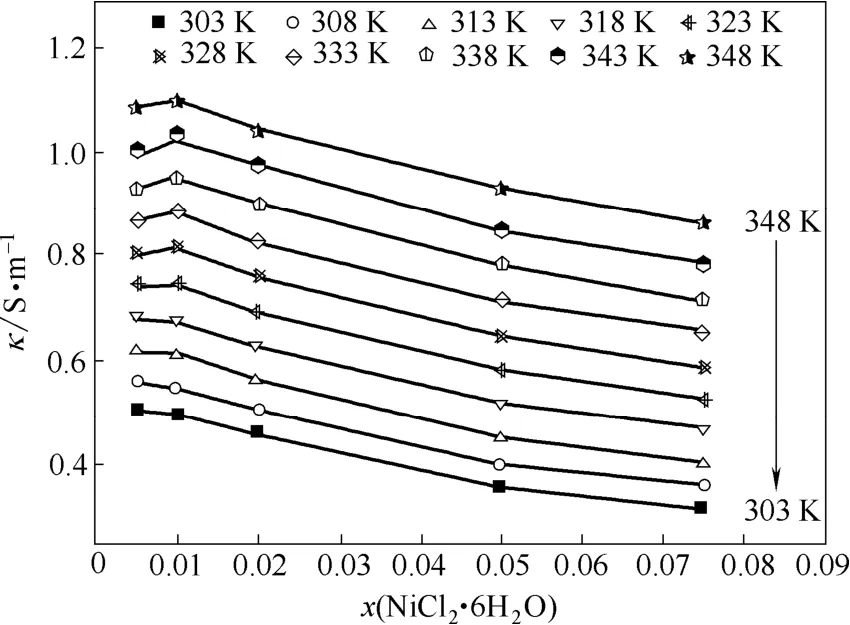
图5 Betaine·HCl-6EG-nNiCl2·6H2O低共熔离子液体的电导率随x(NiCl2·6H2O)的变化Fig. 5 Effect of x(NiCl2·6H2O) on electrical conductivity of Betaine·HCl-6EG-nNiCl2·6H2O deep eutectic ionic liquid
将表4中的κ0和Eκ值分别对x(NiCl2·6H2O)作图,其结果如图6所示。
从式(3)的表达形式可以发现,κ0为指前因子,κ随Eκ按指数规律呈负增大趋势,κ0和Eκ的综合效应影响κ值的大小。结合表4和图6可知,随着x(NiCl2·6H2O)的增加,κ0和Eκ值均增大,Eκ值由14.68 kJ·mol-1增加为19.72 kJ·mol-1,κ0值由173.1 S·m-1增加为793.6 S·m-1,κ0和Eκ的综合作用,使得κ值减小。
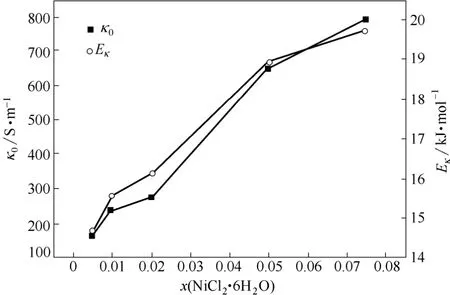
图6 κ0和Eκ随x(NiCl2·6H2O)的变化Fig. 6 Effect of x(NiCl2·6H2O) on values of κ0and Eκ
2.3黏度与电导率的关系
从微观来看,黏度是由于分子运动和分子间相互作用力产生的,而溶液的导电性是在外电场作用下溶液中导电离子的定向迁移产生的,因而黏度与电导率有密切的关系。分析图2和图5发现,随着x(NiCl2·6H2O)数值的增加,Betaine·HCl-6EG-nNiCl2·6H2O低共熔离子液体的电导率逐渐减小,黏度逐渐增大。
溶液的电导率是其带电电荷及淌度的度量,故电导率可表示为[31]
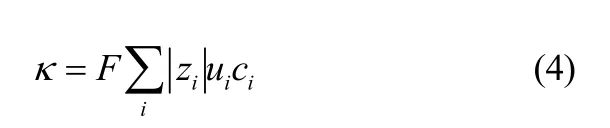
式中,κ为电导率,S·m-1;F为法拉第常数,96485 C·mol-1;|zi|为带电体所带电荷数;ci为带电体物质的量浓度,mol·m-3;ui为带电体淌度,m2·s-1·V-1。
淌度可由式(5)计算[31]
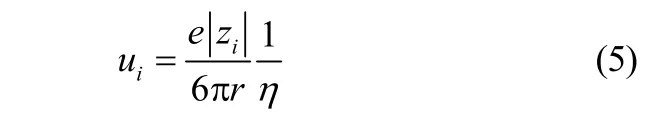
式中,η为黏度,mPa·s;r为带电体半径,m;e为电子电量,1.6022×10-19C;π为圆周率。
由式(4)和式(5)可知,电导率与带电体物质的量浓度及淌度呈正比,而淌度与带电体半径及黏度呈反比。
将式(4)和式(5)整理得
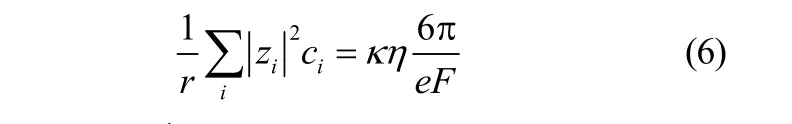
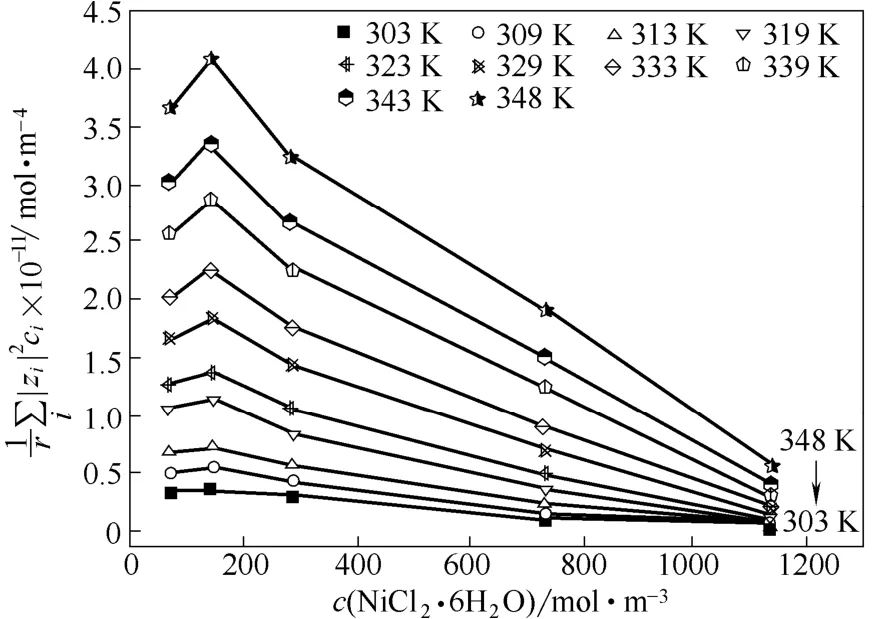
图7 Betaine·HCl-6EG-nNiCl2·6H2O低共熔离子液体的电导率与黏度的关系随温度和NiCl2·6H2O浓度的变化Fig. 7 Relationship between electrical conductivity and viscosity as functions of temperature and NiCl2·6H2O concentration in Betaine·HCl-6EG-nNiCl2·6H2O deep eutectic ionic liquid
3 结 论
(1)Betaine·HCl-6EG低共熔溶剂能够溶解NiCl2·6H2O形成Betaine·HCl-6EG-nNiCl2·6H2O低共熔离子液体,在303~353 K和n=0~0.568的范围内Betaine·HCl-6EG-nNiCl2·6H2O低共熔离子液体均为液态,而且都具有较低的黏度和较好的导电性,其黏度值为3.28~243.64 mPa·s,电导率值为0.314~1.092 S·m-1,这些指标能够满足该离子液体作为电解质电沉积镍的要求。
(2)随着温度的升高,Betaine·HCl-6EG-nNiCl2·6H2O低共熔离子液体的电导率增大,黏度减小;黏度、电导率与温度的关系均可以用Arrhenius经验公式描述,该离子液体的黏滞活化能为29.83~49.57 kJ·mol-1,电导活化能为14.68~19.72 kJ·mol-1,温度对黏度的影响比电导率更为显著。随着Betaine·HCl-6EG-nNiCl2·6H2O低共熔离子液体中NiCl2·6H2O浓度的增加,黏滞活化能和电导活化能均增大,致使离子液体的电导率减小、黏度增大。
(3)随着Betaine·HCl-6EG-nNiCl2·6H2O低共熔离子液体中NiCl2·6H2O浓度的增加,离子液体的数值减小,表明NiCl2·6H2O的加入会使离子液体形成尺寸较大的络合离子,使导电离子的有效浓度降低、离子半径增大,从而使离子液体的黏度增大、电导率减小。
References
[1] 邓友全. 离子液体——性质、制备与应用[M]. 北京: 中国石化出版社,2006: 384-388. DENG Y Q. Ionic Liquid—Property,Preparation and Application[M]. Beijing: China Sinopec Press,2006: 384-388.
[2] 李汝雄. 绿色溶剂——离子液体的合成及应用[M]. 北京: 化学工业出版社,2004: 255-269. LI R X. Green Solvent—Synthesis and Application of Ionic Liquid[M]. Beijing: Chemical Industry Press,2004: 255-269.
[3] ENDRES F,MACFARLANE D,ABBOTT A. Electrodeposition from ionic liquids [J]. Phys. Chem. Chem. Phys.,2008,15(4): 182.
[4] ZHU Y L,KATAYAMA Y,MIURA T,et al. Electrochemical preparation of nickel and iron nanoparticles in a hydrophobic ionic liquid [J]. Electrochemical and Solid-state Letters,2011,14(12): 110-115.
[5] GOU S P,SUN I W. Electrodeposition behavior of nickel and nickel-zinc alloys from the zinc chloride-1-ethyl-3-methylimidazolium chloride low temperature molten salt [J]. Electrochimica Acta,2008,53(5): 2538-2544.
[6] SRIVASTAVA M,YOGANANDAN G,GRIPS V K W. Electrodeposition of Ni and Co coatings from ionic liquid [J]. Surface Engineering,2012,28(6): 424-429.
[7] ZHANG Q B,HUA Y X. Electrodeposition behavior of nickel from a low temperature urea-molten salt [J]. Chinese Journal of ChemicalEngineering,2013,21(12): 1397-1403. DOI: 10.1016/S1004-9541(13)60641-2.
[8] DENG M J,SUN I W,CHEN P Y,et al. Electrodeposition behavior of nickel in the water- and air-stable 1-ethyl-3-methylimidazolium dicyanamide room temperature ionic liquid [J]. Electrochimica Acta,2008,53(19): 5812-5818.
[9] ZEIN EI ABEDIN S,ENDRES F. Electrodeposition of metals and semiconductors in air- and water-stable ionic liquids [J]. ChemPhysChem,2006,7(1): 58-61.
[10] WELLS A S,COOMBE V T. On the freshwater ecotoxicity and biodegradation properties of some common ionic liquids [J]. Organic Process Research & Development,2006,10(4): 794-798.
[11] ABBOTT A P,CAPPER G,DAVIES D L,et al. Preparation of novel,moisture-stable,Lewis-acidic ionic liquids containing quaternary ammonium salts with functional side chains [J]. Chemical Communications,2001,(19): 2010-2011.
[12] ABBOTT A P,CAPPER G,DAVIES D L,et al. Novel solvent properties of choline chloride/urea mixtures [J]. Chemical Communications,2003,(1): 70-71.
[13] ABBOTT A P,GLEN C,DAVIES D L,et al. Ionic liquid analogues formed from hydrated metal salts [J]. Chemistry,2004,10(15): 3769-3774.
[14] ABBOTT A P,GLEN C,DAVIES D L,et al. Ionic liquids based upon metal halide/substituted quaternary ammonium salt mixtures [J]. Inorganic Chemistry,2004,43(11): 3447-3452.
[15] ABBOTT A P,DAVID B,GLEN C,et al. Deep eutectic solvents formed between choline chloride and carboxylic acids: versatile alternatives to ionic liquids [J]. Journal of the American Chemical Society,2004,126(29): 9142-9147.
[16] ABBOTT A P,GLEN C,DAVIES D L,et al. Selective extraction of metals from mixed oxide matrixes using choline-based ionic liquids [J]. Inorganic Chemistry,2005,44(19): 6497-6499.
[17] ABBOTT A P,BARRON J C,RYDER K S,et al. Eutectic-based ionic liquids with metal-containing anions and cations [J]. Chemistry—A European Journal,2007,13(22): 6495-6501.
[18] ABBOTT A P,TTAIB K E,RYDER K S,et al. Electrodeposition of nickel using eutectic based ionic liquids [J]. Transactions of the Institute of Metal Finishing,2008,86(4): 234-240(7).
[19] ZHANG Q H,DE OLIVEIRA VIGIER K,ROYER S,et al. Deep eutectic solvents: syntheses,properties and applications [J]. Chemical Society Reviews,2012,41(21): 7108-7146.
[20] 卢海君,华一新,李艳,等. 以甜菜碱盐酸盐和尿素合成低共熔溶剂的研究 [J]. 昆明理工大学学报(理工版),2010,35(6): 11-14. DOI: 10.3969/j.issn.1007-855x.2010.06.003. LU H J,HUA Y X,LI Y,et al. Study of deep eutectic solvents based betaine hydrochloride and urea [J]. Journal of Kunming University of Science & Technology,2010,35(6): 11-14. DOI: 10.3969/j.issn. 1007-855x.2010.06.003.
[21] 龚凯,华一新,徐存英,等. 光亮镍在甜菜碱盐酸盐-乙二醇离子液体中的电沉积行为 [J]. 中国有色金属学报(英文版),2015,25(7): 2458-2465. DOI: 10.1016/S1003-6326(15)63862-6. GONG K,HUA Y X,XU C Y,et al. Electrodeposition behavior of bright nickel in air and water-stable betaine·HCl-ethylene glycol ionic liquid [J]. Transactions of Nonferrous Metals Society of China,2015,25(7): 2458-2465. DOI: 10.1016/S1003-6326(15)63862-6.
[22] CHEREMISINOFF N P. Industrial Solvents Handbook [M]. 2nd ed. New York : Marcel Dekker,Inc.,2003.
[23] RIDDICK J A,BUNGER W B,SAKANO T K,et al. Organic Solvents: Physical Properties and Methods of Purification[M]. 4th ed. New York: John Wiley & Sons,1985: 149-175.
[24] 王建辉. 甜菜碱的合成及产品提纯的新方法 [J]. 河北化工,2006,(2): 22-23. WANG J H. The synthesis of betaine and a new method of purification [J]. Hebei Chemical,2006,(2): 22-23.
[25] 阿不都拉江·那斯尔,王倩,宋明秀,等. 甜菜碱盐酸盐的合成方法研究 [J]. 化学试剂,2013,35(11): 983-986. NASI’ER A,WANG Q,SONG M X,et al. Synthesis of betaine hydrochloride [J]. Chemical Reagents,2013,35(11): 983-986.
[26] 陈林世. 甜菜碱盐酸盐的环保制备方法: 101863785A[P]. 2010-10-20. CHEN L S. Environmental-protection synthesis method of betaine hydrochloride: 101863785A[P]. 2010-10-20.
[27] 陈林世. 一种甜菜碱盐酸盐的制备方法: 102807499A[P]. 2012-12-05. CHEN L S. A preparation method of betaine hydrochloride: 102807499A[P]. 2012-12-05.
[28] 赵景瑞,冯维春,胡波,等. 一种甜菜碱盐酸盐的纯化方法: 103804210A[P]. 2014-05-21. ZHAO J R,FENG W C,HU B,et al. A purification method of betaine hydrochloride: 103804210A[P]. 2014-05-21.
[29] BONHÔTE P,DIAS A P,ARMAND M,et al. Hydrophobic,highly conductive ambient-temperature molten salts [J]. Inorganic Chemistry,1998,37(1): 1168-1178.
[30] 王晶,金轶锋. 用相关系数r判断线性拟合质量的探讨 [J]. 中国科技博览,2010,(4): 95-96. WANG J,JIN Y F. A discussion of linear fitting quality by correlation coefficient [J]. China Science and Technology Review,2010,(4): 95-96.
[31] 高颖,邬冰. 电化学基础[M]. 北京: 化学工业出版社,2004. GAO Y,WU B. Fundamentals of Electrochemistry[M]. Beijing: Chemical Industry Press,2004.
Viscosity and electrical conductivity of Betaine·HCl-6EG-nNiCl2·6H2O deep eutectic ionic liquids
GONG Kai,HUA Yixin,XU Cunying,LI Jian,LI Yan,ZHOU Zhongren
(State Key Laboratory of Complex Nonferrous Metal Resources Clean Utilization,Faculty of Metallurgical and Energy Engineering,Kunming University of Science and Technology,Kunming 650093,Yunnan,China)
Abstract:The viscosity and electrical conductivity of Betaine·HCl-6EG-nNiCl2·6H2O deep eutectic ionic liquids,formed by adding nickel(Ⅱ) chloride hexahydrate (NiCl2·6H2O) into a deep eutectic solvent (DES) composed of Betaine hydrochloride (Betaine·HCl) and Ethylene glycol (EG) in 1:6 molar ratio,were reported at 303—353 K and 303—348 K with an interval of 5 K under atmospheric pressure. The viscosity and electrical conductivity associated with temperature and NiCl2·6H2O concentration were investigated,respectively. The results revealed that within the selected temperature and NiCl2·6H2O concentration ranges,Betaine·HCl-6EG-nNiCl2·6H2O deep eutectic ionic liquids showed low viscosities and good electrical conductivities. With increasing temperature,the viscosities decreased and electrical conductivities increased. The effect of temperature was more significant on viscosity than on electrical conductivity. The dependence of temperature of viscosity and electrical conductivity was found to be greatly described by Arrhenius empirical expressions. According to these expressions,the activation energies for viscous flow and conduction were calculated. With increasing NiCl2·6H2O concentration,the values of the activation energies for viscous flow and conduction increased. Because of the addingNiCl2·6H2O,the formations of the larger size complex ions reduced the concentrations of the effective conductive ions and increased the ionic radius,resulting in increasing viscosity and decreasing electrical conductivity.
Key words:Betaine·HCl-6EG DES; viscosity; electrical conductivity; nickel(Ⅱ) chloride hexahydrate; ionic liquids; numerical analysis
DOI:10.11949/j.issn.0438-1157.20151264
中图分类号:O 0645;TQ 013.1
文献标志码:A
文章编号:0438—1157(2016)04—1090—08
基金项目:国家自然科学基金项目(51274108,21263007)。
Corresponding author:Prof. HUA Yixin,huakust@163.com

