甘蔗生长素结合蛋白ScABP4基因的克隆与表达
邓宇晴,翟玉山,彭 磊,董 萌,徐 倩,程光远,林彦铨,徐景升
(福建农林大学/农业部福建甘蔗生物学与遗传改良重点实验室, 福州 350002)
甘蔗生长素结合蛋白ScABP4基因的克隆与表达
邓宇晴,翟玉山,彭磊,董萌,徐倩,程光远,林彦铨,徐景升*
(福建农林大学/农业部福建甘蔗生物学与遗传改良重点实验室, 福州 350002)
摘要:生长素结合蛋白(auxin binding protein, ABP)在生长素信号转导、植物生长发育调控等方面发挥重要作用。该研究利用RT-PCR方法从甘蔗品种Badila中克隆得到了1个ABP基因,序列分析显示该基因的开放读码框(ORF)长度为615 bp,编码204个氨基酸。多序列比对和系统进化树分析表明它与高粱(Sorghum bicolor)和玉米(Zea mays)的ABP4蛋白的亲缘关系最近,因此将该基因命名为ScABP4。将其构建到原核表达载体pGEX-6P-1中,成功表达出一个分子量约为22.5 kD的蛋白。亚细胞定位结果显示ScABP4主要定位于细胞质网状结构和细胞膜;生物信息学分析显示ScABP4是一个带有信号肽的分泌蛋白,说明ScABP4蛋白可能储存在内质网中并在质膜上执行其生物学功能。荧光定量PCR分析结果表明,ScABP4基因在甘蔗的芽、根、茎、叶中均有表达,其中在芽中相对表达量最高。生长素和黑暗处理下ScABP4基因的表达上调,说明ScABP4基因可能参与甘蔗对生长素的响应及与光信号通路的互作。此外,ABA、JA、SA、CuCl2胁迫能够诱导ScABP4基因的表达,CdCl2胁迫可抑制ScABP4的表达。由此推测,ScABP4基因可能参与甘蔗对病害、干旱、渗透、重金属等胁迫的应答过程。该研究结果为探讨甘蔗生长素结合蛋白基因的功能提供了实验证据。
关键词:甘蔗;生长素结合蛋白;同源克隆;表达分析
生长素(auxin)是植物调控生长发育和逆境响应最重要的激素之一,参与植物整个周期的生命活动,如胚形成、细胞分裂和伸长、维管束分化、侧根分化、向地性、向光性等。生长素可以直接作用于细胞膜或细胞内组分,也可以间接参与基因的表达调控。研究生长素的作用机制,阐明生长素在细胞及分子水平的信号转导机制对于了解植物生长发育的调控、信息传递以及环境胁迫应答机制具有重要意义。
生长素的信号转导是其调控植物生长发育的关键环节,其中第一步是与受体结合。目前已知主要有3类生长素受体:其中2类是位于细胞内的泛素化复合体(SCFTIR1/AFB和SCFSKP2A),1类是位于质膜上的生长素结合蛋白(auxin-binding protein1, ABP1)[1]。这3类受体各自介导了1个信号通路,目前研究得较清楚的是由SCFTIR1/AFB介导的信号途径:当生长素浓度较低时,转录抑制子Aux/IAA与ARF(调控生长素基因响应的转录因子)相结合阻止其结合到生长素响应基因启动子上的生长素反应元件(auxin response element, ARE)上,抑制生长素响应基因的表达;当生长素浓度升高时,Aux/IAA被连接到SCFTIR1/AFB复合体上经泛素途径降解,ARF释放出来与ARE结合,启动生长素下游响应基因的转录,从而影响植物的生长发育[2-3];SCFSKP2A复合体则通过结合生长素调控细胞周期转录因子的稳定性,促进细胞周期转录阻遏物的蛋白水解并诱导细胞分裂[1,4];ABP1通过与生长素结合,然后与跨膜激酶蛋白(transmembrane kinase, TMK)形成细胞表面生长素传感复合体,激活小G蛋白RhoGTPase(ROP)2或6信号通路,快速传递生长素信号,从而调控PIN的定位,调控非转录细胞质反应以及相关过程,并参与大量的生长素早期应答基因的转录调控,进而调节细胞扩展和细胞分裂、生长素的极性输出与反馈调控等[5-10]。但是,由于ABP1在植物体中的表达量低且敲除通常会致死,故ABP1介导的信号途径研究相对滞后。植物体内的几条生长素信号途径也并非完全相互独立,而是存在交叉。最近研究发现,ABP1位于TIR1/AFB的上游,它可以增强Aux/IAA蛋白的稳定性,对SCFTIR1/AFB信号途径起到负调控的作用,植物体通过这两种途径的精确平衡从而实现转录调控[11]。
除了ABP1外,ABPs家族还有多个成员,如玉米中至少存在5类ABPs[12-13],且不同物种的ABPs家族成员数目都不同,不同类型的ABPs可能受时空调节并在功能上存在冗余[14-15]。ABPs最早在玉米上被发现[16],随后在拟南芥[17]、辣椒[18]、烟草[19]、棉花[20]、水稻[21]、苎麻[22]、小麦[23]等植物中也克隆了该类基因并进行了相关功能研究,但是迄今为止国内外尚未见到此类基因在甘蔗上的研究报道。
甘蔗(SaccharumofficinarumL.)是中国最重要的糖料作物,也是高生物量的能源作物。甘蔗的收获物是营养体,即蔗茎,甘蔗的茎径、株高等是甘蔗产量形成的最重要因素,它们对生长素的应答非常明显。因此,研究生长素的受体基因,解析生长素对甘蔗的生长发育调控和逆境响应机制对于甘蔗生产具有重要意义。本研究从甘蔗中克隆到一个ABP基因,并通过原核表达、亚细胞定位、实时荧光定量技术对其进行了表达分析,为初步了解甘蔗ABP基因的功能提供了实验证据。
1材料和方法
1.1材料及处理
从福建农林大学试验田中选取长势一致的甘蔗品种Badila健康植株,取正一叶、茎、白色嫩根和芽,用于基因的组织特异性表达实验,设3个生物学重复,每个生物学重复设置3株。
使用Badila组培苗研究不同处理下基因的表达。将5叶期的组培苗放入蒸馏水中培养10 d,选取长势一致的小苗用于处理,根据预实验结果确定取样时间点,每个处理设3个生物学重复,每个生物学重复设置3株。处理组处理条件为水杨酸(5 mmol·L-1SA水溶液)、茉莉酸(100 μmol·L-1JA水溶液)、脱落酸(100 μmol·L-1ABA水溶液),分别于处理3、12和24 h取样;CuCl2(100 μmol·L-1水溶液)、CdCl2(50 μmol·L-1水溶液)处理分别于12、24和48 h取样;生长素(200 μmol·L-1IAA水溶液)处理分别于3、12、24和48 h取样;黑暗处理分别于1、3、6和12 d取样。未处理幼苗为对照。取样后用液氮速冻,然后置-80 ℃冰箱保存备用。
1.2方法
1.2.1ScABP4基因的克隆以高粱和玉米ABP基因序列(XM_002442193.1、EU975483.1、JN243771.1、S53630.1、X16308.1、X16309.1和EU944559.1)作为参考序列,利用Primer Premier 5软件在基因序列5′、3′端保守区域设计特异性引物(表1)。采用Trizol法提取甘蔗品种Badila叶片总RNA,反转录cDNA为模板进行PCR扩增。反应体系为25 μL,含ExTaq0.125 μL,10×PCR buffer 2.5 μL,dNTPs 2 μL,正反向引物各1 μL,模板1 μL,ddH2O 17.375 μL。反应条件为94 ℃预变性4 min;94 ℃变性30 s,55 ℃退火30 s,72 ℃延伸1 min,34个循环;72 ℃延伸10 min。 PCR产物经1.5%琼脂糖凝胶电泳检测,回收目的片段,将其连接到pMD19-T Vector中,然后转化大肠杆菌DH5α感受态细胞,经过蓝白斑筛选以及菌液PCR验证后,委托生工生物工程(上海)有限公司测序。
1.2.2生物信息学分析利用DNAMAN和ORF Finder软件,对克隆获得的ScABP4基因的核酸序列及其推导的氨基酸序列进行分析;利用ExPASy服务器(http://www.expasy.org/proteomics)的ProtParam、Compute PI/Mw和ProtScale工具预测ScABP4蛋白的理化性质和亲疏水性;利用TEPred(http://embnet.vital-it.ch/software/TMPRED_form.html)工具分析 ScABP4蛋白的跨膜结构域;利用SignalP4.1 Server(http://www.cbs.dtu.dk/Services/SignalP/)预测ScABP4蛋白的信号肽;利用GOR IV(http://npsa-pbil.ibcp.fr/cgi-bin/npsa_automat.pl?page=npsa_gor4.html)对
ScABP4蛋白进行二级结构预测;利用MEGA6.0(Neighbor-Joining法)构建系统进化树。
1.2.3ScABP4原核表达根据测序得到的目的基因ORF,设计原核表达特异性引物(表1),以pMD19-T-ScABP4质粒为模板,扩增目的基因片段。反应体系为25 μL,含ExTaq0.125 μL,10×PCR buffer 2.5 μL,dNTPs 2 μL,正反向引物各1 μL,模板1 μL,ddH2O 17.375 μL。反应条件为94 ℃预变性4 min;94 ℃变性30 s,66 ℃退火30 s,72 ℃延伸1 min,34个循环;72 ℃延伸10 min。PCR产物经BamH I 和XhoI酶切,利用T4连接酶连接到同样酶切过的表达载体pGEX-6P-1中,转化大肠杆菌DH5α感受态细胞,重组质粒经双酶切检测、质粒PCR鉴定及测序,阳性克隆命名为pGEX-6P-1-ScABP4。将空质粒和重组质粒分别转入宿主菌E.coliRosetta(DE3)中,挑取单菌落,在10 mL LB液体培养基(含50 mg·L-1Amp)中37 ℃培养过夜。取400 μL培养物于30 mL LB液体培养基(含50 mg·L-1Amp)中二次活化至OD600为0.6;加入终浓度为1 mmol·L-1的IPTG,37 ℃诱导至10 h(每2 h取样1 mL),分别收集菌液,4 ℃、8 000g离心10 min后收集菌体;加入30 μL蛋白加样缓冲液,沸水浴5 min;常温下12 000g离心5 min,吸取10 μL上清液点样,12% SDS-PAGE电泳检测融合蛋白的表达。
1.2.4ScABP4亚细胞定位利用在线软件PSORT(http://psort.hgc.jp/form.html)预测ScABP4的亚细胞定位并进行实验验证。根据目的基因ORF,设计亚细胞定位特异性引物(表1),以PMD19-T-ScABP4质粒为模板,扩增目的基因片段。纯化后的目的基因片段经BamH I 和XbaI酶切后与同样酶切过的pCAMBIA 2300-GFP载体连接,转化大肠杆菌DH5α感受态细胞,经过双酶切检测、质粒PCR鉴定及测序,阳性克隆命名为35S-ScABP4-GFP。将获得的重组质粒阳性克隆和空载体35S-GFP分别转化农杆菌EHA105,在LB液体培养基(含50·μg mL-1Kan和35·μg mL-1Rif)中28 ℃培养过夜,制备农杆菌悬浮液,调整菌液OD600为0.8,注入本氏烟叶片,2 d后观察荧光定位结果。
1.2.5ScABP4基因表达分析采用Trizol法提取甘蔗伸长期的正一叶、芽、茎、幼根及处理组和对照组叶片的总RNA,反转录成cDNA,作为定量PCR的模板。根据克隆获得的ScABP4基因的ORF序列,设计实时荧光定量PCR引物(表1),以GAPDH作为内参基因[24],按照SYBR Green PCR Master Mix Kit(Roche)说明书配置定量反应体系,在7500型实时荧光定量PCR仪(ABI,USA)上完成定量PCR扩增,每个样品设置3次技术重复。扩增程序为50 ℃ 2 min(只有当反应液中加入了UNG酶时选用);95 ℃ 10 min(激活TaqDNA聚合酶);95 ℃变性15 s,60 ℃退火1 min,40个循环;添加溶解曲线。反应结束后,采用2-ΔΔCt算法分析获得数据[25]。
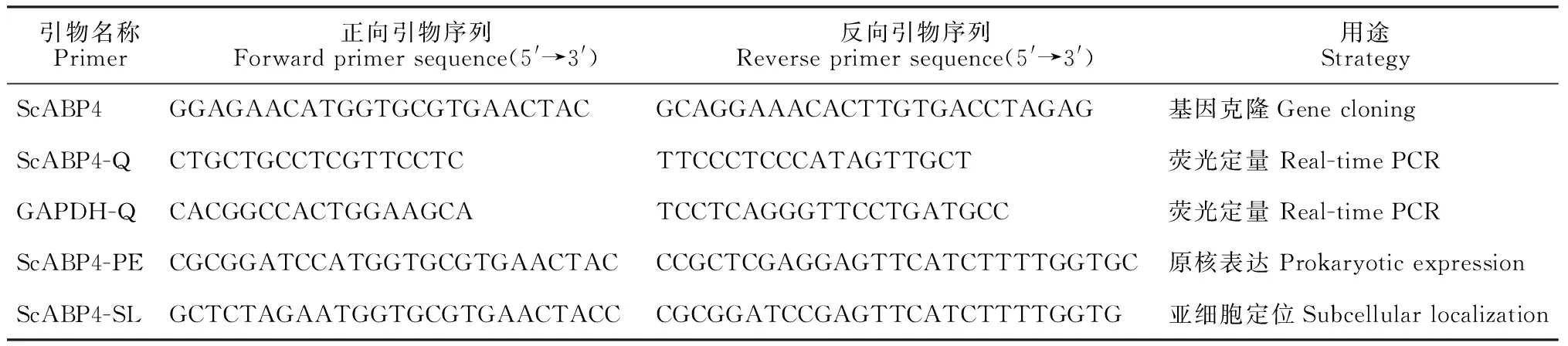
表1 ScABP4基因克隆与表达所用引物
2结果与分析
2.1ScABP4基因序列的获得与生物信息学分析
克隆得到一个长度为640 bp的单一条带(图1)。通过测序和序列分析显示,该基因ORF长度为615 bp,编码204个氨基酸(图2)。利用NCBI数据库(http://www.ncbi.nlm.nih.gov/)的BlastN工具比对得知,该基因与高粱(Sorghumbicolor)、玉米(Zeamays)和谷子(Setariaitalica)等
物种ABP4基因高度同源,相似性分别为95%、94%和87%。表明该基因为甘蔗生长素结合蛋白基因,因此命名为ScABP4,并将其登录到GenBank,登录号为KT880509。
ProtParam、Compute PI/Mw预测表明,ScABP4分子量为22.5 kD,等电点5.87,负电荷残基(Asp+Glu)22,正电荷残基(Arg+Lys)17,不稳定系数42.67,为不稳定蛋白。ProtScale预测表明,ScABP4第27位氨基酸具有最高分值2.911,第61位氨基酸具有最低分值-2.378,平均疏水性(GRAVY)为-0.119,故推测为亲水蛋白。TMPred预测表明,ScABP4蛋白有2个跨膜结构域,其中一个总分为1 750,有从内到外的跨膜能力;另一个总分为1 542,有从外到内的跨膜能力。总GOR IV 预测表明,ScABP4中无规则卷曲所占的比例最高为55.88%,其次是α-螺旋占25.00%,延伸链所占比例是19.12%,无β-折叠结构。信号肽预测表明,第42位丝氨酸残基具有最高的原始剪切位点分值0.364和最高的综合剪切位点分值0.546,第28位亮氨酸残基具有最高的信号肽分值0.987。根据最后算得氨基酸残基的加权平均值0.642,推测ScABP4基因所编码的蛋白中存在信号肽,为分泌蛋白。

M. 100 bp分子量标记; 1. PCR 扩增产物图1 甘蔗ScABP4基因的PCR扩增结果M. 100 bp ladder marker; 1. PCR amplified productFig. 1 PCR amplified products of ScABP4

下画线表示翻译起始位点;*表示终止密码子图2 甘蔗ScABP4基因的cDNA序列及其推导的氨基酸序列Underline indicates translation initiation site; * indicates stop codonFig. 2 The nucleotide acid sequence of ScABP4 and its deduced amino acid sequence
2.2ScABP4氨基酸序列相似性与系统进化分析
使用NCBI中的BlastP程序,对ScABP4的氨基酸序列进行相似性比对。结果(图3)显示,其与高粱(Sorghumbicolor_ref|XP_002442238.1|)、玉米(Zeamays_ref|XP_008662629.1|)、谷子(Setariaitalica_ref|XP_004962873.1|)、二穗短柄草(Brachypodiumdistachyon_ref|XP_003575870.1|)和水稻(OryzasativaJaponicaGroup_ref|NP_001066918.1|)ABP蛋白的氨基酸序列相似性分别为94%、92%、86%、86%和85%。其编码的蛋白质具有ABP家族蛋白的典型特征(图3),即具有包含13~20个氨基酸残基的BoxA、BoxB、BoxC 3个高度保守的生长素结合结构域以及C端内质网结合信号区(KDEL)。

Box A、B和C是植物ABP的3个高度保守结构域;KDEL是C端的内质网滞留信号序列图3 甘蔗ScABP4氨基酸序列与其他植物相似性比对Boxes A, B and C correspond to highly conserved domains among all plant ABP; KDEL is the C-terminal sequence which may function as a signal for retaining the protein in the lumen of the ERFig. 3 Similarity comparison of ScABP4 amino acid sequences among sugarcane and other plant species

分支节点上的数值为自举值;标尺代表遗传距离;括号内编号氨基酸登录号图4 不同物种基于ABP基因氨基酸序列的系统进化树Numbers above branches on the left indicate bootstrap values of 1 000 replicates; The scale bar represents genetic distance; The accession No. is given in bracketsFig. 4 Phylogenetic tree of amino acid sequences encoded by ABP gene among different plant species

M1. 15 000+2 000 bp分子量标记; M2. 100 bp 分子量标记; 1. 重组质粒双酶切片段图5 pGEX-6P-1-ScABP4重组质粒双酶切鉴定M1. 15 000+2 000 bp marker; M2. 100 bp marker; 1. Enzyme digestion fractions of pGEX-6P-1-ScABP4Fig. 5 PCR identification of pGEX-6P-1-ScABP4 with BamH I/Xho I
ScABP4蛋白的系统进化分析(图4)结果显示,进化树大体分为两个分支,其中同属单子叶植物的高粱、玉米、水稻、谷子、二穗短柄草、燕麦(Avenasativa_dbj|BAA25433.1|)、大麦(Hordeumvulgare_dbj|BAK02611.1|)和乌拉尔图小麦(Triticumurartu_gb|EMS50686.1|)位于一个分支,双子叶植物油棕(Elaeisguineensis_ref|XP_010931928.1|)、海枣(Phoenixdactylifera_ref|XP_008793651.1|)、龙眼(Dimocarpuslongan_gb|ACX54195.3|)为另一分支,ScABP4与高粱、玉米等物种ABP进化距离较近。
2.3原核表达载体的鉴定与重组蛋白的SDS-PAGE分析
重组质粒pGEX-6P-1-ScABP4经BamH I、XhoI酶切后产物呈现清晰的2条泳带,分别在640 bp(目的基因片段)和5 000 bp(载体片段)左右(图5)。对重组质粒测序显示,序列ORF与原克隆序列一致,表明原核表达载体构建成功。重组质粒SDS-PAGE电泳结果显示,在分子量48 kD左右处
可见1条特异性条带,ABP4蛋白的大小理论约为22 kD,加上pGEX-6P-1载体上的GST标签蛋白大小约为26 kD,因此与本文预测的蛋白大小基本相符,可以确定该融合蛋白成功表达(图6)。
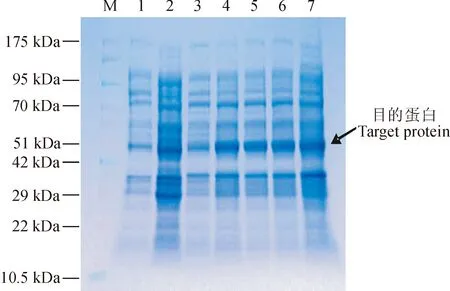
M. 蛋白质分子质量标准;1. 未诱导空质粒;2. IPTG 诱导8 h后的空质粒;3. 未诱导重组质粒;4~7. IPTG分别诱导2、4、6、8 h后的重组质粒图6 诱导表达产物的SDS-PAGE分析M. Protein molecular weight marker; 1. pGEX-6P-1 without induction; 2. pGEX-6P-1 after inducing for 8 h; 3. pGEX-6P-1-ScABP4 without induction; 4-7. pGEX-6P-1-ScABP4 after inducing for 2, 4, 6 and 8 h, respectivelyFig. 6 Analysis of expressed proteins by SDS-PAGE

A. GFP对照; B. GFP空载的明场; C. GFP空载的叶绿体; D. GFP空载的叠加场; E. ScABP4-GFP; F. ScABP4-GFP的明场; G. ScABP4-GFP的叶绿体; H. ScABP4-GFP的叠加场图7 ScABP4的亚细胞定位分析A. GFP control; B. GFP vision under natural light; C. Chlorophyll of 35S-GFP; D. GFP overlapped vision of A, B, and C; E. ScABP4-GFP; F. ScABP4-GFP vision under natural light; G. Chlorophyll of 35S-ScABP4-GFP;H. ScABP4-GFP overlapped vision of E, F and GFig. 7 Subcellular localization of ScABP4 fused with GFP in the epidermal cells of N. benthamiana (bars=50 μm)
2.4ScABP4的亚细胞定位分析
根据Psort软件预测,ScABP4蛋白定位于内质网(腔)、质膜、微体(过氧物酶体)、高尔基体的可能性分别为80.0%、79.0%、63.1%和30%,其中定位于内质网(腔)和质膜的概率最高,因此,推测其最有可能定位于内质网(腔)和质膜上。
本氏烟叶片在激光共聚焦显微镜下观察绿色荧光。结果(图7)显示,对照组35S-GFP可单独在烟草表皮细胞中大量表达,绿色荧光信号在细胞质、质膜和细胞核中均有分布;与其相比,35S-ScABP4-GFP融合蛋白绿色荧光信号主要分布于细胞网状结构中以及细胞膜结构上,该定位结果与Psort软件预测结果基本一致。

不同字母表示差异显著性(P<0.05)图8 ScABP4基因的组织特异性表达分析The different subscriptions with different letters indicate significant difference (P < 0.05)Fig. 8 Tissue-specific expression analysis of ScABP4 from different tissues in sugarcane
2.5ScABP4基因的表达分析
ScABP4在伸长期甘蔗的不同组织中均有表达,而且具有组织特异性,其中在芽中表达量最高,其次是在叶中,在茎中表达量最低(图8)。
ScABP4基因能够被外源IAA(200 μmol·L-1)、黑暗、SA(5 mmol·L-1)、JA(100 μmol·L-1)、ABA(100 μmol·L-1)和CuCl2(100 μmol·L-1)强烈诱导上调表达,而在CdCl2(50 μmol·L-1)胁迫下基因的表达量显著下调(图9),说明CdCl2抑制ScABP4基因的表达。其中,ABA、IAA、CuCl2处理下ScABP4基因的表达量均在24 h达到最高,分别为对照的1.3、2.3、1.5倍;JA处理3 h后,ScABP4基因表达量显著上调,约为对照的2.8倍,随后表达量逐渐降低,但仍明显高于对照(图9,A);黑暗处理6 d时ScABP4基因的表达量明显上调,为对照的3倍,此后随着时间推移到12 d,表达量仍处于较高水平(图9,B)。
3讨论
生长素结合蛋白中研究得最深入的是ABP1,而其他家族成员则相对较少,尚不清楚它们在植物体内时空表达、调控及功能上是否存在特异性。近年来有文献报道,在玉米中ABP4参与幼苗生长,介导幼苗对生长素的响应,与光信号通路互作并与ABP1在功能上互作[14-15],但在其他植物上鲜见ABP4的研究报道。
本研究发现ScABP4主要定位于细胞质网状结构和细胞膜,但是由于本实验没有使用内质网特异性标记,所以ScABP4在细胞质中的精细定位还有待进一步探讨。ScABP4是分泌蛋白,推测它可能与ABP1一样,储存于内质网腔,通过分泌途径在质膜上发挥作用。

小写字母表示同一处理下不同处理时间的差异显著性(P<0.05)图9 ScABP4基因在不同处理下的表达The different lowercase letters indicate significant difference of the same treatment during different treatment times (P < 0.05)Fig. 9 qRT-PCR analysis of ScABP4 expression in different treatments
Fellner[26-27]发现,ABP4在光和生长素诱导的生长响应中起重要作用,在古老的玉米品种中ABP4基因在光照和外源生长素诱导下上调表达。本研究中ScABP4在外源生长素处理下上调表达,与Fellner的结论一致,推测外源生长素诱导产生ScABP4与之结合,以便进行下一步的运输。但ScABP4在黑暗处理下也上调表达,与Fellner的结论相左,推测ABP家族成员的功能可能具有物种特异性。在玉米黄化苗中,ABP1和ABP4都响应光信号并在下胚轴伸长上功能互补,但是在胚芽鞘的生长上,ABP1并非必需,而在叶片角度发育上,ABP4对ABP1可能起负调控作用[15]。甘蔗是高倍体植物,甘蔗中ABP家族成员的数目和功能可能更为复杂。植物激素可以调控植物生长发育,参与环境信号传导。ABA是一种胁迫激素,它能诱导植物抗性基因的表达;JA能诱导植物产生对害虫有毒、抗营养和抗消化作用的化合物,对害虫生理活动产生不利影响;SA在超敏反应中能介导细胞死亡,诱导病程相关蛋白(pathogenesis-related protein,PR)基因的表达和一些防卫基因的表达。在基因的启动子区通常有多种反应元件结合位点,这使得基因可以接受不同信号的转录因子诱导表达,因此,这些激素信号通路之间相互作用,共同响应环境刺激[28]。目前,尚未有ABP基因在上述激素胁迫下表达的相关报道。本研究首次发现在甘蔗幼苗中ScABP4受SA、JA和ABA诱导上调表达,推测这些激素处理对甘蔗幼苗造成逆境,而甘蔗苗处于旺盛的生长发育阶段,因此合成更多生长素受体,调节内源生长素的含量和分布,以此拮抗这些激素的负作用。铜是植物必需微量元素,是细胞色素氧化酶、多酚氧化酶、抗坏血酸氧化酶、多胺氧化酶、Cu/Zn-SOD等蛋白质的重要辅因子,参与呼吸代谢中的氧化还原反应;在叶绿体质体蓝素中铜参与光合作用的电子传递过程,适量的铜对植物的生长发育有刺激和促进作用,过量则对植物有害;镉是植物非必需微量元素,高浓度下会对植物产生毒害作用[29-30]。在本研究中,CuCl2处理引起ScABP4上调表达,CdCl2处理引起ScABP4下调表达,说明ScABP4基因响应了重金属胁迫,但在不同重金属胁迫下差异表达。已有报道显示,高浓度的镉能够抑制生长素的合成[30],推测ScABP4作为生长素受体而下调表达;也有研究表明,铜胁迫下诱导内质网蛋白加工基因上调表达[31],ScABP4是内质网中的分泌蛋白,故可能因此而上调表达。植物对外界环境信号的应答机制复杂,本研究初步研究了ScABP4在不同处理下的表达,其具体的生物学功能,以及对生长素调控的分子机制还有待进一步研究。
参考文献:
[1]SALEHIN M, BAGCHI R, ESTELLE M. SCFTIR1/AFB-based auxin perception: mechanism and role in plant growth and development[J].ThePlantCell, 2015, 27(1): 9-19.
[2]DHARMASIRI N, ESTELLE M. Auxin signaling and regulated protein degradation[J].TrendsinPlantScience, 2004, 9(6): 302-308.
[3]KEPINSKI S, LEYSER O. TheArabidopsisF-box protein TIR1 is an auxin receptor[J].Nature, 2005, 435(7 041): 446-451.
[4]JURADO S, ABRAHAM Z, MANZANO C,etal. TheArabidopsiscell cycle F-box protein SKP2A binds to auxin[J].ThePlantCell, 2010, 22(12): 3 891-3 904.
[5]XU T, DAI N, CHEN J,etal. Cell surface ABP1-TMK auxin-sensing complex activates ROP GTPase signaling[J].Science, 2014, 343(6 174): 1 025-1 028.
[6]TROMAS A, BRAUN N, MULLER P,etal. The AUXIN BINDING PROTEIN 1 is required for differential auxin responses mediating root growth[J].PLoSOne, 2009,4(9): e6648.
[7]CHEN D, REN Y, DENG Y,etal. Auxin polar transport is essential for the development of zygote and embryo inNicotianatabacumL. and correlated with ABP1 and PM H+-ATPase activities[J].JournalofExperimentalBotany, 2010, 61(6):1 853-1 867.
[8]TROMAS A, PAPONOV I, PERROT-RECHENMANN C. AUXIN BINDING PROTEIN 1: functional and evolutionary aspects[J].TrendsinPlantScience, 2010, 15(8): 436-446.
[9]EFFENDI Y, SCHERER G F E. AUXIN BINDING-PROTEIN1 (ABP1), a receptor to regulate auxin transport and early auxin genes in an interlocking system with PIN proteins and the receptor TIR1[J].PlantSignaling&Behavior, 2011, 6(8): 1 101-1 103.
[10]SHI J H, YANG Z B. Is ABP1 an auxin receptor yet[J].MolecularPlant, 2011, 4(4): 635-640.
[11]TROMAS A, PAQUE S, STIERLV,etal. Auxin-Binding Protein 1 is a negative regulator of the SCFTIR1/AFBpathway[J].NatureCommunications, 2013, 4: 2 496.
[12]HESSE T, FELDWISCH J, BALSHSEMANN D,etal. Molecular cloning and structural analysis of a gene fromZeamays(L.) coding for a putative receptor for the plant hormone auxin[J].TheEMBOJournal, 1989, 8(9): 2 453.
[13]SCHWOB E, CHOI S Y, SIMMONS C,etal. Molecular analysis of three maize 22 kDa auxin-binding protein genes-transient promoter expression and regulatory regions[J].ThePlantJournal, 1993, 4(3): 423-432.
[14]BORUCKA J, FELLNER M. Auxin binding proteins ABP1 and ABP4 are involved in the light-and auxin-induced down-regulation of phytochrome gene PHYB in maize (ZeamaysL.) mesocotyl[J].PlantGrowthRegulation, 2012, 68(3): 503-509.
[16]HERTEL R, THOMSON K S, RUSSO V E A. In-vitro auxin binding to particulate cell fractions from corn coleoptiles[J].Planta, 1972, 107(4): 325-340.
[17]KLODE M, DAHLKE R I, SAUTER M,etal. Expression and subcellular localization ofArabidopsisthalianaauxin-binding protein 1 (ABP1)[J].JournalofPlantGrowthRegulation, 2011, 30(4): 416-424.
[18]CHOI S Y. Molecular cloning and expression of the hot pepperERabp1 gene encoding auxin-binding protein[J].PlantmolecularBiology, 1996, 32(5): 995-997.
[19]SHIMOMURA S, ICHIKAWA H, WATANABE S. Characterization of auxin-binding protein 1 from tobacco: Content, localization and auxin-binding activity[J].Planta, 1999, 2 008(4): 21-25.
[20]孙建波, 崔百明, 刘德兵, 等. 棉花生长素结合蛋白ABP1基因cDNA的克隆及序列分析[J]. 棉花学报, 2007, 19(4): 243-247.
SUN J B, CUI B M, LIU D B,etal. Cloning and analysis of auxin-binding protein 1 cDNA genes inGossypiumhirsutum[J].CottonScience, 2007, 19(4): 243-247.
[21]龚蓉, 黄志刚, 王若仲, 等. 水稻生长素结合蛋白ABP1的原核表达及纯化[J]. 激光生物学报, 2011, 20(1): 78-82.
GONG R, HUANG Z G, WANG R Z,etal. Prokaryotic expression and purification of the auxin binding protein 1 in rice[J].ActaLaserBiologySinica, 2011, 20(1): 78-82.
[22]黄妤, 刘峰, 郭清泉, 等. 苎麻生长素结合蛋白ABP1基因cDNA的克隆及表达[J]. 作物学报, 2008, 34(8): 1 358-1 365.
HUANG Y, LIU F, GUO Q Q,etal. Cloning and expression of auxin-binding proteins 1 gene in ramie [Boehmerianivea(Linn.) Gaud.][J].ActaAgronomicaSinica, 2008, 34(8): 1 358-1 365.
[23]乔麟轶, 张磊, 张文萍, 等. 小麦生长素结合基因TaABP1-D的克隆、功能标记开发及其与株高的关联[J]. 作物学报, 2012,38(11): 2 034-2 041.
QIAO L Y, ZHANGL, ZHANG W P,etal. Molecular cloning and development of a functional marker ofTaABP1-Dgene associated with plant height in bread wheat[J].ActaAgronomicaSinica, 2012, 38(11): 2 034-2 041.
[24]ISKANDAR H M, SIMPSON R S, CASU R E,etal. Comparison of reference genes for quantitative real-time polymerase chain reaction analysis of gene expression in sugarcane[J].PlantMolecularBiologyReporter, 2004, 22(4): 325-337.
[25]LIVAK K J, SCHMITTGEN T D. Analysis of relative gene expression data using real-time quantitative PCR and the 2-ΔΔCTmethod[J].Methods, 2001, 25(4): 402-408.
[26]FELLNER M, HORTON L A, COCKE A E,etal. Light interacts with auxin during leaf elongation and leaf angle development in young corn seedlings[J].Planta, 2003, 216(3): 366-376.
[27]FELLNER M, FORD E D, VOLKENBURGH E V. Development of erect leaves in a modern maize hybrid is associated with reduced responsiveness to auxin and light of young seedlings in vitro[J].PlantSignaling&Behavior, 2006, 1(4): 201-211.
[28]温小杰, 张学勇, 郝晨阳, 等. 植物激素信号传导途径研究进展[J]. 中国农业科技导报, 2010, 12(6): 10-17.
WEN X J, ZHANG X Y, HAO C Y,etal. Research progress on plant hormone signal pathways[J].JournalofAgriculturalScienceandTechnology, 2010, 12(6): 10-17.
[29]PONGRATZ R. Arsenic speciation in environmental samples of contaminatedsoil[J].ScienceoftheTotalEnvironment, 1998, 224(1): 133-141.
[30]吴坤, 吴中红, 邰付菊,等. 镉胁迫对烟草叶激素水平、光合特性、荧光特性的影响[J]. 生态学报, 2011, 31(16): 4 517-4 524.
WU K, WU Z H, TAI F J,etal. Effects of cadmium on the contents of phytohormones, photosynthetic performance and fluorescent characteristics in tobacco leaves[J].ActaEcologicaSinica, 2011, 31(16): 4 517-4 524.
[31]张黛静, 王多多, 董文, 等. 铜胁迫下小麦幼根转录组学及蛋白质组学研究[J]. 河南农业科学, 2015, 44(4): 31-35.
ZHANG D J, WANG D D, DONG W,etal. Transcriptomics and proteomics analysis in root of wheat under copper stress[J].JournalofHenanAgriculturalSciences, 2015, 44(4): 31-35.
(编辑:宋亚珍)
Molecular Cloning and Expression ofScABP4 Gene in Sugarcane
DENG Yuqing,ZHAI Yushan,PENG Lei,DONG Meng,XU Qian,CHENG Guangyuan,LIN Yanquan,XU Jingsheng*
(Fujian Agriculture and Forestry University / Key Laboratory of Sugarcane Biology and Genetic Breeding, Ministry of Agriculture, Fuzhou 350002,China)
Abstract:Auxin binding protein (ABP) plays an important role in auxin signal transduction and the regulation of plant growth and development. To study the function and expression features of the ABP gene in sugarcane, we cloned an ABP gene from a sugarcane cultivar (Badila) using RT-PCR. Sequence analysis showed that it contained a 615 bp open reading frame (ORF) and encoded a deduced protein of 204 amino acids. It was designated as ScABP4 because of the multiple sequence alignment and phylogenetic tree analysis results revealed that it had closer relationships with ABP4 in Sorghum bicolor and Zea mays. It was cloned into the prokaryotic expression vector pGEX-6P-1 and expressed a 22.5 kD protein successfully in E. coli. Subcellular localization assay showed that ScABP4 protein is located in the reticular of cytoplasm and on the cytomembrane; protein structure prediction showed that it has a signal-peptide, speculate it may be stored in the endoplasmic reticulum, and exert its function on the plasma membrane. qRT-PCR showed that ScABP4 expressed in bud, root, stem and leaf in sugarcane with the highest expression level in bud. ScABP4 was up-regulated by IAA or dark treatments indicated that ScABP4 might participate in sugarcane responses to auxin, and involved in light signaling pathway(s). In addition, the expression of ScABP4 in sugarcane was induced by ABA, JA, SA and CuCl2 but was down-regulated by CdCl2. These results indicated that ScABP4 might involve in the sugarcane resistance to disease, osmotic and heavy metal stress, which provides the basis for further studying the functions of ScABP4.
Key words:sugarcane;auxin binding protein;homologous cloning;expression analysis
文章编号:1000-4025(2016)05-0865-09
doi:10.7606/j.issn.1000-4025.2016.05.0865
收稿日期:2016-01-31;修改稿收到日期:2016-04-20
基金项目:国家高技术研究发展计划(863计划)项目(2013AA102604);国家自然科学基金(31171605;31371688);国家现代农业产业技术体系项目(CARS-20-1-1)
作者简介:邓宇晴(1990-),女,在读硕士研究生,主要从事甘蔗病原与寄主互作分子机制方面的研究。E-mail:dyqdyq999@163.com *通信作者:徐景升,副研究员,博士生导师,主要从事甘蔗功能基因组学研究。E-mail:xujingsheng@126.com
中图分类号:Q785;Q786
文献标志码:A

