贺兰山杜松种子萌发的影响因素研究
刘永辉,马振华
(国家林业局 西北林业调查规划设计院, 陕西 西安 710048)
贺兰山杜松种子萌发的影响因素研究
刘永辉,马振华
(国家林业局 西北林业调查规划设计院, 陕西 西安 710048)
[摘要]【目的】 研究不同预处理及环境因素对贺兰山杜松种子萌发的影响,为提高杜松种子的萌发效率、促进杜松林实生更新及人工栽培奠定基础。【方法】 在气候箱内模拟林间生境条件,研究不同温度(5,10,15,20,25,30,35 ℃)、光照时间(0,10,24 h)、土壤含水量(10%,15%,20%,25%,30%,35%,40%,45%)、埋土深度(0,1,2,3,4,5 cm)及超声波时间(0,5,10,15,20,25,30 min)和不同质量分数(0%,10%,20%,30%)聚乙二醇(PEG)浸种2种预处理方法对贺兰山杜松种子萌发的影响。【结果】 不同温度下杜松种子萌发率、萌发势和发芽指数差异显著,萌发的适宜温度为15~25 ℃;杜松种子在全光照(24 h)条件下的萌发率高达71%,显著高于其他非全光照处理;杜松种子萌发的最适土壤含水量为20%,在此条件下的萌发率可达75%;埋土深度对杜松种子萌发有一定影响,以1~2 cm浅层埋土更适宜于种子萌发;超声波和PEG预处理均能促进种子萌发,种子萌发率随超声波时间的延长与PEG溶液质量分数的增大而呈现先升高后降低的变化趋势,59 kHz、500 W超声波处理10 min种子的萌发率最高,但仍低于经20%PEG溶液浸泡24 h时的萌发率。【结论】 在4种环境因素与2种预处理方法中,光照时间和PEG预处理是影响杜松种子萌发的重要因素。用20%的PEG溶液浸泡种子24 h后,在25 ℃、全光照、土壤含水量20%、埋土深度1~2 cm条件下,杜松种子萌发效果最佳,萌发率可达75%。
[关键词]杜松;种子萌发;环境因素;贺兰山
杜松(Juniperusrigida)为柏科刺柏属常绿乔木,是一种耐寒耐旱适应性强的优良树种,在中国主要分布于内蒙古、河北北部、山西、陕西及宁夏等省区[1-2],是贺兰山水源涵养林的主要组成群系[3]。杜松除有较高的园林绿化应用价值外,其球果还可入药,枝、叶可提取芳香油[4]。长期以来,由于人为干扰、生境变化以及自身生长缓慢等原因[5],其天然群体的分布规模日益缩小,甚至处于濒危状态[6]。目前,针对杜松的研究主要集中在群落特征[1]、遗传多样性[7]、种群结构与生存力[2]、空间分布格局和动态[8]、表型多样性[3]及小孢子的发生与雄配子体的发育[9]等方面,针对其种子萌发的研究,仅见曹泽猷[10]、杜文革等[11]和王志军等[12]采用不同催芽方法对杜松种子萌发与育苗的影响进行了分析,但有关杜松种子萌发的影响因素研究尚鲜有报道。
种子萌发是植物生活史中的一个关键环节[13]。植物更新是森林群落动态的重要组成部分,而大多数植物的更新从种子萌发开始以完成其生活史,因此植物种群的规模和遗传稳定性取决于实生苗的数量和成活率[14]。种子萌发对实生更新起到了至关重要的作用,除种子的生活力、贮藏寿命等特征外,外部环境条件如温度、水分、土壤等自然条件及人工处理等[15-16]都会影响种子的萌发。杜松种皮致密而坚硬,表面有大量油脂,种皮透水透气性差,萌发困难,这极大影响了杜松种群的自然更新及引种栽培工作[17]。贺兰山林区的杜松通常以萌蘖更新为主,但其弊端在于萌生多代后会引起杜松生活力的衰退,使其向灌丛方向演化或沦为荒草坡。因此,研究贺兰山杜松种子的萌发特性对该区杜松林的天然更新及人工培育具有十分重要的意义。本试验采用光照培养箱模拟贺兰山林间环境,研究了温度、光照、土壤含水量、埋藏深度等环境条件及超声波和聚乙二醇(PEG)溶液浸泡预处理等因素对杜松种子萌发的影响,以期提高贺兰山杜松林种子的萌发效率,为杜松林的实生更新以及人工栽培奠定基础。
1材料与方法
1.1试验材料的搜集及种子萌发前的准备工作
杜松种子采自于贺兰山苏峪口国家森林公园杜松天然群落。于2013年9月底在每株选定的母树个体上、中、下部的四周采收完整成熟的杜松种子。种子千粒质量22.34 g,含水量43.6%。采收后阴干封装并于4 ℃保存备用。采收种子的同时按要求采取试验用土样。
杜松种子萌发前需去除表面油脂,设置15和25 ℃ 2个温度进行变温催芽。将处理后的种子置于50 ℃、10 g/L的碳酸氢钠溶液中浸泡1 d,自然冷却,清水洗净后再浸泡3 d,用体积分数5%的福尔马林溶液消毒25 min,洗净后于20~25 ℃的室内沙藏60 d,然后于4 ℃下贮存40 d备用。
1.2室内萌发试验
根据试验设计,在查阅前人相关研究结果[15-16,18-21]的基础上,依次进行了温度、光照、土壤含水量、埋土深度4种环境因素及超声波处理、聚乙二醇溶液浸泡2种预处理方法的单因素试验。各项试验均在人工气候箱中进行,每处理每个培养皿中放20粒杜松种子,重复3次,并从第2 天开始每天观察记录杜松种子的发芽情况,连续3 d无种子萌发时结束试验,用1%四唑染色法检测未萌发杜松种子的活力。
1.2.1温度与种子萌发的关系试验设置5,10,15,20,25,30和35 ℃ 7个温度梯度处理。将备用的杜松种子放入人工气候箱内,并将其温度分别设定为以上7个温度。模拟的光照条件为光强3 000 lx连续光照10 h后再进行14 h的黑暗处理,其他因素为土壤含水量20%、埋土深度1 cm。同时,设置15 ℃/25 ℃与15 ℃/30 ℃ 2个变温处理,其他处理条件同上。
1.2.2光照与种子萌发的关系通过杜松种子萌发的温度试验可以得出适宜的种子萌发温度,在该温度下对杜松种子进行24 h全光照、10 h半光照和24 h全黑暗(0 h光照)3种光照处理试验。其他因素为土壤含水量20%、埋土深度1 cm。
1.2.3土壤含水量与种子萌发的关系将130 ℃高温消毒8 h后的土样加水调配成含水量为10%~45%、梯度为5%的土壤,然后覆盖于装有20粒杜松种子的培养皿内,埋土深度约1 cm,温度和光照条件根据前文试验结果设定。每天称质量,以便及时补充蒸发而流失的水分,确保土壤湿度的稳定性。
1.2.4埋土深度与种子萌发的关系埋土深度试验在上述试验得到的适宜温度、光照和土壤含水量条件下进行。埋土深度设置0,1,2,3,4和5 cm共6个处理。每个培养皿中放入20粒种子后称质量覆膜,每24 h给培养皿补水1次。
1.2.5超声波处理与种子萌发的关系超声波预处理试验选用SK 8200HP超声波清洗仪(59 kHz,500 W)处理杜松种子,处理介质为自来水,处理时间设置0,5,10,15,20,25和30 min 7个等级[18]。然后在前述试验所得最佳温度、光照、水分及埋深条件下进行种子萌发试验。
1.2.6聚乙二醇(PEG)溶液浸泡处理与种子萌发的关系PEG质量分数设置0%,10%,20%和30%共4个梯度[19-20],每个梯度下浸种时间均为24 h,然后在前述试验所得的最佳温度、光照、水分及埋深条件下进行种子萌发试验。
1.3种子萌发指标的测定及计算方法
种子萌发指标的测定及计算参照付菁等[16]对辽东栎种子萌发影响因子的试验研究方法进行。种子萌发率指萌发种子数占参试种子总数的比例,可以表示群体种子形成幼苗的潜势。其计算公式可表示为:

(1)
萌发势指种子发芽达到高峰时的萌发率,其计算公式可表示为:

(2)
发芽指数是反映种子发芽整齐度的指标,其计算公式可表示为:

(3)
式中:Gt为第t日的种子萌发率,Dt为相应的发芽日数。
1.4数据处理
所有数据均采用“平均值±标准差”表示,运用SPSS 12.0软件进行方差分析与多重比较。
2结果与分析
2.1温度对杜松种子萌发的影响
2.1.1恒温杜松种子的萌发与温度有密切关系。图1和图2结果显示,杜松种子萌发率、萌发势、发芽指数在一些温度下表现出显著差异(P<0.05)。在5~35 ℃下,杜松种子均有萌发,但种子的萌发率随着温度的升高而呈现出先增加后降低的趋势。如图1可知,5 ℃条件下杜松种子的萌发率仅为5%,25 ℃条件下则达到65%,是5 ℃条件下的13倍。图2表明,适宜的温度处理可使杜松种子于5~10 d后萌发,而集中的萌发期为试验的20~30 d。综上可知,在25 ℃条件下,杜松种子的萌发率、萌发势、发芽指数均高于其他6个温度梯度,且差异显著。因此杜松种子的最适宜萌发温度为25 ℃。

图 1不同温度处理下杜松种子的萌发情况
同一指标标不同小写字母表示不同处理间
差异显著 (P<0.05)。下同
Fig.1Germination ofJuniperusrigidaseeds
with different temperatures
Different lowercase letters indicate significant
difference (P<0.05).The same below
2.1.2变温由图3可知,15 ℃/25 ℃变温条件下杜松种子萌发率、萌发势和发芽指数高于15 ℃/30 ℃变温条件。结合图1可以看出,当温度低于15 ℃或者高于25 ℃时,杜松种子萌发率明显下降,表明15~25 ℃是杜松种子萌发的适宜土壤温度。
2.2光照对杜松种子萌发的影响
依据上述试验得出的结果,光照对杜松种子萌发的影响试验选择在25 ℃下进行。图4显示,在24 h全光照、10 h半光照与24 h全黑暗处理条件下,杜松种子萌发率和萌发势存在显著差异(P<0.05),但是不同光照条件下发芽指数差异不显著,这说明光照时间对杜松种子的萌发率和萌发势有较大影响,但对发芽指数影响甚微。此外,根据图 5可知,24 h全光照条件下杜松种子的萌发率、萌发势均高于10 h半光照和24 h全黑暗处理,可见光照条件也是影响杜松种子萌发的重要因素之一。
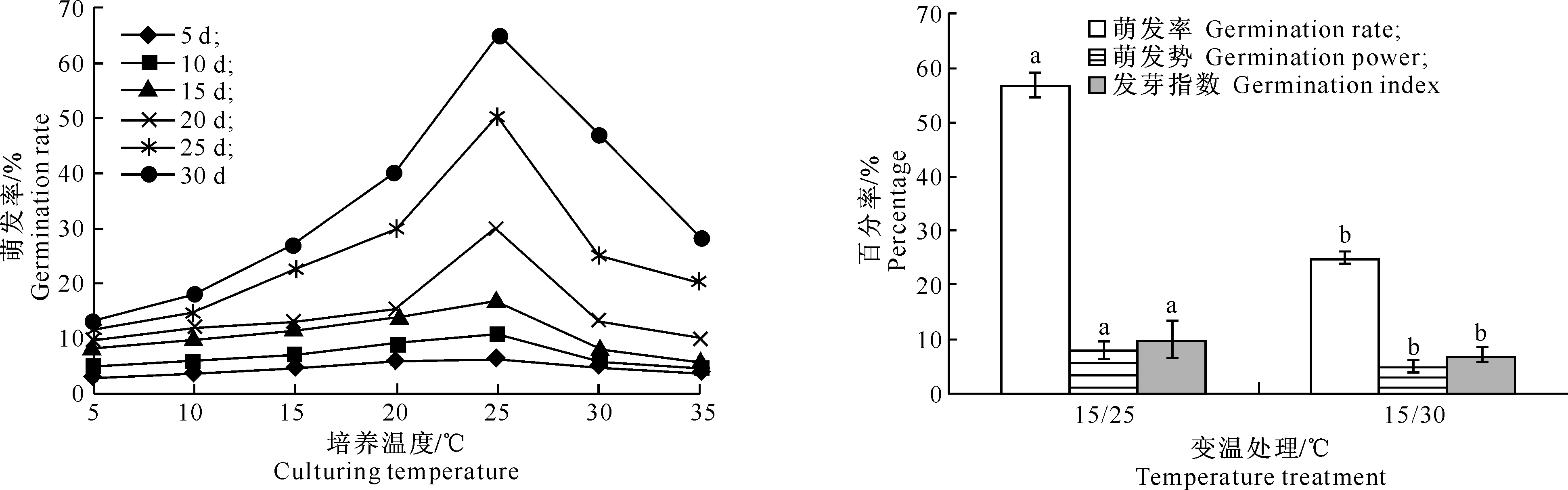
图 2不同温度(恒温)下杜松种子的萌发进程
Fig.2Germination process ofJuniperusrigida
seeds with different temperatures
图 3不同变温处理下杜松种子的萌发情况
Fig.3Germination ofJuniperusrigidaseeds with
different changing temperatures
2.3土壤含水量对杜松种子萌发的影响
由图6可以看出,在土壤含水量为20%时杜松种子萌发率达到最高值,为75%,同时萌发势和发芽指数也均达到最高值,且与其他含水量处理存在显著差异。杜松种子萌发时间大致相同,多集中于7~15 d,具有一定的整齐度(图7)。杜松种子的萌发率在土壤含水量为45%时最低,可能是由于土壤含水量较高时土壤透气性变差所致。

图 4 不同光照处理下杜松种子的萌发情况

图 6不同土壤含水量处理下杜松种子的萌发情况
Fig.6Germination ofJuniperusrigidaseeds with
different soil moistures
图 7不同土壤含水量条件下杜松种子的萌发进程
Fig.7Germination process ofJuniperusrigida
seeds with different soil moistures
2.4埋土深度对杜松种子萌发的影响
由图8可以看出,不同埋土深度处理下杜松种子的萌发率均表现出一定的差异。在观察期(0~45 d)内,杜松种子萌发率、萌发势和发芽指数随埋土深度的增加均呈先增加后下降趋势。从图9可以看出,在萌发的前5 d,埋土深度为5 cm的种子萌发率最低,埋土深度为0 cm的萌发率次之;前15 d内,埋土深度为1和2 cm的杜松种子萌发迅速,且以2 cm深度下的萌发率最高,25 d时萌发率达到最大;埋土深度为3,4和5 cm的杜松种子在前15 d内可萌发,但与埋藏深度1和2 cm相比,这3个埋土深度限制了杜松种子的萌发;与埋深0 cm相比,埋土深度为1~4 cm处理的萌发率均有所提高。结合图8和图9可以看出,埋土深度1和2 cm的种子萌发率较高,埋土深度3 cm的萌发率次之。
图 8不同埋土深度下杜松种子的萌发情况
Fig.8Germination ofJuniperusrigidaseeds with different soil burial depths
图 9不同埋土深度下杜松种子的萌发进程
Fig.9Germination process ofJuniperusrigidaseeds with different soil burial depths
2.5超声波处理对杜松种子萌发的影响
以频率59 kHz、功率500 W的超声波对杜松种子进行不同时间(0,5,10,15,20,25和30 min)的预处理,各处理下杜松种子萌发特性如图10所示。图10显示,与不进行超声预处理相比,除超声30 min处理外,超声5~25 min处理均可有效提高杜松种子的萌发率,但程度不同且存在一定差异,其中超声波处理10 min的杜松种子萌发率、萌发势和发芽指数均达到最高,其中萌发率高达73%;继续增加超声时间至15,25和30 min时,杜松种子的萌发率等指标与超声处理10 min相比均有所下降,其中超声30 min处理的萌发率较对照降低9%。

图 10不同超声波处理时间下杜松种子的萌发特性
Fig.10Germination characteristics ofJuniperusrigidaseeds with different ultrasonic wave times
图 11不同质量分数PEG处理对杜松种子萌发的影响
Fig.11Effect of different PEG concentrations on germination ofJuniperusrigidaseeds
2.6不同质量分数PEG溶液浸泡对杜松种子萌发的影响
由图11可知,与对照相比,杜松种子可通过PEG溶液浸泡处理显著提高其萌发率、萌发势和发芽指数(40%PEG处理除外),且随着PEG质量分数增大均呈先升高后下降趋势,其中以20%PEG溶液浸泡处理24 h的效果最佳,萌发率、萌发势和发芽指数均达到最大,其中萌发率高达75%;当PEG溶液质量分数高于20%后,种子萌发率、萌发势和发芽指数均有所下降,但与未经PEG处理(对照)的种子相比仍有明显提高(40% PEG处理的发芽指数除外),以30%PEG溶液为例,其处理种子的萌发率、萌发势和发芽指数分别较对照提高11%,15.46%和2.45%,说明用一定质量分数的PEG溶液处理杜松种子,能显著提高其萌发率,其中用20%PEG溶液处理最为适宜。
3结论与讨论
3.1种子萌发的适宜温度
种子的萌发过程受到多种内、外因素的影响[20]。温度作为影响种子萌发的关键因素而被广泛研究,适宜的温度能够加强种子萌发过程中的酶促反应和呼吸作用,使种子本身贮藏的养分更容易被有效利用。不同种子萌发的最适温度存在差异,这与植物原产地的温度条件有密切关系。通常来讲,温带植物种子的最适萌发温度为15~25 ℃[21]。付菁等[16]进行了恒温与变温对子午岭辽东栎种子萌发的影响试验,发现在25 ℃条件下辽东栎种子的萌发率与5,10,30,35 ℃相比差异显著,萌发势、发芽指数与5,10,15,20,30,35 ℃条件下相比差异极显著,这说明25 ℃是辽东栎种子的最适宜萌发温度;同时在15 ℃/25 ℃与15 ℃/30 ℃ 2组变温条件下的试验结果表明,15 ℃/25 ℃变温条件下辽东栎种子的萌发率明显高于15 ℃/30 ℃变温条件,说明辽东栎种子萌发时的土壤适宜温度为15~25 ℃。本试验得到了与此相似的结论,即25 ℃条件下杜松种子的萌发特性优于其他温度处理,在15 ℃/25 ℃变温条件下杜松种子的萌发率表现更好,表明15~25 ℃是杜松种子萌发的适宜土壤温度。
3.2种子萌发的适宜光照条件
光作为一种刺激信号,可以打破种子休眠,因此其对种子萌发有重要影响[20]。霍仲芳[21]对花棒种子萌发进行了详细研究,试验设置了3个温度条件(20,25,30 ℃),在同一温度下,分别对种子进行全光照和无光照处理,结果表明全光照条件下种子萌发率显著高于无光照条件。本研究中,杜松种子在全光照处理下萌发率最好,与此研究结论一致。付菁等[16]也进行了光因素对辽东栎种子萌发的影响研究,其研究结论也与本研究一致。此外,光的作用常与环境温度变化密切相关,因此在研究种子萌发过程中,除了需要考虑温度、水分等要素外,还得考虑光的影响作用。
3.3种子萌发的适宜土壤含水量
水分影响种子萌发的原因是种子经过成熟期后极度脱水,当土壤含水量适宜时种子经过充分吸胀才能启动萌发进程,也就是说吸水是种子萌发的开始,因此土壤水分含量的高低对种子的萌发速率和萌发率均有十分重要的影响。霍仲芳[21]的研究表明,不同含水量(15%~30%)条件下花棒种子的萌发率差异显著,以土壤含水量20%时的萌发率最高。本研究也表明,土壤含水量为20%时杜松种子萌发率、萌发势、发芽指数均达最高值,土壤含水量过低或过高都会抑制杜松种子的萌发。因为土壤含水量过低会阻碍种子吸水,使萌发过程受阻;土壤含水量过高则会导致土壤通气性差、缺氧,致使种子萌发减缓;另外,土壤水分含量过多也会使土壤温度上升减慢,导致萌发环境温度不适宜,从而使种子萌发率降低甚至不能萌发。本研究结合野外实际调查比较了8个不同梯度土壤含水量对杜松种子萌发的影响,结果显示杜松种子萌发的最适宜土壤含水量为20%。贺小秀等[15]也开展了水分对柠条种子萌发的影响试验,结果显示土壤含水量为14%时萌发效果最佳。这可能是由于柠条独特的生境条件导致其种子的生理特性与杜松种子有所差异,另外还可能与种子资源及基因特性有关。
3.4种子萌发的适宜覆土深度
覆土深度对种子萌发率有较大影响,不同土层中种子萌发率有很大差异。贺小秀等[15]的研究表明,土壤表层柠条种子萌发率为10%,在1和2 cm土层中萌发率可以提高到77.8%和70%,人工播种柠条时种子的覆土厚度以1~2 cm为宜,覆土太厚(3 cm以上)或不覆土对柠条种子的发芽都有不利影响;当柠条种子被埋到5 cm以下土层时其萌发率仅为4.0%。本研究表明,在一定埋土深度范围内,杜松种子的萌发率随埋土深度的增加而先提高后降低,不同覆土厚度下杜松种子的萌发率存在一定差异,其中5 cm埋土深度处理的杜松种子萌发率最低,为35%,移除上层土壤后发现大部分种子已经霉变,只有少许种子萌发,这说明埋藏过深、覆土过多会导致土壤透气性差、缺氧,致使无氧呼吸产生的CO和酒精对种子产生毒害作用,最终导致种子腐烂[22];另一方面,杜松是喜光树种,种子埋藏过深致使土壤内部光照减弱,种子萌发时不能感受到光刺激,萌发过程也会受到抑制[15]。此外,种子萌发后出土时间的长短也会受到埋藏深度的影响。由于杜松种子属球果类型,外表被坚硬外壳覆盖,种子萌发需要先破壳后破土,所以种子埋藏越深,萌发时间越长。自然状态条件下,当杜松种子成熟后,很难落到土层3 cm以下,大部分种子都散落到土壤的表层,有的种子在经过风吹或水流冲刷后上面可以覆盖薄薄的一层土,在这样的条件下可以顺利萌发,且有利于幼苗的形成。但是另一方面,由于表土层太薄,不利于种子吸收土壤中的水分、养分,使根系不能顺利扎入土层而形成壮苗,将导致大量的幼苗在冬天死亡,这一点也解释了杜松种群繁殖率较低乃至处于濒危地位的原因。
3.5超声波预处理与杜松种子萌发
超声波预处理是通过物理作用促进种子萌发的一种常用方法,超声波的空化热效应、机械效应以及消毒效应可以加速种子萌发,提高种子萌发率和发芽速度[23]。时维静等[24]采用超声波处理白头翁种子、李刚等[25]采用超声波处理当归种子以及刘丽莉等[26]采用超声波处理美洲商陆种子的萌发研究均得到了相同的结论。
超声波对种子萌发特性的作用效果受到各种因素的影响,如超声波功率、频率、处理时间以及种子生物学特性等,因此处理条件呈现多样化。如柴胡种子经超声波(50 W,40 kHz)处理25 min,种子发芽指标达到最优[27];苏铁种子经超声波(1.45 MHz,25 W)处理20 min效果最好[28];冬瓜种子经超声波(80 W,40 kHz)处理5 min,种子萌发率、萌发势、发芽指数和发芽速率均有所提高[29]。本研究表明,59 kHz、500 W超声波处理10 min时杜松种子的萌发效果最好,萌发率、萌发势和发芽指数分别较未经超声波处理的对照增加20%,15.32%和2.53%;但处理时间超过10 min时,超声波处理则会抑制种子萌发,推测其原因可能是过长的超声波处理时间破坏了包括细胞膜在内的细胞组织器官,导致种子活力下降。本研究结论可以供生产中借鉴,但由于本研究仅采用59 kHz、500 W超声波处理杜松种子,对其他频率、功率的超声波处理试验还有待深入研究。
3.6PEG溶液浸种处理与松种子萌发
本研究发现,经过PEG溶液浸泡处理后,杜松种子的萌发率、萌发势和发芽指数均有所提高,这与孙建华等[30]、丁永乐等[31]和Mc Donaldm[32]得出的结论相符。在本试验中,随着PEG溶液质量分数的增大,杜松种子萌发率先升高后降低,其中20%PEG溶液浸泡处理可以显著提高种子的萌发率、萌发势和发芽指数,这与洪法水等[33]、陈源等[34]和刘杰等[35]的研究结论相一致。PEG溶液处理促进种子萌发的原因在于PEG是一种高分子渗透保护剂,其可以通过溶液渗透势调节种子吸水速度,修复细胞膜,增强种子活力[30];此外,相关研究显示PEG还可以启动与种子萌发相关的代谢过程[33-35]。本试验在同一时间处理梯度下设置了4组PEG质量分数梯度,试验得出的规律相对有限,因此在今后的研究中还应当增加质量分数和时间梯度的设置,从而使试验结果更加可靠。
PEG处理条件的选择对种子萌发效果至关重要。PEG渗调条件的选择应归根于种子[30],种子的吸水特性以及影响吸水速度的所有因子都会对种子萌发效果产生影响。李敏[36]曾提出,PEG渗调处理应注意渗调潜势、渗调温度、渗调时间,除此外还应注意微生物侵染、氧气与光照的调控等;喻方圆等[37]还提出,在PEG渗调处理的同时添加适量H2O2,可起到消毒和补充氧气的作用。总之,种子PEG渗调条件的选择应以种子为出发点,围绕种子吸水过程,结合PEG溶液所能营造的渗调氛围进行合理的选择[19]。
[参考文献]
[1]褚胜利,李登武,李景侠.陕西府谷杜松自然保护区杜松群落特征研究 [J].干旱地区农业研究,2008,26(2):165-170.
Chu S L,Li D W,Li J X.Study on the feature ofJuniperusrigidacommunity in Fugu Nature Reserve in Shaanxi Province [J].Agricultural Research in the Arid Areas,2008,26(2):165-170.(in Chinese)
[2]褚胜利,李登武,李景侠.陕西府谷杜松自然保护区杜松种群结构与生命表分析 [J].四川大学学报(自然科学版),2008,45(1):176-180.
Chu S L,Li D W,Li J X.Study on the population structure and life table of the endangered population ofJuniperusrigidain Fugu nature reserve in Shaanxi province [J].Journal of Sichuan University (Natural Science Edition),2008,45(1):176-180.(in Chinese)
[3]刘雨,李登武,秦廷松,等.宁夏贺兰山杜松天然群体的表型多样性研究 [J].浙江农林大学学报,2011,28(4):619-627.
Liu Y,Li D W,Qin T S,et al.Phenotypic diversity for natural populations ofJuniperusrigidain the Helan Mountains of Ningxia [J].Journal of Zhejiang A&F University,2011,28(4):619-627.(in Chinese)
[4]中国科学院中国植物志编辑委员会.中国植物志:一卷 [M].北京:科学出版社,2004.
Editorial Committee of Flora of China,Chinese Academy of Sciences.Flora of China:Vol.1 [M].Beijing:Science Press,2004.(in Chinese)
[5]高艳平,胡玉山.干旱寒冷地区园林绿化优良树种:杜松 [J].河北林业科技,2005(4):108.
Gao Y P,Hu Y S.An excellent tree species in arid and cold areas:Juniperusrigida[J].The Journal of Hebei Forestry Science and Technology,2005(4):108.(in Chinese)
[6]李景侠,张文辉,杨赵洁.陕西省地方重点保护植物及保护对策 [J].西北林学院学报,1999,14(3):6-12.
Li J X,Zhang W H,Yang Z J.On the important native conservated plants in Shaanxi province and strategies of conservation [J].Journal of Northwest Forestry University,1999,14(3):6-12.(in Chinese)
[7]Huh M K,Huh H W.Genetic diversity and population structure ofJuniperusrigida(Cupressaceae) andJuniperuscoreana[J].Evol Ecol,2000,14(2):87-98.
[8]褚胜利,李登武,李景侠.陕西府谷自然保护区杜松种群的空间分布格局及其动态 [J].植物资源与环境学报,2007,16(4):34-37.
Chu S L,Li D W,Li J X.Spatial distribution patterns and dynamics ofJuniperusrigidapopulation in Fugu Nature Reserve of Shaanxi Province [J].Journal of Plant Resources and Environment,2007,16(4):34-37.(in Chinese)
[9]曹志勇,邵芬娟,刘亚娟,等.杜松小孢子的发生和雄配子体的发育 [J].林业科学,2009,46(3):74-78,173.
Cao Z Y,Shao F J,Liu Y J,et al.Microsporogenesis and male gametophyte development ofJuniperusrigida[J].Scientla Silvae Sinicae,2009,46(3):74-78,173.(in Chinese)
[10]曹泽猷.杜松种子萌发及育苗技术的研究 [J].林业实用技术,1993(4):6-9.
Cao Z Q.Study onJuniperusrigidaseed germination and seedling technology [J].Practical Forestry Technology,1993(4):6-9.(in Chinese)
[11]杜文革,王统海,李雪,等.用浓硫酸快速催芽杜松种子的试验 [J].中国林副特产,2008(5):37-38.
Du W G,Wang T H,Li X,et al.A test on quickly sproutingJuniperusrigidaseeds with concentrated sulfuric acid [J].Forest By-Product and Speciality in China,2008(5):37-38.(in Chinese)
[12]王志军,刘继先.不同种子催芽方法对杜松育苗的影响 [J].林业勘查设计,2012(1):82-83.
Wang Z J,Liu J X.The effect of different methods of seed germination on the seedlings ofJuniperusrigidaSieb et Zucc [J].Forest Investigation Design,2012(1):82-83.(in Chinese)
[13]焦菊英,王万中,李靖.黄土高原林草水土保持有效盖度分析 [J].植物生态学报,2000,24(5):608-612.
Jiao J Y,Wang W Z,Li J.Effective cover rate of woodland and grassland for soil and water conservation [J].Acta Phytoecology Sinica,2000,24(5):608-612.(in Chinese)
[14]杨期和,叶万辉,张云,等.锥栗种子萌发和贮藏特性的初步研究 [J].北京林业大学学报,2005,27(1):92-95.
Yang Q H,Ye W H,Zhang Y,et al.Eco-physiological characteristics of germination and storage ofCastanopsischinensisseeds [J].Journal of Beijing Forestry University,2005,27(1):92-95.(in Chinese)
[15]贺小秀,王勇.不同环境因子对柠条种子萌发影响的研究 [J].中国农学通报,2010,26(17):137-140.
He X X,Wang Y.Influence of different environmental factors on bourgeoning condition ofCaraganakorshinskillseed [J].Chinese Agricultural Science Bulletin,2010,26(17):137-140.(in Chinese)
[16]付菁,王辉,李永兵.子午岭辽东栎种子萌发影响因子试验研究 [J].甘肃农业大学学报,2009,44(1):123-126.
Fu J,Wang H,Li Y B.Study on impact factors ofQuercuswutaishanicaseed germination in Ziwu Mountains [J].Journal of Gansu Agricultural University,2009,44(1):123-126.(in Chinese)
[17]李新艺,贺蕾.杜松育苗技术初探 [J].陕西林业,2011(3):36.
Li X Y,He L.Preliminary study of techniques for growing seedlings ofJuniperusrigida[J].Forestry of Shaanxi,2011(3):36.(in Chinese)
[18]史锋厚,刘传志,李晓军,等.超声波处理对油松种子萌发的影响 [J].种子,2011,30(8):81-83.
Shi F H,Liu C Z,Li X J,et al.Effect of ultrasonic wave treatment on germination of Chinese Pine seed [J].Seed, 2011,30(8):81-83.(in Chinese)
[19]朱灿灿,史锋厚,沈永宝,等.PEG处理对油松种子萌发的影响 [J].种子,2007,26(8):63-67.
Zhu C C,Shi F H,Shen Y B,et al.Effects of PEG treatment on germination of Chinese Pine seed [J].Seed,2007,26(8):63-67.(in Chinese)
[20]傅家瑞.种子生理 [M].北京:科学出版社,1985.
Fu J R.Seed physiology [M].Beijing:Science Press,1985.(in Chinese)
[21]霍仲芳.环境因子对花棒种子萌发影响的研究 [J].内蒙古林业调查设计,2010,33(2):98-100.
Huo Z F.Influence of environmental factors on seed germination ofHedysarumscoparium[J].Inner Mongaolia Forestry Investigation and Design,2010,33(2):98-100.(in Chinese)
[22]李合生,孟庆伟,夏凯,等.现代植物生理学 [M].北京:高等教育出版社,2002:284.
Li H S,Meng Q W,Xia K,et al.Modern plant physiology [M].Beijing:Higher Education Press,2002:284.(in Chinese)
[23]蒋玲艳,王林果.生物技术领域中超声波的应用 [J].生物技术通讯,2006,17(1):126-128.
Jiang L Y,Wang L G.Application of ultrasound in biotechnology [J].Letters in Biotechnology,2006,17(1):126-128.(in Chinese)
[24]时维静,张子学,于群英,等.白头翁种子发芽特性研究 [J].种子,2005,24(4):60-62.
Shi W J,Zhang Z X,Yu Q Y,et al.Study on germination characters of pasqueflower seed [J].Seed,2005,24(4):60-62.(in Chinese)
[25]李刚,王乃亮,罗娘娇,等.超声波处理对当归种子萌发及活力的影响 [J].西北师范大学学报(自然科学版),2007,43(3):75-78.
Li G,Wang N L,Luo N J,et al.The effect of ultrasonic wave onAngelicasineasia(Oliv) Diels seeds vitality and germination [J].Journal of Northwest Normal University (Natural Science Edition),2007,43(3):75-78.(in Chinese)
[26]刘丽莉,冯涛,严明理,等.几种破除美洲商陆种子休眠的方法 [J].植物生理学通讯,2007,43(4):795-796.
Liu L L,Feng T,Yan M L,et al.Several methods of breaking dormancy in seeds ofPhytolaccaamericana[J].Plant Physiology Communications,2007,43(4):795-796.(in Chinese)
[27]董汇泽,杨君丽,张生菊.超声波对野生柴胡种子萌发及活力的影响 [J].中国种业,2005(12):46-47.
Dong H Z,Yang J L,Zhang S J.Effect of ultrasonic on the germination and vigor ofBupleurumroot seed [J].China Seed Industry,2005(12):46-47.(in Chinese)
[28]肖宜安,李化茂,冯若.超声辐照对苏铁种子萌发的影响 [J].植物生理学通讯,1999,35(4):293.
Xiao Y A,Li H M,Feng R.Effect of ultrasonic irradiation on the germination ofCycadsseed [J].Plant Physiology Communications,1999,35(4):293.(in Chinese)
[29]陆美莲,郑慧明.理化处理促进冬瓜种子萌发 [J].作物杂志,2003(6):38-39.
Lu M L,Zheng H M.Physical and chemical treatment promote wax gourd seed germination [J].Crops,2003(6):38-39.(in Chinese)
[30]孙建华,王彦荣,余玲,等.聚乙二醇引发对几种牧草种子发芽率和活力的影响 [J].草业学报,1999,8(2):34-42.
Sun J H,Wang Y R,Yu L,et al.Effects of osmotic priming with polyethylene glycol on seed germination and vigour of some herbage species [J].Acta Prataculturae Sinica,1999,8(2):34-42.(in Chinese)
[31]丁永乐,杨铁钊,郑宪滨,等.PEG对烤烟种子萌发和幼苗生理特性的影响 [J].河南农业科学,2000(1):8-10.
Ding Y L,Yang T Z,Zheng X B,et al.Effect of PEG on seed germination and seedling physiological characters of seedlings in flue-cured tobacco [J].Journal of Henan Agricultural Sciences,2000(1):8-10.(in Chinese)
[32]Mc Donaldm B.Seed deterioration physiology repair and assessment [J].Seed Sci Technol,1999,27:177-237.
[33]洪法水,马成仓,王旭明,等.聚乙烯醇预处理小麦种子对萌发代谢及生长的影响 [J].作物学报,1997,23(2):247-252.
Hong F S,Ma C C,Wang X M,et al.Effect of polyvinyl alcohol pretreatment on seed germination metabolism and growth of wheat [J].Acta Agronomica Sinica,1997,23(2):247-252.(in Chinese)
[34]陈源,冯建民,汪爱君,等.马尾松种子活化技术研究 [J].浙江林业科技,1999,19(2):21-25.
Chen Y,Feng J M,Wang A J,et al.Studies on activation techniques for seed ofPinusmassoniana[J].Journal of Zhejiang Forestry Science and Technology,1999,19(2):21-25.(in Chinese)
[35]刘杰,刘公社,齐冬梅,等.聚乙二醇处理对羊草种子萌发及活性氧代谢的影响 [J].草业学报,2002,11(1):1-3.
Liu J,Liu G S,Qi D M,et al.Effect of PEG on germination and active oxygen metabolism in wildrye (Leymuschinensis) seeds [J].Acta Prataculturae Sinica,2002,11(1):1-3.(in Chinese)
[36]李敏.利用PEG渗调法提高牧草种子活力的研究 [J].国外畜牧学:草原与牧草,1995(3):29-31.
Li M.Study on improving the grass seed vigor using PEG infiltration method [J].Foreign Animal Husbandry:Grassland and Forage Grass,1995(3):29-31.(in Chinese)
[37]喻方圆,刘远.聚乙二醇渗透处理对马尾松种子活力的影响 [J].南京林业大学学报,2000,24(1):38-40.
Yu S X,Liu Y.Effects of PEG pretreatment on seed vigor of Masson Pine [J].Journal of Nanjing Forestry University,2000,24(1):38-40.(in Chinese)
Influencing factors on seed germination ofJuniperusrigidafrom Helan Mountain
LIU Yong-hui,MA Zhen-hua
(NorthwestInstituteofForestInventory,PlanningandDesign,StateForestryAdministration,Xi’an,Shaanxi710048,China)
Abstract:【Objective】 This study investigated the effect of different pretreatment methods and environmental factors on seed germination of Juniperus rigida in Helan Mountain to improve its germination efficiency,forest regeneration,and artificial cultivation.【Method】 The effects of different temperatures (5,10,15,20,25,30,and 35 ℃),light times (0,10,and 24 h),soil moistures (10%,15%,20%,25%,30%,35%,40%,and 45%),soil burial depths (0,1,2,3,4,and 5 cm),as well as two pretreatment methods with ultrasonic wave with different times (0,5,10,15,20,25,and 30 min) and polyethylene glycol (PEG) with different concentrations (0%,10%,20%,and 30%) on germination of J.rigida seeds were studied under the simulated environment in artificial climate box.【Result】 The germination rate,germination potential and germination index were all significantly different under different temperatures and optimum germination temperature was 15-25 ℃.With full-light (24 h),germination rate of J.rigida seeds was 71%,higher than all other treatments.The germination rate reached 75% when the soil moisture was 20%.Burial depth had great impacts on the germination rate and shallow underground burial (1-2 cm) was more appropriate for germination.Both ultrasonic wave and PEG methods promoted the seed germination.With the extension of ultrasonic pretreatment time and the increase of PEG solution concentration,the seed germination rate showed a parabolic trend,increasing first and then decreasing.The highest seed germination rate with 59 kHz and 500 W ultrasonic wave for 10 min was lower than that soaked in 20% PEG solution for 24 h.【Conclusion】 Sun light time and PEG pretreatment were the important factors influencing J.rigida seeds germination rate and the optimal rate of 75% was obtained with 25 ℃,soil moisture content 20%,1-2 cm of buried depth,and 20% PEG solution for 24 h.
Key words:Juniperus rigida;seed germination;environmental factors;Helan Mountain
DOI:网络出版时间:2016-05-0314:0510.13207/j.cnki.jnwafu.2016.06.010
[收稿日期]2014-10-31
[基金项目]国家自然科学基金项目(30972352)
[作者简介]刘永辉(1979-),男,陕西西安人,工程师,主要从事林业资源调查规划及新技术开发利用研究。
[中图分类号]S791.450.5
[文献标志码]A
[文章编号]1671-9387(2016)06-0062-09
网络出版地址:http://www.cnki.net/kcms/detail/61.1390.S.20160503.1405.020.html

