高渗培养基对椎间盘内髓核细胞活力及代谢的影响
白亦光, 陈巧玲, 刘 康, 杨泽龙, 罗栩伟, 冯 刚
(1川北医学院第二临床医学院,南充市中心医院骨科,南充 637000; 2川北医学院第二临床医学院,南充市中心医院肿瘤科; 3川北医学院第二临床医学院,南充市中心医院组织工程与干细胞研究所; *通讯作者,E-mail:cql166@163.com)
高渗培养基对椎间盘内髓核细胞活力及代谢的影响
白亦光1, 陈巧玲2*, 刘康3, 杨泽龙1, 罗栩伟1, 冯刚3
(1川北医学院第二临床医学院,南充市中心医院骨科,南充637000;2川北医学院第二临床医学院,南充市中心医院肿瘤科;3川北医学院第二临床医学院,南充市中心医院组织工程与干细胞研究所;*通讯作者,E-mail:cql166@163.com)
摘要:目的探讨高渗培养基对椎间盘内髓核组织及髓核细胞活力的影响。方法6-7周龄SD大鼠10只,无菌取每只大鼠胸腰段椎间盘9个,置于高渗(410 mOsm/kg)培养基中整体培养,培养前及培养第7,14,21,28天,利用Mitotracker Green荧光探针、免疫组织化学和生物化学方法检测细胞的活力、椎间盘结构的变化以及髓核组织细胞外基质成分的变化。结果椎间盘组织形态、细胞存活率及髓核细胞外基质成分与新鲜离体椎间盘无统计学差异。髓核细胞存活率荧光强度检测提示培养后第21天与培养前比较荧光强度明显降低(7 782±367 vs 10 435±376,P<0.05)。髓核组织内蛋白多糖含量(mg/100 mg)检测提示培养第21天与培养前相比明显降低(3.72±0.45 vs 6.35±0.76,P<0.05)。结论在高渗培养基中(410 mOsm/kg),髓核细胞可以良好存活至少14 d,大鼠髓核组织内蛋白多糖可以有效保持14 d。
关键词:高渗培养基;椎间盘;髓核组织;髓核细胞
椎间盘退行性变(intervertebral disc degeneration,IDD)是目前人类下腰痛的主要病因,如腰椎间盘突出症、腰椎管狭窄症和退变性腰椎侧凸等一系列疾病均与其有关[1]。关于IDD的病因和病理生理机制尚未完全明确,一般认为主要是椎间盘细胞和细胞外基质(蛋白聚糖、胶原等)的丢失以及终板的钙化,改变了椎间盘生物力学机制[2]。目前主要临床治疗方法是外科手术治疗,在解除病变节段的同时,又使邻近节段发生退变,还降低了关联运动阶段的灵活性,增加了邻近节段的负担。目前对于椎间盘生物治疗的研究主要体现在利用基因工程、细胞工程及组织工程手段来恢复退变椎间盘细胞的数量及生物活性,如使用骨髓间充质干细胞,脂肪干细胞,GDF-5基因干预,体外完整组织工程椎间盘的构建等[3]。但尚没有一种完整椎间盘培养模型可供观察。
本实验拟在体外建立一种椎间盘器官整体培养系统并观察在此系统中髓核细胞的活力,为今后研究IDD此类疾病探索一种有效的离体器官模型。
1材料与方法
1.1实验动物及主要试剂、仪器
6-7周龄SD大鼠10只,近交系,清洁动物,体重约(300±25)g,雌雄不限,由川北医学院实验动物中心提供。CO2培养箱箱(美国Thermo公司),超净工作台(美国Airtech公司),倒置相差显微镜(日本Nikon公司)。Ⅱ型胶原免疫细胞化学试剂盒(美国Chondrex公司),DAB显色试剂盒(碧云天生物技术公司),胎牛血清(美国Hyclone公司),DMEM高糖培养基(美国Hyclone公司)。Mitotracker Green分子探针(美国Hyclone公司)。Mitotracker Green(Molecular Probes,Eugene,OR)(浓度5 μmol/L)
1.2椎间盘器官整体获取及培养
10%水合氯醛(5 ml/kg)麻醉大鼠,无菌操作完整切取包括上、下软骨终板、纤维环及髓核组织的胸腰段椎间盘整体器官共90个,在操作过程中尽可能的将软骨终板向邻近的骨质分离干净,用含肝素的高渗PBS液充分冲洗后,置入含有渗透压为410 mOsmol/kg高渗培养液的12孔培养板内,每天换液1次。于培养第0,7,14,21,28天进行以下检测。
1.3细胞活力的测定
在培养0,7,14,21,28 d各取3个椎间盘,用HBSS液反复漂洗各标本。放入已加入Mitotracker Green分子探针(5 μmol/L)的培养基中,在37 ℃孵箱中共孵育1 h。将椎间盘放入不含荧光染料的新鲜培养基中孵育1 h,以除去未结合的荧光染料。然后,无菌条件下切开椎间盘纤维环,刮出髓核组织,浸入载玻片上的HBSS液中,在荧光显微镜下进行观察,髓核组织中有活力的细胞因被分子探针染色而发出绿色荧光。
1.4组织学及免疫组化
通过病理组织学切片番红O染色镜下观察整体椎间盘的结构,采用免疫荧光染色了解髓核组织内Aggrecan(蛋白聚糖)的表达量,具体方法如下:使用10%多聚甲醛固定,脱钙液浸泡6 d,沿矢状位中线切开整体椎间盘,包埋,切片(厚5 μm),染色观察,使用倒置显微镜观察并采集图像。
番红O染色:切片二甲苯梯度酒精脱蜡至水;苏木素染色10 min;0.2%亮绿染色10 min;0.1%番红O染色10 min,1%醋酸酒精分化液分化3 s,树脂封片后镜下观察。
Aggrecan(蛋白聚糖)免疫荧光染色:将上述切片二甲苯梯度酒精脱蜡至水;3%过氧化氢封闭10 min(避光);微波加热修复抗原;正常血清封闭处理30 min;添加一抗(小鼠抗兔)4 ℃过夜;添加二抗(羊抗小鼠)37 ℃ 1 h;抗荧光淬灭剂封片;荧光显微镜下观察并采集图像。
1.5髓核组织蛋白多糖(sGAG)含量测定
将各时间点椎间盘中髓核组织取出经木瓜蛋白酶1 ml 56 ℃消化24 h;配制1 000 μg/ml硫酸软骨素溶液:取出数个干净1.5 ml EP管,按标准做1-100 μg/ml标准液,并做好标记;取木瓜蛋白酶消化的组织混合液0.5 ml,加入100 mmol/L碘乙酸0.5 ml,继续加入0.5 mol/L Tris 0.5 ml;加入50 mmol/L Tris-HCl (pH8.0)3 ml;测定标准曲线:取100 μl标准液,加入2.5 ml DMB显色液,混匀,反应15 s,于525 nm处比色,测吸光度,做标准曲线;DMB显色:同法测定组织上清液吸光度。根据标准曲线计算样品sGAG含量。
1.6统计学分析
采用SPSS13.0统计软件包进行分析。数据以均数±标准差表示,组间比较采用单因素方差分析,P<0.05为差异有统计学意义。
2结果
2.1髓核细胞成活率观察
Mitotracker Green荧光探针测定显示:体外培养至第7天,髓核组织内髓核细胞数量较多、活力较好,显微镜下表现出较高的荧光强度(见图1A);第14天髓核细胞荧光强度出现降低(见图1B),第21天时荧光强度进一步下降(见图1C);到第28天时显微镜下显示荧光几乎消失,表明髓核细胞的存活率明显下降(见图1D)。髓核细胞不同时期Mitotracker Green荧光定量测定结果见表1。其中第21天时荧光强度较培养第14天明显降低,有统计学差异(F=5.34,P<0.05)。
2.2椎间盘组织学变化
番红O染色观察提示培养第7天、第14天,椎间盘结构完整,与髓核组织界限清晰,髓核组织内可看到完整髓核细胞簇状分布,染色呈红色,胞外基质丰富饱满,纤维环排列有序(见图2A、B)。培养第21天后髓核组织中细胞含量明显减少且分布不均匀,形态呈现不规则,纤维环软骨组织增生,纹理排列紊乱(见图2C)。培养第28天时髓核组织中主要为纤维软骨组织,髓核细胞几乎完全消失,形态进一步呈现不规则状态(见图2D)。

图1 培养第7天、第14天、第21天和第28天Mitotracker Green荧光探针观察髓核细胞活性 (×40)Figure 1 Cell viability of nucleus pulposus by Mitotracker green fluorescent probe at 7 d, 14 d, 21 d and 28 d after the culture (×40)
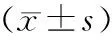
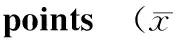

时间荧光强度值培养前10435±376培养第7天9976±348培养第14天9899±281培养第21天7782±367*培养第28天7568±298*
与培养前、培养第7,14天比较,*P<0.05
2.3椎间盘组织中蛋白聚糖含量变化
Aggrecan免疫荧光显示椎间盘组织中蛋白聚糖荧光随时间延长明显降低,培养第7,14天髓核组织蛋白聚糖免疫荧光检测呈现绿色荧光(见图3A、B)。培养第21天可见荧光含量减少,分布不均匀(见图3C)。第28天荧光强度减弱更加明显,髓核组织荧光显著减少,荧光区域之间被纤维条索状结构分割(见图3D)。
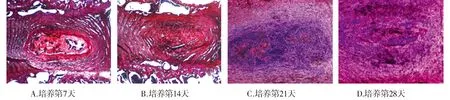
图2 培养第7天、第14天、第21天和第28天整体椎间盘番红O染色结果 (×40)Figure 2 Safranin O dye results of the whole intervertebral disc after culture for 7 d, 14 d, 21 d and28 d (×40)

图3 培养第7天、第14天、第21天和第28天免疫荧光观察椎间盘组织中蛋白聚糖的表达 (×40)Figure 3 Immunofluorescence results of aggrecan content in intervertebral disc tissue after culture for 7 d, 14 d, 21 d and 28 d (×40)
2.4髓核组织蛋白聚糖含量测定
木瓜蛋白酶消化法测得髓核组织中蛋白聚糖含量结果显示:培养第7天,第14天蛋白多糖含量下降无明显统计学意义;第21天时与培养前、培养第7,14天相比蛋白聚糖含量下降有明显统计学意义(P<0.05,见表2),培养第21天,第28天蛋白多糖含量进行性下降。

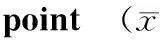

时间蛋白多糖含量培养前6.35±0.76培养第7天5.07±0.54培养第14天5.12±0.87培养第21天3.72±0.45*培养第28天2.45±0.32*
与培养前、培养第7,14天比较,*P<0.05
3讨论
椎间盘器官培养模型是利用椎间盘自身的三维结构和可调控的培养条件,将完整的椎间盘(包括髓核及其周围的纤维环和终板)在体外进行整体培养,从而保留了重要的细胞-细胞和细胞-基质的相互作用。近年来国内外学者对椎间盘器官整体培养逐渐重视。椎间盘器官由上、下软骨终板,中间的纤维环和髓核组织组成,纤维环主要由纤维环细胞及Ⅰ型胶原组成,髓核组织主要由髓核细胞、Ⅱ型胶原及蛋白聚糖组成[4]。椎间盘髓核及纤维环的营养代谢主要通过软骨终板的渗透作用得以实现,所以在体外设计这样的整体器官培养模型对研究下腰痛病因、病理及治疗学等方面具有积极的意义。
国外许多学者在取材工程中,尽可能地分离软骨终板周围骨质,以缩短营养物质的弥散距离,Ariga等[5]对小鼠的椎间盘进行了器官培养,取材时仅保留了靠近终板1-2 mm厚的椎体骨质;Gantenbein等[6]则在切取羊椎间盘前对椎间盘组织进行了抗凝预处理,防止血凝块阻塞毛细血管网,从而影响营养物质的弥散。我们则切取包括上、下软骨终板及难以分离的少量松质骨、纤维环及髓核组织,这一方面有利于体外高渗培养时的营养渗透,而另一方面则保持间盘的结构的完整性。椎间盘的整体结构与功能较大程度地依赖髓核细胞的生存能力及细胞外基质的丰富程度,在椎间盘的生物研究领域已不断证实,椎间盘的退变最开始发生于髓核细胞的凋亡和髓核组织含水量的下降,在影像学表现为椎间盘高度的下降和MRI上T2相髓核信号的降低。
本研究表明,在高渗的培养液中,髓核细胞及髓核组织能够存活2周左右,2周后髓核细胞的生存能力出现明显的下降。髓核组织内细胞及胞外基质的变化与椎间盘整体的功能密切相关,从椎间盘髓核结构方面和Mitotracker Green荧光探针测定髓核细胞成活率方面观察,两种结果呈现出同步退变的过程,即髓核细胞活性下降的同时,椎间盘髓核结构也发生一定程度的紊乱。在特定的渗透压下,体外整体培养的椎间盘可以有效地存活2周,为椎间盘的生物治疗提供了简便易行的模型,在410 mOsm/kg高渗状态下,培养基内的营养成分通过软骨终板或者纤维环渗透入髓核组织内部,供给髓核细胞营养,维持2周内髓核细胞的生存。离体培养的整体椎间盘组织相比于体内缺乏力学刺激而产生向外膨胀的应力,人为的高渗培养基可以产生有效的回缩应力对抗膨胀,还可通过改变细胞外基质的渗透性来维持细胞基质代谢平衡或者直接通过提高培养基的渗透压来模拟椎间盘在体内所处的力学环境,从而维持髓核细胞基质的代谢平衡[7]。
番红O染色则可对髓核组织内的蛋白聚糖的变化行大体观察,从实验结果中可以看到,2周内椎间盘结构完整,与髓核组织界限清晰,有效地维持了髓核组织的形态,表明整体椎间盘在体外可以良好存活。Aggrecan免疫荧光显示椎间盘组织中蛋白聚糖荧光含量,培养第21天可见荧光含量减少。第28天荧光强度减弱更加明显,与木瓜蛋白酶消化法测得髓核组织中蛋白多糖含量结果保持了较大的一致,Mitotracker Green荧光探针测定显示髓核细胞成活率,获得了荧光定量测定结果,其结果为组织学和免疫组化检测提供了佐证。所以我们得出了这样的结果,在410 mOsm/kg高渗状态下,大鼠椎间盘整体培养中髓核细胞的存活和髓核组织的生物特性可以至少良好地保持2周。
椎间盘器官整体培养可以最大限度地保留髓核细胞间、细胞与基质间及基质内部的结构完整性,也保证了功能方面的完整性,这也是椎间盘器官整体培养相对于孤立的进行髓核、纤维环或者终板的研究有较明显的优势所在。在椎间盘器官整体培养基本可行的基础上,一些研究者不断完善培养条件试图获得更为理想的椎间盘:Risbud等[8]比较了不同亚型TGF-β对基质表达的影响得出TGF-β3对基质表达的促进作用更强,而且提高了细胞的成活力及代谢活性,同时降低了细胞的凋亡率。近期,Koerner等[9]在椎间盘整体培养模型中利用P多肽激活了椎间盘中炎症通路,并导致了IL-6在椎间盘内的高表达。Li等[10]在大鼠椎间盘整体培养模型中利用芝麻素抑制盘内炎性物质的分泌和细胞外基质分解。可见椎间盘器官的整体培养模型可为椎间盘退行性变的研究提供更加完整的实验空间,在整体椎间盘中进行实验研究能够更加贴近真实的人类椎间盘退变过程。从而为由椎间盘引起的下腰痛提供更为广阔的研究舞台。
本实验室会在本次实验的基础上通过进一步在高渗培养基中添加各种生长因子,了解通过培养基成分的改变对髓核组织体外生存的影响,进而了解整体椎间盘器官体外存活的机制,为了解椎间盘退行性变疾病发病机制及治疗策略提供更加有益的科学的研究。
参考文献:
[1]白亦光,韩小伟,张旭乾,等.穿刺抽吸法诱导兔椎间盘退变模型[J].川北医学院学报,2013,28(2):91-94.
[2]彭宝淦,贾连顺,施杞,等.软骨终板钙化在椎间盘退变过程中的作用机理[J].中国矫形外科杂志,2000,7(2):147-150.
[3]冯刚.椎间盘退行性变的生物治疗研究专题[J].川北医学院学报,2013,28(2):89.
[4]Kroeber M,Unglaub F,Guehring T,etal.Effects of controlled dynamic disc distraction on degenerated intervertebral discs:an in vivo study on the rabbit lumbar spine model[J].Spine(Phila Pa 1976),2005,30(2):181-177.
[5]Ariga K,Yonenobu K,Nakase T,etal.Mechanical stress-induced apoptosis of endplate chondrocytes in organ-cultured mouse intervertebral discs:an ex vivo study[J].Spine(Phila Pa 1976),2003,28(14):1528-1533.
[6]Gantenbein B,Grünhagen T,Lee CR,etal.An in vitro organ culturing system for intervertebral disc explants with vertebral endplates:a feasibility study with ovine caudal discs[J].Spine(Phila Pa 1976),2006,31(23):2665-2673.
[7]Pritchard S,Guilak F.The role of F-actin in hypoosmotically induced cell volume change and calcium signaling in annulus fibrous cells[J].Ann Biomed Eng,200432(1):103-111.
[8]Risbud MV,Di Martino A,Guttapalli A,etal.Toward an optimum system for intervertebral disc organ culture:TGF-3 enhances nucleus pulposus and anulus fibrosus survival and function through modulation of TGF-R expression and ERK signaling[J].Spine (Phila Pa 1976),2006,31(8):884-890.
[9]Koerner JD,Markova DZ,Schroeder GD,etal.The effect of substance p on an intervertebral disc rat organ culture model[J].Spine(Phila Pa 1976),2016:Epub ahead of print.
[10]Li K,Li Y,Xu B,etal.Sesamin inhibits lipopolysaccharide induced inflammation and extracellular matrix catabolism in rat intervertebral disc[J].Connect Tissue Res,2016:Epub ahead of print.
Effect of hypertonic medium on cell viability and metabolism of nucleus pulposus of intervertebral discs
BAI Yiguang1, CHEN Qiaoling2*,LIU Kang3, YANG Zelong1, LUO Xuwei1, FENG Gang3
(1DepartmentofOrthopedics,NanchongCentralHospital,SecondClinicalCollegeofNorthSichuanMedicalCollege,Nanchong637000,China;2DepartmentofOncology,NanchongCentralHospital,SecondClinicalCollegeofNorthSichuanMedicalCollege;3TissueEngineeringandStemCellResearchInstitute,NanchongCentralHospital,SecondClinicalCollegeofNorthSichuanMedicalCollege;*Correspondingauthor,E-mail:cql166@163.com)
Abstract:ObjectiveTo explore the effects of hypertonic medium on cell viability and metabolism of nucleus pulposus in the intervertebral discs.MethodsNine thoracolumbar intervertebral discs were harvested from every 6-7-week-old SD rat(n=10) and cultured with hypertonic medium(410 mOsm/kg). Cell viability, structural integrity and proteoglycan content were assessed using Mitotracker Green fluorescent probe, histochemical and biochemical methods at days 0, 7, 14, 21 and 28 after the culture. ResultsThe morphology of the whole intervertebral discs, cell viability and extracellular matrix component of nucleus pulposus at day 14 showed no statistical changes compared with those in fresh intervertebral discs in vitro. However, cell survival fluorescence intensity decreased significantly at day 21 in comparison of that before culture(7 782±367 vs 10 435±376,P<0.05). The proteoglycan content of nucleus pulposus(mg/100 mg) at day 21 markedly reduced in comparison with that before culture (3.72±0.45 vs 6.35±0.76,P<0.05).ConclusionNucleus pulposus cells in the rat intervertebral discs cultured with the hypertonic medium(410 mOsm/kg) could survive at least 14 d. Proteoglycan in nucleus pulposus tissue of rats can effectively keep the richness in 14 d.
Key words:hypertonic medium;intervertebral discs;nucleus pulposus tissue;nucleus pulposus cells
基金项目:国家自然科学基金资助项目(81171472,81071270,30872614);四川省教育厅科研基金资助项目(15ZA0216,15ZB0201);南充市科技局科技支撑项目(14A0017,14A0022);川北医学院科研发展计划基金资助项目(CBY14-A-ZD02,CBY15-A-ZD02)
作者简介:白亦光,男,1986-07生,硕士,住院医师,E-mail:baiyiguang@163.com
收稿日期:2016-01-19
中图分类号:R681.5
文献标志码:A
文章编号:1007-6611(2016)06-0531-05
DOI:10.13753/j.issn.1007-6611.2016.06.010

