尿素辅助模板法合成介孔氮掺杂CeO2及其CO2捕获应用研究
印朝闯, 李亚光, 王燕刚, 王 佳, 康诗飞
(上海理工大学 环境与建筑学院, 上海 200093)
尿素辅助模板法合成介孔氮掺杂CeO2及其CO2捕获应用研究
印朝闯,李亚光,王燕刚,王佳,康诗飞
(上海理工大学 环境与建筑学院, 上海200093)
摘要:以硝酸铈为前驱物,以尿素为助剂,采用一种简单的模板法合成了介孔氮掺杂CeO2材料.利用X射线衍射仪(XRD)、吸附-脱附仪(BET)、透射电子显微镜(TEM)和傅里叶变换红外光谱(FT-IR)等设备对合成材料进行表征.多种测试结果证明:试验得到的纳米材料具有均一的介孔结构和较高的比表面积(124.8 m2·g-1)并掺杂了氮元素.同时,测定了介孔CeO2材料对于CO2的吸附性能,并研究了氮掺杂对CeO2材料的CO2吸附性能的影响.结果表明:相比未掺杂氮的介孔CeO2,氮掺杂的介孔CeO2具有更好的CO2吸附性能和循环吸附脱附性能.
关键词:介孔CeO2; 氮掺杂; 尿素; 模板法; CO2吸附
大气中CO2浓度的持续增加对全球气候平衡造成了严重威胁[1-2].CO2捕获与封存技术是目前减少CO2排放和减缓气候变化的主要方法.在这个方案中,CO2从电厂的废气中被捕获并长时间封存于地下地质结构中.在现存的CO2捕获技术中,液氨化学吸收法被认为是2030年之前最适用的方法[3].但是氨溶液法具有一些缺点,如较高的吸收剂再生能耗、设备的腐蚀和高黏度.因此,为了克服液体吸收法中存在的一些固有问题,研究了固体吸附法并应用于CO2吸附.
以金属氧化物为基底的材料在CO2吸附上表现出了良好的应用前景,如CaO基[4-5]、MgO基[6-8]和TiO2基材料[9-11].在这个背景下,CeO2因具有丰富的氧空穴、高的比表面积和丰富的碱性表面官能团,因此也被用于研究[12-14].目前一些研究已经证实了CO2在CeO2表面的吸附作用.早在1989年,Li等[15]报道称室温下CO在脱除水的CeO2表面可以被部分氧化为CO2,然后产生的CO2吸附在CeO2表面,并产生两种碳酸盐物种和一种无机羧酸盐物种.Appel等[16]指出低温下CeO2吸附CO2后,会产生在高温下也能够稳定存在的碳酸盐物种.Li等[17]发现CO2在纳米CeO2材料上的吸附与在大块CeO2材料上的吸附不同,这主要是由于材料表面暴露出不同的晶面.发现具有更多表面氧空穴位和高比表面积的CeO2拥有更高的CO2吸附容量.他们合成了一种六面体形貌的CeO2材料,该材料与Yang等[18]合成的Sm掺杂的CeO2相比,其具有更好的CO2捕获能力,吸附容量为149 μmol·g-1(6.56 m2·g-1).然而与改性的TiO2材料、商业活性炭[19]、石墨烯基材料[20]和其他CO2吸附剂相比,CeO2基材料明显缺少竞争力.所以改性CeO2为一种有前途的CO2吸附剂仍然是一项有趣并具有挑战性的工作.
在本研究中,采用简单的一步尿素辅助模板法合成了一种介孔氮掺杂的CeO2材料;对得到的氮掺杂CeO2吸附剂,进行了物化性质表征和CO2的捕获性能研究.
1试验
1.1试验原料及仪器
试验原料主要有普朗尼克三嵌段共聚物P123(Mw=5 800,EO20PO70EO20)、正硅酸四乙酯(TEOS)、盐酸(HCl)、甘油、氢氧化钠(NaOH)、硝酸铈(Ce(NO3)3·6H2O)和尿素,其均为分析纯,试验用水为二次去离子水.
试验仪器有D8 Advance型X射线衍射仪(德国Bruker公司);JEOL JEM-1400/JEM-2010型透射电镜;3H-2000PS4型孔径分析仪(贝士德公司);傅里叶红外光谱仪(美国Thermo Scientific公司);STA 8000热重分析仪(美国Perkin Elmer公司).
1.2材料的制备
1.2.1有序介孔CeO2材料的制备
有序介孔CeO2的合成如文献[21]所述.合成过程如下:先将12 mmol的Ce(NO3)3·6H2O溶解于15 mL的丙酮中,搅拌得到澄清溶液后,将2 g SBA-15硬模板加入其中,并继续搅拌2 h.然后将得到的混合物转移至干净的玻璃皿中使溶剂挥发.为了获得更高的CeO2产率,上述干燥后的粉末在200 ℃下煅烧6 h分解前驱物后,继续重复上述的浸渍步骤,但是金属盐前驱物的加入量为前一步中的2/3.得到的产物继续在马弗炉中以2 ℃/min 升温至500 ℃,并保温4 h分解无机盐前驱物.最终,用2mol/L的NaOH溶液刻蚀3次,去除产物中的氧化硅模板.得到的最终产物命名为OM-CeO2.
1.2.2介孔氮掺杂CeO2材料的制备
介孔氮掺杂的CeO2(M-NCeO2)材料合成过程如下:首先将10 g尿素和1 g Ce(NO3)3·6H2O溶解于去离子水中,搅拌30 min后将混合物放入干燥箱中6 ℃保持12 h,去除其中的水分.得到的粉末收集后置于氧化铝坩埚中并加盖,后在马弗炉中空气氛围下以15 ℃/min的速度升温至550 ℃,煅烧2 h.纯的CeO2(P-CeO2)与CeO2(M-NCeO2)材料的制备过程相似,但在制备中未加入尿素.
1.3CeO2材料的吸附性能和循环性能测试
所有材料的CO2吸附性能测试均在STA 8000热重分析仪中常压下进行.测试过程如下:10~20 mg样品置于氧化铝样品盘中,在Ar(25 mL/min)氛围中升温至250 ℃保温2 h,去除样品中物理吸附的水分和吸附的其他气体.然后再以10 ℃/min降温至30 ℃,并将温度平衡在30 ℃.在系统中通入纯的CO2(25 mL/min)后进行吸附测试,吸附过程在30 ℃下进行,保温20 min.吸附后将气氛切换为Ar,以10 ℃/min升温至250 ℃保温2 h,最后再降温至30 ℃,进行样品的脱附过程.为了测试吸附剂对CO2的吸附性能和再生吸附性能,进行了15次脱附和吸附循环试验.材料在CO2氛围中达到吸附饱和后就升温至250 ℃,在Ar氛围下进行脱附.脱附完成后降温至30 ℃,继续在CO2氛围中吸附20 min.如此循环15次,测试材料的CO2吸附容量的变化.
2结果与分析
图1(a)给出了M-NCeO2和P-CeO2的大角XRD图.其中位于28°,33°,47°,56°,59°,69°,76°和79°的衍射峰对应立方萤石结构CeO2的(111),(200),(220),(311),(222),(400),(331)和(420)晶面(PDF卡片号:34~0394).与P-CeO2相比,M-NCeO2的衍射峰较弱且较宽,这表明M-NCeO2具有更小的晶粒直径.可能是由于氮元素掺杂进入了CeO2的晶格,同时尿素的快速热解释放出大量的气体,阻止了晶粒的增长和高温下的烧结.图1(b)为OM-CeO2的小角XRD图.小角XRD图可以看出OM-CeO2为有序介孔,成功复制了SBA-15模板.掺杂的氮元素可以从图2的能谱中看出.TEM图用于观察材料的微观结构,图3为M-NCeO2和P-CeO2的TEM图.图3(a)为M-CeO2的低倍率TEM图,图中显示材料在大范围内有一定规律的介孔孔道.通过图3(b)的高倍率图可以发现,这些孔的孔径在3~4 nm.然而未加入尿素制备的P-CeO2的TEM图(见图3(c)和3(d)),则表现出纳米颗粒的团聚,颗粒粒径在10~20 nm.从以上结果中可以看出,尿素对CeO2中形成规律介孔结构起到了重要的作用,尿素在该过程中可能起到一种模板的作用[22].
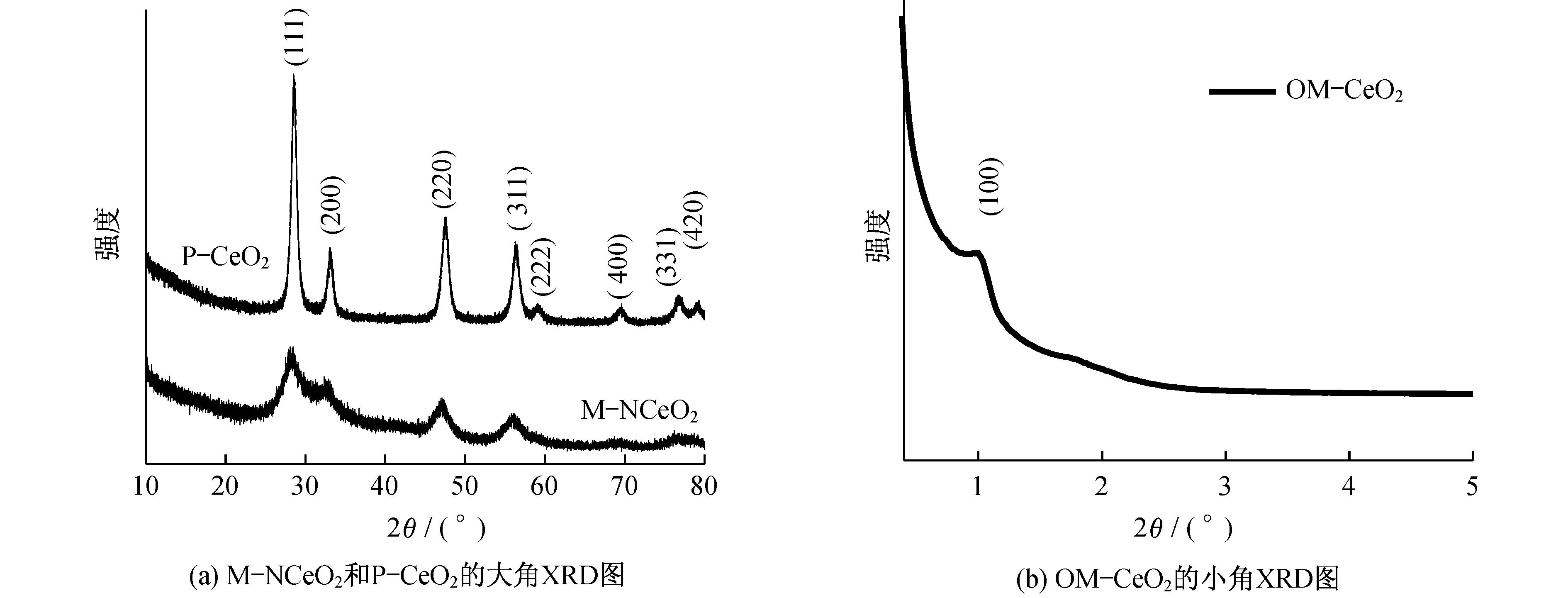
图1 M-NCeO2、P-CeO2和OM-CeO2的XRD图
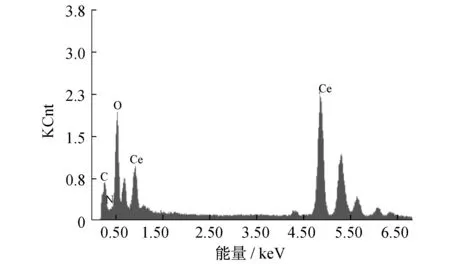
图2 M-NCeO2样品的EDX图谱
图4为M-NCeO2、P-CeO2和OM-CeO2的N2吸附-脱附曲线和相应的孔径分布曲线.图4(a)中,M-NCeO2的等温曲线在0.4~0.6的分压范围内有一个H1型回滞环,该曲线为典型的第4类曲线.相同的曲线在图4(b)中也可以看到,这表明M-NCeO2和OM-CeO2都具有均匀的介孔结构.孔径分布曲线由等温线的吸附支分析得到.从图4中的插图可以看到,M-NCeO2和OM-NCeO2的孔径都主要集中在3.5 nm左右,这与TEM图的结果一致.对于P-CeO2样品,从等温曲线上可以看出,在0.7~0.9的分压范围内有明显的N2吸附,而且孔径主要分布在8.5 nm左右,这主要归因于团聚的CeO2纳米颗粒之间形成的缝隙.除此之外,从表1中可以看出M-NCeO2和OM-CeO2的比表面积(124.8 m2·g-1和126.4 m2·g-1)远大于P-CeO2的比表面积(51.2 m2·g-1).

图3 M-NCeO2和P-CeO2的低倍率和高倍率TEM图
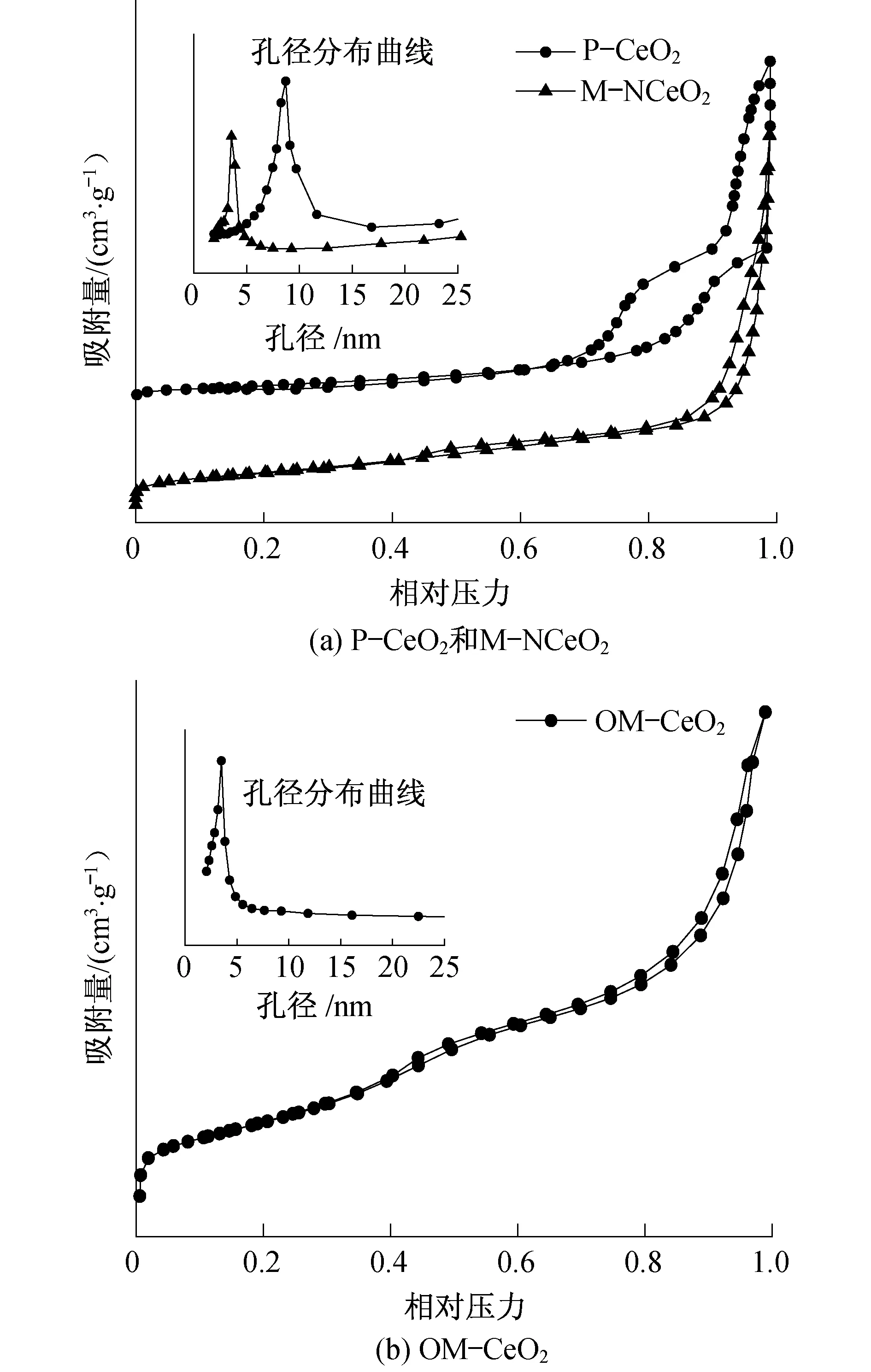
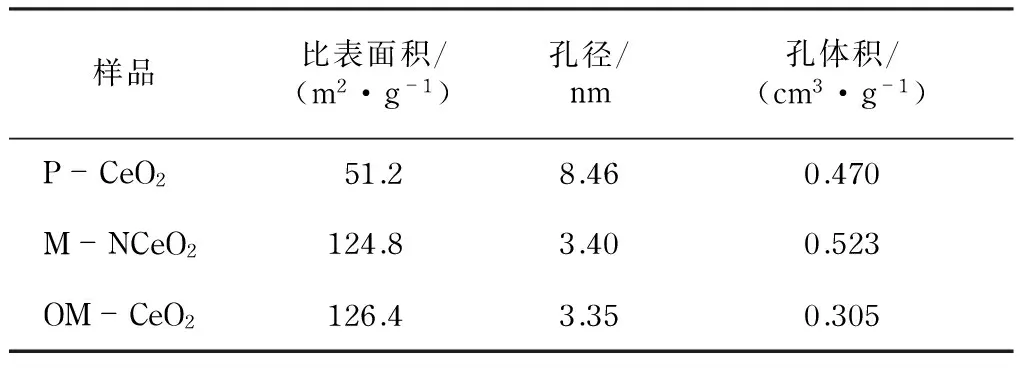
图4 P-CeO2,M-NCeO2和OM-CeO2的N2吸附-脱附曲线
图5为M-NCeO2和P-CeO2的FT-IR谱图.两种材料的谱图较为相似,在1 624和3 425 cm-1处出现的峰,分别归属于材料吸附的空气水分子中的羟基的弯曲振动和氢键结合的水分子中O-H的振动.在1 200~1 600 cm-1产生的多处峰,主要是由于未达到吸附饱和的CeO2材料表面吸附空气氛围中的CO2产生了碳酸盐物种[15].其中1 040 cm-1附近明显的吸收峰可能也归属于碳酸盐物种.值得注意的是,M-NCeO2谱图中的这些碳酸盐物种的特征峰,相比P-CeO2更为明显.这表明M-NCeO2对CO2有更强的亲和力,从而导致了材料表面有更高的碳酸盐物种含量.因此该结果可能意味着M-NCeO2和CO2之间较好的结合,会使其成为一种具有CO2捕获前景的吸附剂.
为了具体研究几种CeO2材料的CO2吸附性能,本文采用热重分析的方法进行了测试.图6为几种材料在常压CO2氛围下的吸附曲线,从图6中可以看出,几种材料在很短的时间内都达到了吸附平衡.M-NCeO2的CO2吸附容量为24.2 mg·g-1,相比于P-CeO2(7.8 mg·g-1)具有绝对的优势,同时该吸附容量也高于其他文献中报道的CeO2基吸附剂[17].众所周知,比表面积是影响类似材料低温下CO2吸附容量的因素之一,然而不能确认比表面积是否为M-NCeO2具有较好吸附性能的主要因素.所以为了排除比表面积的影响,本文制备了有序的介孔CeO2(OM-CeO2)材料,吸附曲线在相同的图中显示(见图6).可以看出,OM-CeO2的CO2吸附容量为11.6 mg·g-1,高于P-CeO2,但是远低于M-NCeO2.OM-CeO2相比P-CeO2具有较高吸附量,这主要是因为其比表面积远高于P-CeO2,但是其吸附量还远低于M-NCeO2.从表1中可以看出OM-CeO2和M-NCeO2具有相近的比表面积和孔径,同时他们都具有相似的介孔结构,所以认为M-NCeO2拥有如此高的CO2吸附量可能是由于氮元素掺杂后,材料的表面特性发生了变化.
图7为M-NCeO2循环吸附-脱附CO2的性能图.从图7中可以看出,经过15次循环后,该吸附剂都保持了良好的稳定性,吸附效果没有明显变化.该材料较高的吸附量和稳定的循环性能有利于其潜在的实际应用.作为一种n型半导体,CeO2和TiO2有一些相似的特性,都可以应用于光催化还原CO2为碳氢燃料(如CO、CH4和CH3OH等)[12].由于CO2分子在半导体材料的表面吸附是光催化还原反应中的一个关键步骤,CO2在M-NCeO2的表面具有较好的吸附效果,M-NCeO2将会利于CO2的光催化还原反应,这使得介孔氮掺杂的CeO2材料有可能应用于光催化还原CO2.

图5 P-CeO2 和 M-NCeO2材料的FT-IR谱图
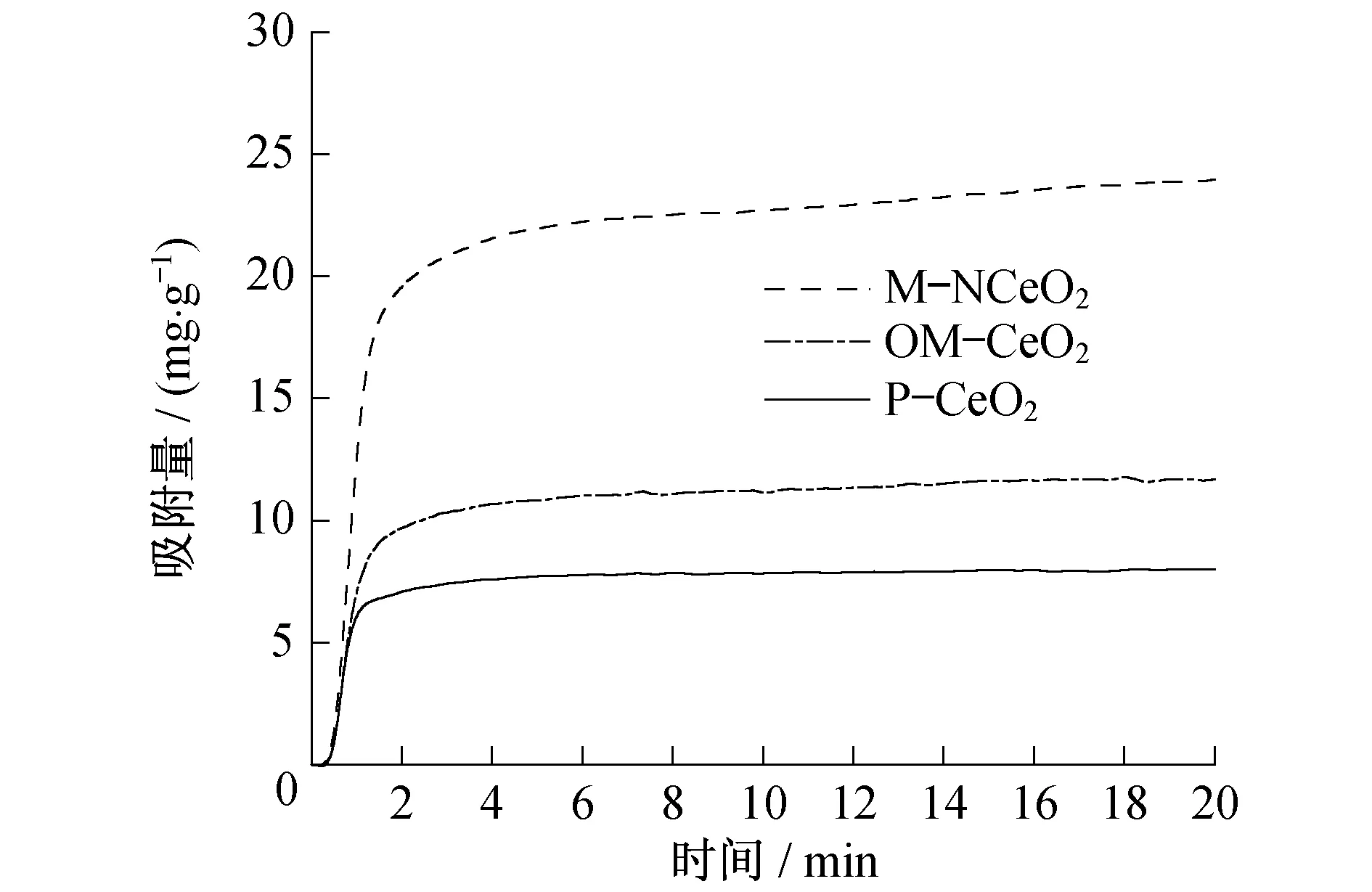
图6 几种CeO2材料在30 ℃常压下的CO2吸附曲线
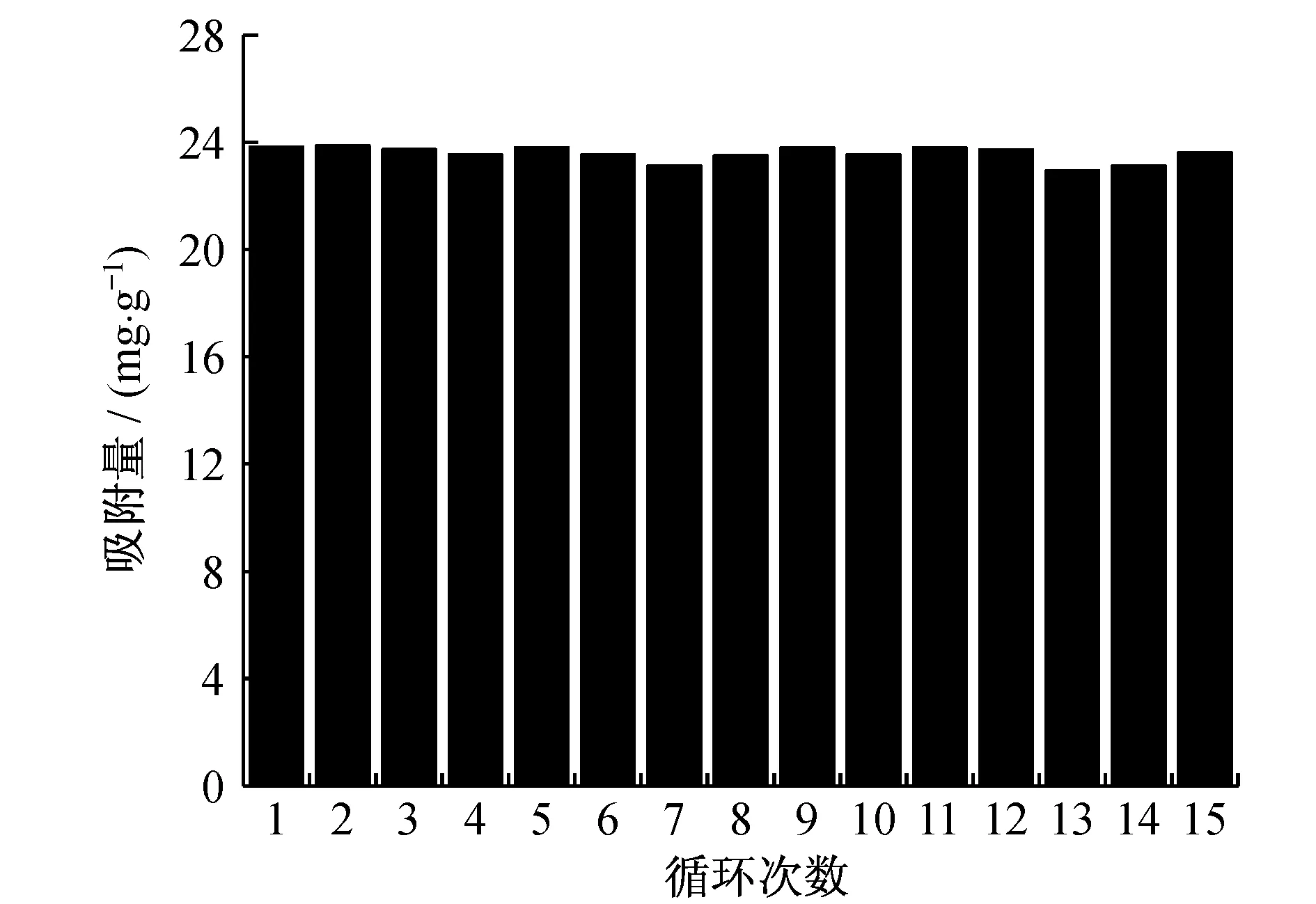
图7 M-NCeO2材料的吸附-脱附循环性能
3结论
总之,以硝酸铈作为前驱物,通过一种简单的尿素辅助模板法首次合成了介孔氮掺杂的CeO2材料.XRD、N2吸附-脱附曲线和TEM结果一致,表明合成的氮掺杂的CeO2材料具有较高的比表面积和均一的孔隙.EDX、FT-IR和CO2吸附容量测试的结果,证实了在CeO2中引入氮元素后能够进一步促进CeO2和CO2之间的结合.本文合成的介孔氮掺杂CeO2吸附剂,与未掺杂的介孔CeO2相比,表现出了良好的CO2吸附性能和稳定性,在工业CO2吸附材方面有较好的应用价值.此外,该介孔氮掺杂的CeO2材料还有望作为催化基底材料,进一步应用于改善CeO2材料光催化还原CO2的性能.
参考文献:
[1]Solomon S,Plattner G K,Knutti R,etal.Irreversible climate change due to carbon dioxide emissions[J].Proceedings of the National Academy of Sciences of the United States of America,2009,106(6):1704-1709.
[2]Abas N,Khan N.Carbon conundrum,climate change,CO2capture and consumptions[J].Journal of CO2Utilization,2014,8:39-48.
[3]Yu C H,Huang C H,Tan C S.A review of CO2capture by absorption and adsorption[J].Aerosol and Air Quality Research,2012,12(5):745-769.
[4]Chen H C,Zhao C S.Development of a CaO-based sorbent with improved cyclic stability for CO2capture in pressurized carbonation[J].Chemical Engineering Journal,2011,171(1):197-205.
[5]Ridha F N,Manovic V,Macchi A,etal.CO2capture at ambient temperature in a fixed bed with CaO-based sorbents[J].Applied Energy,2015,140:297-303.
[6]Bhagiyalakshmi M,Hemalatha P,Ganesh M,etal.A direct synthesis of mesoporous carbon supported MgO sorbent for CO2capture[J].Fuel,2011,90(4):1662-1667.
[7]Han K K,Zhou Y,Chun Y,etal.Efficient MgO-based mesoporous CO2trapper and its performance at high temperature[J].Journal of Hazardous Materials,2012,203-204:341-347.
[8]Liu W J,Jiang H,Tian K,etal.Mesoporous carbon stabilized MgO nanoparticles synthesized by pyrolysis of MgCl2preloaded waste biomass for highly efficient CO2capture[J].Environmental Science & Technology,2013,47(16):9397-9403.
[9]Song F J,Zhong Q,Ding J,etal.Mesoporous TiO2as the support of tetraethylenepentamine for CO2capture from simulated flue gas[J].RSC Advances,2013,3(45):23785-23790.
[10]Zhao X L,Hu X,Hu G S,etal.Enhancement of CO2adsorption and amine efficiency of titania modified by moderate loading of diethylenetriamine[J].Journal of Materials Chemistry A,2013,1(20):6208-6215.
[11]Kapica-Kozar J,Kusiak-Nejman E,Wanag A,etal.Alkali-treated titanium dioxide as adsorbent for CO2capture from air[J].Microporous and Mesoporous Materials,2015,202:241-249.
[12]Wang Y G,Wang F,Chen Y T,etal.Enhanced photocatalytic performance of ordered mesoporous Fe-doped CeO2catalysts for the reduction of CO2with H2O under simulated solar irradiation[J].Applied Catalysis B:Environmental,2014,147:602-609.
[13]Ma D W,Lu Z S,Tang Y N,etal.Effect of lattice strain on the oxygen vacancy formation and hydrogen adsorption at CeO2(111) surface[J].Physics Letters A,2014,378(34):2570-2575.
[14]Binet C,Jadi A,Lavalley J C.IR study of carbon dioxide and carbon monoxide adsorption onto ceria-effect of the reduction state of ceria[J].Journal de Chimie Physique et de Physico-Chimie Biologique,1992,89(9):1779-1797.
[15]Li C,Sakata Y,Arai T,etal.Carbon monoxide and carbon dioxide adsorption on cerium oxide studied by fourier-transform infrared spectroscopy.Part 1.-Formation of carbonate species on dehydroxylated CeO2,at room temperature[J].Journal of the Chemical Society,Faraday Transactions 1:Physical Chemistry in Condensed Phases,1989,85(4):929-943.
[16]Appel L G,Eon J G,Schmal M.The CO2-CeO2interaction and its role in the CeO2reactivity[J].Catalysis Letters,1998,56(4):199-202.
[17]Li C C,Liu X H,Lu G Z,etal.Redox properties and CO2capture ability of CeO2prepared by a glycol solvothermal method[J].Chinese Journal of Catalysis,2014,35(8):1364-1375.
[18]Yang S C,Su W N,Rick J,etal.Oxygen vacancy engineering of cerium oxides for carbon dioxide capture and reduction[J].Chem Sus Chem,2013,6(8):1326-1329.
[19]Khalil S H,Aroua M K,Daud W M A W.Study on the improvement of the capacity of amine-impregnated commercial activated carbon beds for CO2adsorbing[J].Chemical Engineering Journal,2012,183:15-20.
[20]Oh J,Mo Y H,Le V D,etal.Borane-modified graphene-based materials as CO2adsorbents[J].Carbon,2014,79:450-456.
[21]Galvita V V,Poelman H,Bliznuk V,etal.CeO2-modified Fe2O3for CO2utilization via chemical looping[J].Industrial & Engineering Chemistry Research,2013,52(25):8416-8426.
[22]Fuchs V M,Soto E L,Blanco M N,etal.Direct modification with tungstophosphoric acid of mesoporous titania synthesized by urea-templated sol-gel reactions[J].Journal of Colloid and Interface Science,2008,327(2):403-411.
A Urea-assisted Template Method to Synthesize Mesoporous N-doped CeO2for CO2Capture
YIN Chaochuang,LI Yaguang,WANG Yangang,WANG Jia,KANG Shifei
(School of Environment and Architecture,University of Shanghai for Science and Technology,Shanghai 200093,China)
Abstract:Novel mesoporous N-doped CeO2 has been prepared via a simple urea-assisted template method using cerium nitrate as precursor and urea as additives.X-ray diffraction,adsorption-desorption and FT-IR spectrum techniques are employed to characterize the samples.It is observed that the synthesized material has a uniform mesostructure with a high specific surface area(124.8 m2·g-1),and nitrogen element is introduced into it.The effects of mesoporous CeO2 without and with nitrogen element on the absoportion of CO2are measured.The result shows that the synthesized mesoporous N-doped CeO2 applied as an adsorbent exhibits significant enhancement of CO2 adsorption performance compared with undoped mesoporous CeO2.
Keywords:mesoporous CeO2; N-doped; urea; template method; CO2 adsorption
文章编号:1005-2046(2016)02-0008-06
DOI:10.13258/j.cnki.nmme.2016.02.002
收稿日期:2016-01-14
基金项目:国家自然科学基金青年基金项目(51502172)
作者简介:印朝闯(1990—),男,硕士研究生. 主要从事CO2捕获材料的研究. E-mail: 842961272@qq.com 通信作者: 康诗飞(1987—),男,讲师. 主要从事锂离子电池电极材料的研究. E-mail: sfkang@usst.edu.cn
中图分类号:X 511
文献标志码:A

