降水处理对南亚热带季风林土壤微生物群落结构的影响
吴华清,陈小梅*,林媚珍,张静,褚国伟,邓琦
1.广州大学地理科学学院,广东 广州 510006;2.中国科学院华南植物园,广东 广州 510650;3.中国科学院武汉植物园,湖北 武汉 430074
降水处理对南亚热带季风林土壤微生物群落结构的影响
吴华清1,陈小梅1*,林媚珍1,张静2,褚国伟2,邓琦3
1.广州大学地理科学学院,广东 广州 510006;2.中国科学院华南植物园,广东 广州 510650;3.中国科学院武汉植物园,湖北 武汉 430074
摘要:全球变暖导致降水格局的变化,进而影响到土壤碳排放与土壤环境特征,土壤微生物群落结构是反映这一变化的有效早期响应指示。以南亚热带鼎湖山季风常绿阔叶林(季风林)土壤为对象,探讨降水变化对不同土壤层土壤微生物群落的影响,试验设置3种降水变化处理(年降水量不变但降水次数增加、减少50%降水量、自然降水),采用磷脂脂肪酸(PLFA)技术提取土壤微生物含量。结果表明:(1)不同降水处理对同一土层土壤微生物总PLFAs量、细菌PLFAs量、真菌PLFAs量、放线菌PLFAs量、丛枝菌根真菌PLFAs量影响不显著(P>0.05);(2)0~10 cm土层中,土壤微生物细菌(革兰氏阳性菌和革兰氏阴性菌)、真菌、放线菌和丛枝菌根真菌的相对丰度值差异不明显,说明不同降水处理条件下,该层土壤微生物群落结构较为相似;(3)10~20 cm土层中,不同降水处理对细菌(革兰氏阳性菌和革兰氏阴性菌)的相对丰度产生明显的影响(P<0.05);(4)在所有试验处理中,土壤pH作为一个重要的影响因子,与土壤微生物总PLFAs量成极显著负相关关系(P<0.01)。
关键词:降水变化;土壤微生物生物量;微生物群落结构;季风常绿阔叶林磷;脂脂肪酸(PLFA)
引用格式:吴华清,陈小梅,林媚珍,张静,褚国伟,邓琦.降水处理对南亚热带季风林土壤微生物群落结构的影响[J].生态环境学报,2016,25(4):583-590.
WU Huaqing,CHEN Xiaomei,LIN Meizhen,ZHANG Jing,ZHU Guowei,DENG Qi.Effects of the Soil Microbial Community Structure to Changes in Precipitation in the South Subtropical Monsoon Forest [J].Ecology and Environmental Sciences,2016,25(4):583-590.
土壤微生物能分解和合成有机质,是土壤碳积累过程的重要参与者,且对土壤环境的变化敏感,其微生物量和群落结构是对外界环境胁迫的早期响应指标(曹志平,2007)。研究表明,随着全球气候的变暖,南亚热带地区的降水强度和频数发生变化(IPCC,2013;陈小梅等,2010;Zhou et al.,2011)。降水的变化在一定程度上改变土壤结构、湿度和pH等环境因子,进而影响土壤微生物群落结构。因此,探讨土壤微生物生物量和群落结构对降水变化的响应,可为研究土壤碳变化对全球气候的响应提供一定的理论基础数据。
森林是陆地生态系统最大的碳库,约有45%的碳储存于土壤层(FAO,2011),其巨大的碳汇功能可能缓解全球气候变化,所以研究降水变化对森林土壤微生物群落结构的影响,是评价未来全球气候变化的重要关键。在国内外研究中,针对降水变化对森林土壤微生物群落结构的研究已有相关文献报道,包括热带、温带和亚热带森林生态系统对模拟降水的响应,然而,目前有关季风常绿阔叶林土壤微生物群落结构的研究较少(Leckie,2005;Landesman et al.,2010;Cregger et al.,2012;徐嘉,2014)。结果发现,土壤微生物群落结构和功能存在明显的季节性变动和区域差异,不同森林类型的土壤微生物群落对降水变化处理的响应不同(Lipson et al.,2002,2008;Waldrop et al.,2006;Mchugh et al.,2014)。目前,被广泛应用于研究土壤微生物生物量和群落结构的方法主要有氯仿熏蒸浸提法、微生物平板培养法、核酸生物学法以及磷脂脂肪酸(Phospholipid fatty acid,PLFA)法等(张瑞福等,2004476-479;吴愉萍,2009)。由于磷脂是一种含有磷酸的脂类物质,是微生物细胞膜上的主要组成成分,且存在于活体生物内,而具有特殊的甲基脂肪酸已经被作为区分微生物的依据,因此PLFA法已应用于微生物群落结构的分析(Petersenet al.,1994;张瑞福等,2004476-477;张秋芳等,2009)。
徐嘉(2014)运用PLFA提取方法,研究南亚热带马尾松林土壤微生物群落结构对降雨减少的响应,结果表明,降水量减少会降低土壤含水量,减慢微生物养分的传输,使得不同土壤层的微生物含量存在差异;而在雨季,减雨处理对马尾松土壤大部分微生物生物量的影响不显著,同时,只对少数的微生物的相对丰度具有显著的影响。作为亚热带森林演替顶级植被——季风常绿阔叶林,其土壤结构、孔隙、水等特性更为稳定,且土壤微生物群落对环境胁迫抵抗能力更强(李晶等,2013)。在降水频率、强度或降水量改变的情况下,季风林土壤微生物对其变化作出如何响应,值得深入的探讨,以便更深入地了解稳定群落土壤微生物对外界环境变化的抵抗能力。
已有研究发现,近50年以来,我国东南沿海地区无雨日在逐渐增加(吴徐燕等,2011)。因此,本文以位于南亚热带季风气候区的鼎湖山季风常绿阔叶林土壤为研究对象,设计3种不同的降水处理,包括年降水量不变但增加降水次数、减少50%降水量和自然降水,利用PLFA提取技术,研究季风林土壤0~10和10~20 cm的微生物生物量和群落结构对降雨变化的响应,阐明稳定群落土壤微生物抵抗环境胁迫的能力,为后期土壤碳源汇的研究提供科学的依据。
1 材料与方法
1.1研究区概况
鼎湖山(112°30′39′′~112°33′41′′E,23°09′21′′~23°11′30′′N)位于广东省肇庆地区境内,为国家级自然保护区。其气候属南亚热带季风气候,冬夏季节交替明显,年平均气温20.9 ℃,最热月(7月)和最冷月(1月)平均气温分别为28.0和12.6 ℃;年均相对湿度为82%,年均降雨量和蒸发量分别为1927和1115 mm,4─9月为雨季,约占全年降雨量的80%,10月─次年3月为旱季。鼎湖山保存着最为古老的亚热带季风常绿阔叶林,分布在庆云寺周围,其海拔高度约250~400 m,是以锥栗(Castanopsis chinensia)、荷木(Schima superba)和厚壳桂(Cryptocarya chinensis)等为优势树种的顶级演替群落,该样地所处的季风林土壤为发育于砂岩或砂页岩的赤红壤(吴建平等,2015;中国科学院华南植物园,2010)。
1.2实验设计
2013年6月,在季风林内,分别选取坡度、坡向、坡位和群落结构基本一致的地段,设置3块样地,每块样地设置3个样方,每个样方设置1种降水处理:年降水量不变但增加降水次数(以下简称增加降水次数,IP)、减少50%降水量(以下简称减少降水,RP)和自然降水(对照组,NP)。其中,增加降水次数和减少降水处理的样方设置如下:每个样方的设置范围为5 m×5 m,四周用PVC (Polyvinyl chloride)板材围起,PVC板材插入地表下30 cm,以阻止地表径流的流入;地上部分高出地表1 m,上方搭建遮雨棚(采用无色透明的塑料胶瓦片,为了减少光照强度的影响,高度设为1 m左右)。
在增加降水次数处理的样方里,每次自然降雨时,使用遮雨棚拦截50%降雨量,并收集于大桶内,于雨后天晴日,将降雨期间收集的雨水通过自动喷洒系统均匀喷洒入相应的处理样方内,从而达到增加降雨次数、减弱降雨强度而全年总降雨量不变的效果;同时在减少降水处理的样方里,每次自然降雨时,使用遮雨棚拦截50%降雨量,并收集于大桶内。每次遮雨期结束后,收集遮雨棚上凋落物并回归至相对应的样方地表上,以避免由于凋落物的输入差异而造成的实验误差。
1.3样品采集
于2015年7月(雨季)采集土壤样品,分别在每个样方内随机选取5个点,去除表土上覆盖的枯枝落叶,用内径5 cm土钻取0~10和10~20 cm层的土壤,每个点取3~4钻,混合后装入布袋,并用标签做好标记。剔除样品中可见的根系、动植物残体和石块等杂物,并过2 mm筛,分成两份装入塑料袋后,一份置于放有冰块的泡沫箱内,于-20 ℃冰箱保存,并于7 d内完成实验,另一份土壤自然风干用于常规分析。
1.4项目测定
土壤湿度和pH值采用常规分析方法测定。土壤湿度用土壤含水量表达,采用称重烘干的测量方法。土壤pH值用电极电位法测量,其中水土比例是2.5∶1。
土壤微生物用磷脂脂肪酸(PLFA)提取技术测定。基于改进的Bligh和Dayer的测定方法(Bligh et al.,1959),本实验的主要过程包括土壤浸提、分馏、甲酯化、酯基转移,接着采用色谱仪分析微生物PLFA的含量,最后用微生物单个PLFA的含量与碳内标19∶0的浓度之比来计算微生物生物量和相对丰度。其中称取的干土为8 g,而试剂氯仿∶甲醇∶磷酸缓冲液的比例为1∶2∶0.8,甲醇∶甲苯为1∶1,0.2 mol·L-1氢氧化钾。
1.5数据分析
PLFA生物量的单位为nmol·g-1,而PLFA的相对丰度是特定PLFA含量占总PLFA含量的分数,即特定PLFA的摩尔分数,记为x特定PLFA。用单因素方差分析(one-way ANOVA)检验3种降水处理之间的土壤微生物PLFA量和相对丰度的差异,用主成分分析(principal component analysis,PCA)检测微生物群落结构的差异,用相关性分析(correlation analysis,CA)检验土壤湿度和pH与微生物PLFA量、群落结构之间的关系。所有的数据分析和制图均在统计软件Excel 2003以及SPSS 19.0中完成。
2 结果与分析
根据已有的研究结果(于树等,20084223-4224;徐嘉,201453-54;Sun et al.,2015;Brant et al.,2006),按照标准命名法分类所测的PLFA,见表1,其它的PLFA种类,如i13:0、i14:0、16:0等仍用来分析微生物PLFA总量。

表1 磷脂脂肪酸分类Table 1 Identifier of phospholipid fatty acids
2.1土壤微生物PLFAs量的变化
不同降水处理下各菌群PLFAs量与真菌/细菌比值结果如图1所示。在雨季,同一土壤层不同降水处理间的微生物PLFAs总量以及细菌PLFAs量、真菌PLFAs量、放线菌PLFAs量、丛枝菌根真菌PLFAs量差异均不显著(P>0.05)。土壤微生物PLFAs总量和各菌群PLFAs量的变化趋势相似,表现为同一处理 0~10 cm土层的微生物PLFAs量比10~20 cm的多;在0~10 cm土层中,其微生物PLFAs量均以RP处理的最高,而IP处理下的微生物量与对照组NP的相差不大,其中RP处理下的真菌PLFAs量,比IP和NP处理下的多28%左右;在10~20 cm土层中,IP处理和RP处理的微生物PLFAs量值相近,均比对照组NP处理的多22%~70%,特别是细菌在这一层的响应最大,在IP 和RP处理下,其PLFAs量分别增加约70%和61%。在0~10和10~20 cm土层中,相对于NP,IP和RP处理下的土壤真菌/细菌比值没有明显的差异(P>0.05)。
2.2土壤微生物群落结构分析
降水处理不仅对土壤微生物生物量产生影响,而且不同程度影响土壤微生物群落结构。微生物PLFA的相对丰度分析结果见图2和图3。图2显示,在相同降水处理下,土壤各层细菌(包括革兰氏阳性菌和阴性菌)的相对丰度最大,为优势菌种,其次为放线菌,而丛枝菌根真菌的相对丰度是最低的;与对照组比较,不同降水处理均对土壤0~10 cm的细菌、真菌、放线菌和AMF的相对丰度影响不明显(P>0.05),但在10~20 cm土层里,IP和RP明显增大了细菌的相对丰度,IP和RP处理均明显增大GP的相对丰度,IP处理明显降低GN的相对丰度。这反映出了降水处理首先对10~20 cm土层的优势菌种影响最明显。
从图3可以看出,在相同降水处理下,指示革兰氏阳性菌i16:0的相对丰度是最大的;在0~10 cm土壤层,IP处理明显增大14:0、15:0和减少18:1w7c的相对丰度,RP处理明显增高18:2w6c和降低10Me18:0的相对丰度,而IP和RP处理均明显减少i17:0、a17:0和cy17:0的相对丰度;在10~20 cm土壤层中,IP处理明显降低i17:0和10Me18:0的相对丰度,RP处理明显减少17:0、i18:0、cy17:0、18:2w6c的相对丰度,而IP和RP处理均明显增大14:0、15:0、i16:0和降低a17:0的相对丰度。因此,IP处理明显增加了土壤各层革兰氏阳性菌的14:0、15:0和降低i17:0、a17:0的相对丰度,RP处理降低革兰氏阳性菌的a17:0和革兰氏阴性菌的cy17:0,而真菌18:2w6c主要受RP处理的影响。
用主成分分析土壤0~10和10~20 cm的微生物PLFA,得图4。如图4(a)显示,在0~10 cm土层中,前两个主成分解释了微生物群落结构变异的92.216%,其中第一主成分解释了83.116%,这3种降水处理沿第一主成分轴的关系比较接近,这主要是因为这3种降水处理之间各菌群的相对丰度差异不显著(图2)。图4(b)表明,在土壤10~20 cm中前两个主成分解释了微生物群落结构变异的94.049%,其中第一主成分解释了90.480%,在第一主成分中,IP和RP处理成正方向,而NP处理成负方向,且IP及RP处理均和NP处理的得分贡献值存在一些差异,这种差异主要是由IP和RP处理明显提高细菌的相对丰度而引起的。
2.3土壤湿度和pH与微生物群落结构的相关关系
用单因素方差分析每块样方的土壤湿度以及pH,得表2。结果表明,不同降水处理对季风林土壤pH和0~10 cm的湿度影响均不明显(P>0.05),但是降水处理对10~20 cm土层的湿度有较大的影响,IP处理明显增大土壤的湿度。

图1 不同土壤层微生物磷脂脂肪酸量及真菌/细菌比值Fig.1 Soil microbial PLFAs and fungi/bacteria ratio in different soil layers
分析土壤湿度、pH与微生物总PLFAs量和相对丰度之间的相关关系(表3),结果表明,土壤湿度均与土壤微生物总PLFAs量和各菌群相对丰度无显著相关性(P>0.05),这说明,在雨季,土壤湿度不是影响土壤微生物生物量和群落结构变化的主要原因;在0~10 cm土层中,土壤pH与革兰氏阴性菌的相对丰度成显著负相关关系(P<0.05),与微生物总PLFAs量成极显著负相关关系(P<0.01);在10~20 cm土层里,土壤pH均与微生物生物量和各菌群相对丰度无明显关系(P>0.05);真菌/细菌比值与土壤湿度、pH之间无显著相关关系(P>0.05)。
3 讨论
降水可以改变土壤的通透性、气体交换以及水分状况等,从而影响土壤微生物的活性,使得微生物组成以及群落结构发生相应的变化,这些影响随着时空的变化而不同(王宁等,2015)。由于鼎湖山的季风林有近400年的保护历史,作为地带性成熟森林植被,系统结构较为稳定(方熊等,2012),能够长时间维持林内土壤适宜微生物存活和繁殖的环境,因而降水处理对土壤环境的改变作用比较缓慢。本研究结果表明,两年的不同降水处理试验的土壤pH和0~10 cm土层的土壤湿度没有显著差异(表2),这可能由于鼎湖山属于湿润地区,年均相对湿度达到82%,再加上成熟稳定的季风林特性,使接近于地表层的土层pH和含水值维持在原有的范围内。而增加降水次数处理,使土壤上层水下渗的频数增多,因而导致IP处理明显增大10~20 cm土壤含水量(表2)。

图2 不同土壤层微生物PLFAs的相对丰度Fig.2 Relative abundances of the microbial community PLFAs in different soil layers

图3 不同土壤层微生物单个PLFA的相对丰度Fig.3 Relative abundances of the microbial community each PLFA in differentsoil layers
在本实验中,土壤湿度与土壤微生物PLFAs总量和各菌群的相对丰度的相关关系不明显(表3)。因此,在雨季,土壤湿度并不是影响微生物活动的主要因子。土壤微生物活动受到多种因素的影响,已有研究发现,在湿润或有干湿交替的生态系统中,如果雨季土壤湿度未超出一定范围,其不能明显影响土壤微生物活动(陈全胜等,2003)973-974,而本研究恰恰也说明了这一点。土壤pH是影响土壤微生物生物量和群落结构变化的一个主要的因子,在0~10 cm土层中,土壤pH与微生物总PLFAs量成极显著负相关关系(表3)。有研究发现,桉树林土壤细菌的相对丰度与土壤pH呈正相关(Cao et al.,2010),与本研究的观点相反,这可能是由于森林类型不同所导致的。

图4 不同土壤层微生物群落结构主成分分析Fig.4 Principal component analysis of soil microbial community structure in different soil layer

表2 不同土壤层的湿度和pHTable 2 Characteristics of soil moisture and pH in different soil layers
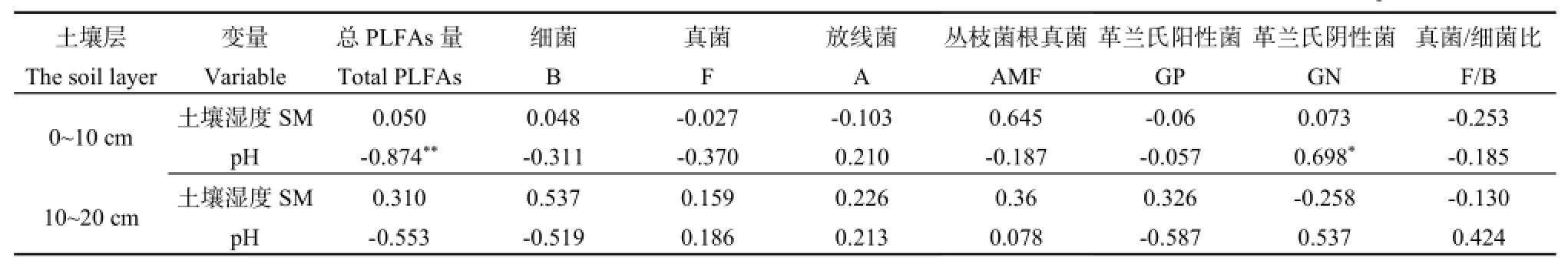
表3 土壤微生物总PLFAs量和相对丰度与土壤湿度、pH的相关系数Table 3 Correlation coefficients between soil total microbial biomass relative abundance of PLFA and the soil moisture and pH
尽管本研究同一土层的不同降水处理间的土壤微生物PLFAs量差异不明显,但是在0~10 cm土层中,微生物总PLFAs量、细菌PLFAs量、真菌PLFAs量、放线菌PLFAs量和丛枝菌根真菌PLFAs量在减少降水量处理的情况下,其值均是最大的(图1),这可能是因为在湿润的生态系统中,降水在湿季可能会对土壤呼吸有明显的抑制现象(陈全胜等,2003)974-975。因此,减少降水量可能使土壤通透性更好,促进土壤的呼吸,更有利于微生物的繁殖。但在10~20 cm土层,土壤pH与土壤微生物PLFAs总量成显著负相关关系,因而IP处理的土壤微生物生物量反而是最高的。
同时,由于0~10 cm土层的微生物PLFAs相对丰度并未受到不同降水处理的明显影响(图2),因此,其微生物群落结构比较相似(图4)。在10~20 cm土层中,细菌(包括革兰氏阳性菌和阴性菌)相对丰度在不同降水处理下有不同的变化。IP和RP处理均明显增大了细菌的相对丰度(图2),主要是指示细菌的14:0、15:0、i16:0(图3),从而在主成分分析中,这3种降水处理下的土壤微生物群落结构有一些差异(图4)。
真菌/细菌比值通常被用来比较真菌与细菌生物量的变化以及两种微生物的相对丰度(于树等,2008)4224-4225。在0~10 cm土层中,RP处理下的真菌/细菌比值最大,比IP处理下的高出了18%左右(图1),主要是因为在0~10 cm土层中,受到减少降水量处理的影响,其真菌PLFAs量最大。从真菌/细菌比值的数值来看,在0~10和10~20 cm土层中,真菌和细菌受IP和RP处理的影响不一。
4 结论
根据南亚热带的降水变化规律,利用在鼎湖山季风林内两年(2013年6月─2015年7月)的人工降水处理实验,采用磷脂脂肪酸(PLFA)方法,分析雨季0~10和10~20 cm土层土壤微生物生物量和群落结构对不同降水处理的响应。结果表明,同一土壤层的不同降水处理之间的微生物生物量差异不明显,而同一降水处理下,土壤微生物生物量随着土层的深度增加而减少。同对照组比较,0~10 cm土层中各菌种的相对丰度并未受到降水处理的显著影响,不同降水处理下的土壤微生物群落结构比较相似。在10~20 cm土层中,由于细菌的相对丰度在全年降水量不变但增加降水次数和减少50%降水量的处理下,比对照组明显增加,3种降水处理下的土壤微生物群落结构有较大的差异。从减少降水量处理增大了0~10 cm土层的真菌/细菌比值看,此层真菌更易受到该处理的影响;土壤pH与土壤微生物PLFAs总量成极显著负相关关系,说明pH是影响土壤微生物的一个重要的因子。可见,土壤微生物对降水处理的响应是复杂的,这一初步研究结果可为今后进一步研究土壤微生物对全球气候的响应提供基础数据。
参考文献:
BLIGH E G,DYER W J.1959.A rapid method of total lipid extraction and purification [J].Canadian Journal of Biochemistry and Physiology,37(8):911-917.
BRANT J B,MYROLD D D,SULZMAN E W.2006.Root controls on soil microbial com-munity structure in forest soils [J].Oecologia,148(4):650-659.
CAO Y,FU S,ZOU X,et al.2010.Soil microbial community composition under Eucalyptus plantations of different age in subtropical China [J].European Journal of Soil Biology,46(2):128-135.
CREGGER M A,SCHADT C W,MCDOWELL N G,et al.2012.Response of the soil microbial community to changes in precipitation in a Semiarid Ecosystem [J].Applied and Environmental Microbiology,78(24):8587-8594.
FAO.2011.Global Forest Resources Assessment 2010 [R].Luoma:Forestry Department:41-48.
IPCC.2013.Climate Change 2013:The Physical Science Basis [R].Cambridge:Cambridge University Press,234-239.
LANDESMAN W J,DIGHTON J.2010.Response of soil microbial communities and the production of plant-available nitrogen to a two-year rainfall manipulation in the New Jersey Pinelands [J].Soil Biology and Biochemistry,42(10):1751-1758.
LECKIE S E.2005.Methods of microbial community profiling and their application to forest soils [J].Forest Ecology and Management,220(1-3):88-106.
LIPSON D A,MONSON R K,SCHMIDT S K,et al.2008.The trade-off between growth rate and yield in microbial communities and the consequences for under-snow soil respiration in a high elevation coniferous forest [J].Biogeochemistry,95(1):23-35.
LIPSON D A,SCHADT C W,SCHMIDT S K.2002.Changes in soil microbial community structure and function in an alpine dry meadow following spring snow melt [J].Microbial Ecology,43(3):307-314.
MCHUGH T A,KOCH G W,SCHWARTZ E.2014.Minor changes in soil bacterial and fungal community compositong occur in response to monsoon precipitation in a semiarid grassland [J].Microbial Ecology,68(2):370-378.
PETERSEN S O,KLUG M J.1994.Effects of sieving,storage,and incubation temperature on the phospholipid fatty acid profile of a soil microbial community [J].Applied and Environmental Microbiology,60(7):2421-2430.
SUN R,THATER B,SHI P,et al.2015.The effect of cowpea (Vigna unguiculata) with root mucilage on phenanthrene (PHE) dissipation and microbial community composition using phospholipid fatty acid (PLFA) analysis and artificial neural network (ANN) modeling [J].International Biodeterioration & Biodegradation,100(6):29-37.
WALDROP M P,FIRESTONE M K.2006.Seasonal drnamics of microbial community compositon and function in oak canopy and open grassland soils [J].Microbial Ecology,52(3):470-479.
ZHOU G Y,WEI X H,WU Y P,et al.2011.Quantifying the hydrological responses to climate change in an intact forested small watershed in Southern China [J].Global Change Biology,17(12):3736-3746.
曹志平.2007.土壤生态学[M].北京:化学工业出版社:40-75.
陈全胜,李凌浩,韩兴国,等.2003.水分对土壤呼吸的影响及机理[J].生态学报,23(5):972-978.
陈小梅,刘秀菊,邓琦,等.2010.降水变率对森林土壤有机碳组分与分布格局的影响[J].应用生态学报,21(5):1210-1216.
方熊,刘菊秀,张德强,等.2012.降水变化、氮添加对鼎湖山主要森林土壤有机碳矿化和微生物量碳的影响[J].应用与环境生物学报,18(4):531-538.
李晶,刘玉荣,贺纪正,等.2013.土壤微生物对环境胁迫的响应机制[J].环境科学学报,33(4):959-967.
李世清,任书杰,李生秀.2004.土壤微生物体氮的季节性变化及其与土壤水分和温度的关系[J].植物营养与肥料学报,10(1):18-23.
王宁,王美菊,李世兰,等.2015.降水变化对红松阔叶林土壤微生物生物量生长季动态的影响[J].应用生态学报,26(5):1297-1305.
吴建平,梁国华,熊鑫,等.2015.鼎湖山季风常绿阔叶林土壤微生物量碳和有机碳对模拟酸雨的响应[J].生态学报,35(20):1-10.
吴徐燕,杨德保,王式功,等.2011.近50年我国大陆无雨日的时空变化特征分析[J].干旱区地理,34(4):596-603.
吴愉萍.2009.基于磷脂脂肪酸(PLFA)分析技术的土壤微生物群落结构多样性研究[D].浙江大学:1-129.
徐嘉.2014.南亚热带两种人工林土壤碳过程对减少降雨的响应[D].北京:中国林业科学研究所:1-94.
徐伟强,周璋,赵厚本,等.2015.南亚热带3种常绿阔叶次生林的生物量结构和固碳现状[J].生态环境学报,24(12):1938-1943.
于树,汪景宽,李双异.2008.应用PLFA方法分析长期不同施肥处理对玉米地土壤微生物群落结构的影响[J].生态学报,28(9):4221-4227.
张秋芳,刘波,林营志,等.2009.土壤微生物群落磷脂脂肪酸(PLFA)生物标记多样性[J].生态学报,29(8):4127-4137.
张瑞福,崔中利,李顺鹏.2004.土壤微生物群落结构研究方法进展[J].土壤,36(5):476-480.
中国科学院华南植物园.鼎湖山国家级自然保护区[EB/OL].(2010-09-25)[2016-01-01].http://www.dhs.scib.cas.cn/gkjj/qqgg_zrtj/ 201009/t20100925_2973528.html.
Effects of the Soil Microbial Community Structure to Changes in Precipitation in the South Subtropical Monsoon Forest
WU Huaqing1,CHEN Xiaomei1,LIN Meizhen1,ZHANG Jing2,ZHU Guowei2,DENG Qi3
1.School of Geographical Sciences,Guangzhou University,Guangzhou 510006,China;2.South China Botanical Garden,Chinese Academy of Sciences,Guangzhou 510650,China;3.Wuhan Botanical Garden,Chinese Academy of Sciences,Wuhan 430074,China.
Abstract:Changes in precipitation patterns caused by global warming is a common phenomenon,which affects soil carbon respiration and soil environmental characteristics.Soil microbial community structure is an effective indicator to reflect this change.In this paper,we take the soil of the south subtropical monsoon evergreen broad-leaved forest in Dinghu mountain as research object.Our object explores the influence of precipitation changes on soil microbial communities in different soil layers.Three experimental treatments are included:The precipitation is constant but the times of precipitation increases,reduce the amount of precipitation by 50%,normal precipitation (control group).Soil microbial biomass was measured by the method of phospholipid fatty acid (PLFA).The experiment results show that:(1) The three precipitant treatments did not significantly affected the amounts of soil microbial total PLFAs,bacteria PLFAs,fungi PLFAs,actinomycetes PLFAs and arbuscular mycorrhizal fungi PLFAs of the same layer in the rainy premonsoon season.(2) In the layer 0~10 cm,the relative abundance of bacterial,gram-positive bacteria,gram-negative bacteria,fungi,actinomycetes,arbuscular mycorrhizal had not significant difference,which indicated the soil microbial community structures were similar under different treatment conditions.(3) In the layer 10~20 cm,the relative abundance of bacterial show obvious difference (P<0.05) in the soil microbial community structure.(4) There was the negative correlation between the soil pH value and the total PLFAs of soil microbial biomass (P<0.01) under different experimental treatment.
Key words:precipitation changes; soil microbial biomass; microbial community structure; monsoon evergreen broadleaf forest;phospholipid fatty acid
DOI:10.16258/j.cnki.1674-5906.2016.04.006
中图分类号:S718.5; X171
文献标志码:A
文章编号:1674-5906(2016)04-0583-08
基金项目:国家自然科学基金项目(31400415);广东省自然科学基金项目(2014A030310354);广州市属高校科技计划项目(1201430746);广东省普通高校青年创新人才项目(2014KQNCX110)
作者简介:吴华清(1990年生),女,硕士研究生,主要从事区域环境演变与自然灾害管理研究。E-mail:1032050758@qq.com
*通信作者。陈小梅,E-mail:xmchen@scib.ac.cn
收稿日期:2016-02-22

