益肾化浊方对快速老化小鼠认知功能与海马神经元形态学的影响及机制
宋宛珊 张玉莲 周 震 张琳琳 韩文文 王 凯
(天津中医药大学,天津 300193)
益肾化浊方对快速老化小鼠认知功能与海马神经元形态学的影响及机制
宋宛珊1张玉莲1周震1张琳琳1韩文文1王凯
(天津中医药大学,天津300193)
〔摘要〕目的探讨益肾化浊方对阿尔兹海默病模型快速老化鼠(SAMP)8空间记忆能力、海马神经元形态学的影响及其作用机制。方法将48只9月龄健康雄性SMAP8采用双盲法随机分为SAMP8组、安理申组、益肾化浊方组,每组16只,另取16只SAMR1作为对照组。各组小鼠分别灌胃给予安理申(30 mg/kg)、益肾化浊方(20 g/kg)或等体积0.9%生理盐水,2次/d,连续14 w。分别采用Morris水迷宫检测空间学习记忆能力,尼氏染色观察细胞凋亡情况,电镜观察神经元超微结构,RT-PCR、Western印迹检测β-淀粉样蛋白前体(APP)、早老蛋白(PS1)基因和GSK-3β蛋白表达。结果与对照组比较,SAMP8组游泳总路程、逃避潜伏时间、海马CA1区神经元凋亡数目和APP、PS1基因及GSK-3β蛋白表达量均显著增加(P<0.01),穿越平台次数显著减少(P<0.01),游泳速度显著降低(P<0.01),超微结构损伤明显;与SAMP8组比较,安理申组与益肾化浊方组游泳总路程明显缩短(P<0.01),穿越平台次数明显增加(P<0.01),游泳速度亦显著加快(P<0.01),同时显著减轻神经元超微结构损伤;此外,安理申可显著下调GSK-3β蛋白表达(P<0.01),益肾化浊方可显著减少神经元凋亡数目(P<0.01),同时下调APP、PS1基因表达(P<0.01);组别和训练天数对逃避潜伏时间、总路程、穿越平台次数有明显影响(P<0.01)。结论益肾化浊方可有效提高SAMP8的空间记忆能力,抗神经元凋亡并保护神经元超微结构,其作用机制可能与下调APP、PS1基因和GSK-3β蛋白的表达相关。
〔关键词〕阿尔兹海默病;益肾化浊方;认知功能;神经元凋亡;超微结构
阿尔茨海默病(AD)的主要病理机制可能是过度磷酸化的Tau蛋白和淀粉样蛋白斑(Aβ)相互作用形成神经元纤维缠结,进而引起神经元及突触损伤〔1,2〕。近年来,单一靶点治疗AD的药物研发逐渐停滞,多靶点治疗AD的药物得到了更多关注。本课题组临床研究证实了益肾化浊方可显著改善轻度AD(肾虚证)患者的中医症状,能一定程度地改善其认知功能及日常生活能力〔3〕;药理研究表明,益肾化浊方可通过整体多靶点调节神经-内分泌-免疫网络(NEI网络)相关指标,促进 AD 模型大鼠海马区脑源性神经营养因子(BDNF)及其受体 TrkB 蛋白的表达,进而改善其学习记忆功能〔4,5〕。本研究在此基础上,观察益肾化浊方对快速小鼠(SAMP)8海马的影响,探讨益肾化浊方防治AD的可能作用机制。
1材料与方法
1.1动物48只健康雄性SAMP8和16只健康雄性SAMR1鼠龄9个月±3 d,体重(30±2)g。小鼠饲养环境:温度(23±1)℃,湿度50%~60%,自由饮食、饮水,12 h/12 h明-暗循环光照。所有动物由天津中医药大学第一附属医院动物中心提供〔许可证号:SCXK(津)2010-0001〕,饲养程序均依照中国实验动物管理规章要求操作,并且经天津中医药大学伦理委员会批准。
1.2主要试剂与仪器淀粉样蛋白前体(APP)单克隆抗体、早老蛋白(PS)1抗体、GSK-3β抗体均购于Cell Signaling Technology(CST)公司;羊抗兔抗体购自millipore公司;SDS-PAGE胶配制套装购于碧云天;Trizol购于Invitrogen;安理申(5 mg/片×7片/板×1板/盒,批号:110507A)购于卫材(中国)药业有限公司;全自动多功能显微镜(Leica dm rxa2)为德国莱卡公司产品;透射电子显微镜(H-7500型)为日立建机株式会社产品。
1.3益肾化浊方的制备益肾化浊方的组成:淫羊藿10 g、补骨脂10 g、女贞子10 g、制首乌12 g、炙黄芪10 g、川芎10 g、石菖蒲12 g。将上述药物370 g(5付)加1 000 ml水浸泡12 h,80℃超声30 min,过滤,保存滤液;滤渣再加1 000 ml水采用同样条件重复超声2次,残渣弃去。将3次所得滤液合并,过滤,100℃水浴加热,浓缩至370 ml,生药浓度为1 g/ml。由天津中医药大学制剂中心制备,4℃保存备用。
1.4方法
1.4.1动物造模和分组48只SAMP8随机分为SAMP组、安理申组、益肾化浊方组,每组16只。16只SAMR1作为空白对照组。安理申组和益肾化浊方组分别给予安理申、益肾化浊方灌胃治疗,给药剂量为安理申30 mg/kg,益肾化浊方20 g/kg,2次/d,连续灌胃14 w。SAMR1组和模型组灌胃给予等量0.9%生理盐水。每组随机选取10只小鼠用于水迷宫、RT-PCR和Western印迹实验,3只小鼠用于Nissl染色,3只小鼠用于透射电镜观察。
1.4.2Morris水迷宫参照文献〔6〕方法,实验前1 d,水池中不放置平台,让小鼠自由游泳60 s,使其熟悉水迷宫环境。实验中,训练小鼠定位始终位于东北象限中间的隐藏平台。实验时,从第一象限池壁选择并标记两个与逃逸平台等距的入水点,将小鼠从其中一个入水点面向池壁放入水中。当小鼠爬到隐蔽平台上即停止实验;小鼠爬到隐蔽平台上后让其停留30 s,下一个实验中将小鼠从另一个入水点放入水中以找到隐蔽平台即停止实验并计时。至60 s找不到平台,则潜伏期记为60 s,如果小鼠在平台上停留至少3 s,则说明找到平台。如果小鼠没有停留地通过平台或找到平台后立刻跳入水中,则继续实验,直到小鼠成功找到平台。正式实验连续进行5 d。
1.4.3Nissl染色行为学实验结束之后,每组随机选取3只小鼠,6.5%水合氯醛麻醉,再用60 ml冷藏的4%多聚甲醛(以0.1 mol/L PBS溶解)和30 ml 0.9%生理盐水灌注。取小鼠大脑,固定、脱水、石蜡包被,用旋转式切片机切成25 μm薄片。石蜡切片在1%甲苯胺蓝中56℃染色20 min,用70%乙醇处理1 min,再经95%乙醇处理,脱水,洗净,中性树胶封片。计数单位面积神经元数量,计算均值。
1.4.4透射电镜超微结构观察小鼠直接脱颈处死,快速断头取脑,在冰上取海马齿状回(DG区)1 mm3的组织块放入前固定液(4%戊二醛固定液)中,以上步骤在3 min之内完成。7 d之内进行锇酸固定、乙醇系列脱水、树脂包埋聚合,制成50 nm的超薄切片。醋酸铀30~40 min和柠檬酸铅30 min双重电子染色,置于透射电镜下观察海马CA1区超微结构。
1.4.5实时定量RT-PCR(1)设计和合成引物:检测mRNA的引物由Primer5.0设计,由大连TAKARA生物公司合成,引物序列见表1。(2)总RNA提取和RT-PCR:总RNA由随机引物和RT试剂盒进行反转录,根据说明书步骤操作。应用Bio-Rad公司热循环扩增仪进行扩增,获得每个样品每次反应的Ct值,计算得到△Ct,样品间基因表达的相对定量用2-△△CT表示。所有样品均由三个独立实验平行三次取平均值。

表1 RT-PCR引物序列
1.4.6Western印迹实验取每只SAMP8的海马区,提取总蛋白,检测蛋白浓度,用SD上样缓冲液处理样品,10%SDS-PAGE电泳分离,转至硝酸纤维素膜上。一抗均用PBS按1∶1 000稀释,4℃孵育过夜。用含0.1%吐温20的PBS(PBST)清洗3次,辣根过氧化物酶标记的羊抗兔抗体作为二抗(稀释比例1∶5 000),室温孵育1~1.5 h,0.1% PBST清洗3次,采用ECL化学发光法检测。用图像分析软件分析条带灰度值,进行半定量分析。
1.5统计学分析Morris水迷宫所得数据除平均游泳速度外,均采用two-way ANOVA和Bonferroni′s past hoc检验,平均游泳速度和其余结果均行t检验。所有数据均用PRISM6.0软件处理,Bonferroni's past hoc检验以P<0.008 5为差异有统计学意义,其余检验均认为P<0.05为差异有统计学意义。
2结果
2.1益肾化浊方对小鼠学习和记忆能力的影响水迷宫行为学测试主要分为定位航行实验(逃避潜伏时间和总路程)和空间探索实验(穿越平台次数和平均速度)两部分。水迷宫轨迹图显示,与SAMP8组相比,益肾化浊方组寻找平台更具有趋向性,但其寻找方式仍次于SAMR1组(图1A)。组别和训练天数均可显著影响逃避潜伏时间、总路程、穿越平台次数、平均速度(P<0.01),两者之间交互作用仅对穿越平台次数有明显影响。
与对照组比较,SAMP8组逃避潜伏时间、总路程明显增加(P<0.01),穿越平台次数明显减少(P<0.01),平均速度明显减慢(P= 0.010 7);与SAMP8组比较,安理申组与益肾化浊方组逃避潜伏时间、总路程明显减少(P<0.01),穿越平台次数增加(P=0.086 6),平均速度显著增加(P<0.01);与安理申组比较,益肾化浊方组逃避潜伏时间显著缩短(P<0.01),但总路程和平均速度改善程度均低于安理申组(P<0.01),穿越平台次数则无明显差异(P=0.30)(图1B、1C、1D、1E)。

A:水迷宫路径图,B:逃避潜伏时间,C:总路程,D:穿越平台次数,E:游泳速度图1 各组小鼠空间记忆能力变化情况
2.2益肾化浊方对小鼠海马CA1区神经元凋亡的影响与对照组〔(2.00±1.00)个〕比较,SAMP8组海马CA1区神经元凋亡数目〔(25.00±5.00)个〕明显增加(P=0.001 4);与SAMP8组比较,安理申组海马CA1区神经元凋亡数目〔(19.00±3.00)个〕无明显变化,而益肾化浊方组海马CA1区神经元凋亡数目〔(15.00±3.00)个〕明显减少(P=0.041 1);益肾化浊方组与安理申组无显著差异(P=0.177 8)(图2)。
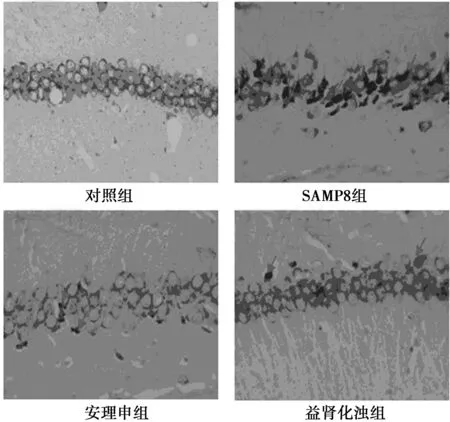
图2 小鼠海马CA1区神经元凋亡情况
2.3益肾化浊方对小鼠海马CA1区超微结构的影响对照组神经元线粒体结构基本完整,可见比较清晰的嵴和膜,粗面内质网颗粒均匀,游离核糖体均匀分布于细胞质之中,可见脂褐素;SAMP8组神经元细胞质轻重度水肿,线粒体绝大部分嵴和部分膜融合、模糊不清,可见嵴断裂及缺失现象,粗面内质网可见重度颗粒融合及脱颗粒现象,游离核糖体重度减少;安理申组神经元线粒体大部分嵴和部分膜融合、模糊不清,可见嵴断裂及缺失现象,线粒体可见空化现象,粗面内质网可见中度颗粒融合及脱颗粒现象;益肾化浊方组神经元线粒体部分嵴和膜融合、模糊不清,粗面内质网有中度颗粒融合及脱颗粒现象,可见脂褐素和次级溶酶体(图3)。
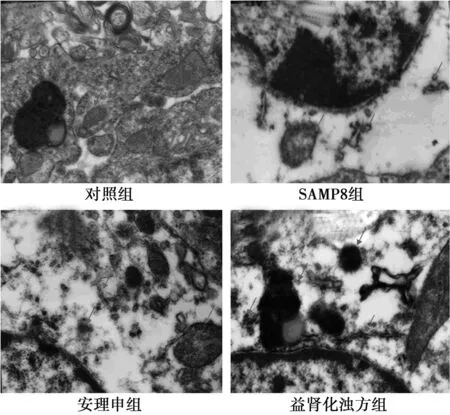
图3 小鼠海马CA1区神经元超微结构(×4 000)
2.4益肾化浊方对小鼠APP和PS1基因表达的影响与对照组(1.00±0.00)比较,SAMP8组海马区APP mRNA表达(2.38±0.61)明显增加(P=0.001 8);与SAMP8组比较,安理申组海马区APP mRNA表达(1.83±0.85)无明显差异,而益肾化浊方组海马区APP mRNA表达(1.27±0.16)明显减少(P=0.004 5),益肾化浊方组与安理申组无明显差异(P=0.100 7)。与对照组(1.00±0.55)比较,SAMP8组海马区PS1 mRNA表达(1.73±0.62)明显增加(P=0.012 2);与SAMP8组比较,安理申组海马区PS1 mRNA表达(1.37±0.27)无明显变化,而益肾化浊方组海马区PS1 mRNA表达(1.01±0.16)明显减少(P=0.002 4);益肾化浊方组与安理申组无明显差异(P=0.350 9)。
2.5益肾化浊方对小鼠GSK-3β蛋白表达的影响与对照组(0.69±0.08)比较,SAMP8组海马区GSK-3β蛋白表达(1.00±0.28)明显增加(P=0.003 4);与SAMP8组比较,安理申组海马区GSK-3β蛋白表达(0.66±0.14)明显减少(P=0.003 0),而益肾化浊方组海马区GSK-3β蛋白表达(0.94±0.16)无明显变化;与安理申组比较,益肾化浊方组海马区GSK-3β蛋白表达明显增加(P=0.000 6)(图4)。
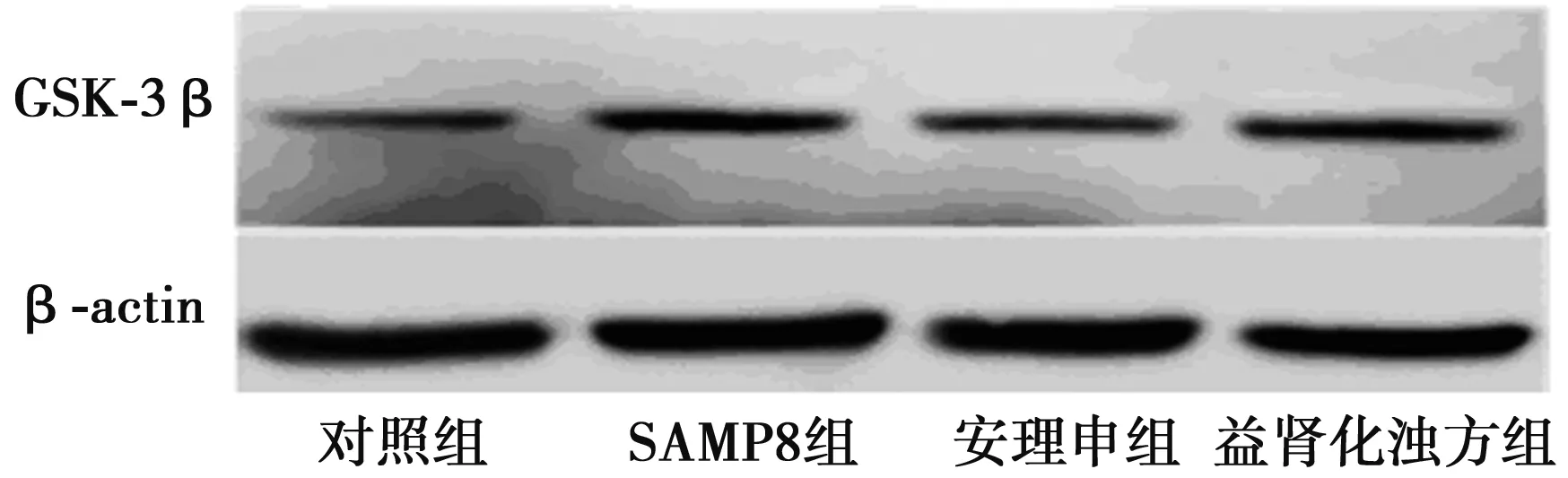
图4 GSK-3β蛋白表达情况
3讨论
AD属祖国医学“痴呆”范畴,其发病与中医五脏中肾的关系最为密切,肾虚精亏、髓海不足是AD形成的基本病机并始终贯穿其全过程〔7,8〕。随着肾精亏虚,其他脏腑功能也相应虚衰,气血运化不畅成瘀,津液失于布化为痰,痰瘀互结,酿生浊毒而痹阻脑络,因肾虚所致的浊毒成为AD发病的主要因素。在中医经典脏象理论“肾藏精”、“肾生髓通于脑”理论的指导下,投用补肾益精、化浊开窍方药切中病机。方由制首乌、女贞子、淫羊藿、补骨脂、石菖蒲、炙黄芪、川芎七味中药组方,方中制首乌、女贞子补肝肾,益精髓;淫羊藿、补骨脂壮肾阳,温肾精,以应“阴中求阳,阳中求阴”之意;菖蒲化痰开窍,黄芪补气行血,川芎辛散上行,为血中气药,三者合用可达化浊开窍之目的,诸药相辅相成,共奏补肾益精、化浊开窍之功。
SAMP8是生命过程正常的小鼠,可作为抗快速老化系(SAMR)的品系之一,其寿命一般为12~13个月。研究发现〔9,10〕,SAMP8生长6个月后,海马区即有Aβ1~40、Aβ1~42沉积产生,其数量随着年龄增加而不断增多,同时伴有Tau蛋白磷酸化,导致神经递质、蛋白基因表达等改变,因此,SAMP8可作为AD动物模型。
Morris水迷宫是用来测量啮齿动物空间学习和记忆的量化指标与主要工具〔11~13〕,Nissl染色则是观察神经元丢失的主要检测手段之一。本研究发现,益肾化浊方可有效改善SMP8的空间认知功能,并减少海马CA1区神经元的缺失,改善神经元细胞器等结构,其细胞质内出现了正常老化神经元常见的脂褐素、次级溶酶体结构,提示益肾化浊方可改善神经元自身代谢,使神经元更趋向于正常老化。
Aβ是APP的代谢产物〔14〕。APP是一种跨膜蛋白质,广泛存在于人体各种组织中,以脑组织中表达最高。其有两种水解途径:一是被α分泌酶水解,生成可溶性的α-APPs和C83片段多肽,不产生Aβ片段;二是在胞质溶酶体内由β分泌酶首先裂解产生可溶性的APPs,剩余部分再通过γ分泌酶裂解,产生Aβ碎片。在某些病理条件下,APP第二条水解途径开启,促使大量Aβ堆积,其中大约90%为Aβ1~40片段,剩余大部分是Aβ1~42片段,均具有很强的细胞毒性,是加速诱发AD的重要原因〔15,16〕。Aβ1~42/Aβ1~40还受PS1基因的影响,PS1参与γ分泌酶裂解APP的过程,它可以导致Aβ1~42/Aβ1~40比例增加,细胞毒性增强,进而引起神经元的丢失〔17,18〕。本研究发现,益肾化浊方可显著抑制APP、PS1基因的表达,可能会进一步减少Aβ,尤其是Aβ1~42片段的生成,从而延缓AD发展。
近些年,Tau蛋白假说备受关注。Tau蛋白在神经细胞中的主要作用是稳定微管,其C末端易导致纤维结构聚集。GSK-3β可以促使Tau蛋白C末端高度磷酸化,使Tau蛋白具有很强的神经毒性,导致神经元缺失〔19~22〕。此外,GSK-3β还参与APP的β分泌酶与γ分泌酶水解,促使神经元轴突崩解,认知功能下降〔23〕。本研究发现,益肾化浊方和安理申均可一定程度地降低GSK-3β蛋白的表达,但安理申效果更明显。
综上所述,益肾化浊方可通过下调APP、PS1基因与GSK-3β蛋白的表达,抑制海马CA1区神经元凋亡,改善神经元超微结构,增强SAMP8空间学习和记忆能力。与安理申相比,该方作用靶点更多,充分体现了中药复方多成分、多靶点的作用特点,作用时间较持久,为防治AD提供了新的选择。
4参考文献
1Ghosh AK,Kumaragurubaran N,Tang J.Recent developments of structure based beta-secretase inhibitors for Alzheimer′s disease 〔J〕.Curr Top Med Chem,2005;5(16):1609-22.
2Mario Nizzari,Stefano Thellung,Alessandro Corsaro,etal.Neurodegeneration in Alzheimer disease:Role of amyloid precursor protein and presenilin1 intracellular signaling 〔J〕.J Toxicol,2012;doi:10.1155/2012/187297.
3傅凯丽,林翠茹,张玉莲,等.“益肾化浊方”治疗轻度阿尔茨海默病15例临床研究〔J〕.江苏中医药,2012;44(8):28-9.
4张琳琳,周震,李程,等.益肾化浊方对SAMP8小鼠NEI网络相关指标的影响〔J〕.世界中医药,2014;9(6):689-92.
5王凯,张琳琳,宋宛珊,等.益肾化浊方对阿尔茨海默病模型大鼠海马区BDNF及其受体TrkB蛋白表达的影响〔J〕.中国实验方剂学杂志,2015;21(5):111-4.
6刘金凤,聂坤,栗振杰,等.Morris 水迷宫测评方法的改进及对快速老化痴呆小鼠 SAMP8 认知功能的再评价〔J〕.中国中医急症,2013;22(1):5-7,22.
7郭振球.老年期痴呆的证治学研究〔J〕.中医药研究,1991;1:16.
8傅仁杰,罗社文.中医药治疗老年性呆病的临床研究述评〔J〕.北京中医药大学学报,1994;17(3):2.
9Del Valle J,Duran-Vilaregut J,Manich G,etal.Early amyloid accumulation in the hippocampus of SAMP8 mice 〔J〕.J Alzheimers Dis,2010;19(4):1303-15.
10李延峥,李林,张兰.快速老化小鼠SAMP8在阿尔茨海默病研究中的应用〔J〕.中国康复理论与实践,2012;18(12):1119-22.
11Morris R.Developments of a water maze procedure for studying spatial,learning in the rat 〔J〕.J Neurosci Methods,1984;11(1):47-60.
12Nowakowska E,Kus K,Bobkiewicz-Kozlowska T.Role of neuropeptides in antidepressant and memory improving effects of venlafaxine 〔J〕.Pol J Pharmacol,2002;54(6):605-13.
13Frisone DF,Frye CA,Zimmerberg B.Social isolation stress during the third week of life has age-dependent effects on spatial learning in rats 〔J〕.Behav Brain Res,2002;128(2):153-60.
14Shanmugam G,Polavarapu PL,Láng E,etal.Conformational analysis of amyloid precursor protein fragment containing amino acids 667-676,and the effect of D-Asp and iso-Asp substitution at Asp672 residue 〔J〕.J Struct Biol,2012;177(3):621-9.
15Torreilles F,Touchon J.Pathogenic theories and intrathecal analysis of the sporadic from of Alzheimers′ disease〔J〕.Prog Neurobiol,2002;66(3):191-203.
16Deshpande A,Mina E,Glabe C,etal.Different conformations of amyloid-beta induce neurotoxicity by distinct mechanisms in human cortical neurons〔J〕.J Neurosci,2006;26(22):6011-8.
17Guo Q,Fu W,Sopher BL,etal.Increased vulnerability of hippocampal neurons to excitotoxic necrosis in presenilin-1 mutant knock in mice 〔J〕.Nat Med,1999;5(1):101-6.
18Duff K,Eckman C,Zehr C,etal.Increased amyloid-beta 42(43)in brains of mice expressing mutant presenilin-1 〔J〕.Nature,1996;383(6602):710-3.
19Biernat J,Gustke N,Drewes G,etal.Phosphorylation of Ser262 strongly reduces binding of tau to microtubules:distinction between PHF-like immunoreactivity and microtubule binding 〔J〕.Neuron,1993;11(1):153-63.
20Sengupta A,Kabat J,Novak M,etal.Phosphorylation of tau at both Thr231 and Ser262 is required for maximal inhibition of its binding to microtubules 〔J〕.Arch Biochem Biophys,1998;357(2):299-309.
21Abraha A,Ghoshal N,Gamblin TC,etal.C-term inal inhibition of tau assembly in vitro and in Alzheimer’s disease 〔J〕.J Cell Sci,2000;113(Pt21):3737-45.
22Haase C,Stieler JT,Arendt T,etal.Pseudophosphorylation of tau protein alters its ability for self-aggregation 〔J〕.J Neurochem,2004;88(6):1509-20.
23Cai Z,Zhao Y,Zhao B.Roles of glycogen synthase kinase 3 in Alzheimer′s disease 〔J〕.Curr Alzheimer Res,2012;9(7):864-79.
〔2015-09-14修回〕
(编辑郭菁)
Effects and mechanisms of Yishenhuazhuo recipe on the cognitive function and hippocampus neurons morphology of SAMP8 mice
SONG Wan-Shan,ZHANG Yu-Lian,ZHOU Zhen,et al.
Tianjin University of Traditional Chinese Medicine,Tianjin 300193,China
【Abstract】ObjectiveTo study effects and mechanisms of Yishenhuazhuo recipe(YSHZR)on spatial learning and memory and the hippocampus neurons morphology in the senescence-accelerated prone 8(SAMP8)mice.MethodsForty-eight of 9-month-old SAMP8 mice were randomly allocated to model(SAMP8 mice),Aricept treated and YSHZR treated groups.Meanwhile,sixteen senescence-resistant 1(SAMR1)mice were used as controls(SAMR1 group).Aricept(30 mg/kg),YSHZR(20 g/kg)or equal-volume saline(SAMR1 and SAMP8 mice)was administered in each mouse for 14 weeks by gastric infusion twice per day.Spatial learning and memory were measured by the Morris water maze.Neuronal apoptosis was quantified by Nissl staining.The mRNA expression of APP and PS1 and the protein expression of GSK-3β in the hippocampus were detected by RT-PCR and Western blot respectively.ResultsCompared with SAMR1 group,the path length,escape latency,number of neuronal apoptosis,GSK-3β protein and APP,PS1 gene expression in hippocampal CA1 of SAMP8 mice were significantly increased(P<0.01),frequency of entrance was significantly reduced(P<0.01),the swim speed was also significantly lowered(P<0.01),and the neuronal ultrastructural damage was very evident;compared with SAMP8 group,the path length in Aricept group and YSHZR group of mice were significantly shorter(P<0.01),the frequency of entrance was significantly increased(P<0.01),swim speed was also significantly faster(P<0.01),and neuronal ultrastructure damage was significantly reduced;moreover,Aricept significantly reduced GSK-3β protein expression(P<0.01),but YSHZR could significantly reduce the number of neuronal apoptosis(P<0.01),and down-regulate the gene expression of APP,PS1(P<0.01);groups and training days had significant effects on escape latency,total distance and the number of cross platform(P<0.01).ConclusionsYSHZR plays a role of improving spatial memory,reducing neuronal apoptosis and protecting ultrastructure,which may be related to down-regulating the expression of APP,PS1 gene and GSK-3β protein.
【Key words】Alzheimer′s disease;Yishenhuazhuo recipe(YSHZR);Cognitive function;Neuronal apoptosis;Ultrastructure
基金项目:国家重点基础研究发展计划(973计划)(No.2010CB530405)
通讯作者:张玉莲(1963-),女,博士,主任医师,博士生导师,主要从事中医脑病临床与基础研究。
〔中图分类号〕R285.5
〔文献标识码〕A
〔文章编号〕1005-9202(2016)11-2586-05;
doi:10.3969/j.issn.1005-9202.2016.11.009
1天津中医药大学第二附属医院
第一作者:宋宛珊(1987-),女,博士,主治医师,主要从事中医脑病临床与基础研究。

