一种苗期鉴定烟草赤星病抗性的新方法
侯 烁,朱承广,赵 强,向小华,程亚增,闫杏杏, 蒋彩虹,程立锐,杨爱国,王元英*
(1.青岛农业大学,青岛 266109;2.中国农业科学院烟草研究所,烟草行业烟草基因资源利用重点实验室,青岛 266101)
一种苗期鉴定烟草赤星病抗性的新方法
侯 烁1,2,朱承广2,赵 强2,向小华2,程亚增2,闫杏杏2, 蒋彩虹2,程立锐2,杨爱国2,王元英2*
(1.青岛农业大学,青岛 266109;2.中国农业科学院烟草研究所,烟草行业烟草基因资源利用重点实验室,青岛 266101)
烟草赤星病抗性的高通量鉴定是快速筛选和培育烟草抗赤星病品种的前提条件。以15份对赤星病表现不同抗性水平的烟草种质为材料,采用链格孢菌菌饼接种苗期离体叶片,以发病叶片病斑面积作为抗性评价指标,对15份烟草种质的抗性进行评价,并与其田间成株期赤星病抗性进行比较分析。结果表明,采用苗期菌饼接种,供试15份烟草种质的病斑面积差异显著,感病品种病斑平均面积明显大于抗病品种;各品种苗期赤星病鉴定结果与成株期抗性鉴定结果基本一致,且苗期病斑面积大小与3个不同年份、同一地点的成株期平均病级指数间相关性均达到显著水平,分别为0.78、0.74和0.66。表明本研究探讨的苗期离体叶片菌饼鉴定法可以用于烟草赤星病早期鉴定,病斑面积可以作为评价指标准确反映不同烟草品种间赤星病的抗性差异。
赤星病;离体鉴定;病斑;病级指数
烟草赤星病是一类由链格孢菌引起的烟株成熟后期病害,其主要危害烟草叶片,影响烟叶的产量和品质[1]。由于烟草赤星病的发病条件受温度、湿度等环境因素影响较大,使得烟草赤星病的接种鉴定成为一个难题。因此,建立一个在可控条件下快速准确的鉴定方法十分必要。首先科学的接种鉴定株都能发病且接种后病原菌要处于相对一致的有利于发病环境当中;二是科学的调查标准与适时的病情调查,调查标准可靠,主观误差尽可能小,病情调查时期适当[2]。目前,针对烟草赤星病抗性接种鉴定主要有3种方法:田间鉴定法[3]、离体叶片鉴定法[4-5]和毒素鉴定法[6-7]。为了克服大田鉴定周期长以及鉴定结果受温、湿度等环境因素影响大的缺点[8],本研究在总结前人的研究基础上,探讨了一种苗期鉴定烟草赤星病抗性的新方法,为快速高通量筛选和培育烟草赤星病抗病品种奠定基础。
1 材料与方法
1.1 供试材料
15份供试烟草种质来自中国农业科学院烟草研究所国家烟草种质资源中期库(表1)。其中包括8份选育烤烟种质,4份引进烤烟种质,2份地方烤烟种质和1份引进雪茄烟种质。根据烟草品种资源信息,这15份烟草种质对赤星病的抗性各异,其中净叶黄和Beinhart1000-1是烟草赤星病抗病育种工作中利用的主要抗源。供试烟草种质均采用1% AgNO3溶液浸泡10 min灭菌后使用。
供试烟草赤星病菌株由中国农业科学院烟草研究所烟草植物保护研究中心提供,为强致病力链格孢菌菌株。
1.2 试验方法
1.2.1 育苗及田间种植 烟草赤星病苗期鉴定材料于中国农业科学院烟草研究所即墨农场温室中进行育苗,将种子播种于假植盘中,覆膜保湿,出苗后揭去保鲜膜,20 d左右每个品种选取50棵健壮幼苗假植于50孔育穴盘中,进行苗期常规管理。40 d左右每份种质选取4棵生长健康、长势一致的烟苗移栽至小花盆中,置于温度为28 ℃,空气相对湿度为65%的人工气候室中生长。
烟草赤星病成株期田间鉴定材料育苗方法同上,2013、2014和2015年均在5月上旬移栽至农场大田,每个品种移栽1行形成一个小区,每行5株,行距1.2 m,株距0.55 m。常规水肥管理。
1.2.2 苗期烟草赤星病接种鉴定方法 (1)叶片选取:烟苗移栽至小花盆后,待烟株长至5~7叶期时从每株顶部往下选取第3或4片完全展开的叶片(图1A),叶片用湿润棉花包住叶柄处保湿,置于铺有滤纸的湿润海绵上,将海绵置于盛有600 mL蒸馏水,长×宽×高=2 cm×15 cm×8 cm的保鲜盒中。
(2)病原菌活化:将链格孢菌在PDA培养基上进行活化,于黑暗条件下28 ℃培养3~4 d。
(3)接种鉴定:采用5 mm打孔器沿菌落边缘打取含白色菌丝的菌饼若干备用(图1B)。每片烟叶背面沿主脉对称接种4个菌饼,白色菌丝面朝下(图1C),每片烟叶为一个重复,共3次重复。接菌完毕后将保鲜盒置于温度为28 ℃,光/暗周期为16 h/8 h条件下人工气候室培养,保鲜盒内湿度保持在90%左右(图1D)。5 d后测量和统计病斑圆形面积(图1E)。
1.2.3 田间烟草赤星病接种鉴定方法 (1)孢子悬浮液制备方法:烟草赤星病菌于PDA培养基上于28 ℃,黑暗条件下进行活化。待菌落铺满整个培 养皿后,进行分生孢子浓度检测,分生孢子浓度约为3×106个/mL时用于接种。按无菌水:分生孢子=50:1的重量比配制成孢子悬浮液备用。
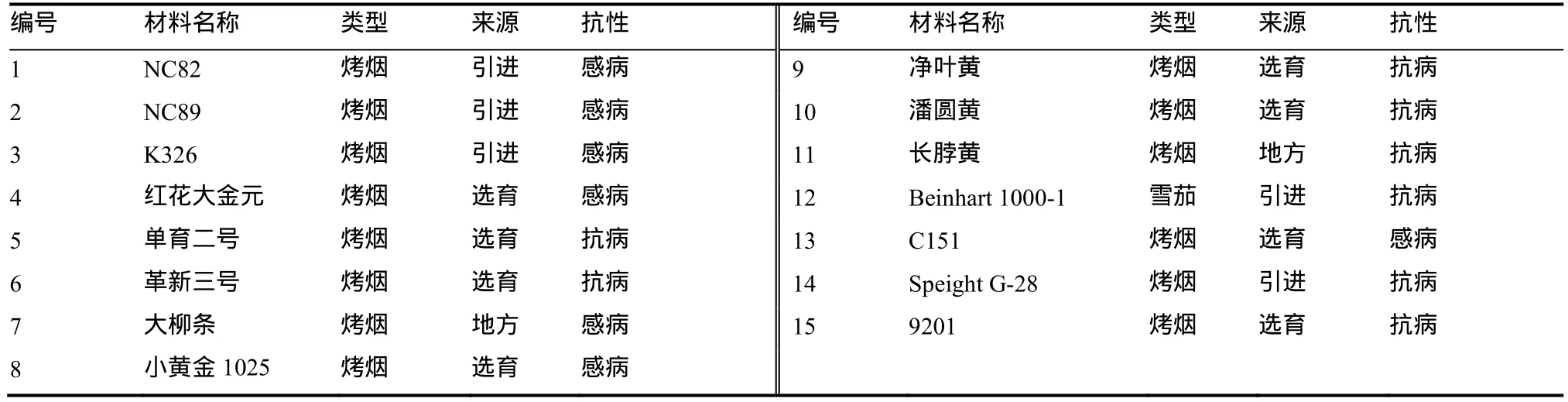
表1 16份烟草种质Table 1 The 16 tobacco germplasms

图1 烟草赤星病接种流程Fig. 1 Tobacco brown spot inoculation process
(2)孢子悬浮液浓度计算方法:移液枪移取5 mL无菌水注入培养皿,用载玻片刮取菌落,洗脱过滤菌丝。用移液枪移取1 mL洗脱液注入血球计数板的凹槽至凹槽满。显微镜观察计数(20×),计数时读取双线格中菌数,共计25格。孢子悬浮液浓度计算方法如下:
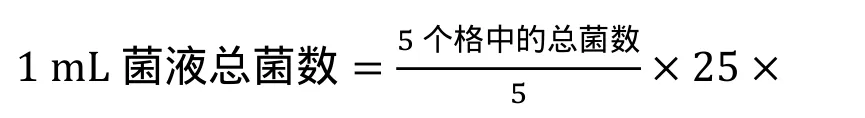
10000×稀释倍数 (此试验稀释倍数为5)
(3)田间病级调查:大田烟株长至9~10叶时利用划伤悬滴接种法接种两片底部叶,套袋保湿,3周后调查发病情况。烟草赤星病分级标准按照烟草病虫害分级及调查方法(GBT23222—2008),以叶片为标准分级调查,共划分为6个标准:0级,全叶无病;1级,病斑面积占叶片面积1%以下;3级,病斑面积占叶片面积2%~5%;5级,病斑面积占叶片面积6%~10%;7级,病斑面积占叶片面积11%~20%;9级,病斑面积占叶片面积21%以上。
病级指数=100×∑(代表数值×病级叶数)/(叶 片总和×发病最终病级代表数值)
抗性评价:免疫,病情指数等于0;高抗,0<病情指数≤30;中抗,30<病情指数≤50;中感,50<病情指数≤70;高感,70<病情指数≤100。 1.2.4 数据处理 数据、图表处理及统计分析在Microsoft Excel 2003中进行,方差分析采用SPSS软件处理。
2 结 果
2.1 苗期离体叶片赤星病抗性鉴定结果
使用菌饼接种烟草苗期离体叶片,5 d后进行表型变化观察。结果表明,抗病品种叶片被侵染部位形成较小的病斑(图2a),感病品种被侵染部位形成较大的病斑,叶片褪绿变黄现象严重(图2b)。接种后5 d进行病斑面积测量统计和方差分析,供试烟草品种间病斑平均面积多重比较结果显示(表2),15份烟草种质病斑平均面积差异显著,病斑平均面积最大为127.58 mm2,最小为7.21 mm2,根据病斑平均面积对15份供试烟草种质进行赤星病抗性划分,NC82、C151和小黄金1025表现为高度感病;大柳条和NC89表现为中度感病;长脖黄和革新三号表现为中度抗病;净叶黄、K326、SpeightG-28、9201、红花大金元、Beinhart1000-1、单育二号和潘圆黄表现为高度抗病。

图2 不同烟草品种接种后5 d病症Fig. 2 Disease symptoms of tobacco 5 days after inoculation
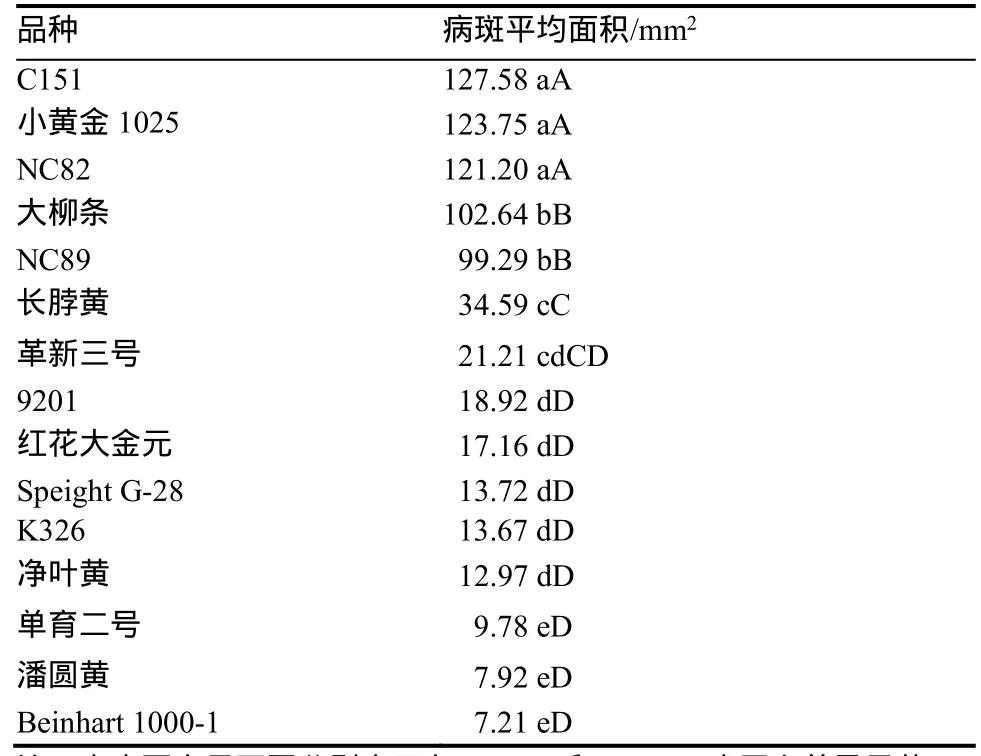
表2 不同烟草品种病斑平均面积多重比较Table 2 The multiple comparison for average lesion area of different tobacco varieties
2.2 田间赤星病抗性鉴定
使用划伤悬滴法接种大田烟草叶片,将接种叶片套袋保湿,3周后进行病级调查统计,2013、2014、2015年病级统计分析结果表明(表3),C151、小黄金1025、大柳条、红花大金元、K326、长脖黄、潘圆黄、和净叶黄9个品种抗性表现相对稳定。其中,C151和小黄金1025三年抗性鉴定结果均表现为高度感病;大柳条、红花大金元和K326三年抗性鉴定结果均表现为中度感病;长脖黄3年抗性鉴定结果均表现为中度抗病;潘圆黄和净叶黄3年抗性鉴定结果均表现为高度抗病。NC89、NC82、革新三号、9201、SpeightG-28、单育二号和Beinhart1000-1七个品种各年份间抗性表现并不都相同。综合3年抗性鉴定结果可知,NC89和NC82表现为高度感病;革新三号、9201和SpeightG-28表现为中度抗病;单育二号和Beinhart1000-1表现为高度抗病。
烟草赤星病苗期鉴定与大田鉴定比较结果显示,苗期和大田期鉴定结果中NC82、C151和小黄金1025均表现为高度感病;大柳条均表现为中度感病,长脖黄、革新三号均表现为中度抗病,净叶黄、Beinhart1000-1、单育二号和潘圆黄均表现为高度抗病,SpeightG-28、NC89和9201苗期与大田期抗感趋势表现一致。说明苗期离体叶片菌饼鉴定法的鉴定结果较为可靠,该法可用于烟草赤星病抗病品种的初步鉴定与筛选。

表3 不同烟草品种田间赤星病抗性鉴定Table 3 Evaluation of different tobacco resistance to brown spot disease in the field
2.3 相关分析验证
使用SPSS软件进行苗期病斑平均面积与大田病情指数间相关分析,结果表明,苗期病斑平均面积与2013、2014和2015年大田病情指数之间的相关系数分别为0.78、0.74和0.66,均达极显著水平(表4),进一步说明苗期病斑面积可以作为赤星病抗性的评价指标。

表4 苗期病斑平均面积与田间病情指间数相关系数Table 4 Correlation coefficients between average lesion area in stage and average disease rating in the filed
3 讨 论
前人在烟草赤星病抗性鉴定方面进行了较多探索和研究。孢子悬浮液和AT毒素是进行赤星病接种鉴定最常用的两种介质,无论苗期还是成株期两种物质都能够用来接种。孢子悬浮液制备比较简单,接种浓度可控,但接种后发病慢,发病情况受孢子悬浮液浓度和温、湿度等环境条件影响较大[9];AT毒素活性强,接种后发病快,但AT毒素的提取和纯化过程复杂[10-11]。因此,在烟草赤星病抗性鉴定过程中,大多数研究者选择分生孢子悬浮液作为接种物质。
针对烟草赤星病的接种鉴定,研究者通常在实验室和大田两种环境中进行。大田鉴定通常以成熟期叶片为接种对象,采用划伤接种或直接喷施孢子悬浮液的方法进行接种鉴定,鉴定结果准确性较高,但其周期长,工作量大[12]。实验室鉴定方法多种多样,有毒素培养基法、毒素浸根法、离体叶片鉴定法等[6-7],本研究在总结前人基础上,采用链格孢菌菌饼接种苗期离体叶片进行赤星病抗性评价,与大田鉴定相比,菌饼制备和接种方法比孢子悬浮液简便,发病相对较快,周期短,省时省力,且温、湿度可控,不受季节限制,受环境影响小。但与其他方法相比,本研究的离体叶片菌饼鉴定法也有不足之处,下一步可增加病害发生和侵染过程中一些调查指标,如病斑形成的快慢和侵染后是否造成叶片衰老变黄等,以便对不同种质赤星病抗性做出更为全面、客观的评价。
本研究采用的苗期离体叶片菌饼鉴定法对不同烟草种质进行赤星病抗性早期鉴定,为开展烟草赤星病抗病育种和抗病分子机制研究奠定了基础。
[1] 张万良,翟争光,谢杨军,等. 烟草赤星病研究进展[J]. 江西农业学报,2011,23(1):118-120.
[2] 王子斌. 水稻纹枯病接种鉴定体系新探索及抗病新种质YSBR1抗性分析[D]. 扬州:扬州大学,2013.
[3] 蒋彩虹,冯全福,王元英,等. 一个与净叶黄抗赤星病基因紧密连锁的SSR标记[J]. 中国烟草科学,2012,33(1):19-22.
[4] Elena T Y, Zhenya P Y, Slavtcho S. Alternaria alternata AT toxin induce programmed cell death[J]. Phytopathol, 2009, 157: 592-601.
[5] Sun H, Wang L, Zhang B. Scopoletin is a phytoalexin against Alternaria alternata in wild tobacco dependent on jasmonate signalling[J]. Journal of Experimental Botany, 2014, 15: 4305-4315.
[6] 郭永峰. 烟草赤星病抗性鉴定的新方法—毒素抗性鉴定法[J]. 中国烟草,1995(3):44-47.
[7] 孙丽萍. 烟草突变体抗赤星病快速高通量筛选鉴定方法研究[D]. 北京:中国农业科学院,2013.
[8] 张亚,何可佳,罗坤,等. 烟草赤星病研究进展及对策[J]. 陕西农业科学,2007(2):82-84.
[9] 刘化冰,张小全,杨铁钊,等. 烟草赤星病抗病性鉴定方法研究进展[J]. 中国农学通报,2009(21):261-265.
[10] 吴中心,姚根怀,张同庆,等. 烟草赤星病抗性鉴定方法的研究[J]. 河南农业科学,1994(6):15-17.
[11] 李梅云. Na盐与AT毒素对烟苗根生长的影响[J]. 中国烟草学报,2006,12(5):43-45.
[12] 巢进,田茂成,黄远斌,等. 烟草不同品种赤星病抗性鉴定[J]. 现代农业科技,2008(17):136-138.
A New Method to Evaluate Tobacco Resistance to Brown Spot Disease at the Seedling Stage
HOU Shuo1,2, ZHU Chengguang2, ZHAO Qiang2, XIANG Xiaohua2, CHENG Yazeng2, YAN Xingxing2, JIANG Caihong2, CHENG Lirui2, YANG Aiguo2, WANG Yuanying2*
(1. Qingdao Agricultural University, Qingdao 266109, China; 2. Tobacco Research Institute, Chinese Academy of Agricultural Sciences, Key Laboratory for Tobacco Gene Resources, Qingdao 266101, China)
High-throughput resistance evaluation in vitro is important for the screening and breeding of tobacco varieties resistant to tobacco brown spot disease. In this study, detached leaves at the seedling stage of 15 tobacco germplasm materials with different resistance to tobacco brown spot disease were inoculated with plugs of Alternaria alternata. The lesion area was used to evaluate the disease resistance of the 15 tobacco germplasm materials after inoculation, and the tobacco resistance identified at the seedling stage was compared with that at the adult stage in the field. The results showed that the lesion areas of 15 tobacco varieties were significantly different after inoculation, and the lesion areas of the susceptible varieties was obviously larger than that of the resistant varieties. The resistance identified at the seedling stage and at the adult stage was similar. At the same location with three years’ field experiments, the correlation coefficients between lesion areas and disease indexes were 0.78, 0.74 and 0.66, all at a significant level. In conclusion, this method of inoculation of fungal plugs on detached seedling leaves can be used to effectively evaluate the resistance of tobacco varieties to brown spot disease at early stages, and lesion area can be taken as an index to accurately indicate the resistance of different tobacco varieties to brown spot disease.
tobacco brown spot; resistance evaluation in vitro; lesion; disease index
S435.72
1007-5119(2016)06-0072-05
10.13496/j.issn.1007-5119.2016.06.013
国家烟草专卖局烟草基因组计划重大专项项目“烟草抗CMV和赤星病连锁分子标记开发及NC82、K326品种抗性改良”(110201301009)
侯 烁(1990-),男,在读硕士研究生,研究方向:作物遗传育种。E-mail:15165235159@163.com。*通信作者,E-mail:wangyuanying@caas.cn
2016-05-16
2016-08-28

