链球菌溶血素O的表达、纯化及生物活性鉴定
陈鸿恩,梁海琦,肖士宾,李富勇
(1.江西省赣州市立医院 341000;2.宁波美康生物科技股份有限公司,浙江宁波 315104)
·临床研究·
链球菌溶血素O的表达、纯化及生物活性鉴定
陈鸿恩1,梁海琦1,肖士宾1,李富勇2
(1.江西省赣州市立医院341000;2.宁波美康生物科技股份有限公司,浙江宁波 315104)
摘要:目的重组表达链球菌溶血素O(SLO),纯化后验证其生物学活性。方法合成目的基因,采用聚合酶链反应扩增、酶切连接的方式构建SLO-pET28a载体,经酶切和测序验证后,转化大肠杆菌BL21(DE3)中,经诱导表达条件优化,采用镍亲和柱和分子筛纯化SLO。分别检测重组SLO和天然SLO对试剂盒校准品的响应情况和与临床样本匹配程度。结果成功构建了SLO-pET28a-BL21(DE3)菌株,在OD600=0.8时,25 ℃,0.4 mmol IPTG诱导,大于90%目的蛋白会可溶性表达。纯化后SLO纯度大于95%。重组的SLO与提取的SLO对试剂盒校准品的响应相当,与临床样本的匹配程度一致。结论重组SLO的生物学活性与提取相当,为检测血清中的抗链球菌溶血素O奠定了基础。
关键词:重组链球菌溶血素O抗原性;溶血活性;表达;纯化;生物活性
大部分链球菌溶血素O(SLO)是由β-溶血型中的a 组链球菌(GAS)分泌的,是具有溶血活性的蛋白分子,相对分子质量约为68×103,其溶血活性和抗原性对氧敏感[1]。抗链球菌溶血素O(ASO)是常用的诊断感染的标志,测定的机制是SLO和ASO的抗原抗体反应,可以采用ELISA或者胶乳比浊等技术手段放大反应的信号,配以标准品可以定量检测血清中的ASO[2-3]。SLO属于细菌膜穿孔蛋白家族,由于这个家族绝大多数成员的膜受体都是胆固醇,所以命名为胆固醇依赖溶细胞毒素家族(CDCs)。CDCs中多数蛋白对氧非常敏感,其功能活性是依靠还原剂而存在。国内医学微生物学教材解释SLO对分子氧敏感,是因为在氧化时SLO可形成链内二硫键。但SLO肽链内只有1个半胱氨酸残基(Cys,C),有的CDC甚至1个Cys也没有,根本不可能形成链内二硫键。同时说明SLO对氧敏感与二硫键无关。SLO的获得一般有两种途径:(1)用含有1%葡萄糖的Todd-Howit肉汤培养GAS[4]。该方法培养提取的SLO虽然活性及抗原性好,但是产量低,提纯方法较复杂,且有链球菌感染的风险,现较少使用。(2)通过重组表达。该蛋白为原核蛋白,故可以采用大肠杆菌表达,该技术成熟简便、产量高、加入标签后易纯化[5]。本研究即利用pET系统表达重组SLO,通过优化诱导表达条件,减少原核表达包涵体蛋白比例。
1材料与方法
1.1材料
1.1.1质粒与细胞TOP10、BL21(DE3)感受态和pET28a质粒由宁波美康生物科技股份有限公司实验室保存。
1.1.2主要试剂抗SLO检测试剂盒及其校准品购于宁波美康生物技术股份有限公司;天然的SLO购于武汉华美生物有限公司;限制性内切核酸酶NcoⅠ和XhoⅠ、T4 DNA连接酶、ExTaq DNA聚合酶购自大连宝生物工程有限公司;SLO基因及PCR引物由苏州金唯智生物科技有限公司合成;质粒小量提取试剂盒、DNA胶回收试剂盒等购自上海拜力生物科技有限公司;Ni-Hp亲和填料和Sephadex G-50凝胶购自GE公司;羊抗人IgG-HRP购于博奥森生物有限公司;其他试剂和药品为国产分析纯。
1.2方法
1.2.1引物设计与合成根据SLO基因序列转译成大肠杆菌偏好的密码序列,并对优化后的基因序列设计引物。在引物上、下游分别引入Nco I、Xho I酶切位点和保护碱基。引物序列(斜体序列为酶切位点):上游引物 5′-CAT GCC ATG GGC CTT GCT CCC AAA GAA ATG CC-3′;下游引物 5′-CGC CT CGA GCT TAT AAG TAA TCG-3′。
1.2.2表达载体SLO-pET28a的构建首先以SLO-PUC57质粒为模版扩增目的片段。PCR扩增体系为:灭菌双蒸水136 μL,5×PCR缓冲液40 μL,dNTPs16 μL,SLO-PUC57(0.2 ng/μL)2 μL,上游引物(25 mmol)2 μL,下游引物(25 mmol)2 μL,ExTaq DNA聚合酶2 μL反应条件如下:94 ℃预变性4 min后,94 ℃变性30 s,62 ℃退火60 s,72 ℃延伸1 min,30个循环,72 ℃再延伸5 min,4 ℃保存。0.8%琼脂糖凝胶电泳鉴定结果。然后PCR扩增所得SLO基因片段经胶回收后,用NcoⅠ和XhoⅠ双酶切,与经过同样双酶切的pET-28a载体在T4 DNA连接酶的作用下16 ℃连接过夜,将连接产物转化TOP10感受态,提取其质粒双酶切鉴定和测序。
1.2.3SLO表达及可溶性分析提取鉴定正确的SLO-pET28a质粒转化至表达型菌株BL21(DE3)感受态中,挑取单菌落接种至LB培养基中,37 ℃培养12 h活化菌种后,按1%的比例接种于新鲜的LB培养基中,37 ℃,200 r/min培养至OD600为0.8左右时,加入终浓度0.4 mmol的IPTG,25 ℃诱导8 h,离心收集菌体。取1 g菌体,加入10 mL PBS,超声破碎后,离心分离上清和沉淀。取诱导培养前的菌体和诱导后菌体、破碎后上清和沉淀进行12%SDS-PAGE分析。
1.2.4SLO的纯化采用Ni-Hp进行纯化,以20 mmol Tris-HCl,0.5 mol NaCl,50 mmol 咪唑为平衡液,经过梯度洗脱测试,采用20 mmol Tris-HCl,0.5 mol NaCl,300 mmol咪唑一步洗脱,根据280 nm处的紫外吸收值收集穿出和洗脱。之后将20 mmol Tris-HCl,0.5 mol NaCl,300 mmol洗脱液上样至20 mmol Tris-HCl,0.5 mol NaCl平衡的Sephadex G-50脱掉咪唑。
1.2.5SLO的生物学鉴定(1)Western Blot验证SLO与血清中ASO的相互作用将纯化后的SLO和商业SLO各5 μg一同做12%SDS-PAGE,然后转移至PVDF膜上,5%的脱脂奶粉封闭1.5 h,ASO试剂盒检测值为185 U/mL用5%的脱脂奶粉稀释1 000倍,室温孵育1 h后,换成1∶2 000稀释的羊抗人IgG-HRP室温孵育1 h,去处膜清洗后加入显色液,判断其与血清中ASO的匹配关系。(2)ELISA检测SLO与ASO校准品的相互作用将纯化后的SLO和商业SLO用包被液稀释至1 μg/mL,每孔100 μL加至酶标板中,37 ℃孵育1 h,后3% BSA 4 ℃封闭过夜。用3% BSA稀释ASO试剂盒的校准品,获得终浓度为4 U/mL的样品,之后等倍稀释,并依次分别加入酶标板中,37 ℃孵育1 h,换成1∶2 000稀释的羊抗人IgG-HRP,37 ℃孵育1 h,TMB显色1 min后2 mol H2SO4终止显色,酶标仪450 nm处读数,判断重组SLO与校准品的匹配关系。此试验做3组复孔。
1.3统计学处理采用SPSS19.0统计软件进行数据分析,组间计量资料比较采用成组设计t检验,组间计数资料比较采用χ2检验,以P<0.05为差异有统计学意义。
2结果
2.1重组克隆载体的构建鉴定PCR扩增出的片段大约在1 600 bp左右,与预期的大小相符,没有其他非特异的条带(图1a);从转化的TOP10中提取质粒,送样测序,结果与PUC57中的目的序列一致,经NcoⅠ和XhoⅠ双酶切鉴定,切出约1 600 bp左右的片段,与目的片段大小相当(图1b)。
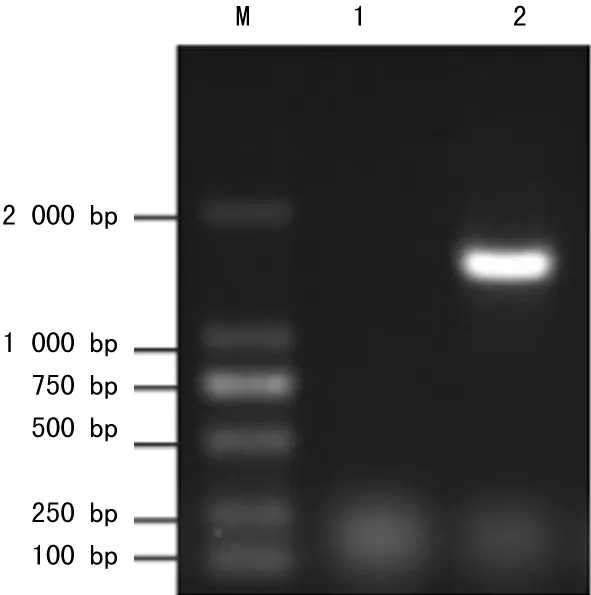
注:M为DNA Marker;1为无模板的对照;2为扩增的SLO。
图1a琼脂糖凝胶电泳检测PCR扩增SLO基因
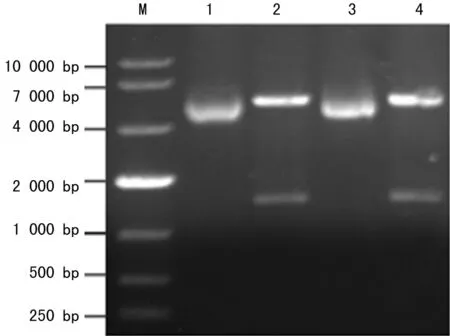
注:M为DNA Marker;1和3为SLO-pET28a;2和4为NcoⅠ和XhoⅠ双酶切SLO-pET28a。
图1b琼脂糖凝胶电泳检测酶切SLO-pET28a
2.2SLO的诱导表达和可溶性分析转化得到SLO-pET28a-BL21(DE3)经过诱导温度和诱导剂浓度优化,可表达相对分子质量约为60×103的蛋白,目的蛋白约占总蛋白的30%(图2a),并且90%以上为可溶表达(图2b)。
2.3重组SLO的分离纯化离心收集菌体、超声破碎后用Ni-Hp纯化,低浓度咪唑洗杂后,用高浓度咪唑洗脱得到纯度约为95%的SLO(图3),后用Sephadex G-50脱掉咪唑,最终产量约为12 mg/g菌体。
2.4重组SLO的生物学鉴定以试剂盒检测的含ASO的血清为一抗,用Western Blot验证重组的SLO与血清中ASO反应能力,显色曝光(图4a),结果显示,重组SLO与血清的ASO反应能力较强,且与天然SLO相当。以ASO校准品为一抗,用ELISA验证SLO的抗原性,通过作图比较,重组的SLO与ASO反应能力较好,且与天然SLO相当(图4b)。以校准品ASO浓度为横坐标,复孔吸光度均值为纵坐标,STDEV为偏差,作图比较,二者吸光度差异无统计学意义(P>0.05)。
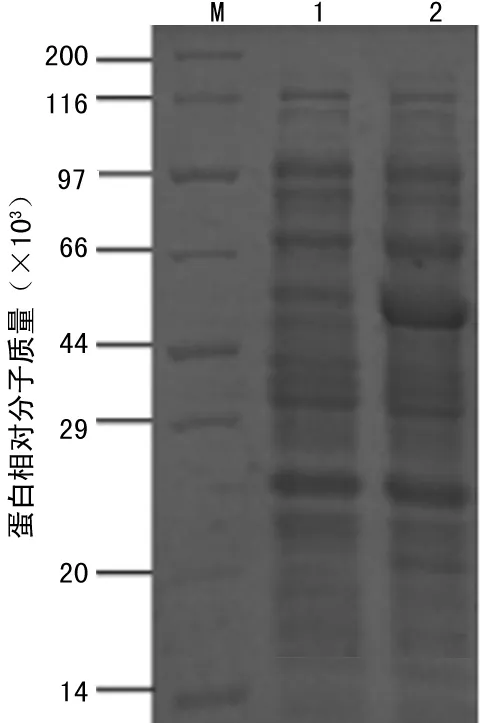
注:M为蛋白 Marker;1为诱导前全菌体蛋白;2为诱导后
全菌体蛋白。
图2aSDS-PAGE分析SLO-pET28a-BL21(DE3)的
诱导表达
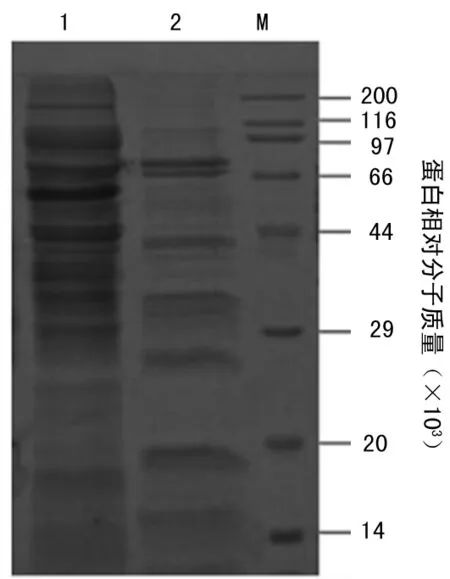
注:M为蛋白 Marker;1为超声破碎后上清;2为超声破碎后沉淀。
图2b目的蛋白的可溶性分析
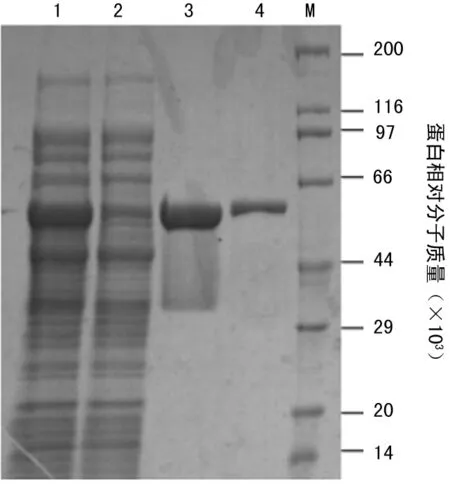
注:M为蛋白 Marker;1为超声破碎后上清;2为经Ni-Hp柱的穿出;3为收集的洗脱蛋白;4为外购天然SLO。
图3Ni-Hp纯化SLO
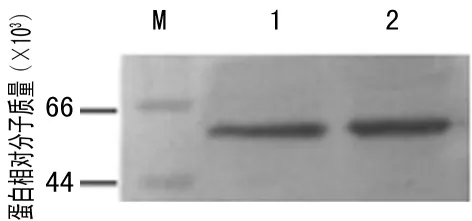
注:M为部分蛋白 Marker;1为重组的SLO;2为外购天然SLO。
图4aWestern Blot验证重组的SLO与血清中ASO反应
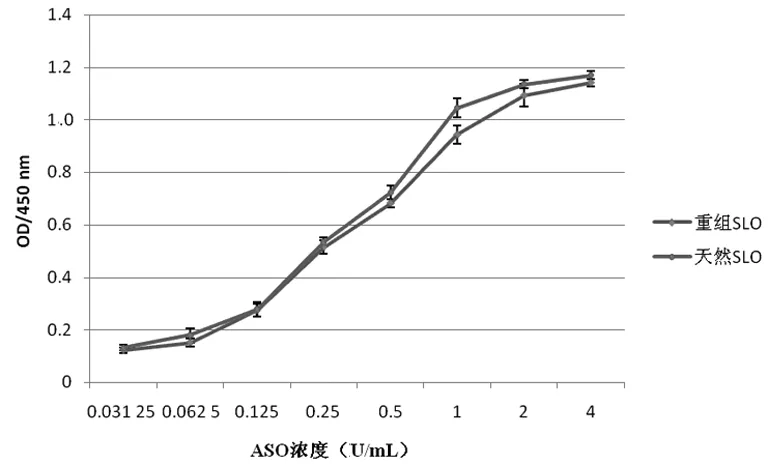
图4b ELISA验证重组的SLO与ASO校准品反应
3讨论
SLO是A群链球菌的代谢产物之一,因为在临床检测中的重要应用,SLO也受到了越来越多的关注[6]。该蛋白的全长有571个氨基酸,其中包括信号肽在内的1~77氨基酸与SLO的溶血活性和抗原性不相关,并且对宿主细胞有毒害作用[7]。Bhakdi 等[8]在链球菌中提取出相对分子质量为68×103和57×103的SLO,并且均有同等的溶血活性。所以本研究选择表达SLO的78~571氨基酸片段,理论相对分子质量约为57×103。虽然原核表达缺乏翻译后的蛋白修饰加工系统,但是对于原核来源的蛋白质,采用大肠杆菌表达,却是不错的选择,真核表达可能会导致过度糖基化[9]。为了利于纯化,且不大幅度影响蛋白的结构功能,本研究在蛋白的N端加入了6×His。
作为鉴定抗原抗体反应的手段,ELISA综合表现更为全面,在有校准品对照时,若使用的抗体均识别抗原上的特定位点,可以做成灵敏的定量方法,市场上有单抗夹心定量抗原的试剂盒。WB抗原纯度较低且没有夹心抗体能展现其优势,在应用于科研方面,图片结果更能被接受,WB被广泛采用[10]。在半定量细胞蛋白时,不需要纯化该蛋白,仅需一种一抗即可。
为了确认重组SLO能否作为试剂盒的原料应用于临床检验,购买了市场上应用良好的ASO胶乳比浊试剂盒,以获取浓度较为准确的ASO校准品和ASO血清样本。以天然SLO为对照,用重组抗原去匹配试剂盒的校准品和该试剂盒检测的血清,分别采用ELISA和WB去验证。全面认证了重组SLO对校准品和血清ASO的响应。
总之,本研究成功构建了SLO原核表达菌株,经过表达条件的优化,实现了可溶性表达。亲和纯化后得到了高纯度的目的蛋白,之后通过验证重组SLO与ASO校准品和ASO血清样本,确认他们有良好的结合能力,为该蛋白在诊断试剂中的应用做好了铺垫。
参考文献
[1]Keyel PA,Roth R,Yokoyama WM,et al.Reduction of streptolysin O(SLO)pore-forming activity enhances inflammasome activation [J].Toxins(Basel),2013,5(6):1105-1118.
[2]Pozzi M,Pellegrino P,Carnovale C,et al.On the connection between autoimmunity,tic disorders and obsessive-compulsive disorders:a meta-analysis on anti-streptolysin O titres [J].J Neuroimmune Pharmacol,2014,9(5):606-614.
[3]Ota H,Sato A,Matsumoto H,et al.Immunological analysis of pseudo-positive reaction in healthy adults at anti-streptolysin O measurement by latex agglutination method[J].Rinsho Byori,2005,53(4):279-283.
[4]曹之舫,武建国.链球菌溶血素O的研究进展 [J].国外医学微生物学分册,1988,11(5):208-211.
[5]Velazquez B,Massaldi H,Battistoni J,et al.Construction and expression of recombinant streptolysin-o and preevaluation of its use in immunoassays [J].Clin Diagn Lab Immunol,2005,12(5):683-684.
[6]Oh SH,Lee KY,Lee JH,et al.Clinical manifestations associated with high titer of anti-streptolysin O in Behcet′s disease [J].Clin Rheumatol,2008,27(8):999-1003.
[7]Pinkney M,Kapur V,Smith J,et al.Different forms of streptolysin O produced by Streptococcus pyogenes and by Escherichia coli expressing recombinant toxin:cleavage by streptococcal cysteine protease [J].Infect Immun,1995,63(7):2776-2779.
[8]Bhakdi S,Roth M,Sziegoleit A,et al.Isolation and identification of two hemolytic forms of streptolysin-O [J].Infect Immun,1984,46(2):394-400.
[9]Vogl T,Hartner FS,Glieder A.New opportunities by synthetic biology for biopharmaceutical production in Pichia pastoris [J].Curr Opin Biotechnol,2013,24(6):1094-1101.
[10]Mielenz M,Mielenz B,Singh SP,et al.Development,validation,and pilot application of a semiquantitative Western blot analysis and an ELISA for bovine adiponectin [J].Domest Anim Endocrinol,2013,44(3):121-130.
DOI:10.3969/j.issn.1673-4130.2016.11.047
文献标识码:A
文章编号:1673-4130(2016)11-1556-04
(收稿日期:2016-01-13修回日期:2016-02-23)

