HDAC1重组腺病毒载体的构建及鉴定
马珊珊, 张 琨, 邢 衢, 黄团结, 程 康, 关方霞
(郑州大学 生命科学学院 河南 郑州 450001)
HDAC1重组腺病毒载体的构建及鉴定
马珊珊, 张 琨, 邢 衢, 黄团结, 程 康, 关方霞
(郑州大学 生命科学学院 河南 郑州 450001)
利用Ad-Easy腺病毒表达系统构建含有人源性组蛋白去乙酰化酶1(HDAC1)基因的重组腺病毒,并检测其在脐带间充质干细胞(hUC-MSCs)中的表达及对hUC-MSCs增殖的影响.RT-PCR扩增人HDAC1 ORF序列,构建pAdTrack-CMV-HDAC1重组腺病毒穿梭质粒,PmeI单切后将其转化进入E.coliBJ5183与腺病毒骨架质粒同源重组,PacI单切线性化后转染至HEK293 细胞中扩增和包装pAd-HDAC1,采用空斑法鉴定病毒滴度;pAd-HDAC1感染hUC-MSCs,倒置荧光显微镜下观察荧光表达,qRT-PCR和Western Blot分别检测细胞中HDAC1在mRNA水平和蛋白水平的表达,CCK-8实验检测HDAC1高表达对hUC-MSCs增殖的影响.结果显示成功扩增人 HDAC1 ORF 序列并构建pAd-HDAC1重组腺病毒;病毒感染后hUC-MSCs中HDAC1 mRNA和蛋白表达水平明显增高,并且促进hUC-MSCs的增殖.成功构建HDAC1高表达的腺病毒,可有效提高hUC-MSCs中HDAC1的表达并促进细胞增殖.
组蛋白去乙酰化酶1; 腺病毒载体; 脐带间充质干细胞; 增殖
0 引言
组蛋白乙酰化修饰是一种表观遗传修饰,它不改变细胞DNA 序列,通过组蛋白乙酰化酶(histone acetylases,HATs)和组蛋白去乙酰化酶(histone deacetylases,HDACs)共同调控基因转录过程,在干细胞增殖、分化以及凋亡等多种生物过程中发挥重要作用[1].哺乳动物细胞中已经发现了18种HDACs[2],在干细胞增殖和定向分化研究中关注较多的是HDAC1.目前研究较多的是使用基因缺失技术或者化学抑制剂抑制HDAC1的功能,分析其对干细胞分化的影响.研究表明,缺失HDAC1基因导致 ESCs 分化水平提高,并提高 ESCs中心肌细胞、肌肉细胞和神经细胞特异标记基因的表达[3].SAHA(HDAC抑制剂)通过提高心肌和平滑肌发育相关基因启动子的乙酰化水平,促进大鼠骨髓间充质干细胞向心肌和平滑肌细胞定向分化[4].但是HDAC1高表达对人源性脐带间充质干细胞(human umbilical cord mesenchymal stem cells,hUC-MSCs)的增殖和分化的影响还未见明确报道.为此,本研究利用Ad-Easy腺病毒载体构建含有HDAC1基因的重组腺病毒,并制备出病毒,感染hUC-MSCs,探究改变hUC-MSCs中HDAC1表达活性后对其增殖的影响,为深入研究HDAC1的双向调控对hUC-MSCs增殖和神经分化的影响提供实验依据.
1 材料与方法
1.1 材料
引物合成、测序、鼠抗人HDAC1、鼠抗人GAPDH抗体在生工生物工程(上海)股份有限公司完成或购买; RNA提取、逆转录、qRT-PCR试剂盒和Western Blot等试剂购自TaKaRa公司.CCK-8试剂盒购自碧云天生物技术公司; hUC-MSCs为实验室前期分离、鉴定和传代培养的细胞.
1.2 HDAC1重组腺病毒载体的构建和包装
使用Ad-Easy腺病毒载体系统制备HDAC1重组腺病毒载体.RNA提取试剂盒提取hUC-MSCs的总RNA,逆转录合成cDNA,以5′-GATAAGGTACCATGGCGCAGACGCAGGGCAC-3′(正向)和5′-CGGGCAAGCTTTCAGGCCAACTTGACCTCCT-3′(反向,下划线的碱基表示引入的酶切位点)为引物RT-PCR扩增HDAC1 ORF.然后将其插入到穿梭质粒pAdTrack-CMV的KpnI和HindIII位点之间,构成pAdTrack-CMV-HDAC1;测序验证后提质粒,PmeI单切使质粒线性化并将其转化进入E.coliBJ5183菌株中,与腺病毒骨架质粒(pAdEasy1)进行同源重组后获得重组腺病毒质粒pAd-HDAC1;pAd-HDAC1经PacI单切线性化后利用Lipofectamine2000转染至HEK293细胞进行病毒包装.
1.3 pAd-HDAC1重组腺病毒的扩增
HDAC1基因随着重组腺病毒在感染的HEK293细胞中大量扩增.当HEK293细胞出现明显病变时,收集细胞,液氮反复冻融4次,12 000 rpm离心10 min后取上清即可收获大量重组腺病毒.
1.4 重组腺病毒的滴度测定
采用空斑法测定病毒滴度.pAd-HDAC1病毒原液用DMEM/高糖培养基以10倍梯度依次稀释,分别感染对数生长期的HEK293细胞,使病毒稀释液与细胞充分接触,37 ℃细胞培养箱中孵育1 h后,弃培养液,每孔加入1 mL配好的琼脂培养基使其均匀覆盖细胞,待琼脂培养基凝固后将板置于培养箱中继续孵育.每天于固定的时间观察各孔中空斑形成情况,计数一次,待空斑数目稳定不变(约7~10 d)时停止.根据孔中发生完全病变的细胞数量,计算出收集的腺病毒滴度(pfu/L).病毒感染滴度(pfu/L)=相同稀释度空斑均数×稀释倍数/病毒液体积.
1.5 pAd-HDAC1重组腺病毒感染hUC-MSCs
取第3代的hUC-MSCs,待其达到80%融合时,PBS漂洗1次加入感染复数为10 的pAd-HDAC1病毒进行感染(感染组),以正常培养的P3 hUC-MSCs作为对照组,以pAd-GFP空病毒感染P3 hUC-MSCs作为阴性对照组.将2组细胞置于37 ℃、5%CO2细胞培养箱中培养48 h后倒置荧光显微镜下观察细胞形态和荧光表达情况.
1.6 qRT-PCR检测HDAC1 mRNA的表达
收集上述感染的hUC-MSCs,按照RNA提取试剂盒说明书提取细胞总RNA,逆转录合成cDNA,以GAPDH作为内参.按照试剂盒说明书配制qRT-PCR反应体系,每组3个重复孔,利用Fast7500 Real Time System进行PCR,95 ℃ 30 s、95 ℃ 5 s、60 ℃ 30 s,40个循环.反应结束后记录扩增曲线和溶解曲线,HDAC1的相对表达量(RQ)=2-ΔΔCt,以Graphpad Prism 5作图.
1.7 Western Blot检测HDAC1蛋白的表达
对上述3组细胞提取总蛋白,测定蛋白浓度后各取100 μg进行SDS-PAGE电泳.切割目的蛋白条带,电转至PVDF膜,然后用50 g/L的脱脂奶粉溶液室温封闭1 h,鼠抗人HDAC一抗(1∶1 000稀释)或鼠抗人GAPDH一抗(1∶500稀释,作为内参)4 ℃过夜孵育,TBST洗膜3次洗去一抗,每次15 min.用辣根过氧化物酶标记的山羊抗鼠二抗在室温条件下温孵育2 h,TBST洗膜3次,用ECL化学发光显影成像.
1.8 CCK-8实验hUC-MSCs的增殖
将上述3组细胞浓度调整为3×104/mL,分别取100 μL细胞接种于96孔板,每孔各接种3 000个细胞,每组设5个复孔.分别于1、2、3、4、5天后换成新鲜培养基,避光条件下每孔加10 μL CCK-8溶液并继续培养2 h.酶标仪检测450 nm处的吸光度值,记录数据并绘制细胞的生长曲线.
1.9 数据处理
采用SPSS 18.0进行统计学分析,应用单因素方差分析 3组细胞中HDAC1 mRNA相对表达量和细胞吸光值的差异,两两比较采用LSD-t检验,检验水准α=0.05.
2 结果
2.1 pAd-HDAC1重组腺病毒的构建
提取hUC-MSCs的总RNA,获得浓度较高纯度较好的总RNA(图1A).RT-PCR扩增出大小为1 400 bp左右的条带(图1B),测序后确定为人HDAC1序列.pAdTrack-CMV-HDAC1质粒与pAdEasy1在BJ5183菌体内同源重组后,PacI酶切鉴定得到1条大于23 kb的腺病毒基因组片段和1条4.5 kb的Ori和氨苄青霉素抗性编码基因片段(图1C),表明 pAd-HDAC1重组腺病毒质粒已成功构建.

A:P0和P3代表hUC-MSCs总RNA的提取; B:RT-PCR扩增人HDAC1 ORF序列; C: pAd-HDAC1质粒电泳图谱.M:marker;1:pAd-HDAC1重组质粒;2:PacI单切线性化重组质粒pAd-HDAC1.图1 pAd-HDAC1重组腺病毒的构建Fig.1 Construction of recombinant adenovirus pAd-HDAC1
2.2 重组腺病毒pAd-HDAC1的滴度测定
PacI线性化后的pAd-HDAC1,经Lip2000转染至HEK293细胞进行包装和大量扩增.然后利用空斑法计算病毒滴度.在24孔板中接种293细胞,然后用不同浓度的病毒感染细胞,根据孔中发生细胞完全病变的细胞数量,计算出收集的pAd-HDAC1重组腺病毒滴度(pfu/L)约为2.1×1010pfu/ L.
2.3 pAd-HDAC1感染hUC-MSCs及HDAC的表达检测
pAd-GFP和pAd-HDAC1感染hUC-MSCs 48 h后,倒置荧光显微镜下可观察到明显的荧光(图2B、C),说明腺病毒已经进入hUC-MSCs.qRT-PCR和Western Blot检测显示pAd-HDAC1感染组中HDAC1 mRNA和蛋白的表达明显高于空病毒组和对照组中的表达(图2D、E).该结果说明pAd-HDAC1腺病毒已经进入hUC-MSCs并在细胞中成功表达.
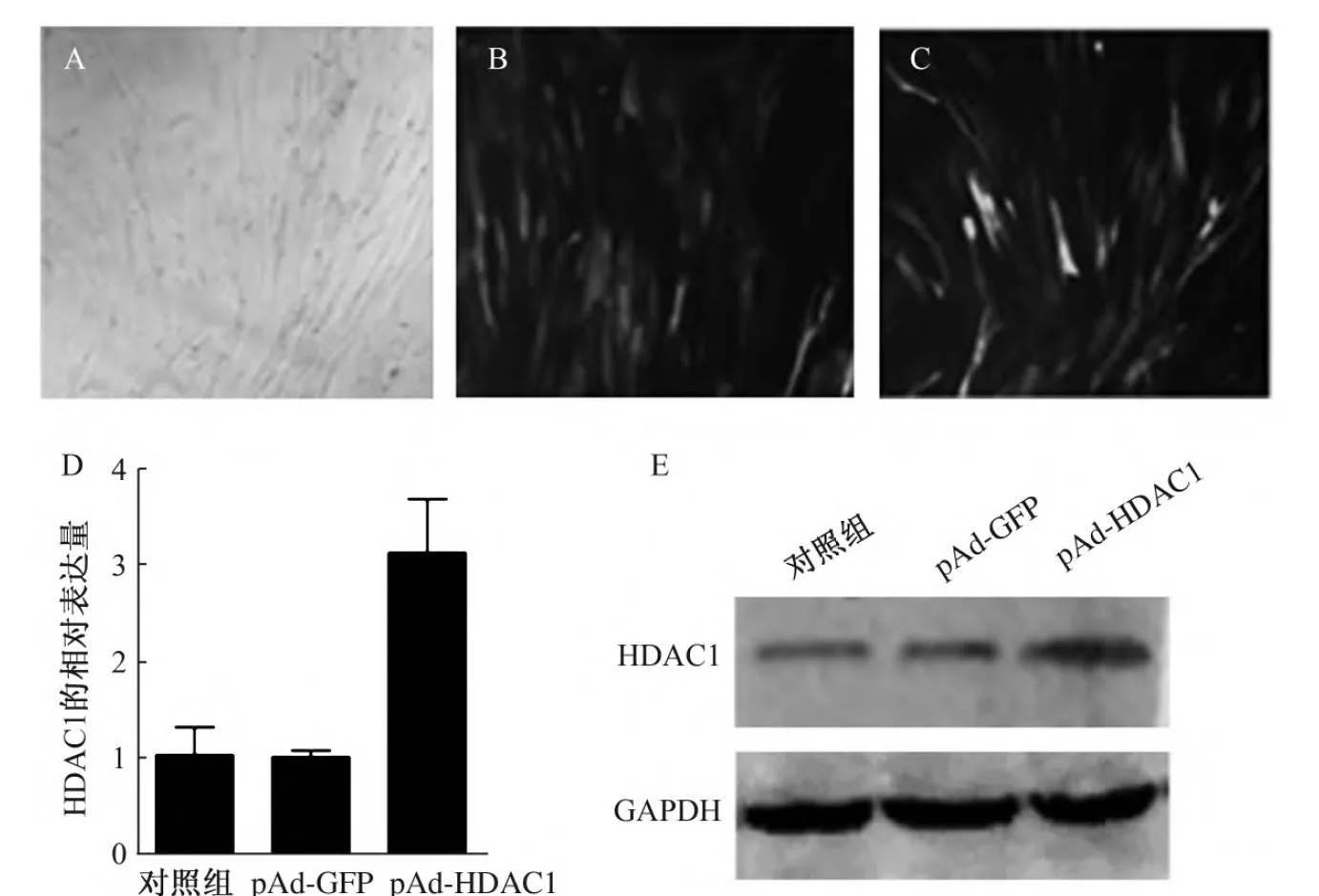
A:正常对照组;B:pAd-GFP组;C:pAd-HDAC1组;D:qRT-PCR检测各组细胞HDAC1 mRNA的表达;E:Western Blot检测HDAC1蛋白的表达.图2 pAd-HDAC1感染hUC-MSCs 48 h后荧光、qRT-PCR和Western Blot检测结果(100×)Fig.2 Fluorescence, qRT-PCR and Western Blot of hUC-MSCs infected by pAd-HDAC1 about 48 h (100×)
2.4 pAd-HDAC1对hUC-MSCs增殖的影响
如图3所示,pAd-HDAC1感染组细胞的增殖速率明显高于对照组细胞(P<0.05),该结果说明HDAC1高表达能够促进hUC-MSCs的增殖.
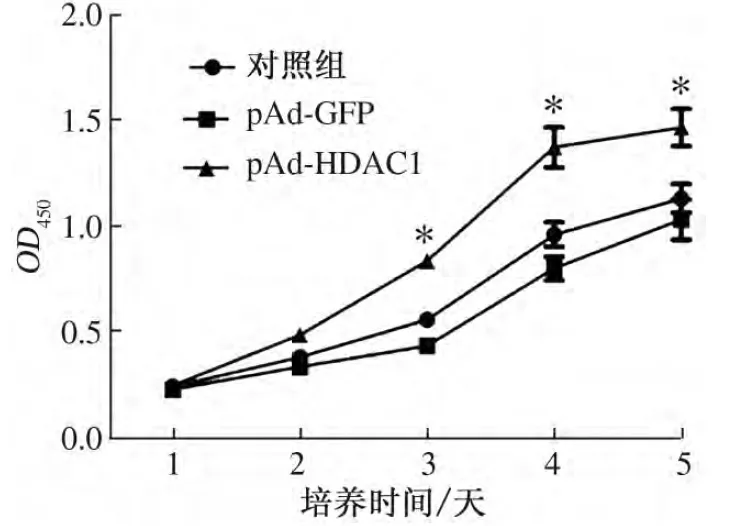
图3 各组hUC-MSCs细胞生长曲线Fig.3 The growth curves of hUC-MSCs in different groups
3 讨论
HDACs 通过使组蛋白去乙酰化与其他多种转录因子形成特定的转录复合物,调控基因转录过程导致基因沉默,参与细胞增殖、分化等多种活动[1].研究表明MSCs定向诱导分化过程中,伴随着HDAC1表达水平的下调[5].研究人员发现抑制HDAC的活性能够促进ESCs、NSCs或者MSCs向神经细胞、肝脏细胞、肌肉细胞等多种细胞定向分化[3,4,6-8].因此,为了体外扩增获得足够数量的MSCs而避免MSCs的自发分化,可以通过提高HDAC1的表达而调控干细胞的增殖.
与脂质体介导质粒转染相比,重组腺病毒表达载体[9]具有宿主范围广,感染效率高,毒性低、非整合宿主染色体等优点[10].因此,本研究应用Ad-Easy腺病毒表达载体系统[11],即以携带 GFP 的腺病毒穿梭质粒(pAdTrack-CMV)和腺病毒骨架质粒(pAd-Easy1)作为载体成功制备含有HDAC1基因的腺病毒.该病毒含有CMV 启动子和GFP基因,可在荧光镜下直接观察感染效果,同时不会整合到宿主细胞基因组中,保证了实验的安全性.qRT-PCR和Western Blot结果显示,pAd-HDAC1感染hUC-MSCs后,HDAC1的mRNA和蛋白表达均明显提高,表明本研究成功构建了HDAC1高表达的腺病毒(pAd-HDAC1),并在干细胞中表达.CCK-8结果显示,HDAC1高表达能够促进hUC-MSCs的增殖,但是对hUC-MSCs定向分化的影响还需要进一步实验验证.
因此,本研究采用Ad-Easy系统成功构建了携带 GFP 的pAd-HDAC1重组腺病毒,pAd-HDAC1能有效感染hUC-MSCs,并促进MSCs在体外的增殖.该结果为下一步在体内水平研究pAd-HDAC1对hUC-MSCs增殖、定向分化和对神经系统疾病的治疗作用奠定基础,具有重要的研究意义.
[1] WU H, SUN Y E. Epigenetic regulation of stem cell differentiation [J]. Pediatr Res, 2006, 59(4 Pt 2): 21.
[2] COSKUN V, TSOA R, SUN Y E. Epigenetic regulation of stem cells differentiating along the neural lineage [J]. Curr Opin Neurobiol, 2012, 22(5): 762-767.
[3] DOVEY O M, FOSTER C T, COWLEY S M. Histone deacetylase 1 (HDAC1), but not HDAC2, controls embryonic stem cell differentiation [J]. Proc Natl Acad Sci USA, 2010, 107(18): 8242-8247.
[4] FENG C, ZHU J, ZHAO L, et al. Suberoylanilide hydroxamic acid promotes cardiomyocyte differentiation of rat mesenchymal stem cells [J]. Exp Cell Res, 2009, 315(17): 3044-3051.
[5] MACDONALD J L, ROSKAMS A J. Histone deacetylases 1 and 2 are expressed at distinct stages of neuro-glial development [J]. Dev Dyn, 2008, 237(8): 2256-2267.
[6] ALMUTAWAA W, KANG N H, PAN Y, et al. Induction of neurotrophic and differentiation factors in neural stem cells by valproic acid [J]. Basic Clin Pharmacol Toxicol, 2014, 115(2): 216-221.
[7] QIAO Y B, WANG R, YANG X F, et al. Dual roles of histone H3 lysine 9 acetylation in human embryonic stem cell pluripotency and neural differentiation [J]. J Biol Chem, 2015, 290 (4): 2508-2520.
[8] SNYKERS S, VANHAECKE T, De BECKER A, et al. Chromatin remodeling agent trichostatin A: a key-factor in the hepatic differentiation of human mesenchymal stem cells derived of adult bone marrow [J]. BMC Dev Biol, 2007, 7(1): 24.
[9] McCONNELL M J, IMPERIALE M J. Biology of adenovirus and its use as a vector for gene therapy [J]. Hum Gene Ther, 2004, 15(11): 1022-1033.
[10]崔渊博. 高表达Sirt2人脐带间充质干细胞移植对APP+鼠的抗衰老作用及机制研究[D]. 郑州:郑州大学, 2014.
[11]HE T C, ZHOU S, DA COSTA L T, et al. A simplified system for generating recombinant adenoviruses [J]. Proc Natl Acad Sci USA, 1998, 95(5): 2509-2514.
(责任编辑:王浩毅)
Construction and Identification of Adenoviral Vector Containing Human HDAC1 Gene
MA Shanshan, ZHANG Kun, XING Qu, HUANG Tuanjie,CHENG Kang, GUAN Fangxia
(SchoolofLifeScience,ZhengzhouUniversity,Zhengzhou450001,China)
It was aimed to construct a recombinant adenovirus containing human histone deacetylase 1 (HDAC1) gene by using Ad-Easy system and detect its effect on the proliferation of hUC-MSCs. Human HDAC1 ORF was generated by RT-PCR and inserted into the shuttle adenovirus plasmid to construct recombinant shuttle adenovirus plasmid (pAdTrack-CMV-HDAC1).The pAdTrack-CMV-HDAC1 was linearized byPmeI and transformed into BJ5183 to homologously recombine with pAdEasy1. After linearized byPacI, pAd-HDAC1 was transfected into HEK293 to package and amplify. The viral titer was determined by air-dilution method. After transfected into hUC-MSCs, the green fluorescence was observed by using fluorescent microscope. qRT-PCR and Western Blot were used to analyze the mRNA and protein expression of HDAC1 and CCK-8 assay was performed to detect the proliferation of hUC-MSCs. Recombinant adenovirus pAd-HDAC1 containing HDAC1 gene was successfully constructed. After transfected into hUC-MSCs, the mRNA and protein expression of HDAC1 in hUC-MSCs were increased significantly, and HDAC1 could promote the proliferation of hUC-MSCs. pAd-HDAC1 was successfully constructed, which can effectively improve expression of HDAC1 in hUC-MSCs and promote hUC-MSCs proliferation.
histone deacetylase 1; adenoviral vectors; umbilical cord mesenchymal stem cells; proliferation
2015-11-15
NSFC-河南人才联合基金项目(U1404313);国家自然科学基金资助项目(81471306);河南省高校科技创新团队项目(15IRTSTHN022);河南省科技创新人才计划项目(154200510008).
马珊珊(1984—),女,河南开封人,副教授,博士,主要从事干细胞与神经修复研究,E-mail: mashanshan84@163.com;通讯作者:关方霞(1969—),女,河南洛阳人,教授,博士,主要从事干细胞与再生医学研究,E-mail: guanfangxia@126.com.
马珊珊,张琨,邢衢,等.HDAC1重组腺病毒载体的构建及鉴定[J].郑州大学学报(理学版),2016,48(2):101-104.
R394.2
A
1671-6841(2016)02-0101-04
10.13705/j.issn.1671-6841.2015259

