抗增殖蛋白在线粒体中生物学功能的研究进展
李 泽,冯 红
(天津体育学院健康与运动科学系 天津300381)
抗增殖蛋白在线粒体中生物学功能的研究进展
李 泽,冯 红*
(天津体育学院健康与运动科学系 天津300381)
抗增殖蛋白(又称Prohibitin,PHB)是一种在进化上高度保守的蛋白,广泛分布于细菌、酵母、果蝇、原虫及哺乳类动物的多种生物细胞中,主要定位于细胞膜、线粒体内膜、细胞核中。由于其在线粒体上的特殊定位、结构和功能,近年来在线粒体中与功能相关的研究中逐渐成为热点,包括调控线粒体形态学变化、细胞能量代谢等。基于抗增殖蛋白在线粒体中的生物学意义,通过对基因结构、定位和功能的分析,系统阐述了其在线粒体中的重要作用,并对应用前景做出了展望。
抗增殖蛋白 线粒体 生物学功能
PHB普遍存在于生物细胞中,主要定位于线粒体内膜上,是一种进化上高度保守的蛋白质。[1]PHB在线粒体中以复合体的形式存在,由PHB1和PHB2两个二级单位组成。这两种蛋白质聚集在线粒体内膜上形成一个大分子花环结构,并且在不同的细胞合成过程——从线粒体生物学功能到细胞死亡与反复衰老的过程中,两者之间紧密联系。PHB与人类的多种疾病关系密切,包括癌症、衰老和糖尿病等,因此对其研究十分广泛。迄今,PHB在人类的详细生物学研究方面还尚未明确,而其复合物为从酵母到哺乳动物的线粒体中的生物学和新陈代谢研究都提供了重要的依据。本文将简述近年来国内外学者对于PHB在线粒体中的生物学功能的研究和讨论。
1 PHB的发现和定位
McClung等(1989)首次从大鼠细胞中发现PHB的基因。随后Nuell等(1991)将PHB基因通过显微注射进入正常人的成纤维细胞中,发现DNA的合成被PHB mRNA所抑制,得出PHB具有抗细胞增殖的作用,而有了抗增殖蛋白这个名字。Sato[2]等(1992)发现PHB基因位于染色体17q12-q21上,后来发现PHB的功能在于其基因的3-UTR,但PHB3-UTR抗增殖的机制一直存在许多争议。直到Liu[3]等(2009)使用特异性针对PHB 3-UTR的微小RNA进行RNA干扰实验,发现低分化胃腺癌中的PHB表达下调,这才证明微小RNA能够通过抑制PHB的表达促进癌细胞增殖。近年来的研究发现,PHB的功能不仅体现于细胞核内,其在大鼠、人等哺乳动物细胞线粒体内膜上的作用机制也越来越受到学者们的重视。
2 PHB家族简介
迄今为止,已知的PHB属于SPFH蛋白质家族的蛋白,该家族的蛋白质都含有一个PHB结构域,通常作为支架蛋白存在于脂筏中。PHB家族包含PHB1、PHB2、PHB3和PHB4 4个不同的亚型。其中人的PHB1由275个氨基酸组成,定位于染色体17q21区,包含7个外显子,分子量为32,kD;[4]PHB2包含10个外显子,由316个氨基酸构成,其分子量为34,kD,定位于染色体12p31区。[5]PHB比较保守,在各物种之间的同源性较高,从酵母到鼠以及人,其氨基酸序列一致性近60%,,小鼠和大鼠PHB的氨基酸序列是相同的,但这些不同于人类的氨基酸序列;PHB1和PHB2也具有高度的同源性,两者氨基酸序列一致性超过50%,。[6]
PHB多以聚合体形式存在,由12~16对PHB1与PHB2形成一种高对分子质量的复合体。通过免疫共沉淀、质谱分析及化学交联技术[7]成功模拟出了酵母线粒体中抗增殖蛋白复合体的分子结构[8](见图1)。这种聚合体呈直径为20~25,nm、分子量达1,MD的花环状的大分子结构,这两种蛋白质组合成环状的大分子结构线粒体内膜并涉及到不同细胞进程:从线粒体生物合成和功能到细胞死亡和复制性衰老。在人类研究方面,PHB已经与多种疾病密切相关。另外,也有以同源二聚体或四聚体形式存在的PHB,这样可以有效抑制金属蛋白酶对其降解。[9-10]PHB1与PHB2在这种复合物中是相互依存的,不管缺失PHB1或者是PHB2都将使这种复合物不复存在。
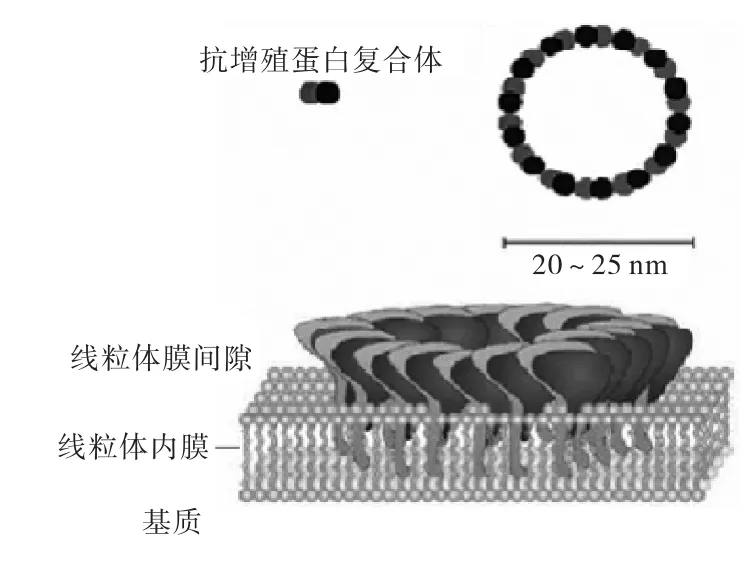
图1 酵母线粒体中PHB复合体模式图Fig.1 Mode pattern of PHB complex in yeast mitochondria
3 PHB在线粒体生物学功能中的作用
在早期研究中,因PHB具有抑制肿瘤和细胞增殖的作用,故大多数研究都只限于此方面。随着时代的发展和研究的不断深入,根据其定位发现PHB还有着新型的分子伴侣的作用,其作用是维持线粒体的形态、结构和功能。PHB还存在于细胞核内,起负性调控转录的作用,影响着细胞生命活动的整个过程。[11]PHB在线粒体中参与多个过程,如影响细胞分裂、癌症的发生以及衰老的过程。
近年来,线粒体中PHB复合物的一些作用已经被证实。首先,PHB复合物依赖调节膜蛋白降解线粒体的M-AAA蛋白酶。[12]其次,证明了PHB在作为膜结合伴侣,维持并稳定新合成的编码线粒体蛋白质中的作用。PHB蛋白也可能在稳定的线粒体基因组中发挥作用。此外,PHB复合物可以通过稳定OPA-1来调节线粒体形态和作为支架蛋白通过膜蛋白到特定的脂质环境。然而,线粒体PHB复合物的实际生物学功能仍然是未知的。越来越多的证据表明,PHB的功能是与线粒体联系在一起来体现的。
3.1 PHB调控线粒体形态学变化
PHB复合体能够与线粒体内膜、外膜的蛋白(视神经萎缩蛋白1,optic atrophy 1,OPA1)相结合维持线粒体的形态、融合分裂与合成。当PHB减少或缺失时,线粒体形态与结构将发生改变。H2O2能引起老龄化的视网膜色素上皮细胞PHB 花环结构的瓦解,导致线粒体被破坏,并且使PHB从线粒体向细胞核转移。PHB的存在能够调节细胞内ROS生成的平衡,降低线粒体的氧化损伤,维持mtDNA拷贝数的稳定。线粒体在形态方面的变化,证明了PHB与线粒体膜的溶解机制密切相关。对线粒体结构进行进一步研究,在小鼠的胚胎成纤维细胞中,敲除PHB基因后,发现线粒体的嵴不能正常形成,被认为是由于诱导细胞凋亡的前期影响因子OPA1缺失所致。[13]当OPA1被重新表达后,线粒体结构形态又恢复正常。PHB通过OPA1调节线粒体形态这一点在缺乏PHB的小鼠成纤维细胞的生长方面也得到了证实。[14]
3.2 PHB与线粒体衰老假说
自Harman在1956年提出衰老自由基学说,一直到1989年Linnane[15]等提出线粒体衰老假说,人们越来越关注线粒体与衰老二者之间的关系。衰老的过程被认为是细胞中自由基不断积累的缘故,线粒体是自由基产生的主要场所,自由基能够破坏生物膜,使大分子(蛋白质、核酸)失联,从而影响细胞以及线粒体的正常功能。线粒体的完整性和功能在衰老过程中都会随之减弱。衰老过程中产生ROS的主要来源是线粒体呼吸。线粒体蛋白是衰老表现的标志性分子之一,而PHB又是重要的线粒体蛋白。所以,许多学者认为PHB与衰老有着密切的关系。研究者通过研究发现,PHB蛋白功能减退时,线粒体新组装的蛋白质稳定性降低,导致氧化呼吸链不能正确装配,细胞无法进行正常的氧化代谢,自由基增加,导致细胞衰老。因此认为,PHB复合体通过调节线粒体的能量代谢从而影响组织细胞寿命。
2009年Michael[16]等通过诱导血管内皮细胞PHB1的下调发现,活性氧(ROS)水平明显升高,细胞周期受阻,衰老的生化标志p16、p2l和β-半乳糖苷酶都相应增加,从细胞形态学方面观察发现细胞出现衰老样的改变,从而证实了PHB可以通过影响线粒体的功能最终导致细胞衰老这一论断。
Li[17]等通过二维电泳技术在衰老细胞中发现以磷酸化形式存在的PHB的比例显著降低,通过敲除PHB基因发现细胞的寿命将会减少1/3,这种情况有可能与PHB的分子伴侣作用相关。当细胞衰老时,磷酸化的PHB含量降低,新合成的线粒体蛋白稳定性降低,氧化呼吸链不能正确装配,线粒体氧化呼吸功能受限,进一步验证了PHB在衰老中的作用。[17]
线粒体突变可以引发多种结果和可能性,不同突变造成的结果也不同,以组织特异性的方式影响老化速率。老龄化是一个激素调节的过程,因此重要的是要了解什么时候以及在哪个特定组织PHB耗尽,才能发挥其对长寿的有益效果。正是鉴于PHB和参与寿命调控的生化途径的进化保守性的高度,因此PHB在高等生物中将会有类似的作用。在氧化应激刺激下,PHB与细胞老龄化密切相关,有望成为抗衰老的药物靶标,故它的机制还有待进一步研究。
3.3 PHB调节氧化呼吸链的活性
在正常细胞中,PHB主要定位在线粒体内膜上,通过与天然底物等多种蛋白质相互作用,调控它们的组装和降解,介导调节氧化呼吸链的活性以及相关信号通路。Artal-Sanz M等通过研究酵母细胞发现,在酵母细胞中,PHB低表达时线粒体蛋白稳定性降低,致使氧化呼吸链不能正确装配,而PHB高表达时,细胞呼吸链复合体Ⅳ和复合体Ⅰ趋于稳定。[11]Sessa等2008年在血管内皮细胞中发现,敲除PHB1基因后,复合体Ⅰ活力明显降低,而复合体Ⅱ、Ⅲ的活力正常,细胞氧耗未发生明显变化,于是推测可能是存在于细胞内的耗氧补偿机制所致。然而在小鼠胚胎成纤维细胞中发现,当敲除PHB基因后,细胞的ATP含量、细胞耗氧量、电子传递链的活力均在正常值范围内,这种情况可能是PHB在不同种类细胞中不同的氧化磷酸化需求中起着不同的作用。[18]
Schleicher M等通过将PHB1基因沉默后,证明PHB是通过PI3K-Akt途径来调节RAC1的,而激活这一信号通路最终诱导了细胞的衰老。
3.4 PHB调控细胞能量代谢
PHB主要位于线粒体内膜上,参与维持线粒体形态、结构和功能。在大多数细胞中,线粒体是运动能量代谢的中心。Mishra S等通过研究发现PHB的存在抑制着丙酮酸羧化酶的活性,进一步抑制葡萄糖的有氧氧化供能,所以认为PHB调节线粒体能量代谢可能是通过调节丙酮酸羧化酶的活性来实现的。2012年Kathhiria A S等研究发现,自噬是代谢调节的一种表现形式,而在自噬的过程中存在着PHB的调节,PHB可能是通过与AMPK协同作用来实现的。
4 展 望
本文通过对PHB的发现、定位以及在线粒体生物学功能中的简述,发现其主要生物学功能是参与调控线粒体在形态学方面的变化以及通过氧化磷酸化调控能量代谢,此外还参与信号通路,发现其与衰老有着密切关系。
PHB在临床中的作用和价值越来越受重视并被多数学者所肯定,特别是在衰老、肿瘤学等方面。虽然PHB在确切的功能调节机制上的作用还不明确,但通过对其在线粒体上的生物学功能的深入研究,将促进我们对疾病发病和发展机制的认识,从而为探寻其在临床方面所提供的新靶点的可能性提供科学依据。
[1] Snedden W A,Fromm H. Characterization of the plant homologue of PHB,a gene associated with antiproliferative activity in mammalian cells [J]. Plant MolBiol,1997,33(4):753-756.
[2] Nuell M J,Stewart D A,Walker L,et a1. Prohibitin,an evolutionarily conserved intracellular protein that blocks DNA synthesis in normal fibroblasts and HeLa cells [J]. MolCellBiol,1991,11(3):1372-1381.
[3] Liu T,Tang H,Lang Y,et a1. MicroRNA-27a functions as oncogene in gastric adenocarcinoma by targetingprohibitin [J]. Cancer Lett,2009,273(2):233-242.
[4] Artal-Sanz M,Tavernarakis N. Opposing function of mitochondrial prohibitin in aging [J]. Aging,2010,2(12):1004-1011.
[5] Nijtmans L G,Artal S M,Grivell L A,et al. The mitochondrial PHB complex:roles in mitochondrial respiratory complex assembly,aging and degenerative disease [J]. Cell Mol LifeSci,2002,59(1):143-155.
[6] Mishra S,Ande S R,Nyomba B I. The role of prohibitin in cell signaling [J]. FEBS,2010,277(19):3937-3946.
[7] Back J W,Sanz M A,De J L,et al. A structure for the yeast prohibitin complex:structure prediction and evidence from chemical crosslinking and mass spectrometry[J]. Protein Sci,2002,11(10):2471-2478.
[8] Sato T,Saito H,Swensen J,et al. The human prohibitin gene located on chromosome 17q21 is mutated in sporadic breast cancer [J]. Cancer Res,1992,52(6):1643-1646.
[9] Coates P J,Jamieson D J,Smart K,et al. The prohibitin family of mitochondrial proteins regulate replicative lifespan [J]. CurrBiol,1997,7(8):607-610.
[10] 王晓东,李智立. 蛋白质复合体及蛋白质相互作用研究新策略——化学交联结合质谱分析法[J]. 生物物理学报,2009,25(3):157-167.
[11] Artal-Sanz M,Tsang W Y,Willems E M,et al. The mitochondrial prohibitin complex is essential for embryonic viability and germline function in Caenorhabditis elegans [J]. BiolChem,2003,278(34):32091-32099.
[12] Mishra S,Murphy L C,Murphy L J. The PHBs:emerging roles in diverse functions [J]. J Cell Mol Med,2006,10(2):353-363.
[13] Peng X J,Mehta R,Wang S,et al. Prohibitin is a novel target gene of vitamin D involved in its antiproliferative action in breast cancer cells [J]. Cancer Res,2006,66(14):7361-7369.
[14] Manjeshwar S,Lerner M R,Zang X P,et al. Expression of prohibitin 3' untranslated region suppressor RNA alters morphology and inhibits motility of breast cancer cells [J]. J MolHistol,2004,35(6):639-646.
[15] Bather S,Achmz G,Schmitz M L,et al. Prohibitin and prohibitone are contained in high-molecular weight complexes and interact with alpha-actinin and annexin A2[J]. Biochimie,2002,84(12):1207-1220.
[16] Miehad S,Benjamin R,Yajaira S,et al. Prohibitin-l maintains the angiogenic capacity of endothelial cells by regulating mitochondrial function and senescence [J]. J Cell Biol,2008,180(1):101-112.
[17] Sripathi S R,He W,Atkinson C L,et al. Mitochondrial-nuclear communication by prohibitin shuttling under oxidative stress [J]. Biochemistry,2011,50(39):8342-8351.
[18] Merkwirth C,Langer T. PHB function within mitochondria:essential roles for cell proliferation and cristae morphogenesis [J]. Biochim Biophys Acta,2009,1793(1):27-32.
Research of Prohibitin on Mitochondrial Biological Functions
LI Ze,FENG Hong*
(Department of Health and Exercise Science,Tianjin University of Sport,Tianjin 300381,China)
Prohibitin(PHB)is a widely distributed and highly-conserved protein,which is encoded by nuclear genes and locates in nucleus membranes,mitochondrial membrane substrates and matrixes.Because of its special position in mitochondrial and its special structure and function,PHB has become a new research hotpot,including modulating mitochondrial morphology and cellular energetic metabolism.In this paper,based on the biological significance of PHB in mitochondria and analysis of its gene structure,mapping and function,PHB was described regarding its role in mitochondria and its application was prospected.
prohibitin(PHB);mitochondria;biological function
Q51
:A
:1006-8945(2016)04-0037-04
*
国家自然科学基金面上项目:Prohibitin 1 在运动能量代谢中的作用及调控F0F1-ATP合酶机制(编号:31470061)。
2016-02-16

