超声评估乳腺癌新辅助化疗早期疗效的多因素分析
张紫杰,郭凤娟,张彦,白玲,范雪,陈翠京
(1.河北北方学院,河北张家口075000;2.军事医学科学院附属医院超声科,北京100071)
超声评估乳腺癌新辅助化疗早期疗效的多因素分析
张紫杰1,郭凤娟1,张彦2,白玲2,范雪2,陈翠京2
(1.河北北方学院,河北张家口075000;2.军事医学科学院附属医院超声科,北京100071)
摘要:目的分析和筛选评估乳腺癌新辅助化疗(NAC)早期疗效的超声指标,建立数学模型并进行初步评价。方法对79例乳腺癌患者于化疗前及每2个疗程后行超声检查,监测血流阻力指数(RI)、收缩期最高血流速度(PSV)、弹性应变率(SR)、弹性评分、血流分级。采用单因素和多因素Logistic回归分析方法,筛选出可对乳腺癌NAC疗效做出早期评估的因素,建立数学模型,利用受试者工作曲线(ROC)检验回归模型的诊断效能。结果单因素分析结果显示,5项指标比较差异有统计学意义;其中RI、PSV、SR被纳入多因素Logistic回归方程。同时ROC方法评价显示,所建立的模型能提高诊断的敏感性和特异性。结论RI、PSV、SR可对乳腺癌NAC早期疗效做出可靠性评估;多因素回归模型较单因素指标在预测乳腺癌NAC早期疗效中有更高的诊断符合率。
关键词:超声;乳腺癌;新辅助化疗;Logistic回归
乳腺癌新辅助化疗(neoadjuvant chemotherapy,NAC)已成为局部晚期乳腺癌及较大肿块乳腺癌的规范化治疗,但临床研究发现10%~35%的乳腺患者对NAC不敏感[1],若能在早期正确评估乳腺癌患者NAC疗效,可使化疗无效的患者及早更换化疗方案,对临床实践有非常重要的指导意义。本研究采用单因素和多因素Logistic回归分析方法,评价对乳腺癌NAC早期疗效做出评估的超声指标,筛选识别敏感指标并建立回归模型,评价该诊断模型的临床应用价值,期望为指导临床治疗及预后判断提供参考依据。
1 资料与方法
1.1一般资料
选取2014年6月-2015年5月在本院行超声引导下穿刺活检,首次诊断为乳腺癌并接受NAC治疗,最终接受手术治疗的患者79例,均为女性,年龄23~73岁,中位年龄49岁。所有病灶为临床Ⅱ、Ⅲ期,均接受包含蒽环类和紫杉类药物化疗方案,21d 为1疗程,患者均完成4~8个疗程化疗,且末次化疗后2周内施行手术。
1.2检查仪器及方法
选用日本日立公司HITACHI Vision Preirus彩色超声诊断仪,高频线阵探头,探头频率8~9 MHz。所有患者于化疗前及每2个疗程结束后行彩色多普勒超声及超声弹性成像检查,依据Adler血流分级法[2],监测病灶的血流分级、动脉血流阻力指数(resistance index,RI)及收缩期最高血流速度(peak systole velocity,PSV),依据参考文献[2]的血流分级,0、1级为有效,2、3级为无效;依据罗葆明等[3]的改良5分法,监测病灶弹性评分(1~5分)和弹性应变率(strain ratio,SR),1~3分为良性,4、5分为恶性[4]。所有患者采用相同的超声成像条件,且由同一名有经验的医师进行检查。
1.3病理评价标准
病理学疗效评价依照Miller & Payne病理评价系统[5],将化疗反应从病灶无反应到肿瘤完全消失分为5级:1级为肿瘤细胞较前无变化;2级为肿瘤密度减少<30%;3级为肿瘤细胞密度减少30%~90%;4级为大量肿瘤细胞减少>90%;5级为肿瘤完全消失,镜下未见浸润癌残留包括原位癌。根据术后病理结果将病理反应4、5级合称组织学显著反应(major histological response,MHR);1~3级为组织学非显著反应(non-major histological response,NMHR)。
1.4统计学方法
采用SPSS 17.0统计软件进行数据分析,计数资料以用百分比或率表示,用χ2检验,计量资料以均数±标准差(±s)表示,用两独立样本的非参数检验;绘制受试者工作曲线(receiver operating characteristic curve,ROC)制定单因素的截断值;多因素分析采用Logistic回归模型,引入水准0.05,剔除水准0.10,使用进入法。比较各单因素和多因素ROC的曲线下面积(area under curve,AUC),进行诊断学评价,P<0.05为差异有统计学意义。
2 结果
2.1病理学
79个病灶接受新辅助化疗后,依照Miller & Payne的评价分级方法,MHR组41例,其中5级22例,4级19例;NMHR组38例,其中3级16例,2 级21例,1级1例。
2.2各指标单因素分析
化疗前及疗程结束后各参数在MHR与NMHR组间比较,结果显示,化疗前两组间比较,差异无统计学意义(P>0.05)(见表1、2)。化疗2个疗程结束后各超声参数在MHR与NMHR组间比较,差异有统计学意义(P<0.05)(见表3、4)。2个疗程结束后MHR组血流分级评价正确率为46.3%(19/41),NMHR组血流分级评价正确率为89.5%(34/38),经χ2检验,差异有统计学意义(χ2=12.258,P=0.000);MHR组弹性评分评价正确率为61.0%(25/41),NMHR组弹性评分评价正确率为57.9%(22/38),经χ2检验,差异有统计学意义(χ2=4.904,P=0.027)。同时绘制化疗2个疗程后指标RI、PSV、SR变化预测NAC疗效的ROC曲线(见附图)。RI、PSV、SR的AUC分别为0.757,0.806和0.858,取离参考线的最远点为阈值,即以RI=0.60为临界值,PSV=10.45为临界值,SR=4.46为临界值,敏感性分别为81.3%、78.7%和94.5%,特异性分别为70.9%、83.0%和70.9%。
表1 NAC前MHR组与NMHR组定量参数比较(±s)

表1 NAC前MHR组与NMHR组定量参数比较(±s)
组别 RI SR PSV MHR组 0.72±0.13 13.07±10.9 14.65±7.97 NMHR组 0.73±0.08 13.03±8.34 16.79±9.97 Z值P值-0.157 0.876 0.523 0.601 -0.849 0.396
2.3多因素Logistic回归分析
将单因素分析有统计学意义的参数作为自变量,并参照文献[2-4]及本研究ROC曲线对相关指标进行赋值(见表5)。通过二分类Logistic回归分析筛选自变量,最后RI(X1)、PSV(X2)、SR(X3)选入模型,其比值比(odds ratio,OR^)分别为5.663、12.071和27.451,危险度从大到小依次为SR、PSV和RI(见表6)。
得到的Logistic回归模型为:Logist(P)=-12.709+ 1.734X1+2.491X2+3.312X3,绘制多参数回归模型的ROC曲线(见附图),AUC为0.928[Sb=0.028(95%CI:0.873,0.983)P=0.000],曲线下面积明显大于其他曲线下面积,表明多因素联合诊断能较大地提升单因素诊断能力,对乳腺癌NAC早期疗效评估具有一定的临床意义。
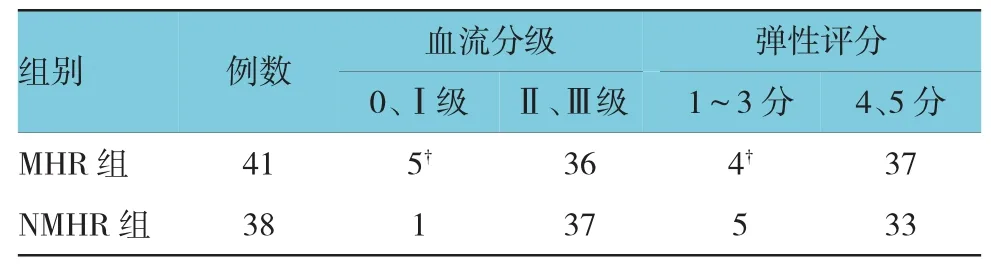
表2 NAC前MHR组与NMHR组超声弹性成像评分比较
表3 NAC 2个疗程后MHR组与NMHR组定量参数比较(±s)
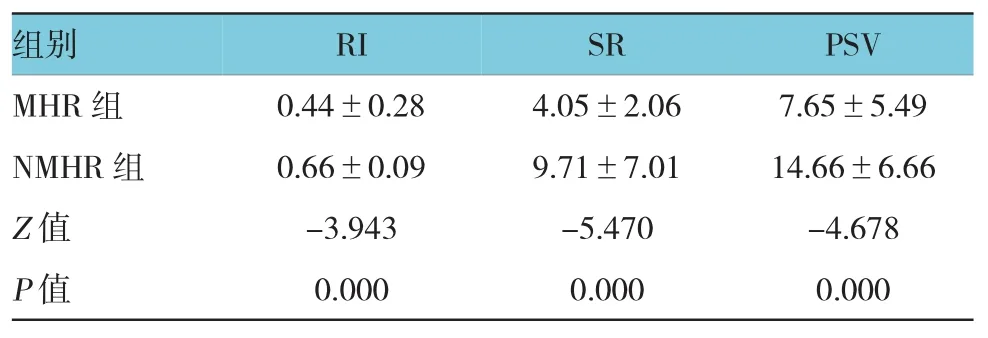
表3 NAC 2个疗程后MHR组与NMHR组定量参数比较(±s)
组别 RI SR PSV MHR组 0.44±0.28 4.05±2.06 7.65±5.49 NMHR组 0.66±0.09 9.71±7.01 14.66±6.66 Z值P值-3.943 0.000 -5.470 0.000 -4.678 0.000

表4 NAC 2个疗程后MHR组与NMHR组超声弹性成像评分比较
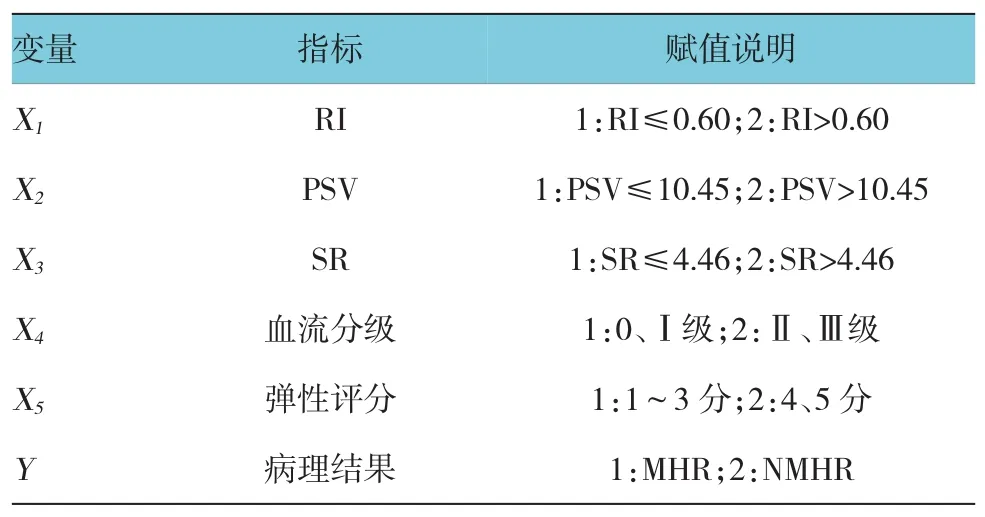
表5 超声各指标评估乳腺癌NAC早期疗效的多因素分析变量赋值标准
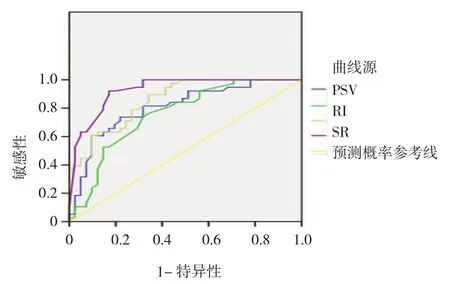
附图 2个疗程后各参数及多参数回归模型预测疗效的ROC曲线

表6 超声评估乳腺癌NAC早期疗效的多因素Logistic回归分析结果
3 讨论
乳腺癌病灶经新辅助化疗后会发生不同程度的变化,如进展、稳定或好转,若能早期准确地显示以上变化,对临床决定下一步的治疗方式至关重要[6]。病理缓解率相较于临床评价方法更能准确地反映病灶的真实情况[7],但通常在术后获得,无法早期调整治疗。近年来,应用影像技术评估乳腺癌NAC疗效已成为研究的热点[8-10],但至今仍缺乏客观的影像学评价标准。且乳腺癌NAC与有效的各影像学图像表现存在一定的交叉,故不能仅依靠某一项指标判断疗效。因此多参数回归模型为评估乳腺癌NAC疗效提供一个新的诊断思路。本研究采用无创且可重复性的超声技术,筛选可对乳腺癌NAC早期疗效做出评估的超声指标,进一步对有效指标进行多因素分析,建立数学诊断模型,采用ROC方法评价,检验其应用价值及可行性。
彩色多普勒超声能够检测乳腺癌病灶内细微的血流动力学变化,提供评估NAC疗效的直接依据[11]。NAC敏感的病灶肿瘤血管萎缩闭塞,数量减少且通透性降低,血流特征由2、3级下降为0、1级;同时肿瘤细胞坏死,减少对周围血管的压迫,PSV及RI降低;对化疗不敏感病灶,因其肿瘤坏死不明显、体积缩小有限、肿瘤血管闭塞较少等原因,乳腺癌病灶内血流指标变化往往不明显[12]。本组资料中,无论MHR组还是NMHR组,血流分级在化疗2个疗程后均有所下降,MHR组下降更明显,且组间比较差异有统计学意义。2个疗程后以RI、PSV变化绘制ROC曲线,AUC分别为为0.757和0.806,以RI=0.60为临界值,PSV=10.45为临界值,敏感性分别为81.3%和78.7%,特异性分别为70.9%和83.0%。
超声弹性成像技术与组织生物学特性紧密相关,通过获取有关组织弹性信息进行成像,可有效鉴别实质性肿瘤的良、恶性。SR可比较病灶与周围正常组织间硬度差异,较客观地反应组织硬度[13]。NAC后肿瘤细胞变性坏死,肿瘤细胞增殖减慢,质地变软,弹性评分及SR随之减低。Hayashi等[14]研究显示,化疗后弹性低评分组评价病理完全缓解率显著高于弹性高评分组,与本研究结果一致。本研究中,化疗2个疗程后MHR组与NMHR组弹性评分比较,差异有统计学意义。以SR变化绘制ROC曲线,AUC为0.858,以SR=4.46为临界值,敏感性、特异性分别为94.5%和70.9%。
既往研究超声对乳腺癌NAC疗效评估均是对化疗后各超声指标进行单因素分析,未能给出多参数评估模型[15-16]。本研究在过去研究的基础上进行多因素分析,并应用ROC曲线评估模型的诊断效能。本研究中单因素分析认为,各指标与NAC早期疗效均有相关性,最终进入Logistic回归模型的有3个因素即RI、PS、VSR,说明3者为评估乳腺癌NAC早期疗效较为重要的指标,其中SR的OR值最大,说明多个指标中SR是早期评估乳腺癌NAC疗效最重要的指标。其中弹性评分及血流分级未被入选回归模型,究其原因可能为:①受操作者影响有一定的主观局限性;②NAC早期的肿瘤微观变化,未能较好地反映到两项指标中。
本研究通过绘制Logistic回归模型的ROC曲线,其曲线下面积为0.928,多因素联合诊断能较大提升单因素诊断能力。综合Logistic回归模型可以提高超声对乳腺癌NAC早期疗效评估的准确性,该诊断方式对指导早期评估乳腺癌NAC疗效具有重要的临床意义。
参考文献:
[1]Caudle AS,Gonzalez-Angulo AM,Hunt KK,et al. Predictors of tumor progression during neoadjuvant chemotherapy in breast cancer[J]. J Clin Oncol,2010,28(11): 1821-1828.
[2]刘锋,张艳,陈洋,等.彩色多普勒超声在乳腺癌新辅助化疗疗效评价中价值[J].中华实用诊断与治疗杂志,2014,28(10):1017-1021.
[3]罗葆明,欧冰,智慧,等.改良超声弹性成像评分标准在乳腺肿块鉴别诊断中的价值[J].现代临床医学生物工程学杂志,2006,12: 396-398.
[4]Falou O,Sadeghi-Naini A,Prematilake S,et al. Evaluation of neoadjuvant chemotherapy response in women with locally advanced breast cancer using ultrasound elastography[J]. Transl Oncol,2013,6(1): 17-24.
[5]Ogston KN,Miller LD,Payne S. A new histological grading system to assess response of breast cancers to primary chemotherapy:prognostic significance and survival[J]. The Breast,2003,12(5): 320-327.
[6]Hafiz F,Choudhury T,Kamal M,et al. The spectrum of pathological changes in breast cancer following neoadjuvant chemotherapy[J]. Mymensingh Med J,2014,23(2): 272-280.
[7]Rebollo-Aguirre AC,Gallego-Peinado M,Sánchez-Sánchez R,et al. Sentinel lymph node biopsy after neoadjuvant chemotherapy in patients with operable breast cancer and positive axillary nodes at initial diagnosis[J]. Rev Esp Med Nucl Imagen Mol,2013,32(4): 240-245.
[8]Abedi M,Farrokh D,Homaei FS,et al. The validity of MRI in evaluation of tumor response to neoadjuvant chemotherapy in locally advanced breast cancer[J]. Iran J Cancer Prev,2013,6(1): 28-35.
[9]张林,郝洁,王立平,等.乳腺超声造影、彩色多普勒超声及磁共振灌注成像在评估乳腺癌新辅助化疗疗效中的对比研究[J].华中科技大学学报,2014,43(4): 449-452.
[10]Menezes GLG,Knuttel FM,Stehouwer BL,et al. Magnetic resonance imaging in breast cancer: a literature review and future perspectives[J]. World J Clin Oncol,2014,5(2): 61-70.
[11]刘晓婷,马灵芝.彩色多普勒超声评价乳腺癌新辅助化疗疗效的研究[J].现代肿瘤医学,2011,19(3): 460-462.
[12]Guo T,Yao F,Yang AM,et al. Endoscopic ultrasound in restaging and predicting pathological response for advanced gastric cancer patients after neoadjuvant chemotherapy[J]. Asia Pac J Clin Oncol,2014,10(2): 28-32.
[13]Tamaki K,Sasano H,Ishida T,et al. The correlation between ultrasonographic findings and pathologic features in breast disorders[J]. Jpn J Clin Oncol,2010,40(10): 905-912.
[14]Hayashi M,Yamamoto Y,Ibusuki M,et al. Evaluation of tumor stiffness by elastography is predictive for pathologic complete response to neoadjuvant chemotherapy in patients with breast cancer[J]. Ann Surg Oncol,2012,19(9): 3042-3049.
[15]Lee SH,Chang JM,Han W,et al. Shear-wave elastography for the detection of residual breast cancer after neoadjuvant chemotherapy[J]. Ann Surg Oncol,2015,22(3): 376-384.
[16]Marinovich ML,Houssami N,Macaskill P,et al. Accuracy of ultrasound for predicting pathologic response during neoadjuvant therapy for breast cancer[J]. Int J Cancer,2015,136(11): 2730-2737.
(童颖丹 编辑)
Multivariate analysis of ultrasound evaluation of early response of breast cancer to neoadjuvant chemotherapy
Zi-jie Zhang1,Feng-juan Guo1,Yan Zhang2,Ling Bai2,Xue Fan2,Cui-jing Chen2
(1. Hebei North College,Zhangjiakou,Hebei 075000,China;2. Department of Ultrasonography,the Affiliated Hospital,Academy of Military Medical Sciences,Beijing 100071,China)
Abstract:Objective To analyze and screen the ultrasonic parameters of evaluating the early response of breast cancer to neoadjuvant chemotherapy(NAC),and to build a mathematical model for preliminary evaluation. Methods Seventy-nine patients with primary breast carcinoma received unltrosound examination before NAC and after 2 cycles. The parameters of resistance index(RI),peak systole velocity(PSV),strain ratio(SR),the color flow grade and elastic score were obtained. Both single and multiple logistic regression analyses were applied. After the factors with statistical significance were selected,the relevant mathematical model was built and then was evaluated by means of receiver operating characteristic(ROC)analysis. Results The univariate analysis showed significant difference in every factor. A mathematical diagnostic model was established based on RI,PSV and SR. And the result of ROC analysis showed it could improve the diagnostic sensitivity and specificity compared with the single-factor mathematical diagnostic model. Conclusions RI,PSV and SR can predict final pathologic response in primary breast cancers after early cycles of NAC. Multivariate regression model has a higher accurate rate of diagnosis than a single factor in predicting the early efficacy of NAC.
Keywords:ultrasound;breast carcinoma;neoadjuvant chemotherapy;logistic regression
中图分类号:R737.9
文献标识码:A
DOI:10.3969/j.issn.1005-8982.2016.07.009
文章编号:1005-8982(2016)07-0040-04
收稿日期:2015-01-04
[通信作者]陈翠京,E-mail:ccj307yy@163.com

