特异性抑制转化生长因子β激活激酶1活性对妊娠期糖尿病孕妇外周血单核细胞炎症通路的影响*
高传龙,袁静,李琴,杨琴,李松,周培,丛林
(安徽医科大学第一附属医院产前诊断中心,安徽合肥230022)
特异性抑制转化生长因子β激活激酶1活性对妊娠期糖尿病孕妇外周血单核细胞炎症通路的影响*
高传龙,袁静,李琴,杨琴,李松,周培,丛林
(安徽医科大学第一附属医院产前诊断中心,安徽合肥230022)
摘要:目的探讨特异性抑制转化生长因子β激活激酶1(TAK1)活性的变化对妊娠期糖尿病(GDM)孕妇外周血单核细胞炎症通路的影响。方法选取GDM孕妇及正常孕妇各30例,采集外周静脉血,分离单核细胞和血浆。依据细胞加药组别的不同,分为LPS刺激组(L组)、脂多糖组(LPS组)、TAK1抑制剂组(LT组)、TAK1抑制剂组(T组)及空白对照组(W组),培养、加药后Western blot检测TAK1及核转录因子-κB (NF-κB)蛋白的表达量,酶联免疫吸附法(ELISA)检测血浆中LPS浓度及各组炎症因子[白介素-1(IL-1)、白介素-10(IL-10)、肿瘤坏死因子-α(TNF-α)]水平,比较各组结果的差异,探讨TAK1的作用。结果GDM孕妇与正常孕妇比较,血浆LPS浓度升高;TAK1及NF-κB蛋白表达量增加,炎症因子(IL-1、IL-10、TNF-α)水平升高,差异有统计学意义(P<0.05)。各小组间比较,L组相较于其他组的TAK1、NF-κB蛋白表达量增加,炎症因子(IL-1、IL-10、TNF-α)表达水平升高,差异有统计学意义(P<0.05);正常孕妇中,LT组、T组、W 组NF-κB蛋白表达量比较,差异无统计学意义(P>0.05),LT组、T组未检测到TAK1明显表达,可检测到W组少量表达,LT组相对于T组,TNF-α、IL-1、IL-10表达水平升高(P<0.05),LT组、T组与W组上清炎症因子表达水平比较,差异无统计学意义(P>0.05);GDM孕妇中,LT组、T组、W组TAK1及NF-κB蛋白表达量比较,差异无统计学意义(P>0.05),LT组相对于T组,TNF-α、IL-1、IL-10表达水平升高(P<0.05),Pearson相关性分析发现,TAK1、NF-κB蛋白表达量与炎症因子(IL-1、IL-10、TNF-α)水平呈正相关(P<0.05)。结论TAK1可能参与GDM孕妇外周血单核细胞炎症通路的形成,抑制TAK1的活性,可以下调通路下游关键介质NF-κB及炎症因子的表达。
关键词:妊娠期糖尿病;炎症通路;脂多糖;转化生长因子β激活激酶1;核转录因子-κB;炎症因子
近年来,妊娠期糖尿病(gestational diabetes mellitus,GDM)发病率呈逐年上升趋势,其近、远期并发症给母儿健康带来严重的危害[1-2],目前认为GDM的发病可能与免疫炎症及胰岛素抵抗(Insulinresistance,IR)有关[3]。许多研究表明,GDM患者体内多种炎症因子水平升高[4]。丛林等[5]的研究同样表明,脂多糖(Lipopolysaccharide,LPS)刺激后的GDM孕妇外周血单核细胞中,核转录因子-κB (nuclear transcription factor-κB,NF-κB)相关炎症通路介导的炎症因子高表达,可能参与GDM的发病,但是关于如何调控GDM孕妇外周血单核细胞炎症通路中炎症因子高表达,还有待进一步研究。在人类B细胞中,转化生长因子β激活激酶1 [transforming growth factor(TGF)-β-activating kinase 1,TAK1]参与LPS/Toll样受体/NF-κB介导的炎症通路的中间环节[6],蛋白特异性抑制剂(5Z-7-Oxozeaenol)可选择性抑制TAK1的磷酸化活性,进而抑制NF-κB的表达[7]。所以本研究选择5Z-7-Oxozeaenol做为TAK1抑制剂,通过选择性抑TAK1活性,观察LPS诱导的GDM孕妇外周血单核细胞炎症通路中,TAK1、NF-κB及炎症因子的表达,探讨TAK1活性变化对该通路的影响。
1 资料与方法
1.1一般资料
选取2014年10月8日-2015年5月8日在安徽医科大学第一附属医院产科门诊产检,并行葡萄糖耐量试验(oral glucose tolerance test,OGTT)检查的适龄孕妇,详细询问病史、家族史、生育史及孕期检查报告。标本收取阶段各选取30例正常孕妇和GDM孕妇。所有纳入者需排除免疫炎症、感染性疾病及其他妊娠期并发症;正常孕妇组和GDM孕妇组年龄22~34岁,平均(27.97±2.34)岁,孕周为24~28周,平均(26.13±0.61)周;正常孕妇组排除妊娠期糖尿病高危因素;GDM孕妇组符合2010年IADPSG妊娠期糖尿病诊断标准[8]。
1.2标本采集
选择符合实验要求的孕妇,空腹采集静脉血5ml,置于灭菌肝素钠抗凝管中。将人淋巴细胞分离液加入灭菌管,缓慢加入混匀的血标本,1 500 r/min低速离心后提取悬浮淋巴细胞,分离血浆存放于-20℃冰箱备用。将提取的悬浮淋巴细胞置于灭菌干管中,加入生理盐水洗涤,2 000 r/min离心。洗涤提纯后用淋巴细胞计数板计数,并用台盼蓝测定细胞活力,调整细胞浓度至6×106个/ml,接种于加入含双抗细胞培养基的24孔板中,放入37℃、5%二氧化碳CO2培养箱中培养。
1.3标本分组和处理
培养24 h后每份标本分为4份,依据加药组别的不同分为4组:LPS(1μg/ml)刺激组(L组)、LPS (1μg/ml)和TAK1抑制剂5Z-7-Oxozeaenol (1μmol)组(LT组)、TAK1抑制剂5Z-7-Oxozeaenol (1μmol)组(T组)及空白对照组(W组),调整各小组培养液总体积为1 ml,培养24 h后分别收集上清和细胞置于-20℃冰箱中保存。
1.4主要试剂
人淋巴细胞分离液购自上海华精生物高科技有限公司,LPS、台盼蓝试剂购自美国Sigma公司,细胞培养液、胎牛血清购自美国Gibco公司,增强化学发光法(enhanced chemiluminescence,ECL)显影液、细胞裂解液(radio immunoprecipitation assay,PIRA)、Western Blot检测常用试剂、山羊抗小鼠二抗购自美国RD公司,小鼠抗人TAK1抗体、小鼠抗人NF-κB抗体、β-actin购自美国Cell Singnaling公司,LPS试剂盒购自厦门鲎试剂公司,酶联免疫吸附法(enzyme-linked immunosorbent assay,ELISA)试剂盒购自深圳晶美生物工程有限公司。
1.5实验方法
1.5.1LPS检测取备用血清,按照鲎试剂盒说明书进行操作。
1.5.2细胞因子检测ELISA法检测上清炎症因子[白细胞介素-1(Interleukin-1,IL-1)、白细胞介素-10 (Interleukin-10,IL-10)、肿瘤坏死因子-α(tumor necrosis factor-α,TNF-α)]浓度,按ELISA试剂盒说明书进行操作,取培养上清液100μl,加入酶标板孔内,依次加入各种试剂,酶标仪492 nm波长处读值。
1.5.3Western blot检测TAK1及NF-κB蛋白的表达将收集的细胞样本按组分别加入含有蛋白酶抑制剂的细胞裂解液[含RIPA裂解液∶苯甲基磺酰氟=99∶1]冰上裂解细胞提取总蛋白,超声后的悬液4℃、14 000 r离心10 min。取上清加5×蛋白上样缓冲液,煮沸10min,样品置入-20℃冰箱冷冻保存。调整各组蛋白为同浓度,各组取等量蛋白上样。10%聚丙烯酰胺凝胶电泳分离蛋白,转移至聚偏氟乙烯膜,5%脱脂奶粉封闭2 h,洗膜,放入1∶1 000稀释的TAK1抗体、NF-κB抗体和肌动蛋白(β-actin)中4℃过夜孵一抗,洗膜,放入1∶1 000稀释的二抗37℃孵育2 h,洗膜,ECL显影液显影。
1.6统计学方法
采用SPSS 19.0统计软件进行数据分析,计量资料以均数±标准差(±s)表示,多组比较用方差分析,方差齐时,两两比较用独立样本t检验。各小组组内相关性分析用Pearson相关分析,Image软件分析显影后图像,P<0.05为差异有统计学意义。
2 结果
2.1血浆LPS检测结果
GDM组血浆LPS(0.82±0.33)EU/ml,高于正常组[(0.52±0.43)EU/ml],经t检验,差异有统计学意义(t=2.795,P=0.010)。
2.2各组炎症因子检测结果比较
2.2.1GDM孕妇与正常孕妇外周血单核细胞培养液上清炎症因子水平比较GDM孕妇与正常孕妇外周血单核细胞培养液上清炎症因子(IL-1、IL-10、TNF-α)表达水平比较,经t检验,差异有统计学意义(P<0.05),表明GDM孕妇各小组[加入LPS(L组)、LPS和TAK1蛋白特异性抑制剂(LT组)、TAK1蛋白特异性抑制剂(T组)、空白对照组(W组)]炎症因子表达水平均高于高于正常孕妇组。见图1~4。
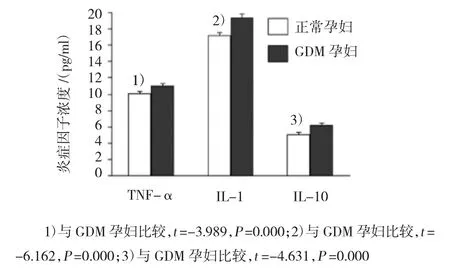
图1 加入LPS(L组)培养后,GDM孕妇与正常孕妇外周血单核细胞培养液上清炎症因子比较
2.2.2正常孕妇外周血单核细胞加药或培养后,各组培养液上清炎症因子水平比较正常孕妇中,L组及其他组上清细胞因子(IL-1、IL-10、TNF-α)表达水平比较,经方差分析,差异有统计学意义(P<0.05)。L组上清细胞因子(TNF-α、IL-1、IL-10)表达水平高于LT、W、T组,经t检验,差异有统计学意义(TNF-α:t=3.061、3.949和4.998,P=0.003、0.000和0.000;IL-1:t=3.840、5.057和6.460,P=0.000;IL-10:t=2.380、4.256和4.854,P=0.000)。W组与T组、LT组上清炎症因子水平,经t检验,差异无统计学意义(P>0.05),W组与T组、LT组上清炎症因子表达水平比较,差异无统计学意义。见表1。
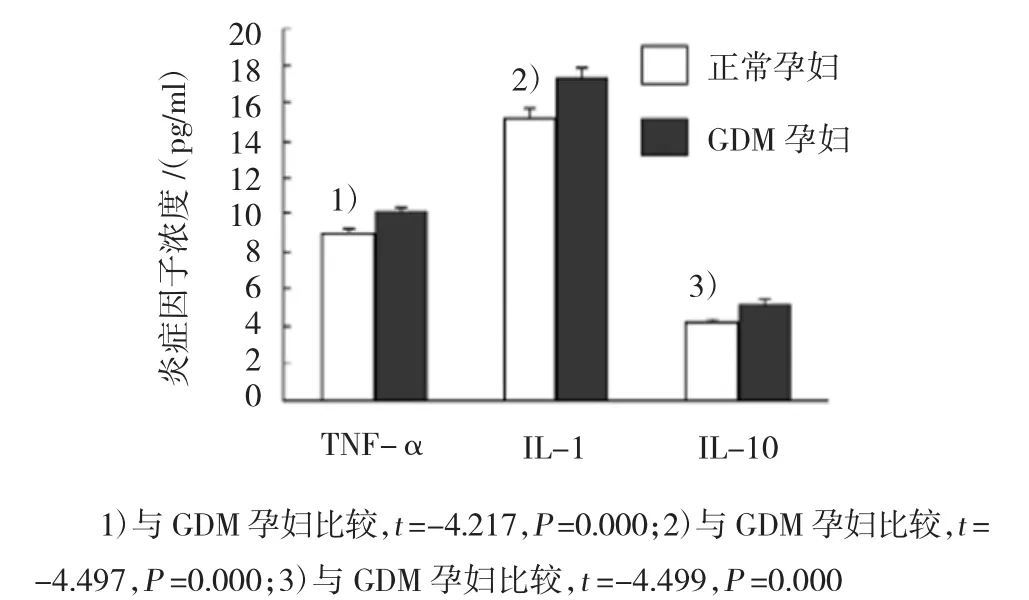
图2 空白对照组(W组)培养后,GDM孕妇与正常孕妇外周血单核细胞培养液上清炎症因子比较
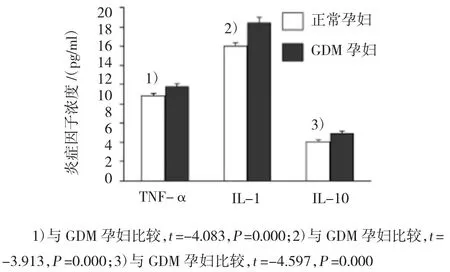
图3 加入TAK1蛋白特异性抑制剂(T组)培养后,GDM孕妇与正常孕妇外周血单核细胞培养液上清炎症因子比较
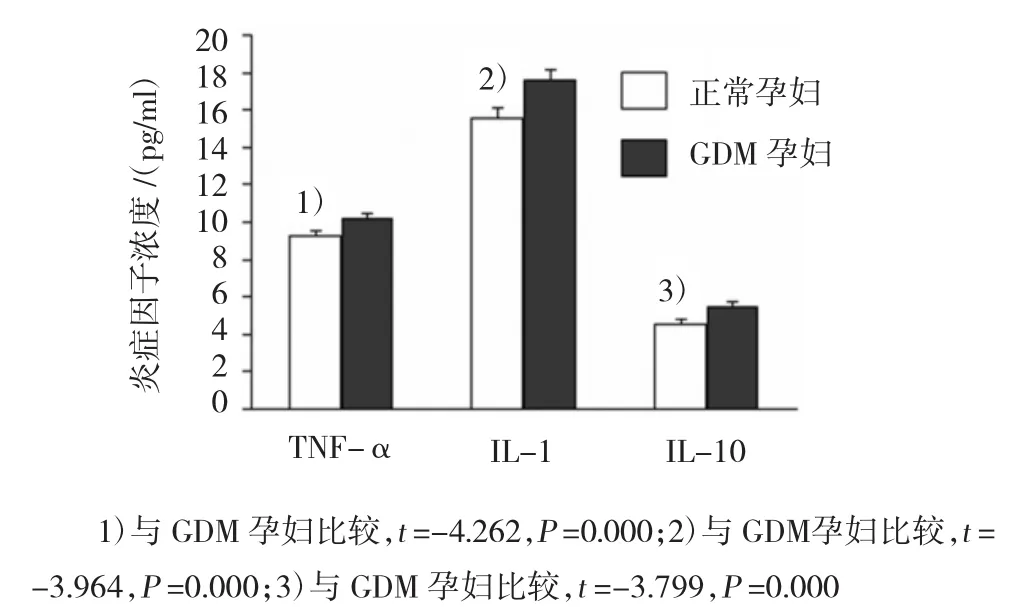
图4 加入LPS和TAK1蛋白特异性抑制剂(LT组)培养后,GDM孕妇与正常孕妇外周血单核细胞培养液上清炎症因子比较
2.2.3GDM孕妇外周血单核细胞加药或培养后,各组培养液上清炎症因子比较GDM孕妇中,L组及其他组上清细胞因子(IL-1、IL-10、TNF-α)表达水平比较,经方差分析,差异有统计学意义(P<0.05)。L组上清细胞因子(TNF-α、IL-1、IL-10)表达水平高于LT、W、T组,经t检验,差异有统计学意义(TNF-α:t =3.318、3.566和4.840,P =0.002、0.001 和0.000;IL-1:t =3.866、4.439和6.513,P =0.000;IL-10:t =2.513、3.621和3.696,P =0.015、0.001和0.000)。W组与T组、LT组上清炎症因子水平比较,经t检验,差异无统计学意义(P>0.05),W组与T组、LT组上清炎症因子表达水平水平比较,差异无统计学意义(P>0.05)。见表2。
表1 正常孕妇外周血单核细胞加药或培养后,各组培养液上清炎症因子比较(n=30,pg/ml,±s)
注:1)与L组(加LPS)比较,P<0.01;2)与W组(空白对照组)比较,P>0.05;3)与T组(加抑制剂)比较,P>0.05;4)与T组(加抑制剂)比较,P=0.012
组别 TNF-α IL-1 IL-10 L组 10.01±1.00 17.11±1.33 5.04±0.80 LT组 9.28±0.841)2)3) 15.6±1.701)2)4) 4.55±0.801)2)3)W组 9.00±0.971) 15.19±1.611) 4.24±0.641)T组 8.85±0.791)2) 13.97±1.451)2) 4.09±0.631)2)F值 9.697 14.577 9.439 P值 0.000 0.000 0.000
表2 GDM孕妇外周血单核细胞加药或培养后,各组培养液上清炎症因子比较(n=30,pg/ml,±s)

表2 GDM孕妇外周血单核细胞加药或培养后,各组培养液上清炎症因子比较(n=30,pg/ml,±s)
注:1)与L组(加LPS)比较,P<0.01;2)与W组(空白对照组)比较,P>0.05;3)与T组(加抑制剂)比较,P>0.05;4)与T组(加抑制剂)比较,P=0.019;5)与L组(加LPS)比较,P=0.012
组别 TNF-α IL-1 IL-10 L组 11.03±0.99 19.36±1.49 6.15±1.04 LT组 10.23±0.881)2)3) 17.55±2.091)2)4) 5.47±1.062)3)5)W组 10.10±1.041) 17.31±2.031) 5.20±0.981)T组 9.79±0.991)2) 16.36±2.031)2) 4.92±0.861)2)F值 8.787 12.677 5.915 P值 0.000 0.000 0.000
2.3各组蛋白表达量比较
2.3.1GDM孕妇与正常孕妇外周血单核细胞TAK1蛋白表达量比较①GDM孕妇(L组、LT组、T组、W组)与正常孕妇TAK1蛋白表达量比较,经t检验,差异有统计学意义(t =2.341、1.968、1.436和1.795,P=0.000),GDM孕妇不同处理组TAK1蛋白表达量均增加;②正常孕妇中,L组及其他各小组检测到的TAK1蛋白表达量比较,经方差分析,差异有统计学意义(F=1.982,P=0.000),L组的TAK1蛋白表达量高于其余各组。加入TAK1抑制剂5Z-7-Oxozeaenol组(T组和LT组)未检测到TAK1的表达,空白对照组(W组)仅检测到TAK1的少量表达;③GDM孕妇中,L组及其他各小组检测到的TAK1蛋白表达量比较,经方差分析,差异有统计学意义(F=2.573,P=0.000),L组的TAK1蛋白表达量高于其余各组。见表3和图5。
2.3.2GDM孕妇与正常孕妇各组外周血单核细胞NF-κB蛋白的表达量比较①GDM孕妇(L组、LT组、T组、W组)与正常孕妇NF-κB蛋白表达量比较,经t检验,差异有统计学意义(t=1.573、1.362、1.036和1.495,P=0.000),GDM孕妇单核细胞NF-κB蛋白表达量高于正常孕妇;②正常孕妇中,L组及其余各组检测到的NF-κB表达量比较,经方差分析,差异有统计学意义(F=1.068,P=0.000),L 组NF-κB表达量高于其余各组。W组与T组、LT组检测到的NF-κB表达量比较,经t检验,差异无统计学意义(P>0.05);③GDM孕妇中,L组及其余各组检测到的NF-κB表达量比较,经方差分析,差异有统计学意义(F=1.915,P=0.000),L组NF-κB表达量高于其余各组。见表4和图6。
表3 GDM孕妇与正常孕妇外周血单核细胞干预培养后,各组TAK1蛋白表达量比较(n=30,±s)

表3 GDM孕妇与正常孕妇外周血单核细胞干预培养后,各组TAK1蛋白表达量比较(n=30,±s)
注:1)与L组(加LPS)比较,P=0.000;2)与T组(加抑制剂)比较,P>0.05
组别 GDM孕妇TAK1 正常孕妇TAK1 L组 2.79±0.79 2.06±0.78 LT组 1.54±0.751)2) 0.00±0.001)W组 1.39±0.641)2) 0.41±0.271)T组 1.31±0.551) 0.00±0.001)F值 2.573 1.982 P值 0.000 0.000
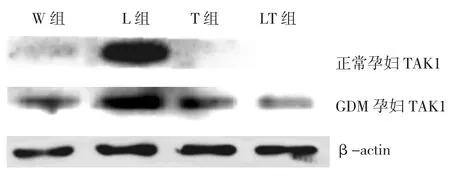
图5 TAK1蛋白显影后图像
2.4GDM孕妇与正常孕妇外周血单核细胞TAK1 及NF-κB蛋白表达量与上清炎症因子水平的相关性分析
Pearson相关性分析发现,TAK1与NF-κB蛋白表达呈正相关(相关系数=0.463,P=0.002);TAK1蛋白表达量与上清炎症因子水平(TNF-α、IL-1、 IL-10)呈正相关(相关系数=0.367、0.542和0.427,P=0.016、0.002和0.025);NF-κB蛋白表达量与上清炎症因子水平(TNF-α、IL-1、IL-10)呈正相关(相关系数=0.561、0.329、0.336,P =0.024、0.010和0.035)。
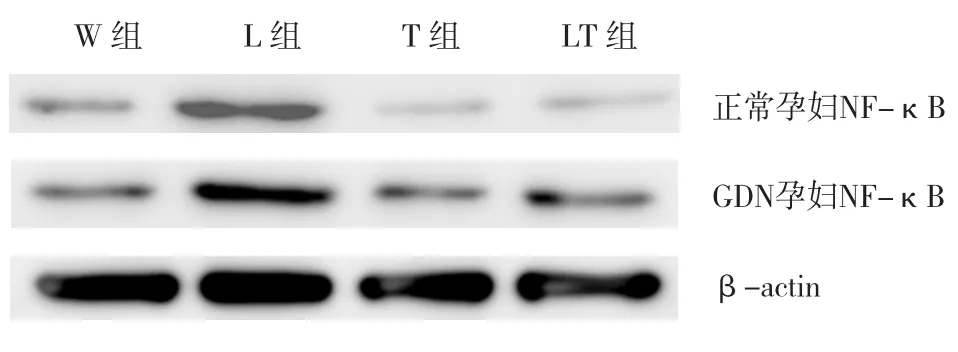
图6 NF-κB蛋白显影后图像
表4 GDM孕妇与正常孕妇外周血单核细胞干预培养后,各组NF-κB蛋白表达量比较(n=30,±s)
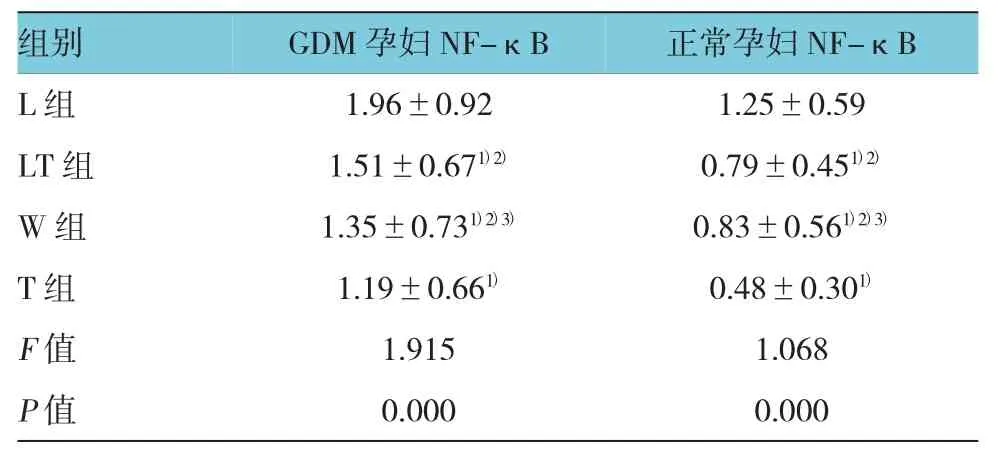
表4 GDM孕妇与正常孕妇外周血单核细胞干预培养后,各组NF-κB蛋白表达量比较(n=30,±s)
注:1)与L组(加LPS)比较,P<0.01;2)与T组(加抑制剂)比较,P>0.05;3)与LT组(加抑制剂)比较,P>0.05
组别 GDM孕妇NF-κB 正常孕妇NF-κB L组 1.96±0.92 1.25±0.59 LT组 1.51±0.671)2) 0.79±0.451)2)W组 1.35±0.731)2)3) 0.83±0.561)2)3)T组 1.19±0.661) 0.48±0.301)F值 1.915 1.068 P值 0.000 0.000
3 讨论
GDM孕妇相对于正常孕妇,体内多种炎症因子水平升高[4],可能存在慢性亚临床炎症状态[9],目前IR同样被认为可能是一个慢性亚临床炎症过程,包括TNF-α、IL-1等在内的炎症因子介导细胞内炎症反应的信号转导,该炎症因子可能通过某些途径,使胰岛素信号转导受阻,从而诱发IR[10-11]。虽然炎症可能与GDM发病相关,但是上述炎症因子升高的机制及其相关通路的激活和调控,还有待进一步探讨。
丛林等[5]研究认为,LPS可通过LPS-TLR4-NF-κB炎症通路刺激炎症因子IL-1、TNF-α等的转录释放,引起致炎因子IL-1、TNF-α和抗炎因子IL-10水平升高,可能参与GDM的发病。本研究结果显示,GDM孕妇血浆LPS浓度在基础状态下高于正常孕妇,因此笔者推测,LPS可能通过刺激炎症因子(IL-1、TNF-α)的释放,加剧GDM孕妇体内炎症的进程。而在有关糖尿病的研究中,IL-1和TNF-α分别与IL-1R、TNF-R受体结合后,同样可以激活类似的炎症通路,进而释放炎症因子[6](IL-1、TNF-α),因此LPS、TNF-α、IL-1等致炎因子及炎症因子便可相互作用,使GDM患者体内的炎症状态持续存在,并通过多种途径引起慢性低度炎症的循环和胰岛素抵抗。而抑制炎症因子的释放,阻断通路的循环有可能缓解IR,从而为GDM的治疗提供新的路径。
有关TAK1的研究中,有研究表明,在LPS刺激诱导的NF-κB相关的炎症通路中,通过有效地抑制TAK1的活性,可以阻止其下游IKK复合物的活化,从而阻止NF-κB入核,抑制炎症因子的释放[12]。但是关于TAK1在GDM孕妇炎症通路中的研究尚未见报道。本研究中GDM孕妇与正常孕妇外周血单核细胞在相同培养刺激条件下,GDM孕妇外周血单核细胞的TAK1及NF-κB蛋白表达量和炎症因子(IL-1、IL-10、TNF-α)的表达水平均升高,提示GDM孕妇体内可能存在TAK1/NF-κB相关的炎症通路激活状态。LPS刺激组的炎症因子、蛋白TAK1 和NF-κB表达量相较于其他组明显增加,而在加入LPS的同时,加入TAK1选择性抑制剂5Z-7-Oxozeaenol的条件下,TAK1和NF-κB蛋白表达量及炎症因子水平均下降,说明LPS可以诱导TAK1/NF-κB/炎症因子的高表达。同时在抑制TAK1活性的情况下,其下游介质NF-κB和炎症因子的表达也明显下调,且TAK1/NF-κB/炎症因子的表达呈正相关,表明TAK1可能参与并调控GDM孕妇外周血单核细胞TAK1/NF-κB/相关炎症通路的形成。
不仅在LPS诱导的炎症通路中,在IL-1和TNF-α等诱导的炎症通路中,TAK1也发挥重要作用,有研究认为,当IL-1、TNF-α和LPS分别与受体包膜上不同受体结合后,可触发TAK1/NF-κB相关的炎症通路,从而启动炎症因子的转录[13]。所以抑制TAK1活性不仅可以抑制LPS诱导的炎症通路,还可能抑制LPS激活的IL-1和TNF-α相关的炎症通路,发挥其对GDM炎症发病机制中一些炎症通路的抑制作用,阻断炎症通路的循环。但是这仅仅是一些猜想,还需进一步深入研究。
综上所述,TAK1可能参与LPS诱导的GDM孕妇外周血单核细胞炎症通路的形成,且可以通过TAK1的环节下调炎症因子的表达,抑制炎症反应的进程。目前,存在不少有关TAK1的抗炎机制的研究,但大多集中在细胞层次和动物模型中,笔者的研究也仅限于机制的研究,仅希望能为GDM的治疗提供新的思路。
参考文献:
[1]Schneider S,Bock C,Wetzel M,et al. The prevalence of gestational diabetes in advanced economies[J]. J Perinat Med,2012,40(5): 511-520.
[2]Alfadhl EM. Gestational diabetes mellitus[J]. Saudi Med J,2015,36(4): 399-406.
[3]Li YY,Xiao R,Li CP,et al. Increased plasma levels of FABP4 and PTEN is associated with more severe insulin resistance in women with gestational diabetes mellitus[J]. Med Sci Monit,2015,21: 426-431.
[4]Yu J,Zhou Y,Gui J,et al. Assessment of the number and function of macrophages in the placenta of gestational diabetes mellitus patients[J]. J Huazhong Univ Sci Technolog Med Sci,2013,33(5): 725-729.
[5]丛林,李从青,袁静,等. LPS-TLR4-NF-κB通路在妊娠期糖尿病、正常孕妇及育龄妇女外周血单核细胞中的表达[J].现代妇产科进展,2010,19(11): 820-822.
[6]He B,Santamaria R,Xu W,et al. The transmembrane activator TACI triggers immunoglobulin class switching by activating B cells through the adaptor MyD88[J]. Nat Immunol,2010,11(9): 836-845.
[7]Wu J,Powell F,Larsen NA,et al. Mechanism and in vitro pharmacology of TAK1 inhibition by(5Z)-7-Oxozeaenol[J]. ACS Chemical Biology,2013,8(3): 643-650.
[8]Metzger BE,Gabbe SG,Persson B,et al. International association of diabetes and pregnancy study groups recommendations on the diagnosis and classification of hyperglycemia in pregnancy[J]. Diabetes Care,2010,33(3): 676-682.
[9]Pantham P,Aye IL,Powell TL. Inflammation in maternal obesity and gestational diabetes mellitus[J]. Placenta,2015,36(7): 709-715.
[10]Shah A,Mehta N,Reilly MP. Adipose inflammation,insulin resistance,and cardiovascular disease[J]. JPEN J Parenter Enteral Nutr,2008,32(6): 638-644.
[11]Odegaard JI,Chawla A. Mechanisms of macrophage activation in obesity-induced insulin resistance[J]. Nat Clin Pract Endocrinol Meta,2008,4(11): 619-626.
[12]Ear T,Fortin CF,Simard FA,et al. Constitutive association of TGF-beta-activated kinase 1 with the lkappaB kinase complex in the nucleus and cytoplasm of human neutrophils and its impact on downstream processes[J]. J Immunol,2010,184(7): 3897-3906.
[13]Odegaard JI,Chawla A. Connecting type 1 and type 2 diabetes through innate immunity[J]. Cold Spring Harb Perspect Med,2012,2(3): 1-18.
(童颖丹 编辑)
Influence of specifical inhibition of TAK1 activity in inflammatory pathway of mononuclear cells in peripheral blood of pregnant women with gestational diabetes mellitus*
Chuan-long Gao,Jing Yuan,Qin Li,Qin Yang,Song Li,Pei Zhou,Lin Cong
(Prenatal Diagnosis Center,the First Affiliated Hospital of Anhui Medical University,Hefei,Anhui 230022,China)
Abstract:Objective To investigate the influence of changes of TGF-β-activated kinase 1(TAK1)activity in the inflammatory pathway of mononuclear cells in the peripheral blood of pregnant women with gestational diabetes mellitus(GDM). Methods Totally 30 GDM pregnant women and 30 normal pregnant women were selected. Peripheral venous blood was drawn,and mononuclear cells and plasma were separated. They were divided into lipopolysaccharide(LPS)-stimulation group(L group),LPS and TAK1-inhibitor group(LT group),book=10,ebook=15TAK1-inhibitor group(T group)and control group(W group). After culture,Western blot was used to detect the expressions of TAK1 and NF-κB,and ELISA was used to detect the plasma concentration of LPS and the expression levels of inflammatory factors(IL-1,IL-10 and TNF-α). The differences between GDM and normal pregnant women were compared and the effect of TAK1 was explored. Results Compared with the normal pregnant women,the plasma LPS concentration,the expression levels of inflammatory factors(IL-1,IL-10 and TNF-α),TAK1 and NF-κB increased in the GDM pregnant women(P<0.05). Compared with other groups,the expression levels of TAK1,NF-κB and inflammatory factors(IL-1,IL-10 and TNF-α)significantly increased in the L group(P<0.05). In the normal pregnant women,the expression levels of NF-κB had no statistical differences(P>0.05)among the T group,the LT group and the W group;no obvious expression of TAK1 was detected in the LT group or the T group while a small amount of TAK1 expression was detected in the W group;compared with the T group,the expression levels of inflammatory factors(TNF-α,IL-1 and IL-10)significantly increased in the LT group(P<0.05). In the GDM pregnant women,the LT group,the T group and the W group had no statistical differences in the expression levels of TAK1 or NF-κB(P>0.05);compared with the T group,the expression levels of inflammatory factors(TNF-α,IL-1 and IL-10)significantly increased in the LT group(P<0.05). The Pearson correlation analysis showed that the expression levels of TAK1 and NF-κB were positively correlated with inflammatory factors(IL-1,IL-10 and TNF-α)(P<0.05). Conclusions TAK1 may be involved in the formation of the inflammatory pathway of mononuclear cells in the peripheral blood of GDM pregnant women. Inhibition of TAK1 activity can down-regulate the expressions of downstream key mediators such as NF-κB and inflammatory factors.
Keywords:gestational diabetes mellitus;inflammatory pathway;lipopolysaccharide;transforming growth factor(TGF)-β-activated kinase 1;NF-κB;inflammatory factor
中图分类号:R587.1
文献标识码:A
DOI:10.3969/j.issn.1005-8982.2016.07.003
文章编号:1005-8982(2016)07-0009-06
收稿日期:2015-11-13
*基金项目:安徽省自然科学基金(No:1208085MH172)
[通信作者]丛林,E-mail:conglin1957@163.com

