高强度聚焦超声联合纳米颗粒在肿瘤治疗中的研究进展
唐家伟严 飞李叶阔
高强度聚焦超声联合纳米颗粒在肿瘤治疗中的研究进展
唐家伟1严 飞2李叶阔3
超声疗法;纳米粒子;肿瘤;综述
高强度聚焦超声(high intensity focused ultrasound,HIFU)是一种很有前景的无创治疗肿瘤的方法,在MRI或诊断超声的成像技术引导下,可以对局部肿瘤进行定点消融[1]。既往很多临床试验对HIFU治疗的可行性和安全性进行了研究,HIFU疗法已应用于前列腺、乳腺、子宫等多个脏器的良恶性肿瘤治疗中[2]。然而,HIFU治疗系统在临床应用中仍然存在一些不足,亟需新的技术来实现更精准的定位和更高效力的消融效果[3]。针对这些问题,纳米颗粒着力于可视化、增效和联合治疗等方面,不断地更新和完善,为提高HIFU治疗肿瘤的疗效起到了极大的推动作用。本文将对目前HIFU联合纳米颗粒在肿瘤治疗中的研究进展做一综述。
1 纳米颗粒增敏HIFU消融效力
HIFU治疗肿瘤的机制主要在于聚焦的超声束可以在组织内产生热效应和机械效应,使组织发生凝固性坏死[4]。然而,随着组织深度的增加,超声能量会衰减,理论上需要提高超声强度来增强治疗效果,但同时也会增加损伤周围正常组织的风险[5]。纳米颗粒可作为HIFU增敏剂,增强超声对靶区域肿瘤组织的消融效果,有效降低HIFU消融所需的强度阈值。
1.1无机纳米颗粒增敏HIFU消融效力 Wang等[6]制备了一种介孔二氧化硅纳米囊(mesoporous silica nanocapsules,MSNC),壳层具有多分散性的介孔,内部为一个中空结构,温度敏感的全氟己烷(perfluorohexane,PFH)被包载在介孔和内核中,见图1。在体外条件下,将样品的温度升高到70℃,达到PFH的沸点之上,可在光学显微镜下看到大量微泡形成。该研究通过对脱气牛肝进行HIFU消融,结果显示MSNC-PFH组的消融组织体积明显大于MSNC组和磷酸盐缓冲液(phosphate buffer solution,PBS)对照组。载VX2肝癌的兔模型体内实验结果显示,PBS组在120W和400W 的HIFU功率下分别作用2s,超声均未检测到聚焦区域的回声改变,而MSNC-PFH组在120W的HIFU作用下2s,超声可检测到聚焦区域回声明显增强,表明该区域肿瘤组织发生了凝固性坏死。MSNC-PFH作为HIFU增效剂的机制可能为,在HIFU的作用下,液态PFH会转变成大量的小气泡,不断地膨胀和融合,在肿瘤组织内形成更大的气泡,产生超声空化相关的生物学效应,如机械共振、微射流、冲击波、生物膜开放等[7],增强了HIFU的消融效能。
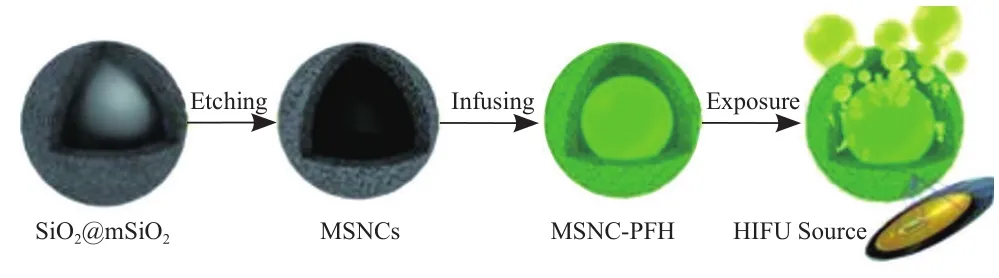
图1 MSNC-PFH的合成步骤以及联合HIFU治疗
在提高HIFU消融效能的同时,提高对靶组织的精准定位,有利于对肿瘤组织的彻底消融。目前集成在HIFU治疗系统中的影像学引导手段主要有MRI和超声。与超声比较,MRI具有更高的空间分辨率、密度分辨率等优势,并可以对治疗靶区的温度进行实时监控[8]。然而,传统的MRI引导的HIFU治疗系统在成像效果和图像引导效率方面仍然存在一些不足,为了增强成像效果,有必要引入具有MRI造影特性的纳米颗粒。
Chen等[9]对MSNC材料进一步修饰,将MnOx纳米颗粒作为MRI T1造影剂,通过氧化还原反应添加到介孔中,制备了一种新的介孔复合纳米囊(mesoporous composite nanocapsules,MCNCs),增强了MRI成像效果。同时,在MCNCs的中空结构中加入PFH,可以起到协同增强HIFU消融效能的作用。在载VX2肝癌兔体内成像实验中,注射MCNCs-PFH和PBS的前后分别进行MRI T1成像,结果显示注射MCNC-PFH后,周围正常肝组织信号显著增强,与肿瘤信号形成鲜明对比,有利于区分肿瘤和周围正常组织的边界,而PBS组在注射前后图像信号无明显变化。体外脱气牛肝消融结果显示,MCNCs-PFH组采用HIFU 150W/5s,消融体积为86.5mm3,而PBS对照组采用HIFU 250W/5s,消融体积仅有66.6mm3。体内载瘤兔实验显示,MCNCs-PFH组的消融体积是PBS组的8.3倍。因此,MCNCs-PFH的引入不仅提高了MRI的引导精度,还可以有效地降低治疗所需HIFU的强度,获得更好的消融效能。
1.2有机纳米颗粒增敏HIFU消融效力 虽然无机介孔二氧化硅材料在MRI引导的HIFU治疗中表现出显著的增强效果,但无机硅纳米材料在向临床转化的过程中,一直面临着生物安全性问题。在生物相容性方面,有机材料具有独特优势。
Sun等[10]使用改良双乳蒸发法制备了一种包载有超顺磁性Fe3O4纳米颗粒的聚乳酸-羟基乙酸共聚物[Poly(lactic-coglycolic acid),PLGA]微囊,粒径大小约为885 nm,具有良好的生物相容性。由于Fe3O4纳米颗粒的存在,体外材料特性检测表明该微囊具有良好的超顺磁性,在荷载VX2肝癌的兔模型上,注射Fe3O4/PLGA之后,正常肝组织出现MRI信号负增强的效应,与肿瘤边界形成鲜明对比,表现出良好的MRI-T2成像效果。在离体脱气牛肝和体内MRI引导下HIFU消融实验中,相同参数下,Fe3O4/PLGA组的消融体积显著大于PLGA组和PBS组。由此证明,Fe3O4/PLGA微囊不仅可以有效提高MRI引导下HIFU治疗肿瘤的精准度,还增强了聚焦区域组织对超声能量的吸收,显著提高了HIFU的消融效力。
实体瘤组织中新生血管较多,结构完整性差,对于粒径<200 nm的颗粒,具有良好的高通透性和滞留效应。为了增强HIFU增敏剂在肿瘤部位的富集,制备粒径更小的有机纳米颗粒显得尤为重要。Zhou等[11]采用液气相转换的策略制备了一种靶向纳米乳,内核是具有良好生物相容性的疏水性PFH,沸点约为56℃;亲水性外壳也是由生物相容性较好的脂质类材料合成;此外,纳米乳的外层壳表面配有叶酸,使该纳米乳具有主动靶向特性。在体外液气相转换试验中,当温度加热到80℃时,显微镜下可以看到大量微泡形成,同时,在超声造影成像下,也可以看到回声增强。在离体脱气牛肝的消融实验中,在相同HIFU参数下,靶向纳米乳组的消融体积明显大于空白脂质颗粒组和PBS组。在体内靶向富集验证试验中,用红色量子点标记纳米乳,经尾静脉注射后进行荧光成像,靶向组可在裸鼠背部肿瘤区域看到红色荧光,而非靶向组在肿瘤区域未看到明显的红色荧光。体内消融实验也表明,相同HIFU参数下,靶向纳米乳组表现出更强的消融效力。
2 HIFU触发纳米颗粒靶向药物/基因递送
HIFU在肿瘤治疗的临床应用中,多数情况都是基于HIFU的热消融力,使肿瘤组织局部温度升高至60℃以上,组织发生凝固性坏死,达到肿瘤治疗的目的[12]。然而,低强度参数的HIFU可以凭借其热效应、空化效应等作用,触发纳米药物载体内的药物释放。
HIFU触发的药物释放,最经典的应用是低温度敏感脂质体(low temperature sensitive liposome,LTSL)[13]。在纳米材料的不断改进中,Park等[14]制备了一种新的稳定型温度敏感脂质体(stable temperature-sensitive liposome,STL),在传统LTSL的配方中增加了脂肪酸共轭的类弹性蛋白多肽。STL的粒径大小约为160 nm,通过硫酸铵梯度法包载阿霉素(doxorubicin,DOX),载药率为95%。与传统LTSL相比,STL在血清中37℃时具有更好的稳定性,39~42℃时DOX迅速释放,尤其是在42℃时,10s内即可达到95%释放率。在载瘤小鼠的体内实验中,HIFU+STL-DOX组在给药后的2 d内出现肿瘤的消退,同时,在后续时间的连续监测中,HIFU+ STL-DOX组的抑制肿瘤生长效力明显高于单纯LTSL-DOX组,表明在HIFU的作用下,肿瘤局部温度上升到42℃左右,触发了DOX从STL-DOX中释放,增强了抗肿瘤效能。
Liang 等[15]通过有机材料与无机材料相结合的方式,兼顾纳米颗粒的稳定性和生物相容性,将硅脂质加入到传统脂质体的配方中,制备了一种粒径大小约为200 nm的硅质体(HTSCs),见图2。这种硅质体表现出良好的生物相容性,可以包载水溶性或者脂溶性的药物。通过改变磷脂成分的比例,可以调节药物的释放效率。HTSCs与传统LTSLs相比,具有更长的血液循环时间。体外研究表明,载药HTSCs在37℃时表现出极强的稳定性,而在42℃时,出现爆发式释放。体内载瘤裸鼠实验结果显示,HIFU+HTSCs组抗肿瘤效力明显优于单纯HTSCs组,表明HIFU成功触发了药物的释放,增强了治疗效果。
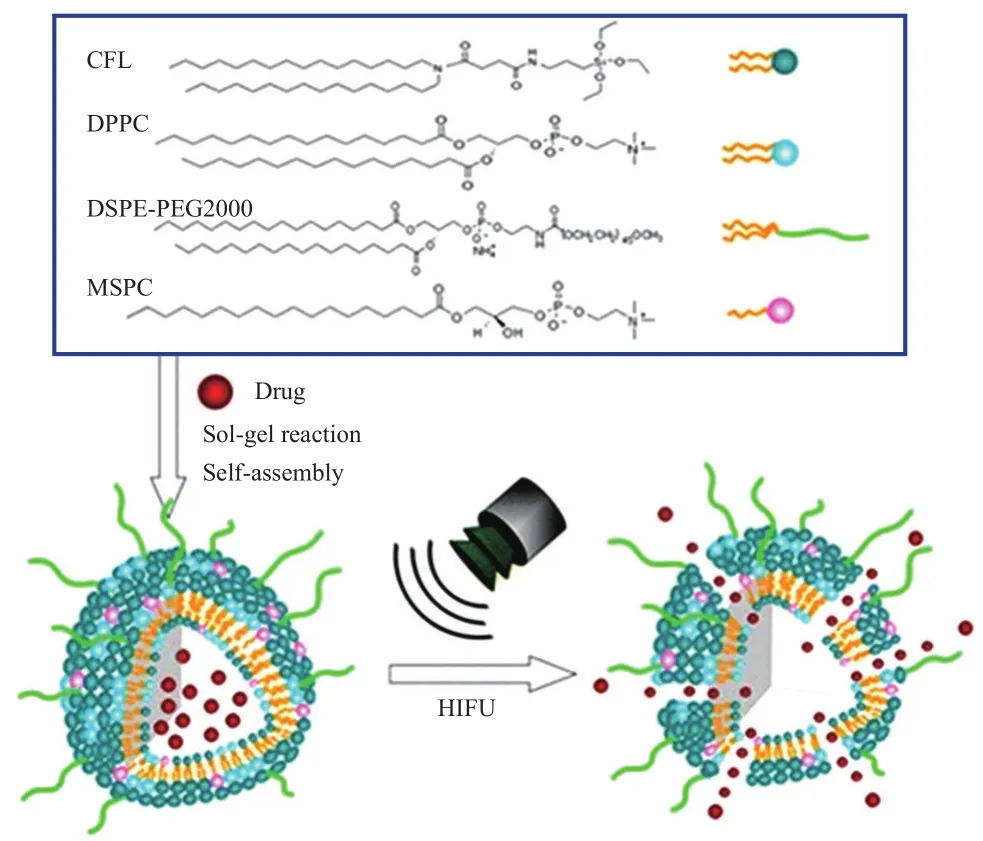
图2 载药HTSCs合成步骤以及HIFU辐照下药物的释放
3 纳米颗粒促进HIFU消融与其他治疗方法相结合
3.1HIFU消融与化疗相结合 虽然HIFU消融具有明确的肿瘤杀伤力,但HIFU消融的局限性在于不能彻底消除残留的肿瘤细胞,因此,具有肿瘤复发和转移的风险[16]。针对这一问题,Zhang等[17]制备了一种多功能靶向载药纳米泡(mAbHLA-G/MTX/PLGA NBs),具有抗HLA-G靶向、包载甲氨蝶呤(methotrexate,MTX),粒径约为477 nm,见图3。该纳米泡在体内和体外都有良好的超声成像增强效果,并对HLA-G过表达的JEG-3细胞培养和肿瘤都有很好的靶向性。体外药物释放实验显示,HIFU+mAbHLA-G/MTX/PLGA NBs组在150W/5s的HIFU辐照后,3h时MTX释放率为50%,72h时MTX释放率为80%,说明HIFU可以有效地触发PLGA内药物的释放。在体内抗肿瘤试验中,相同参数下,HIFU+mAbHLA-G/MTX/PLGA NBs组的消融体积显著大于HIFU+生理盐水组,证实了多功能纳米泡的HIFU消融增效功能。在组织HE染色、增殖细胞核抗原、末端标记法、增生指数、凋亡指数等检测中,HIFU+mAbHLA-G/MTX/PLGA NBs组与其他组相比,表现出HIFU消融与化疗的双重功效,具有最佳的抗肿瘤效果。

图3 mAbHLA-G/MTX/PLGA NBs的结构以及其增强HIFU消融并联合化疗
3.2HIFU消融与放疗相结合 单纯HIFU消融容易残留肿瘤细胞,联合化疗之后,在一定程度上起到了互补的作用。但HIFU消融后,肿瘤局部发生凝固性坏死,肿瘤血管闭塞,阻碍化疗药物向肿瘤细胞渗透,在一定程度上限制了HIFU消融与化疗的联合作用。Yao等[18]将具有高生物相容性的PLGA与具有放疗增敏作用的Bi2S3相结合,制备了一种PLGA- Bi2S3纳米颗粒。该颗粒粒径大小约754 nm,体外和体内超声成像实验验证了该颗粒具有良好的超声成像增强性能。体内HIFU消融实验表明,经尾静脉注射PLGA- Bi2S3后进行HIFU辐照,肿瘤凝固坏死体积是单纯HIFU组的9倍,而采用瘤内注射时,实验组消融体积是单纯HIFU组的350倍。在体内放疗增敏实验中,小鼠经尾静脉给予不同浓度的PLGABi2S3颗粒,在辐照剂量为6 Gy时,放疗后的相对肿瘤体积(V/ V0)随着浓度的升高而呈递减趋势。因此,该纳米颗粒同时具备HIFU消融增敏和放疗增敏的双重功效。
4 结论与展望
HIFU消融治疗肿瘤,因其无创性和毒副作用小,已在临床广泛应用,具有良好的临床价值和应用前景。随着纳米技术的进步,实现了兼具HIFU增敏功能和超声/MRI造影功能的纳米材料突破,对肿瘤的精确定位和增敏治疗具有重要意义[19];HIFU触发的纳米载体靶向药物/基因递送,也成为纳米医疗领域的研究热点[20];HIFU消融与靶向化疗、放疗等其他肿瘤治疗方法相结合,可以弥补彼此的缺陷,成为有效的综合治疗方案。然而,纳米颗粒在向临床转化的过程中,仍面临着一系列如生物安全性等问题[21]。
随着纳米医疗技术的发展,未来HIFU在生物医学领域的应用将蓬勃发展。HIFU增敏剂可以实现超声、MRI、荧光、光声、近红外等多模态成像,提高治疗精准度;HIFU联合超声微泡,打开生物膜屏障如血-脑屏障,促进纳米颗粒的药物递送与基因转染;HIFU消融作为肿瘤综合治疗方案中的一种疗法,与其他疗法优势互补,将具有广阔而深远的应用前景。
[1]Al-Bataineh O,Jenne J,Huber P.Clinical and future applications of high intensity focused ultrasound in cancer.Cancer Treat Rev,2012,38(5):346-353.
[2]赵银珠,熊屏,陈亚珠.高强度聚焦超声联合药物靶向输送在局部肿瘤治疗中的研究进展.中国医学影像学杂志,2014,22(9):708-710.
[3]Niu D,Wang X,Li Y,et al.Facile synthesis of magnetite/ perfluorocarbon co-loaded organic/inorganic hybrid vesicles for dual-modality ultrasound/magnetic resonance imaging and imaging-guided high-intensity focused ultrasound ablation.Adv Mater,2013,25(19):2686-2692.
[4]Huang CW,Sun MK,Chen BT,et al.Simulation of thermal ablation by high-intensity focused ultrasound with temperaturedependent properties.Ultrason Sonochem,2015,27:456-465.
[5]Phenix CP,Togtema M,Pichardo S,et al.High intensity focused ultrasound technology,its scope and applications in therapy and drug delivery.J Pharm Sci,2014,17(1):136-153.
[6]Wang X,Chen H,Chen Y,et al.Perfluorohexane-encapsulated mesoporous silica nanocapsules as enhancement agents for highly efficient high intensity focused ultrasound (HIFU).Adv Mater,2012,24(6):785-791.
[7]陈莉.HIFU联合超声微泡造影剂治疗肿瘤的研究进展.中国医学影像学杂志,2011,19(2):158-160.
[8]Sun Y,Zheng Y,Li P,et al.Evaluation of superparamagnetic Ironoxide-polymer composite microcapsules for magnetic resonanceguided high-intensity focused ultrasound cancer surgery.BMC Cancer,2014,14(1):1-11.
[9]Chen Y,Chen H,Sun Y,et al.Multifunctional mesoporous composite nanocapsules for highly efficient MRI-guided highintensity focused ultrasound cancer surgery.Angew Chem Int Ed Engl,2011,50(52):12505-12509.
[10]Sun Y,Zheng Y,Ran H,et al.Superparamagnetic PLGA-iron oxide microcapsules for dual-modality US/MR imaging and high intensity focused US breast cancer ablation.Biomaterials,2012,33(24):5854-5864.
[11]Zhou Y,Wang Z,Chen Y,et al.Microbubbles from gas-generating perfluorohexane nanoemulsions for targeted temperature-sensitive ultrasonography and synergistic HIFU ablation of tumors.Adv Mater,2013,25(30):4123-4130.
[12]Hectors SJ,Jacobs I,Moonen CT,et al.MRI methods for the evaluation of high intensity focused ultrasound tumor treatment:current status and future needs.Magn Reson Med,2016,75(1):302-317.
[13]Gasselhuber A,Dreher MR,Partanen A,et al.Targeted drug delivery by high intensity focused ultrasound mediated hyperthermia combined with temperature-sensitive liposomes:computational modelling and preliminary in vivovalidation.Int J Hyperthermia,2012,28(4):337-348.
[14]Park SM,Kim MS,Park SJ,et al.Novel temperature-triggered liposome with high stability:formulation,in vitro evaluation,and in vivo study combined with high-intensity focused ultrasound(HIFU).J Control Release,2013,170(3):373-379.
[15]Liang X,Gao J,Jiang L,et al.Nanohybrid liposomal cerasomes with good physiological stability and rapid temperature responsiveness for high intensity focused ultrasound triggered local chemotherapy of cancer.ACS Nano,2015,9(2):1280-1293.
[16]Li J,Krupka T,Yao J,et al.Liquid-solid phase-inversion PLGA implant for the treatment of residual tumor tissue after HIFU ablation.PLoS One,2015,10(2):e0117358.
[17]Zhang X,Zheng Y,Wang Z,et al.Methotrexate-loaded PLGA nanobubbles for ultrasound imaging and synergistic targeted therapy of residual tumor during HIFU ablation.Biomaterials,2014,35(19):5148-5161.
[18]Yao MH,Ma M,Chen Y,et al.Multifunctional Bi2S3/PLGA nanocapsule for combined HIFU/radiation therapy.Biomaterials,2014,35(28):8197-8205.
[19]Chen Y,Chen H,Shi J.Nanobiotechnology promotes noninvasive high-intensity focused ultrasound cancer surgery.Adv Healthc Mater,2015,4(1):158-165.
[20]Grüll H,Langereis S.Hyperthermia-triggered drug delivery from temperature-sensitive liposomes using MRI-guided high intensity focused ultrasound.J Control Release,2012,161(2):317-327.
[21]施剑林,陈雨,陈航榕.多功能介孔氧化硅基纳米诊疗剂的研究进展.无机材料学报,2013,28 (1):1-11.
(本文编缉 冯 婕)
R445.1;R730.59
10.3969/j.issn.1005-5185.2016.05.020
国家自然科学基金项目(81371563);全军医学科研“十二五”计划课题(CWS12J076);广东省科技计划项目(2011B080701019,2012B031800309,2014A020212255)。
1.第二军医大学 上海 200433;2.中国科学院深圳先进技术研究院生物医学与健康工程研究所保罗.C.劳特伯生物医学成像研究中心 广东深圳 518055;3.广州军区广州总医院超声科 广东广州 510010
李叶阔 E-mail:yekuoli@163.com
2015-12-07
2016-03-24

