子宫内膜间质肉瘤的MRI表现
刘雪芬李海明张国福强金伟刘 佳郭 燕
子宫内膜间质肉瘤的MRI表现
刘雪芬1李海明2,3张国福1强金伟2刘 佳1郭 燕4
肉瘤,子宫内膜间质;磁共振成像;扩散加权成像;病理学,外科
子宫内膜间质肉瘤(endometrial stromal sarcoma,ESS)是一种罕见的恶性肿瘤,仅占所有子宫恶性肿瘤的0.2%,占子宫肉瘤的10%以下[1],术前诊断准确率非常低,通常被误诊为子宫肌瘤。虽然国内外已有小样本和个案ESS的影像学研究[2-3],但研究结果并不一致,尤其是常规MRI结合扩散加权成像(DWI)的研究较少见,故其MRI表现有待进一步深入研究。本文对6例ESS的临床资料、常规MRI和DWI征象进行分析,旨在提高对ESS的认识和术前诊断准确性,正确指导手术方案的制订。
1 资料与方法
1.1研究对象 回顾性分析2011年4月—2014年12月复旦大学附属妇产科医院和江苏省南通市肿瘤医院有完整MRI资料、并经手术和病理证实为ESS的6例患者,年龄21~60岁,平均(37.7±14.9)岁。患者临床资料见表1,疾病分期根据国际妇产科联盟(International Federation of Gynecology and Obstetrics,FIGO)子宫平滑肌肉瘤和ESS 临床分期标准[4]。实验室检查:2例CA125轻度升高,4例肿瘤指标均正常。所有患者术前均行常规MRI平扫与增强扫描,5例行DWI扫描。

表1 6例ESS患者的临床表现、手术方式和手术分期
1.2仪器与方法 采用Siemens 1.5 T MR超导扫描仪(Avanto/ Espree,Siemens,Erlangen,Germany),相控阵体线圈。患者仰卧,自由呼吸,先行常规MRI平扫。扫描参数:矢状位T2WI抑脂,TR 4000ms,TE 83ms;横断位T1WI,TR 761ms,TE 10ms;横断位T2WI抑脂,TR 8000ms,TE 83ms;冠状位T2WI,TR 4000ms,TE 98ms;视野(300~380)mm×(320~400)mm;横轴位T1WI脂肪抑制,TR 4.89ms,TE 2.38ms;矩阵256×256或320×320;层厚4.0~8.0mm,层距1.2~1.5mm;激励次数4。增强扫描为横断位、矢状位T1WI抑脂序列,对比剂采用钆喷替酸葡甲胺,剂量0.2mmol/kg,注射速度2~3ml/s,扫描参数同平扫。DWI采用单次激发平面回波成像序列行横断面扫描:TR 3200ms,TE 83ms,b值取0和1000s/mm2,层厚5mm,层距1.2mm,矩阵320×256,视野238mm×280mm,激励次数4,扫描时间1min 24s。
1.3图像分析 由2名具有5年以上MRI工作经验的住院医师分别对图像进行分析,意见不一致时讨论达成一致。评价内容包括:①肿瘤的部位、大小、形态和边界。②肿块囊实性:囊性为主/囊实性/实性。③常规MRI信号强度:参照邻近子宫肌层分为低、等及高信号。④DWI和表观扩散系数(ADC)图上病灶的信号强度参照盆壁肌肉、小肠及髂血管将肿瘤信号强度分3个等级:低信号为信号介于盆壁肌肉与小肠之间,等信号为信号与小肠相当,高信号为信号近似于或强于髂血管。⑤增强程度:参照子宫外肌层分为轻度、中度或明显强化。⑥ADC值:参考常规图像上信号均匀的实性区,在ADC图上测量3个不同区域的ADC值,取平均值。
1.4手术与病理检查 6例患者手术方式见表1。大体观察肿瘤部位、大小、形态及质地。镜下观察肿瘤细胞核非典型性和多形性、核分裂象,是否存在螺旋样小动脉结构,是否伴出血、坏死及其他变性,是否伴宫旁浸润等特征。
2 结果
2.1MRI表现 ESS的MRI表现见表2。肿块位于子宫腔或子宫颈管内3例,3例位于肌层内。肿块最大径3.2~9.6cm,平均(6.3±1.7)cm。病灶呈卵圆形3例,形态不规则3例,2例肿块边界清晰,4例不清晰。6例肿块均呈实性,4例低级别ESS病灶内未见明显出血、坏死及囊变(图1、2),2例高级别ESS病灶内均伴有各种变性,1例合并广泛坏死、出血及钙化,另1例伴广泛黏液样变和出血,并可见纤维和平滑肌成分(图3)。T1WI上,肿块多呈等或等低信号,T2WI上,4例肿块呈不均匀高信号伴条状低信号(图1、3),1例呈均匀高信号(图2),另1例呈混杂信号伴其内蜂窝状流空血管影。增强扫描后,3例低级别ESS病灶实性区均表现为动脉期显著强化、延迟期持续均匀强化(图1、2),1例低级别ESS表现为蜂窝状强化;1例高级别ESS表现为肿瘤根蒂部显著强化(图3),另1例高级别ESS肿瘤内部分隔样强化。6例患者均见盆腔少量积液。4例肿块DWI图像上呈高信号、ADC图呈低信号(图1、2),1例肿块呈DWI及ADC图等信号,DWI结合T2WI有助于显示肿瘤的边界。
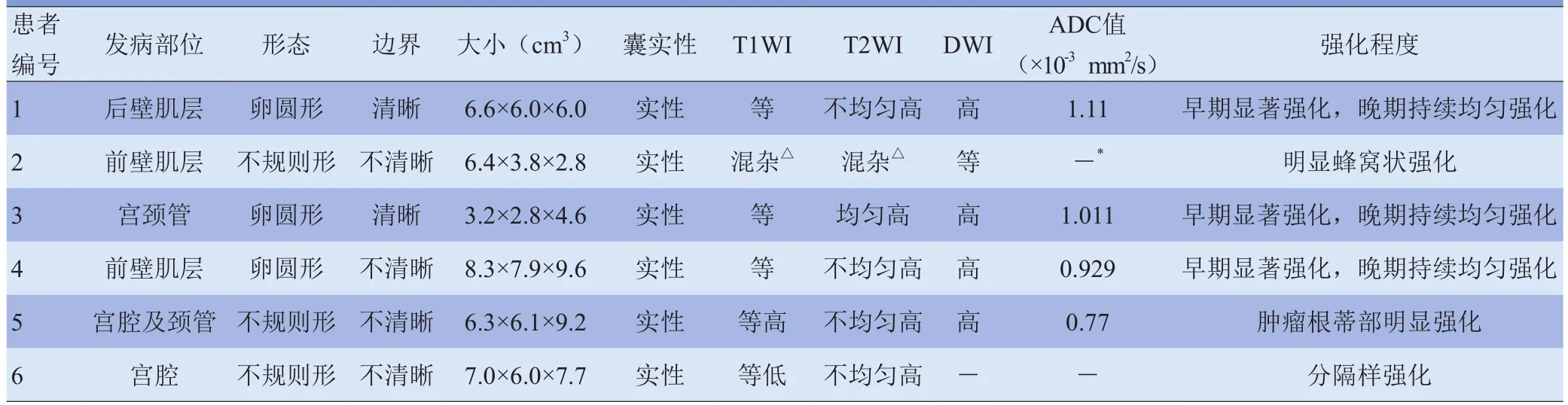
表2 6例ESS患者的MRI表现

图1 女,21岁,低级别ESS,局部伴性索样分化,浸润子宫深肌层达浆膜面,临床I期。横轴位T2WI脂肪抑制序列示子宫后壁肌层内见类圆形实性肿块(箭),呈不均匀高信号,子宫腔内积液(箭头,A);DWI示肿块呈高信号,局部浸润达子宫浆膜面下(箭,B);横轴位T1WI脂肪抑制增强动脉期示肿块明显不均匀强化(星号,C);横轴位T1WI脂肪抑制增强延迟期示肿块持续、均匀强化(星号,D)
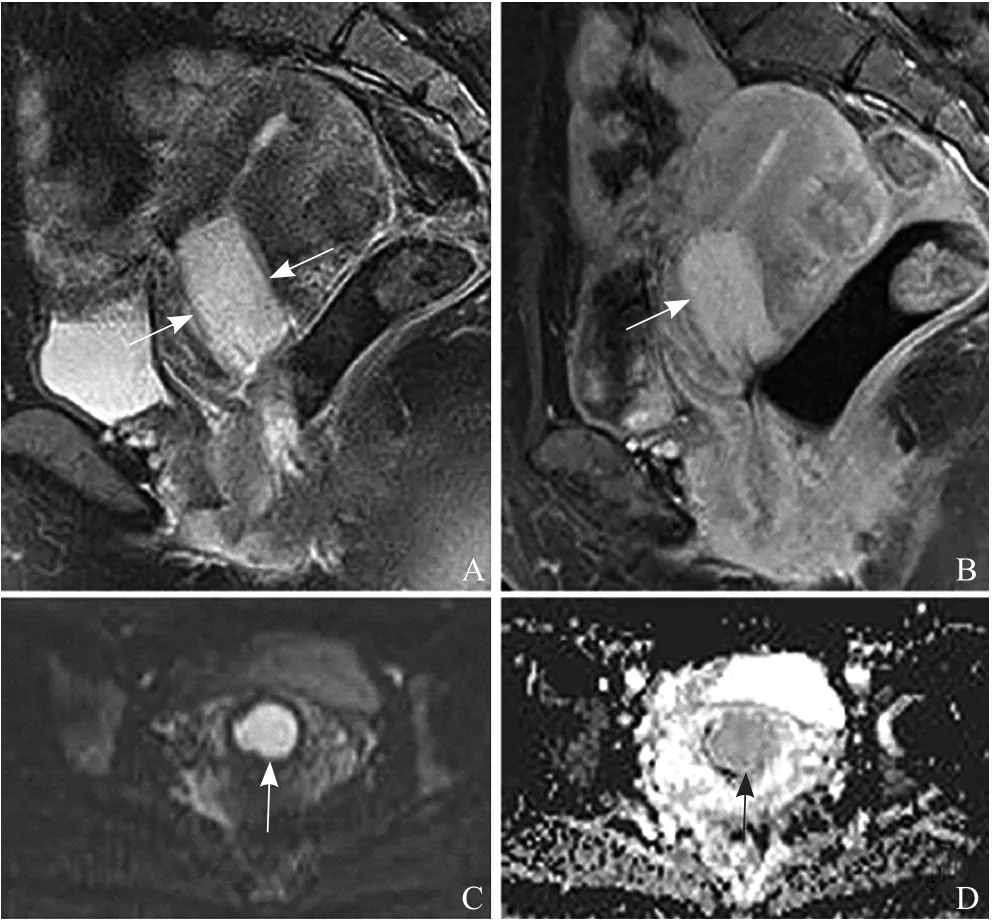
图2 女,42岁,子宫体下段及颈管低级别ESS,侵犯宫颈管浅纤维肌层,临床I期。矢状位T2WI脂肪抑制序列示子宫体下段及颈管内见卵圆形实性肿块(箭),呈均匀高信号(A);矢状位T2WI脂肪抑制增强示肿块呈明显、均匀强化(箭,B);DWI和ADC图分别示肿块呈高信号(箭,C)、低信号(箭,D)
2.2病理表现 大体标本见肿瘤均呈实性,位于宫腔或肌壁间,呈卵圆形或不规则形。切面呈灰白或灰黄色,肿瘤境界多不清楚。4例低级别ESS肿瘤细胞形态与正常子宫内膜间质细胞相似,细胞核相对一致,无明显核异型,核分裂象少见,常见肿瘤细胞围绕螺旋小动脉呈旋涡状生长;2例高级别ESS肿瘤细胞有明显的多形性及核异型性,缺乏典型的生长方式,其中1例伴平滑肌分化及黏液变性。
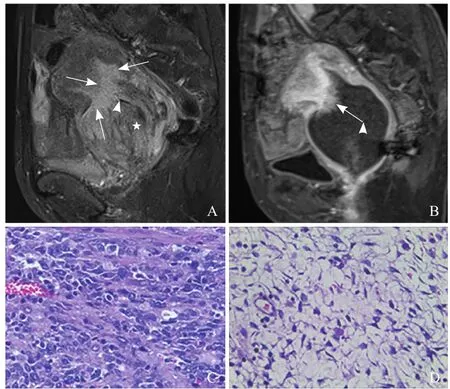
图3 女,60岁,高级别ESS,部分伴平滑肌分化,侵犯浅肌层。矢状位T2WI脂肪抑制序列示子宫体及颈管区内见不规则形实性肿块,呈不均匀高信号内见弧形低信号(箭头),可见肿瘤根蒂部的高信号区(箭)和广泛的稍高信号区伴条状低信号区(星号,A);矢状位T2WI脂肪抑制增强序列示肿瘤根蒂部软组织显著强化(箭),余区域未见明显强化(箭头),提示瘤内黏液样变性(B);病理镜下可见明显的细胞非典型性(HE,×200,C)及肿瘤内广泛的黏液样变性(HE,×200,D)
3 讨论
3.1发病机制及临床、病理特征 ESS起自子宫内膜间质细胞,多好发于子宫体部,少数可发生于子宫外,如卵巢和腹膜等。本组6例均发生于子宫体或子宫颈部。ESS多发生在较年轻的妇女,平均发病年龄42~58岁[5],本组平均发病年龄38岁,其中3例<30岁。ESS的临床表现无明显特异性,最常见的症状为阴道不规则出血,无症状性子宫增大、下腹痛及盆腔包块也较常见,发现时多为临床早期病变,5年生存率可达89.3%,而晚期生存率则下降至50.3%[6]。本组5例临床I期,1例临床III期。ESS术前常被误诊为子宫肌瘤而行肌瘤剥除术,造成不必要的二次手术,因此术前影像学的正确诊断有助于制订治疗方案。
子宫内膜间质肿瘤分为子宫内膜间质结节、低级别ESS、高级别ESS、未分化子宫肉瘤4类[1]。低级别ESS为惰性肿瘤、具有特征性的丛状血管(螺旋动脉)的特征,镜下细胞的非典型性较轻且核分裂象少见。高级别ESS为高度侵袭性的肿瘤,常缺乏丛状血管,具有明显的细胞异型性和非典型的核分裂。
3.2MRI表现 ESS的特征性MRI表现为:①多数ESS发生于宫腔内,少数发生于肌壁间或宫腔外,本组3例发生于肌壁间,3例发生于宫腔内或宫颈管内,与刘静静等[7]的报道不符,其原因可能为前者主要来源于子宫肌层内具有分化潜能的原始子宫间叶细胞,后者主要来源于成熟的子宫内膜间质。②肿块体积较大,直径多>5.0cm。本组5例肿块最大径>5.0cm,肿瘤边界多不清晰,MRI多平面、多序列成像有助于显示肿瘤浸润子宫肌层的深度与范围。③肿块可以呈实性、囊实性或囊性为主型,张洁等[8]研究发现7例ESS均伴有囊变、坏死;Rha等[9]发现低级别ESS常表现为宫腔或肌层肿块伴囊变;Ueda等[3]研究发现低级别ESS少伴囊变、出血及坏死,而高级别ESS易出现这种变性改变。本研究结果与文献[3]一致,本组4例低级别ESS均表现为实性肿块,未见明显坏死、囊变区,1例高级别ESS表现为肿瘤根蒂部少许实性组织伴肿瘤内部大片黏液变性及出血,另1例高级别ESS表现为肿瘤内部大片坏死、出血及钙化。④T1WI上,肿块常呈等或等低信号,合并出血时可伴高信号;T2WI上,肿块多呈不均匀高信号,4例病灶内可见弧形低信号,与组织病理学上肿瘤内部可见纤维、钙化及平滑肌成分相对应,1例肿瘤内伴蜂窝状血管影,对应病理学上肿瘤细胞围绕小血管呈螺旋状排列,1例表现为均匀高信号,可能与肿瘤体积较小有关。⑤Gd-DTPA动态增强扫描表现为富血供肿瘤强化特征,与文献[7]报道相符。3例低级别ESS病灶动脉期明显强化,强化程度高于邻近子宫外肌层,静脉期及延迟期病灶持续强化,且强化逐渐趋于均匀,本课题组认为出现这种强化方式可提示ESS诊断;1例低级别ESS表现为蜂窝状明显强化;2例高级别ESS由于肿瘤内部合并坏死、出血、钙化和黏液变性等改变,表现为明显不均匀强化,其中1例为分隔样强化,1例为肿瘤根蒂部软组织明显强化。⑥Ueda等[3]认为ESS病灶常呈蚯蚓状沿血管、淋巴管和阔韧带蔓延生长,但本组中未见到此征象。
近年来,DWI在妇科肿瘤的应用已有较多研究,并显示了良好的应用价值[10]。但ESS的DWI研究仅见个案或小样本报道[11-12]。本组4例病灶显示DWI高信号、ADC图低信号,结合T2WI能更准确地判断肿瘤的边界,提高肿瘤分期的准确性;1例由于病灶内伴大量蜂窝状血管影,DWI图像上呈与子宫肌层相仿的信号强度,未显示肿瘤边界,这与大体病理上肿瘤呈一堆破碎样组织相对应,组织较疏松,水分子容易扩散,因此DWI上无明显受限。由于术前ESS常被误诊为子宫肌瘤变性,既往研究[11]发现量化的ADC值有助于鉴别子宫肉瘤和退变型平滑肌瘤,显示子宫肉瘤的ADC值显著低于退变型子宫肌瘤。本组4例ESS的平均ADC值约为(0.955±0.144)×10-3mm2/s,文献报道的两个不同研究的子宫肉瘤ADC值分别为(1.17±0.15)×10-3mm2/s(b=500s/mm2)和(0.83 ±0.21)×10-3mm2/s(b=800s/mm2)[8,11],上述ADC值差异还有待大样本及采用同一设备和技术参数进一步验证。
3.3鉴别诊断 ESS需与退变型子宫肌瘤、子宫腺肌症、子宫内膜癌、平滑肌肉瘤及静脉内平滑肌瘤病相鉴别[9]。①退变型子宫肌瘤:子宫肌瘤伴变性时可具有与ESS相同的形态学征象,结合DWI有助于与ESS相鉴别[11]。②子宫腺肌症:子宫结合带增宽,厚度>12mm,T2WI上显示低信号的病灶
内见散在斑点状高信号,与周围肌层分界不清,增强扫描后不均匀强化,而ESS常表现为T2WI上不均匀高信号。③子宫内膜癌:病灶位于子宫内膜,直径常较小,增强扫描后强化程度低于子宫肌层,易与ESS相鉴别[3]。④平滑肌肉瘤:常表现为子宫内较大的不规则形肿块,合并广泛出血和坏死,边界不清,T1WI上肿瘤内常可见高信号出血区,T2WI上肿块实性区呈稍高信号,增强扫描后不均匀强化[13]。⑤静脉内平滑肌瘤病:肿瘤常沿静脉呈蚯蚓状生长,可延伸至阔韧带及宫旁,与ESS鉴别困难。
总之,ESS常表现为宫腔或肌层内较大肿块,低级别ESS常呈实性肿块且不伴明显囊变、坏死及出血,高级别ESS则易发生坏死、出血和其他变性等改变,T2WI上肿块呈不均匀高信号,DWI亦呈高信号,Gd-DTPA增强扫描后显示富血供强化。常规MRI结合DWI有助于ESS的诊断与鉴别诊断。
[1]Ali RH,Rouzbahman M.Endometrial stromal tumours revisited:an update based on the 2014 WHO classification.J Clin Pathol,2015,68(5):325-332.
[2]Koyama T,Togashi K,Konishi I,et al.MR imaging of endometrial stromal sarcomal:correlation with pathologic findings.Am J Roentgenol,1999,173(3):767-772.
[3]Ueda M,Otsuka M,Hatakenaka M,et al.MR imaging findings of uterine endometrial stromal sarcoma:differentiation from endometrial carcinoma.Eur Radiol,2001,11(1):28-33.
[4]D'Angelo E,Prat J.Uterine sarcomas:a review.Gynecol Oncol,2010,116(1):131-139.
[5]Puliyath G,Nair MK.Endometrial stromal sarcoma:a review of the literature.India J Med Paediatr Oncol,2012,33(1):1-6.
[6]Wu TI,Yen TC,Lai CH.Clinical presentation and diagnosis of uterine sarcoma,including imaging.Best Pract Res Clin Obstet Gynaecol,2011,25(6):681-689.
[7]刘静静,王劲,何炳均,等.子宫内膜间质肉瘤的MRI表现(附2例报告及文献回顾).罕少疾病杂志,2010,17(2):31-35.
[8]张洁,薛华丹,金征宇.弥扩散加权成像对子宫肉瘤及良性肌瘤的鉴别诊断.实用放射学杂志,2013,29(11):1790-1793,1802.
[9]Rha SE,Byun JY,Jung SE,et al.CT and MRI of uterine sarcomas and their mimickers.Am J Roentgenol,2003,181(5):1369-1374.
[10]Whittaker CS,Coady A,Culver L,et al.Diffusion-weighted MR imaging of female pelvic tumors:a pictorial review.Radiographics,2009,29(3):759-774.
[11]Tamai K,Koyama T,Saga T,et al.The utility of diffusionweighted MR imaging for differentiating uterine sarcomas from benign leiomyomas.Eur Radiol,2008,18(4):723-730.
[12]Fujii S,Kaneda S,Tsukamoto K,et al.Diffusion-weighted imaging of uterine endometrial stromal sarcoma:a report of 2 cases.J Comput Assist Tomogr,2010,34(3):377-379.
[13]Tirumani SH,Ojili V,Shanbhogue AK,et al.Current concepts in the imaging of uterine sarcoma.Abdom Imaging,2013,38(2):397-411.
(本文编辑 冯 婕)
R445.2;R73
10.3969/j.issn.1005-5185.2016.05.017
1.复旦大学附属妇产科医院放射科 上海 200090;2.复旦大学附属金山医院放射科 上海 201508;3.江苏省南通市肿瘤医院放射科 江苏南通 226361;4.江苏省南通市肿瘤医院病理科 江苏南通 226361
李海明 E-mail:lihaiming0109@163.com
2015-12-29
2016-03-14

