氯虫苯甲酰胺在大豆和土壤中的残留及降解行为
陈国峰,刘 峰,张晓波,廖 辉,陶 波(.东北50030;.黑龙江省农业科学院农产品质量安全研究所暨农业部农产品质量安全风险评估实验站(哈尔滨),哈尔滨50086)
氯虫苯甲酰胺在大豆和土壤中的残留及降解行为
陈国峰1,2,刘峰2,张晓波2,廖辉2,陶波1
(1.东北150030;2.黑龙江省农业科学院农产品质量安全研究所暨农业部农产品质量安全风险评估实验站(哈尔滨),哈尔滨150086)
摘要:建立了毛豆、植株和土壤中的氯虫苯甲酰胺的残留分析方法,并采用田间试验方法研究了氯虫苯甲酰胺在大豆植株和土壤中的消解动态及其在毛豆和土壤中的残留规律。样品用乙腈水溶液匀浆提取,经氨基固相萃取小柱净化,液相色谱-串联质谱测定,结果表明:氯虫苯甲酰胺在毛豆、大豆植株和土壤中的平均回收率为99.8%~107.6%,变异系数在1.7%~7.2%之间;最低检测浓度为0.05 mg·kg-1,最小检出量为2.5×10-10g。田间残留试验表明,氯虫苯甲酰胺在大豆植株和土壤中的残留消解动态规律均符合一级动力学反应模型,半衰期分别为4.3~10.1 d和3.1~10.2 d;以195.7 g·hm-2和293.6 g·hm-2剂量,最多施药3次,距最后一次施药3 d,氯虫苯甲酰胺在毛豆和土壤中的最高残留量分别为0.923、0.757 mg·kg-1,低于日本和澳大利亚规定氯虫苯甲酰胺在毛豆中最大残留限量1 mg·kg-1。综上建议200 g·L-1氯虫苯甲酰胺悬浮剂用于大豆防治豆荚螟时,最多施用3次,用量为195.7~293.6 g·hm-2(36~54 g ai·hm-2),安全间隔期为3 d。
关键词:氯虫苯甲酰胺;大豆;消解;残留
陈国峰,刘峰,张晓波,等.氯虫苯甲酰胺在大豆和土壤中的残留及降解行为[J].农业环境科学学报, 2016, 35(5):894-900.
CHEN Guo-feng, LIU Feng, ZHANG Xiao-bo, et al. Residue analysis and degradation dynamics of chlorantraniliprole in soybean and soil[J]. Journal of Agro-Environment Science, 2016, 35(5): 894-900.
近年来,由于高毒有机磷的禁用,一批低毒、高效的杀虫剂在我国登记并取代了有机磷的地位[1],其中氯虫苯甲酰胺(Chlorantraniliprole)便是由美国杜邦(DuPont)公司开发的一种高效、低毒、作用机制独特的新型邻甲酰氨基苯甲酰胺类杀虫剂[2-7]。因此,开展农药田间试验,研究其在大豆和土壤中残留和消解趋势对保护环境和安全用药具有十分重要的意义。氯虫苯甲酰胺化学名为3-溴-N-{4-氯-2-甲基-6-[(甲氨基)羰基]苯基}-1-(3-氯-2-吡啶基)-1H-吡唑-5-酰胺,属广谱杀虫剂,对危害水稻、果树、蔬菜等作物的大部分鳞翅目、鞘翅目害虫具有快速、长效、广谱的防治作用[2-13]。目前,国内外已报道了氯虫苯甲酰胺的检测方法[7,14-15],对稻纵卷叶螟、甜菜夜蛾等的药效研究[16-21],以及其在水稻、甘蓝、番茄等作物上的残留研究[9,22-24]。但对氯虫苯甲酰胺在大豆中的残留检测方法以及残留和消解动态在国内外均未见报道。目前,我国尚未开展氯虫苯甲酰胺在大豆上防治豆荚螟的登记工作,以及其在毛豆上MRL(最高残留限量)值的制定工作。为了提供氯虫苯甲酰胺在大豆上安全使用的技术支持和制定氯虫苯甲酰胺在毛豆上的MRL值,建立分析其在毛豆、大豆植株和土壤中残留的有效方法以及开展其在大豆田中残留模拟试验十分必要。本研究采用乙腈提取和固相萃取净化的液相色谱-串联质谱的检测技术,研究了新型杀虫剂氯虫苯甲酰胺在大豆和土壤中的残留降解动态和最终残留,以期为氯虫苯甲酰胺在大豆地的合理使用以及我国毛豆中氯虫苯甲酰胺的MRL值制定提供科学依据。
1 材料与方法
1.1仪器设备
Waters TQD型高效液相色谱三重四极杆质谱串联仪(LC-MS/MS,美国Waters公司);色谱柱Acquity UPLCRBEH C18(100 mm×2.1 mm,1.7 μm);氨基固相萃取小柱(1 g·6 mL-1);电子天平Sartorius;匀浆机IKA T18;旋转蒸发仪;过滤器(滤膜孔径约0.22 μm);常用玻璃器皿。
1.2试剂
氯虫苯甲酰胺标准品(99.5%,Dr. Ehrenstorfer公司提供);乙腈、二氯甲烷、NaCl均为分析纯;甲醇、乙酸铵均为色谱纯;去离子水(过0.22 μm滤膜)。
1.3田间试验
1.3.1200 g·L-1氯虫苯甲酰胺悬浮剂在大豆和土壤中的消解动态试验
在供试的大豆田中,设3个重复小区,每小区面积30 m2,小区间设立保护行。施药时间为大豆生长到成熟个体一半大小时施药,施药时应保证用于动态试验的大豆均匀着药。施药剂量为制剂量30 g·hm-2(150 g ai·hm-2),施药后2 h和1、2、3、5、7、10、14、21、 28、45 d采样,处理重复3次,处理间设保护隔离区,另设空白对照。随机采样,将大豆动态全株样本切碎、充分混匀后用四分法缩分样品,分取两份200 g的样品,分别装入封口样品容器中,粘好标签,于-20℃冰柜中保存。小区边行和每行距离两端0.5 m内不采样。
1.3.2200 g·L-1氯虫苯甲酰胺悬浮剂在毛豆和土壤中的最终残留试验
根据田间设计方案设两个施药剂量,分别为低剂量制剂量195.7 g·hm-2(36 g ai·hm-2)和高剂量制剂量293.6 g·hm-2(54 g ai·hm-2)施药,各设2次施药和3次施药两个处理,每个处理3次重复。小区面积30 m2,按照试验设计时间开始第1次施药,施药间隔期7 d。采样时间距离最后一次施药的间隔时间分别为1、3、5、7 d。另设空白对照,处理间设保护带。每小区随机采集毛豆2 kg和土壤2 kg,经混匀缩分后各留样毛豆(带荚)200 g和土壤200 g。所有样品用塑料袋封装、编号,于-20℃以下冰柜低温保存待测。
1.3.3试验地点及土壤类型
氯虫苯甲酰胺在毛豆上的残留试验分别在哈尔滨、石家庄和楚雄进行。试验期间哈尔滨月平均温度在14~25℃之间,降水量为410 mm,试验地土壤类型为黑土,pH6.41,有机质含量为3.23%;石家庄月平均气温在19~30℃之间,降水量为393 mm,土壤类型属于石灰性褐土,pH 7.6,有机质含量1.3%;楚雄月平均气温在16~24℃之间,降水量为617 mm,试验地土壤类型为红壤,pH8.1,有机质含量4.0%。
1.4分析方法
1.4.1前处理
称取毛豆、植株、土壤样品25.0 g于250 mL烧杯中,加入乙腈:水(1:1,V/V)100 mL,高速匀浆2 min,过滤;滤液全部转移至含5 g NaCl的100 mL具塞量筒中,振摇5 min后静置30 min,取上清液10 mL旋转浓缩至干,加入甲醇:二氯甲烷(5:95,V/V)待净化;用甲醇:二氯甲烷(5:95,V/V)5 mL预淋氨基固相萃取柱,将待净化液6 mL(分三次)转入柱中洗脱并收集,于氮吹仪浓缩近干,用5 mL甲醇定容,经0.22 μm微膜过滤,待测。
1.4.2仪器条件
上述色谱操作条件系典型操作参数,为获得最佳效果,实际操作中根据仪器特点对给定操作参数作适当调整。
1.4.3标准工作曲线的绘制
称取氯虫苯甲酰胺标准品0.010 0 g(精确至0.000 1 g),甲醇溶解并配制成1000mg·L-1的标准贮备液,试验时再用甲醇逐级稀释成氯虫苯甲酰胺质量浓度分别为0.05、0.10、0.20、0.50、1.00 mg·L-1的标准工作溶液。在选定的仪器条件下测定,以标准工作溶液浓度为横坐标(x)、峰面积为纵坐标(y)绘制标准工作曲线。
1.4.4方法的回收率和精密度
向空白毛豆、大豆植株和土壤中(采自哈尔滨市红旗乡的未污染样品)添加氯虫苯甲酰胺标准溶液,使样品中添加浓度分别为0.05、0.10、1.00mg·kg-1,每个浓度进行5次重复试验,然后按照上述方法测定,计算回收率和相对标准偏差。色谱图见图2。
2 结果与讨论
2.1方法的准确度、精密度和灵敏度
分别用甲醇配制不同浓度的氯虫苯甲酰胺标准溶液0.05、0.10、0.20、0.50、1.00 mg·L-1,在上述检测条件下测定,线性回归方程为y=12 042x+115.63,相关系数r=0.999 3。
表1为氯虫苯甲酰胺在毛豆、大豆植株和土壤中的添加回收率。对于3种样品的3个添加浓度5个平行样本,氯虫苯甲酰胺在毛豆、大豆植株和土壤中的添加平均回收率分别为102.0%~107.6%、102.4%~106.8%和99.8%~106.8%;变异系数分别为2.9%~7.2%、1.7%~6.4%和2.1%~3.7%,能够满足氯虫苯甲酰胺在毛豆、大豆植株和土壤中残留测定要求。试验得出氯虫苯甲酰胺的最小检出量为2.5×10-10g,该方法在毛豆、大豆植株和土壤中的最低检出浓度均为0.05 mg·kg-1。
2.2氯虫苯甲酰胺在大豆植株和土壤中的消解动态
由图3和表2可见,氯虫苯甲酰胺在大豆植株和土壤中的残留量均随着时间的延长而逐渐降低,其消解过程均符合动力学一级降解模型,即Ct=C0e-k(t其中C0为施药后的原始沉积量,k为消解速率常数,t为施药后的天数,Ct为施药后经过t天的农药浓度)。氯虫苯甲酰胺在哈尔滨、石家庄和楚雄三地田间试验施药21 d后,大豆植株中氯虫苯甲酰胺的降解率分别为90.78%、73.99%和99.30%,土壤中氯虫苯甲酰胺的降解率分别为66.61%、99.08%和90.11%。氯虫苯甲酰胺在大豆植株中的半衰期为4.3~10.1 d,在土壤中的半衰期为3.1~10.2 d。这说明氯虫苯甲酰胺在大豆植株和土壤中均属于易降解农药(半衰期t1/2<30 d)。氯虫苯甲酰胺在大豆植株和土壤中的消解速率与土壤性质和试验期间的天气状况关系密切,试验期间石家庄的平均温度高于哈尔滨和楚雄,可能是导致石家庄土壤中氯虫苯甲酰胺降解速率较快的主要原因。
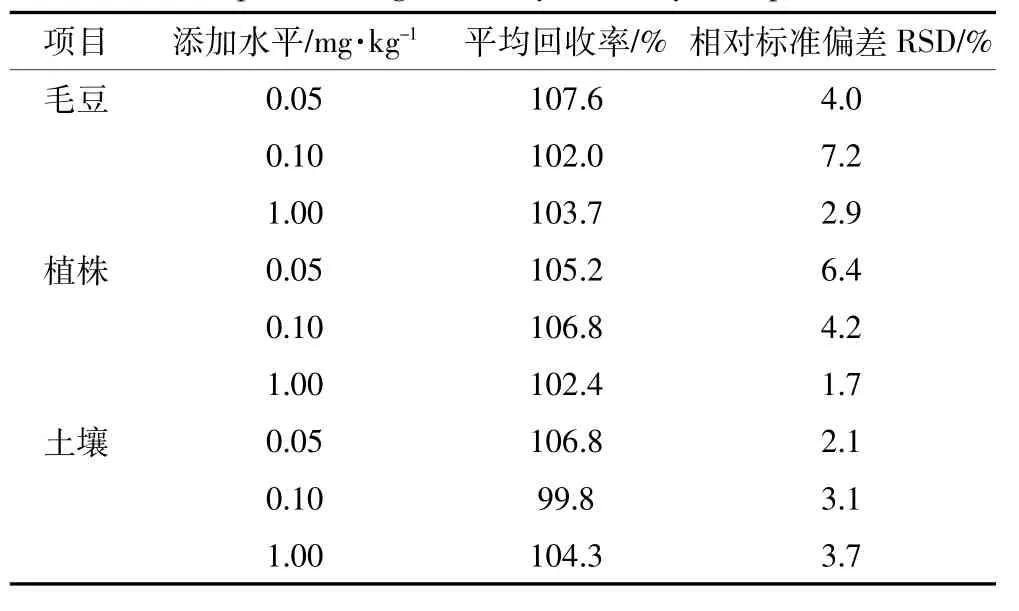
表1 氯虫苯甲酰胺在毛豆、植株和土壤中的添加回收率Table 1 Recoveries and relative standard deviations of chlorantraniliprole in vegetable soybean,soybean plant and soil
图1 氯虫苯甲酰胺标准品(0.10 mg·L-1)色谱图Figure 1 LC-MS/MS chromatography of chlorantraniliprole standard(0.10 mg·L-1)

图2 毛豆、植株和土壤样品色谱图Figure 2 LC-MS/MS chromatography of chlorantraniliprole in vegetable soybean,soybean plant and soil
2.3氯虫苯甲酰胺在毛豆和土壤中的最终残留
200g·L-1氯虫苯甲酰胺悬浮剂在大豆上的最终残留量结果见表3。在哈尔滨、石家庄和楚雄三地的最终残留量的结果基本相似,其规律为施药浓度越高,用药次数越多,距离最后一次施药时间越近,最终残留量也越高。以推荐剂量195.7g·hm-2(36 g ai·hm-2)和1.5倍推荐剂量293.6 g·hm-2(54 g ai·hm-2)在大豆上分别喷施2次和3次200 g·L-1氯虫苯甲酰胺悬浮剂后,在末次施药1、3、5、7 d后每小区随机采集毛豆和土壤样品,对样品中的氯虫苯甲酰胺按上述方法进行提取、净化和测定,结果表明:距末次施药3 d时,氯虫苯甲酰胺在毛豆中的最高残留量为0.923mg·kg-1,在土壤中的最高残留量是0.757 mg·kg-1,均低于日本和澳大利亚规定的氯虫苯甲酰胺在毛豆中的最大残留限量(1 mg·kg-1)。说明在本试验条件下,氯虫苯甲酰胺在毛豆中的残留是安全的。最终残留试验结果表明,随着施药剂量的增大以及施药次数的增多[25],毛豆和土壤中氯虫苯甲酰胺的残留量增高,并随着采收时间的推移逐渐降低。

图3 氯虫苯甲酰胺在大豆植株和土壤中的消解动态曲线Figure 3 Dynamic curves of chlorantraniliprole degradation in soybean plant and soil
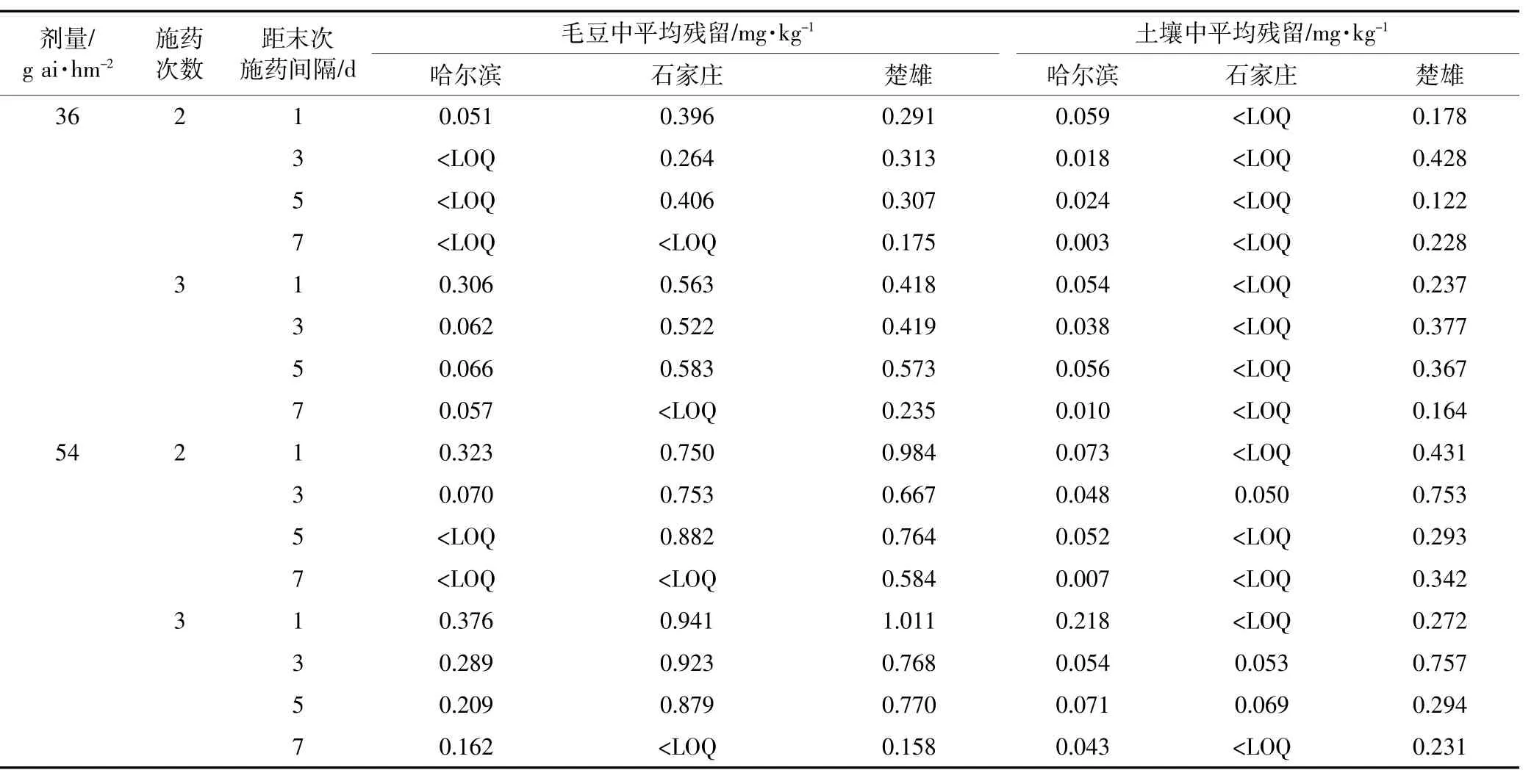
表3 氯虫苯甲酰胺在毛豆和土壤中最终残留量Table 3 Final residues of chlorantraniliprole in vegetable soybeans and soils
3 结论
(1)建立了超高效液相色谱质谱联用仪测定毛豆、大豆植株和土壤中氯虫苯甲酰胺残留量的方法,该方法操作简便,准确性和灵敏度均能满足农药残留检测的要求。
(2)氯虫苯甲酰胺在大豆植株和土壤中的残留消解半衰期分别为4.3~10.1 d和3.1~10.2 d,二者存在一定的差异,这与施药后天气条件、土壤类型及理化性质等因素有关。
(3)以推荐剂量195.7 g·hm-2(36 g ai·hm-2)和1.5倍推荐剂量293.6 g·hm-2(54 g ai·hm-2)在大豆上分别喷施2次和3次200 g·L-1氯虫苯甲酰胺悬浮剂3 d后,氯虫苯甲酰胺在毛豆中的残留是安全的。
参考文献:
[1]Xu Y, Shou L F, Wu Y L. Simultaneous determination of flonicamid and its metabolites in vegetables using QuEChERS and reverse-phase liquid chromatography-tandem mass spectrometry[J]. Journal of Chromatography A, 2011, 1218(38):6663-6666.
[2]吴群,施艳红,操海群,等.氯虫苯甲酰胺在水溶液中光解的影响因素研究[J].农业环境科学学报, 2014, 33(11):2242-2246. WU Qun, SHI Yan-hong, CAO Hai-qun, et al. Photodegradation of chlorantraniliprole in aqueous solution[J]. Journal of Agro-Environment Science, 2014, 33(11):2242-2246.
[3]王廷廷,余向阳,刘贤进,等.氯虫苯甲酰胺在5种土壤中的吸附和解吸特性[J].江苏农业学报, 2012, 28(1):204-209. WANG Ting-ting, YU Xiang-yang, LIU Xian-jin, et al. Sorption and desorption behavior of chlorantraniliprole in five typical soils of China [J]. Jiangsu Jof Agr Sci, 2012, 28(1):204-209.
[4]Saglam O, Athanassiou C G, Vassilakos T N. Comparison of spinetoram, imidacloprid, thiamethoxam and chlorantraniliprole against life stages of Tribolium confusum Jacquelin du Val(Coleoptera:Tenebrionidae)on concrete[J]. Crop Protection, 2013, 53:85-95.
[5]Albrecht M K, Eugene M F. Effect of the anthranilic diamide insecticide, chlorantraniliprole, on Heterorhabditis bacteriophora(Rhabditida:Heterorhabditidae)efficacy against white grubs(Coleoptera:Scarabaeidae)[J]. Biological Control, 2008, 45:93-102.
[6]Jose F, Isabel G, Juana C, et al. Photometabolic pathways of chlorantraniliprole in aqueous slurries containing binary and ternary oxides of Zn and Ti[J]. Chemical Engineering Journal, 2015, 264:720-727
[7]王广成,吴春先,高立明,等.氯虫苯甲酰胺悬浮剂的高效液相色谱分析[J].农药, 2009, 48(4):267-269. WANG Guang-cheng, WU Chun-xian, GAO Li-ming, et al. Analyzed chlorantraniliprole SC by HPLC[J]. Agrochemicals, 2009, 48(4):267-269.
[8]Lai T C, Li J, Su J Y. Monitoring of beet armyworm Spodoptera exigua (Lepidoptera:Noctuidae)resistance to chlorantraniliprole in China[J]. Pesticide Biochemistry and Physiology, 2011, 101(3):198-205
[9]Zhang J M, Chai W G, Wu Y L. Residues of chlorantraniliprole in rice field ecosystem[J]. Chemosphere, 2012, 87(2):132-136.
[10]王廷廷,余向阳,张超兰,等.生物质炭施用对土壤中氯虫苯甲酰胺吸附及消解行为的影响[J].环境科学, 2012, 33(4):1339-1344. WANG Ting-ting, YU Xiang-yang, ZHANG Chao-lan, et al. Impact of biochar amendment on the sorption and dissipation of chlorantraniliprole in soils[J]. Environmental Science, 2012, 33(4):1339-1344.
[11]Vesna L, Cornelis G, Darko D, et al. Chemical and photochemical degradation of chlorantraniliprole and characterization of its transformation products[J]. Chemosphere, 2014, 95:408-414.
[12]Kousik M, Ramandeep K, Sanjay K S, et al. Degradation pattern and risk assessment of chlorantraniliprole on berseem(Trifoliumalexandrinum L.)using high performance liquid chromatography[J]. Chemosphere, 2014, 112:100-104.
[13]Huang J, Wu S F,Ye G Y. Evaluation of lethal effects of chlorantraniliprole on chilosuppressalis and its larval parasitoid, cotesiachilonis[J]. Agricultural Sciences in China, 2011, 10(7):1134-1138.
[14]章虎,钱鸣蓉,李振,等.高效液相色谱-串联质谱快速测定稻米中氯虫苯甲酰胺残留[J].农药, 2010, 49(12):906-908. ZHANG Hu, QIAN Ming-rong, LI Zhen, et al. Determination of chlorantraniliprole residue in rices by HPLC-MS/MS[J]. Agrochemicals, 2010, 49(12):906-908.
[15]占绣萍,马琳,陈建波.高效液相色谱法测定蔬菜和土壤中氯虫苯甲酰胺甲氧虫酰肼的残留[J].现代农药, 2010, 9(5):47-50. ZHAN Xiu-ping, MA Lin, CHEN Jian-bo. Study on chlorantraniliprole and methoxyfenozide residue in vegetables and soil by HPLC[J]. Modern Agrochemicals, 2010, 9(5):47-50.
[16]陈琼,黄水金,秦文婧.氯虫苯甲酰胺对甜菜夜蛾的亚致死效应研究[J].江西农业大学学报, 2011, 33(4):690-695. CHEN Qiong, HUANG Shui-jin, QIN Wen-jing. Sublethal effects of chlorantraniliprole on Spodoptera exigua[J]. Acta Agriculturae Universitatis Jiangxiensis, 2011, 33(4):690-695.
[17]周超,王海娜,李秀环,等.氯虫苯甲酰胺和氟虫双酰胺对不同虫态甜菜夜蛾的毒力作用[J].植物保护学报, 2011, 38(4):344-350. ZHOU Chao, WANG Hai-na, LI Xiu-huan, et al. Comparison of the toxicity of chlorantraniliprole and flubendiamide to different developmental stages of Spodoptera exigua[J]. Acta Phytophylacica Sinica, 2011, 38(4):344-350.
[18]徐德进,顾中言,徐广春,等.雾滴密度及大小对氯虫苯甲酰胺防治稻纵卷叶螟效果的影响[J].中国农业科学, 2012, 45(4):666-674. XU De-jin, GU Zhong-yan, XU Guang-chun, et al. Effects of droplet density and droplet size on control efficiency of chlorantraniliprole against Cnaphalocrocis medinalis(Guenée)[J]. Scientia Agricultura Sinica, 2012, 45(4):666-674.
[19]邢静,梁沛,高希武.亚致死浓度氯虫苯甲酰胺对小菜蛾药剂敏感度和解毒酶活性的影响[J].农药学学报, 2011, 13(5):464-470. XING Jing, LIANG Pei, GAO Xi-wu. Effects of sublethal concentrations of chlorantraniliprole on insecticide susceptibility and detoxifying enzyme activity in Plutella xylostella[J]. Chinese Journal of Pesticide Science, 2011, 13(5):464-470.
[20]杨洪,王召金,道超.氯虫苯甲酰胺对非靶标害虫褐飞虱实验种群的亚致死效应[J].应用生态学报, 2013, 24(2):549-555.YANG Hong, WANG Zhao-jin, DAO Chao. Sublethal effect of chlorantraniliprole on the experimental population of non-target insect Nilaparvata lugens(Stål)[J]. Chinese Journal of Applied Ecology, 2013, 24(2):549-555.
[21]杨柳,赵川,胡美英,等. 25%氯虫苯甲酰胺悬浮剂对稻纵卷叶螟防治试验[J].广东农业科学, 2010, 37(4):133-135. YANG Liu, ZHAO Chuan, HU Mei-ying, et al. Efficiency evaluation of chlorobenzamideinsecticides SCagainst Cnaphalocrocis medinalis Guenee[J]. Guangdong Agricultural Sciences, 2010, 37(4):133-135.
[22]秦冬梅,秦旭,徐应明,等.土壤和番茄中氯虫苯甲酰胺的残留检测与消解动态研究[J].农业环境科学学报, 2010, 29(5):858-863. QIN Dong-mei, QIN Xu, XU Ying-ming, et al. Residue determination and degradation of chlorantraniliprole in soil and tomato[J]. Journal of Agro-Environment Science, 2010, 29(5):858-863.
[23]李瑞娟,于建垒,宋国春,等.氯虫苯甲酰胺在甘蓝和土壤中的残留及消解动态[J].生态环境学报, 2011, 20(4):663-667. LI Rui-juan, YU Jian-lei, SONG Guo-chun, et al. Residues and degradation of chlorantraniliprole in cabbage and soil[J]. Ecology and Environmental Sciences, 2011, 20(4):663-667.
[24]陈小军,王萌,范淑琴,等. QuEChERS前处理结合HPLC-MS/MS法分析氯虫苯甲酰胺在甘蓝和土壤中的残留[J].中国农业科学, 2012, 45(13):2636-2647. CHEN Xiao-jun, WANG Meng, FAN Shu-qin, et al. Degradation dynamics and residues analysis of chlorantraniliprole in cabbage and soil by QuEChERS-high performance liquid chromatography-tandem mass spectrometry[J]. Scientia Agricultura Sinica, 2012, 45(13):2636-2647.
[25]金芬,王静,魏闪闪,等.阿维菌素在黄瓜和土壤中的残留及其消解动态[J].中国农业科学, 2014, 47(18):3684-3690. JIN Fen, WANG Jing, WEI Shan-shan, et al. Degradation dynamics and residues analysis of abamectin in cucumber and soil[J]. Scientia A-gricultura Sinica, 2014, 47(18):3684-3690.
中图分类号:X592
文献标志码:A
文章编号:1672-2043(2016)05-0894-07
doi:10.11654/jaes.2016.05.011
收稿日期:2015-11-06
基金项目:2015年国家农产品质量安全风险评估项目(GJFP201500101)
作者简介:陈国峰(1983—),男,硕士研究生,研究方向为农药残留。E-mail:15114549296@163.com
Residue analysis and degradation dynamics of chlorantraniliprole in soybean and soil
?CHEN Guo-feng1,2, LIU Feng2, ZHANG Xiao-bo2, LIAO Hui2, TAO Bo1
(1.College of Agriculture, Northeast Agricultural University, Harbin 150030, China; 2.Safety and Quality Institute of Agricultural Products, H gricultural Sciences, The Ministry of agriculture of agricultural products quality safety risk assessment Laboratory (Harbin), Harbin 150086, China)
Abstract:In this paper, an analytical method was established for determining chlorantraniliprole in vegetable soybean, soybean plant and soil. Residue and degradation dynamics of chlorantraniliprole were examined after its applications to soybean field. Chlorantraniliprole in vegetable soybean, soybean plant and soil samples was extracted by acetonitrile/water, cleaned by SPE-NH2, and determined by LC-MS/ MS. The average recoveries ranged from 99.8%to 107.6%, with relative standard deviations of 1.7%~7.2%in vegetable soybean, soybean plant and soil. The minimum detectable concentrations of chlorantraniliprole in vegetable soybean, soybean plant and soil were 0.05 mg·kg-1. The minimum detectable limit of chlorantraniliprole was 2.5×10-10g. The degradation of chlorantraniliprole in Harbin, Shijiazhuang and Chuxiong was all fitted the first-order reaction equation. The half-lives of chlorantraniliprole degradation were estimated at 4.3 d to 10.1 d in soybean plant, and 3.1 d to 10.2 d in soil. When chlorantraniliprole was sprayed at a dose of 195.7 g·hm-2and 293.6 g·hm-2twice or three times at a 7 day interval, its maximum residual concentration was 0.923 mg·kg-1and 0.757 mg·kg-1respectively, in green soybean and soil on the 3rd day after the last application, which was below the MRL for chlorantraniliprole in vegetable soybean(1.0 mg·kg-1)set forth by Japan and Australia. These results suggest that 200 g·L-1chlorantraniliprole SC could be used in soybean field up to 3 times with preharvest interval of 3 days.
Keywords:chlorantraniliprole; soybean; degradation dynamics; residue

