饲粮添加壳寡糖和干酪乳杆菌对肉鸡生长性能、肌肉品质及抗氧化性能的影响
李 阳 常文环 张 姝 郑爱娟 刘国华 蔡辉益 刘 伟
(农业部饲料生物技术重点开放实验室,中国农业科学院饲料研究所,北京100081)
饲粮添加壳寡糖和干酪乳杆菌对肉鸡生长性能、肌肉品质及抗氧化性能的影响
李阳常文环*张姝郑爱娟刘国华蔡辉益刘伟
(农业部饲料生物技术重点开放实验室,中国农业科学院饲料研究所,北京100081)
摘要:本试验旨在研究饲粮中添加壳寡糖与干酪乳杆菌对肉鸡生长性能、肌肉品质及抗氧化性能的影响。选用1日龄爱拔益加(AA)健康肉公鸡240只,随机分为4组,每组6个重复,每个重复10只。对照组饲喂基础饲粮,试验组分别在基础饲粮中添加120 mg/kg壳寡糖、2×106 CFU/g干酪乳杆菌、120 mg/kg壳寡糖+2×106 CFU/g干酪乳杆菌。试验期为42 d。结果表明:1)与对照组相比,单独添加壳寡糖或壳寡糖与干酪乳杆菌共同添加可显著提高肉鸡平均日增重、胸肌和腿肌红度(a*)值,肌肉脂肪和肌苷酸含量以及胸肌单不饱和脂肪酸和多不饱和脂肪酸含量(P<0.05),显著降低胸肌饱和脂肪酸含量、腿肌黄度(b*)值(P<0.05)。2)饲粮中单独添加干酪乳杆菌显著提高腿肌脂肪及胸肌单不饱和脂肪酸含量(P<0.05),显著降低胸肌饱和脂肪酸含量(P<0.05)。3)饲粮中单独添加壳寡糖、干酪乳杆菌或二者共同添加均可显著降低血浆、胸肌和腿肌丙二醛含量(P<0.05),显著提高血浆、胸肌和腿肌总超氧化物歧化酶活性及总抗氧化能力(P<0.05),显著降低血浆肌酸激酶的活性(P<0.05)。综合分析表明,饲粮中添加壳寡糖、干酪乳杆菌或二者共同添加可提高肉鸡的生长性能和抗氧化性能,改善肌肉品质,而单独添加120 mg/kg壳寡糖效果最佳。
关键词:壳寡糖;干酪乳杆菌;肉鸡;生长性能;肌肉品质;抗氧化性能
现代肉鸡养殖业中,为了促进肉鸡的生长、减少疾病的发生,存在过量使用抗生素的现象[1-2]。然而,抗生素的过量使用会产生耐药性、药物残留和食品安全等诸多负面问题[3]。当前,天然、健康、风味品质好的鸡肉产品越来越受到消费者的欢迎。因此,开发利用无药物残留、不产生耐药性,既能充分发挥肉鸡的生长潜力又能改善肉鸡风味品质的绿色环保型饲料添加剂已经成为饲料行业发展的必然趋势[4-5]。壳寡糖(chitooligosaccharide,COS)作为改善动物生产性能和产品品质、调节动物脂肪代谢及肠道微生态的一种新型功能性添加剂,正逐渐引起关注[2]。壳寡糖是寡糖的一种,学名为寡糖β-(1,4)-2-氨基-2-脱氧-D-葡萄糖,由氨基葡萄糖通过2~10个β-1,4-糖苷键连接起来的物质,也是天然糖中唯一大量存在的碱性氨基寡糖[6]。黄鑫玮等[6]报道,壳寡糖可以促进幼建鲤肠道内乳酸杆菌和双歧杆菌的增殖,改善肠道结构,并提高其生长性能和免疫性能。在猪上的研究也表明,饲粮中添加壳寡糖可通过提高断奶仔猪肠道绒毛高度和降低隐窝深度,进而提高营养物质的消化率,促进仔猪生长[7-9];还可通过调节血液高密度脂蛋白和甘油三酯的含量改善机体脂肪代谢[10-11]。不过,壳寡糖在肉鸡上的研究相对较少,鲜有报道研究壳寡糖对肉鸡肌肉品质的影响。
乳酸杆菌是世界上公认的有益菌,在维持肠道健康和促进机体免疫系统发育与成熟等方面发挥重要作用[12]。干酪乳杆菌(Lactobacilluscasei)作为乳酸杆菌的一种,具有绿色、安全、无残留的特点。我国农业部在2008年公布的《饲料添加剂目录》中指出干酪乳杆菌在动物饲粮中可直接使用[13]。但目前关于干酪乳杆菌的研究相对较少。Willis等[14]研究表明,干酪乳杆菌复合微生态制剂可显著提高肉鸡平均日增重,改善饲料转化效率。县怡涵等[15]研究指出,干酪乳杆菌可提高断奶后仔猪平均日增重,促进空肠和回肠绒毛发育。
研究表明,壳寡糖具有益生元的作用,聚合度在2~8的壳寡糖可以有效促进双歧杆菌和乳酸杆菌的增殖[16]。目前尚未有关于饲粮中共同添加壳寡糖和干酪乳杆菌对肉鸡应用效果的研究报道,因此本试验通过研究壳寡糖和干酪乳杆菌对肉鸡生长性能、肌肉品质及抗氧化性能的影响,旨在为壳寡糖和干酪乳杆菌在畜禽饲料中的应用提供理论支持。
1材料与方法
1.1试验材料
壳寡糖(纯度≥85%)购于青岛博智汇力生物科技有限公司,干酪乳杆菌Zhang(活菌数≥1.4×1012CFU/g)由内蒙古普泽生物制品有限责任公司提供。
1.2试验设计与试验饲粮
本试验采用2×2两因子完全随机分组试验设计,选择1日龄爱拔益加(AA)肉公鸡240只,随机分为4组,每组6个重复,每个重复10只。4组分别饲喂基础饲粮(对照组)、基础饲粮+120 mg/kg壳寡糖(COS组)、基础饲粮+2×106CFU/g干酪乳杆菌Zhang(L.C-Z组)和基础饲粮+120 mg/kg壳寡糖+2×106CFU/g干酪乳杆菌Zhang(COS+L.C-Z组)。试验期42 d。参照《鸡饲养标准》(NY/T 33—2004)配制基础饲粮,饲粮为颗粒料,其组成及营养水平见表1。
1.3饲养管理
试验在中国农业科学院昌平中试基地进行。试验采用3层笼养,鸡舍光照第1~7天为24 h,第8天开始为23 h。鸡舍温度第1~3天为33 ℃,从第4天开始逐步降温直至保持25 ℃。试验周期内肉鸡自由采食,L.C-Z组和COS+L.C-Z组分别定时在饮水中按照摄入饲料量添加干酪乳杆菌Zhang,饮用之前禁水0.5 h,确保乳杆菌在最短时间内全部被鸡摄入,之后再补充清水。按常规程序进行预防免疫。每天观察试验鸡的精神状态、食欲及粪便情况,记录死亡只数。

表1 基础饲粮组成及营养水平(风干基础)
1)预混料为每千克饲粮提供The premix provided the following per kg of diets:VA 10 000 IU,VD32 000 IU,VE 20 IU,VB12.0 mg,VK32.5 mg,VB24.0 mg,VB65.0 mg, VB120.02 mg,D-泛酸D-pantothenic acid 11.0 mg,烟酸 nicotinic acid 35 mg,叶酸 folic acid 0.5 mg,生物素 biotin 0.12 mg,Fe (as ferrous sulfate) 80 mg,Cu (as copper sulfate) 8 mg,Zn (as zinc sulfate) 78 mg,Mn (as manganese sulfate) 100 mg,I (as potassium iodide) 0.34 mg,Se (as sodium selenite) 0.15 mg。
2)粗蛋白质为实测值,其余为计算值。CP was a measured value, while the others were calculated values.
1.4样品采集及测定
1.4.1样品采集
饲养试验结束后,从每个重复中挑选1只体重相近的鸡,颈静脉采血10 mL置于一次性肝素锂采血管中,室温静置1 h后,3 500 r/min离心10 min制备血浆,分装于Eppendorf管中-20 ℃冰箱保存。鸡只放血处死,脱羽,解剖,测定肉鸡的肌肉品质和抗氧化指标。
1.4.2肉质指标的测定
1.4.2.1pH
用Testo-205型便携式pH计测定屠宰45 min后的左侧胸肌和腿肌的pH。测定时先用手术刀割1个豁口,然后将电极完全插入肌肉中,同一只鸡的胸肌测定3个不同的部位,并保持每个样品的测定部位一致。
1.4.2.2肉色
屠宰45 min后用CR-400型全自动色差计测定右侧胸肌和腿肌的亮度(L*)、红度(a*)和黄度(b*)值,每个样品相同部位测定2次(2次旋转90°),取平均值。
1.4.2.3血浆和肌肉中抗氧化指标的测定
分别采集10 g右侧胸肌和腿肌用锡箔纸包好液氮速冻,用于测定肌肉抗氧化指标。用黄嘌呤氧化酶法测定胸肌、腿肌和血浆中总超氧化物歧化酶(total superoxide dismutase,T-SOD)的活性,硫代巴比妥酸法测定胸肌、腿肌和血浆中丙二醛(malondialdehyde,MDA)的含量,胸肌、腿肌和血浆中总抗氧化能力(total antioxidant capacity,T-AOC)及血浆中肌酸激酶(creatine kinase,CK)活性采用比色法测定。上述指标测定所用试剂盒购自南京建成生物工程研究所,测定时按试剂盒说明书进行操作。
1.4.2.4肌肉脂肪含量的测定
分别采集肉鸡的左侧胸大肌和腓肠肌样品,切碎后置于冷冻干燥机中冻干,然后经过粉碎机粉碎,过40目筛。采用索氏提取法测定肌肉脂肪含量,结果以鲜重表示。测定方法参照中国农业行业标准《家禽生产性能名词术语和度量统计方法》(NY/T 823—2004)。
1.4.2.5肌肉肌苷酸含量的测定
分别取肉鸡的右侧胸大肌和腓肠肌约3 g放入自封袋内,封口后立即放入液氮中,然后转入超低温冰箱-70 ℃保存以测定胸肌和腿肌内的肌苷酸含量。测定时,快速准确称取1 g(精确至0.000 1 g)于培养皿中,剪碎至匀浆器中,加入5%的高氯酸(HClO4)溶液9 mL匀浆,匀浆液转入离心管中,再用同浓度的HClO4溶液洗涤匀浆器,洗液并入离心管中,以1 864×g离心10 min后,用定量滤纸过滤于25 mL三角瓶中。将沉淀物用5 mL同浓度的HClO4溶液再次匀浆、离心,合并2次上清液,用5.0和0.5 mol/L氢氧化钠(NaOH)调pH至6.5,转移至25 mL容量瓶中,定容摇匀。测定前用0.45 μm滤膜过滤后用于高效液相色谱(HPLC,安捷伦1200系列,紫外检测器)分析。分离柱:ZORBAX Eclipse XDB-C18(5 μm,4.6 mm×150 mm);流动相:pH为6.5的0.5 mol/L磷酸缓冲液-色谱纯甲醇溶液(体积比为95∶5);流速:1 mL/min;柱温:25 ℃;运行时间:4 min。
1.4.2.6肌肉脂肪酸含量的测定
分别采集肉鸡的胸大肌样品5 g,切碎后置于冷冻干燥机中冻干,然后经过粉碎机粉碎,过40目筛。取冻干样品约0.2 g于50 mL具塞试管中,加入4 mL甲酯化试剂(氯乙酰∶甲醇=1∶10)和1 mL C11∶0(1 mg/mL)的内标液,盖上盖子,于振荡器上振荡20 s,80 ℃水浴2 h后取出冷却,加入5 mL 7%的碳酸钾(K2CO3)溶液,振荡摇匀,以220×g的速度离心(Anke GL-20B,上海)5 min后过0.2 μm滤膜,上机检测。Agilent 6890气相色谱仪,配DB-23色谱柱(60.0 m×250 μm×0.25 μm);载气:N2,流速2.0 mL/min;分流比:30∶1;进样口温度260 ℃;检测器温度270 ℃;进样量:1 μL。
1.5数据统计分析
试验数据采用SPSS 19.0软件的单因素方差分析(one-way ANOVA)程序进行分析,差异显著时采用Duncan氏法进行多重比较,同时采用GLM中的多因素方差分析,分析各因素的主效应以及交互作用效应。P<0.05表示差异显著,P<0.01表示差异极显著。结果采用“平均值±标准差”表示。
2结果
2.1壳寡糖和干酪乳杆菌对肉鸡生长性能的影响
壳寡糖和干酪乳杆菌对肉鸡生长性能的影响见表2。单因素分析结果表明,与对照组相比,饲粮中单独添加壳寡糖或壳寡糖与干酪乳杆菌共同添加均显著提高肉鸡的平均日增重(average daily gain,ADG)(P<0.05),但COS组与COS+L.C-Z组肉鸡的ADG无显著差异(P>0.05);与对照组相比,L.C-Z组肉鸡的ADG提高了4.01%,但二者之间差异不显著(P>0.05)。饲粮中单独添加壳寡糖、干酪乳杆菌或壳寡糖与干酪乳杆菌共同添加对肉鸡平均日采食量(average daily feed intake,ADFI)和料重比(feed/gain,F/G)均没有显著影响(P>0.05)。
主效应分析结果表明,壳寡糖极显著提高肉鸡ADG(P<0.01),但对肉鸡ADFI和F/G没有显著影响(P>0.05);干酪乳杆菌对肉鸡ADG、ADFI和F/G没有显著影响(P>0.05)。壳寡糖和干酪乳杆菌交互作用对ADG、ADFI和F/G没有显著影响(P>0.05)。
CON:对照;COS:壳寡糖;L.C-Z:干酪乳杆菌Zhang;COS+L.C-Z:壳寡糖+干酪乳杆菌Zhang;“+”表示添加,“-”表示未添加。同行数据肩标不同小写字母表示差异显著(P<0.05),相同或无字母表示差异不显著(P>0.05)。下表同。
CON=control; COS=chitosan oligosaccharide; L.C-Z=Lactobacilluscasei-Zhang; COS+L.C-Z=chitosan oligosaccharide+Lactobacilluscasei-Zhang; + means supplemented; - means not supplemented. In the same row, values with different small letter superscripts mean significant difference (P<0.05), and with the same or no letter superscripts mean no significant difference (P>0.05). The same as below.
2.2壳寡糖和干酪乳杆菌对肉鸡肌肉品质的影响
壳寡糖和干酪乳杆菌对肉鸡肌肉品质的影响见表3。单因素分析结果表明,与对照组相比,饲粮中单独添加壳寡糖、干酪乳杆菌或二者共同添加显著提高胸肌和腿肌a*值(P<0.05),显著降低腿肌b*值(P<0.05),但对胸肌和腿肌pH及L*值影响不显著(P>0.05)。干酪乳杆菌可显著提高腿肌a*值(P<0.05),显著降低腿肌b*值(P<0.05),对胸肌肉品质影响不显著(P>0.05)。
主效应分析结果表明,壳寡糖可显著提高胸肌和腿肌a*值(P<0.05);干酪乳杆菌对肉鸡肌肉品质影响不显著(P>0.05)。壳寡糖和干酪乳杆菌对肉鸡肌肉品质交互作用不显著(P>0.05)。
2.3壳寡糖和干酪乳杆菌对肉鸡肌肉脂肪和肌苷酸含量的影响
壳寡糖和干酪乳杆菌对肉鸡肌肉脂肪和肌苷酸含量的影响见表4。单因素分析结果表明,与对照组相比,饲粮中单独添加壳寡糖或壳寡糖与干酪乳杆菌共同添加均能显著提高胸肌和腿肌脂肪含量(P<0.05),显著提高胸肌和腿肌肌苷酸含量(P<0.05)。单独添加干酪乳杆菌可显著提高腿肌脂肪含量(P<0.05),显著提高胸肌和腿肌肌苷酸含量(P<0.05)。
主效应分析结果表明,壳寡糖可极显著提高胸肌脂肪及胸肌和腿肌肌苷酸含量(P<0.01);干酪乳杆菌可显著提高胸肌脂肪含量(P<0.05)。壳寡糖与干酪乳杆菌交互作用可显著提高胸肌和腿肌肌苷酸含量(P<0.05)。
2.4壳寡糖和干酪乳杆菌对肉鸡胸肌脂肪酸组成的影响
壳寡糖和干酪乳杆菌对肉鸡胸肌脂肪酸组成的影响见表5。单因素分析结果表明,与对照组相比,饲粮中单独添加壳寡糖、干酪乳杆菌或者二者共同添加能显著降低胸肌饱和脂肪酸(SFA)含量(P<0.05),其中胸肌中C16∶0及C18∶0的含量(P<0.05)显著降低;能显著提高胸肌中C16∶1及C18∶1含量(P<0.05),显著提高胸肌单不饱和脂肪酸(MUFA)含量(P<0.05);饲粮中单独添加壳寡糖或壳寡糖与干酪乳杆菌共同添加显著提高胸肌中C18∶2、C18∶3及多不饱和脂肪酸(PUFA)含量(P<0.05)。
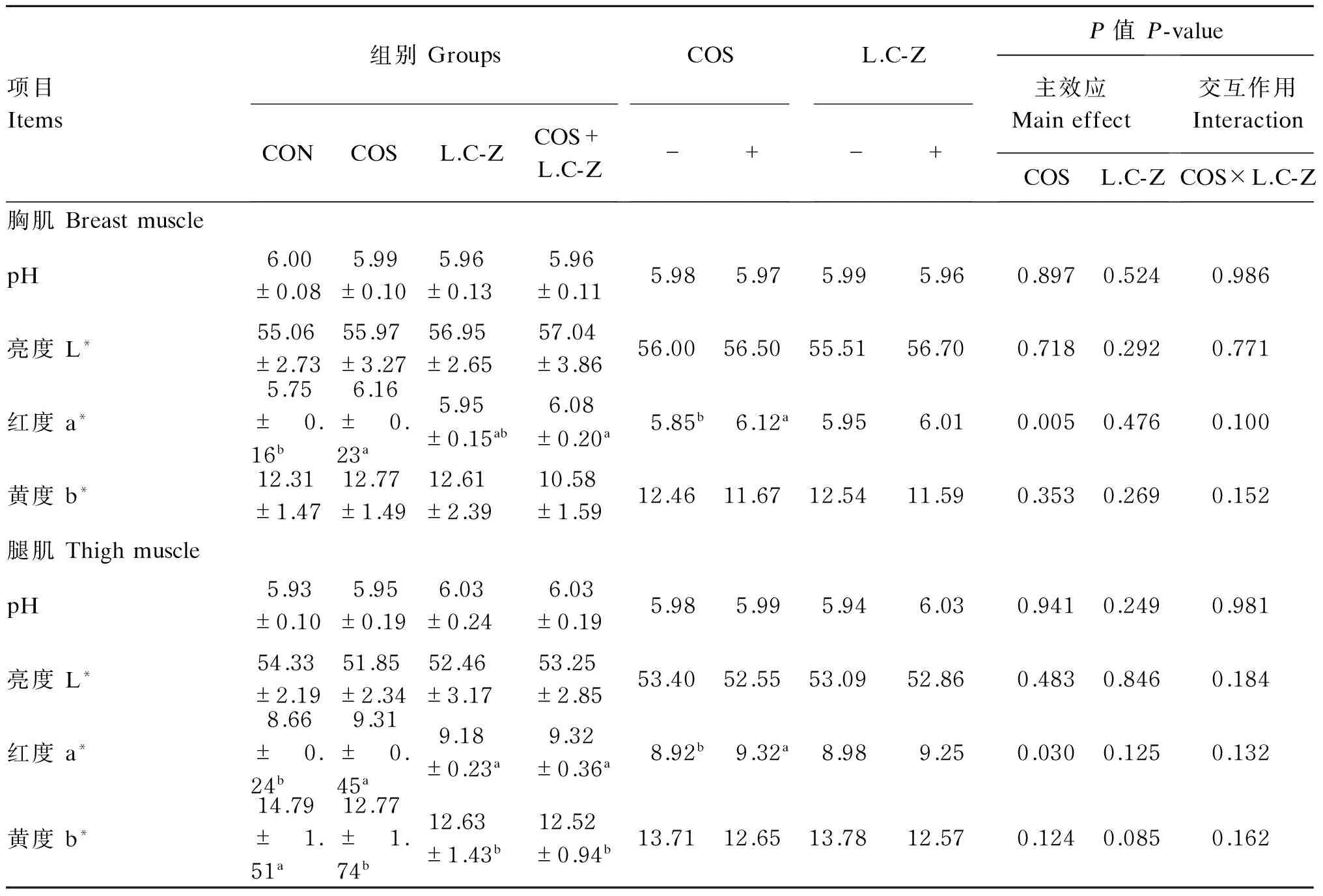
表3 壳寡糖和干酪乳杆菌对42日龄肉鸡肌肉品质的影响
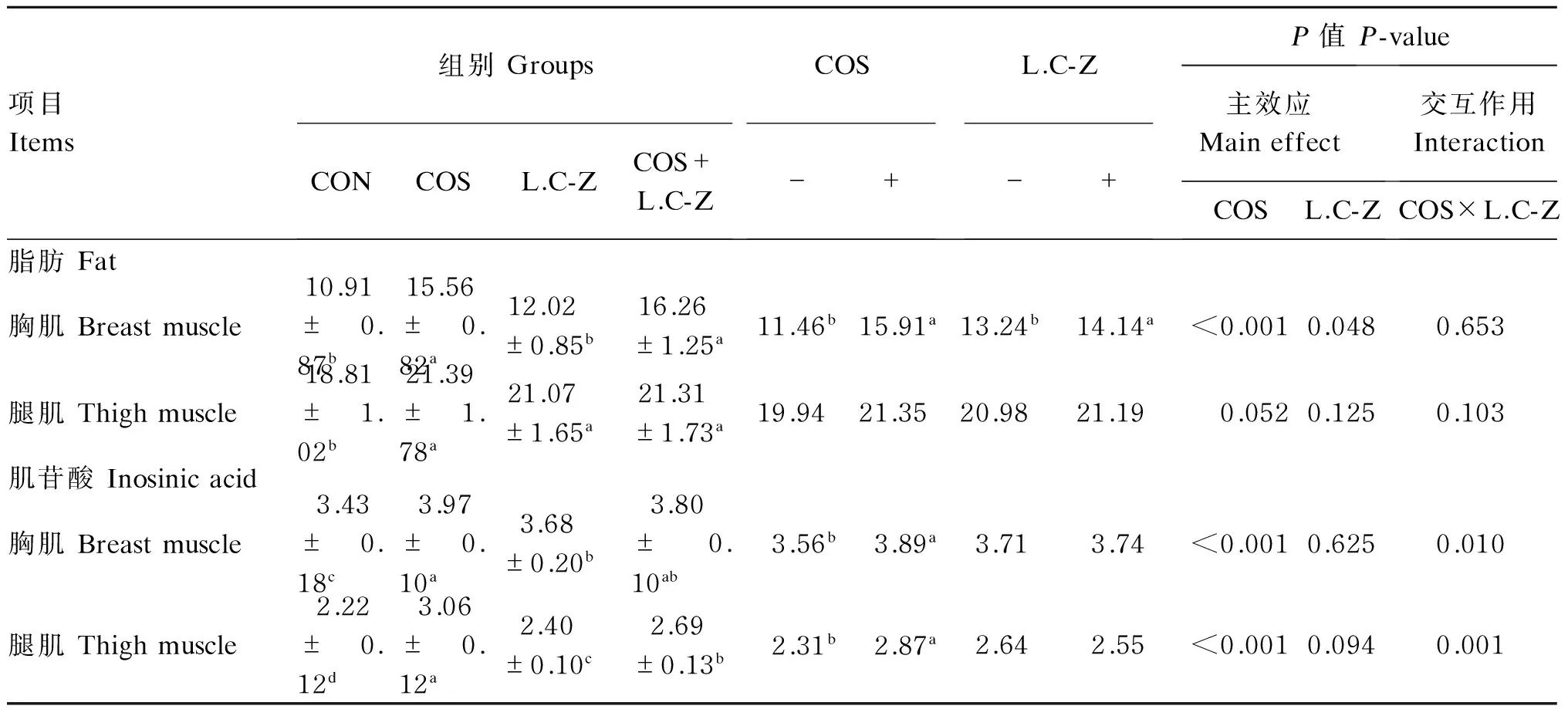
表4 壳寡糖和干酪乳杆菌对42日龄肉鸡肌肉脂肪和肌苷酸含量的影响
主效应分析结果表明,壳寡糖显著降低胸肌中C16∶0含量(P<0.05),显著提高胸肌C18∶1、C18∶2和C18∶3的含量(P<0.05),同时也极显著降低胸肌中SFA含量(P<0.01),极显著提高PUFA含量(P<0.01);干酪乳杆菌对胸肌脂肪酸组成没有显著影响(P>0.05)。壳寡糖与干酪乳杆菌交互作用可显著降低C16∶0、C18∶0及SFA含量(P<0.05),显著提高C16∶1、C18∶1及MUFA含量(P<0.05)。
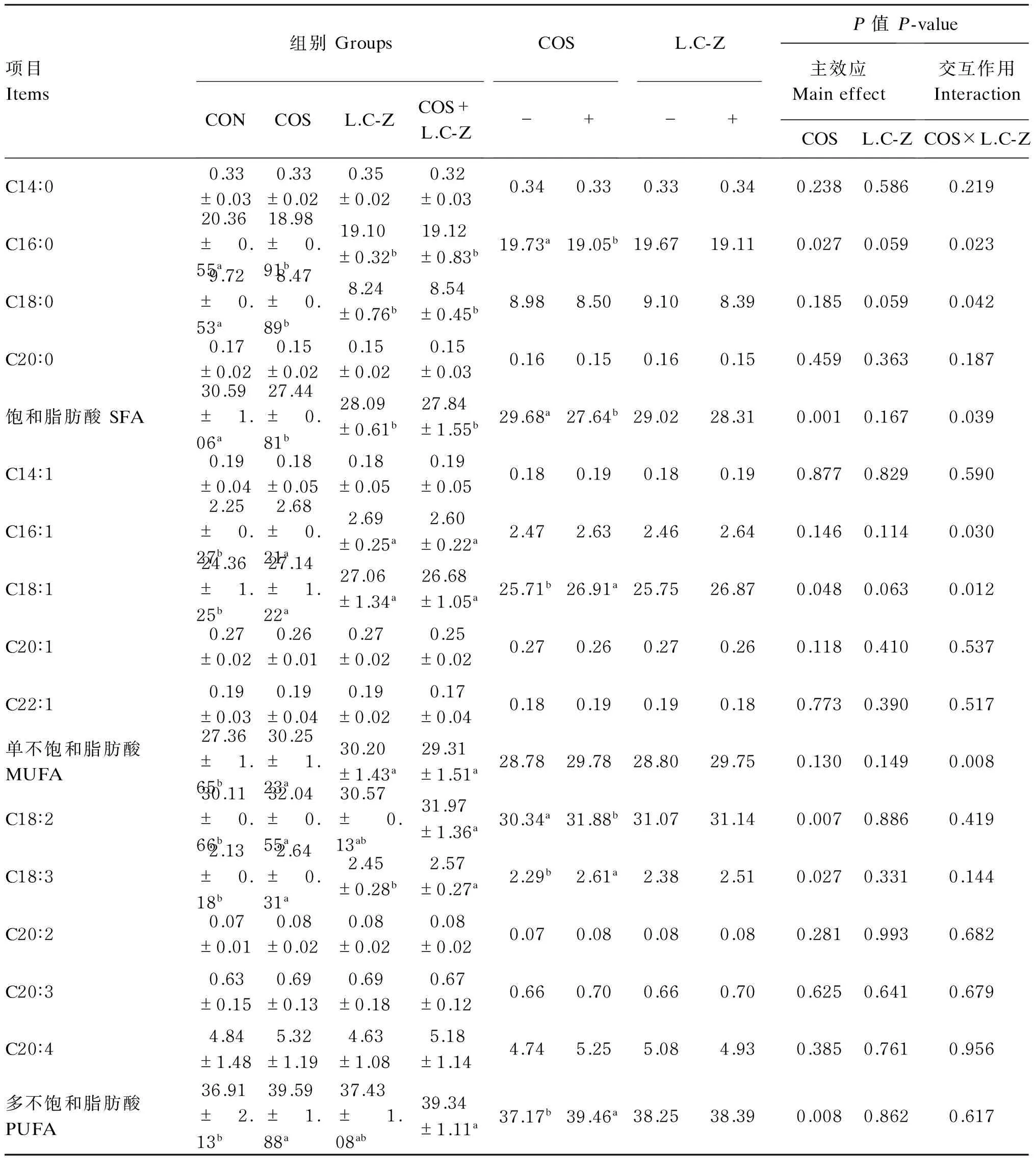
表5 壳寡糖和干酪乳杆菌对42日龄肉鸡胸肌脂肪酸组成的影响
SFA=C14∶0+C16∶0+C18∶0+C20∶0;MUFA=C14∶1+C16∶1+C18∶1+C20∶1+C24∶1;PUFA=18∶2+C18∶3+C20∶2+C20∶3+C20∶4
2.5壳寡糖和干酪乳杆菌对肉鸡抗氧化性能的影响
壳寡糖和干酪乳杆菌对肉鸡抗氧化性能的影响见表6。单因素分析结果表明,与对照组相比,饲粮中单独添加壳寡糖、干酪乳杆菌或二者共同添加显著降低血浆、胸肌和腿肌MDA含量(P<0.05),显著提高血浆、胸肌和腿肌T-AOC及T-SOD的活性(P<0.05)。
主效应分析结果表明,壳寡糖可极显著降低血浆和腿肌MDA含量(P<0.01),可极显著提高血浆T-AOC和T-SOD活性(P<0.01),可极显著提高胸肌T-SOD活性和腿肌T-AOC(P<0.01);干酪乳杆菌显著降低腿肌MDA含量(P<0.05),极显著提高血浆、胸肌和腿肌T-SOD活性(P<0.01),极显著提高腿肌T-AOC(P<0.01)。壳寡糖与干酪乳杆菌交互作用可显著降低血浆、胸肌和腿肌MDA含量(P<0.05),可显著提高血浆T-AOC及腿肌T-AOC和T-SOD活性(P<0.05)。
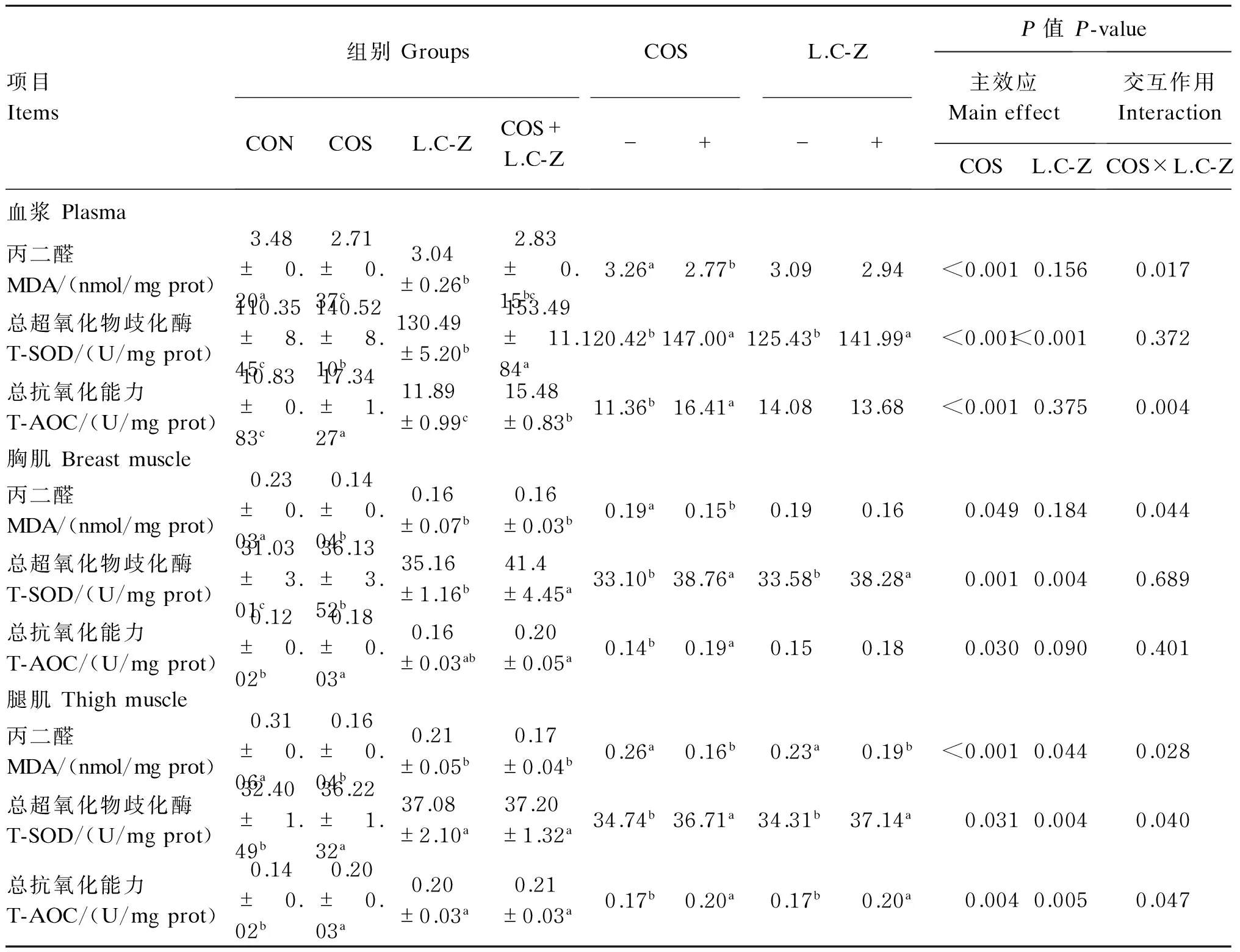
表6 壳寡糖和干酪乳杆菌对42日龄肉鸡抗氧化性能的影响
2.6壳寡糖和干酪乳杆菌对肉鸡血浆CK活性的影响
壳寡糖和干酪乳杆菌对肉鸡血浆CK活性的影响见表7。单因素分析结果表明,饲粮单独添加壳寡糖、干酪乳杆菌或二者共同添加均能显著降低血浆中CK活性(P<0.05)。主效应分析结果表明,壳寡糖极显著降低血浆CK活性(P<0.01),且与干酪乳杆菌存在显著的互作效应(P<0.05)。
3讨论
3.1壳寡糖和干酪乳杆菌对肉鸡生长性能的影响
研究表明,壳寡糖或乳酸杆菌可促进肠道有益微生物乳酸杆菌和双歧杆菌的增殖[6,17];可通过提高小肠绒毛高度和绒毛宽度、降低隐窝深度来增加小肠吸收营养物质的面积,从而提高营养物质的利用效率[18-19];还可促进机体免疫器官发育和提高抗氧化性能,减少动物机体的氧化应激反应来起到促进生长的作用[3,20]。Huang等[21]在肉鸡饲粮中添加50、100和150 mg/kg壳聚糖,结果表明,壳聚糖显著提高了肉鸡ADG,但对肉鸡ADFI没有影响。Li等[22]研究发现,饲粮中添加100 mg/kg壳聚糖显著提高肉鸡ADG和ADFI。本试验研究也发现,在肉鸡饲粮中添加120 mg/kg壳聚糖可显著提高肉鸡ADG,对肉鸡ADFI没有显著影响,这与Huang等[21]研究结果一致,但与Li等[22]报道存在差异,这可能与饲养环境和饲粮组成等有关。

表7 壳寡糖和干酪乳杆菌对42日龄肉鸡血浆CK活性的影响
Safalaoh等[23]研究发现,在饲粮中添加0.1%含有干酪乳杆菌的复合微生态制剂,可以显著提高肉鸡ADG和饲料转化效率。郭元晟[17]研究表明,通过饮水方式添加干酪乳杆菌可以显著提高肉鸡ADG,但对ADFI没有显著影响。本试验结果表明,以饮水方式添加干酪乳杆菌对肉鸡ADG及ADFI均没有影响。这与上述研究结果存在部分不一致,但与Kalavathy等[24]研究结果一致。这可能与乳酸杆菌的添加方式及添加剂量等有关。
以上试验研究了饲粮中单独添加壳聚糖或者干酪乳杆菌对肉鸡生长性能的影响,而本试验首次将二者共同添加到肉鸡饲粮中,研究结果表明,二者共同添加效果并未优于壳聚糖的单独添加效果。其原因可能壳寡糖可以通过带正电的游离氨基与细胞表面带阴离子的物质或者细菌细胞壁等相互结合,使细胞变形或者阻止营养物质的进入,干扰细菌的正常代谢,产生抗菌作用[25-26]。所以,本试验中壳寡糖的添加可能抑制了干酪乳杆菌作用的发挥。
3.2壳寡糖和干酪乳杆菌对肉鸡肌肉品质的影响
pH是影响肉品质的重要因素,能反映出宰后体内糖原酵解的速度,pH过高或过低都会对肌肉产生不利影响,据报道刚屠宰的鸡肉pH约为6~7,约1 h后达到最低约为5.4~5.6。肉色是肌肉本身的生理学、生物化学和微生物学变化的外部表现,其作为一种重要的肉质性状,是肌肉外观评定的重要指标。肌肉色泽主要受肌红蛋白和血红蛋白含量及其存在状态决定,其次也受反射和氧化作用的影响[27]。反映肉色的3个指标分别为L*、a*以及b*。a*值在一定范围内越高表示肌肉品质越好,新鲜度也越高。本试验研究结果表明,饲粮中单独添加壳寡糖、干酪乳杆菌或壳寡糖与干酪乳杆菌共同添加显著提高肉鸡胸肌和腿肌a*值,同时显著降低肉鸡腿肌b*值,但对胸肌和腿肌pH和L*值无显著影响。李菊等[28]研究发现对肉鸡饲喂乳酸杆菌(CAU6001)可以提高肉鸡胸肌和腿肌a*值和b*值,但对pH和L*值无显著影响。郭元晟[17]研究报道,饲喂干酪乳杆菌对肉鸡肌肉的肉色及pH无显著影响,但有提高a*值和降低b*值的趋势。壳寡糖对肉鸡肌肉品质的研究报道较少,Zhou等[29]研究指出饲粮中添加壳寡糖可以提高胸肌pH和降低胸肌b*值,但对胸肌a*值和L*值无显著影响。本试验中单独添加壳寡糖、干酪乳杆菌及二者共同添加具有改善肌肉品质作用,可能是因为壳寡糖及干酪乳杆菌能够提高胸肌和腿肌的抗氧化性能,能够保护肌肉含磷脂的细胞膜免受脂质过氧化损伤,这种抗氧化作用延缓了肌肉中肌红蛋白变为高铁血红蛋白的速度[27]。肉品质的影响因素很多,而且各因素之间关系较为复杂,对于壳寡糖和干酪乳杆菌影响肉品质的作用机理尚不明确,有待进一步研究探讨。
3.3壳寡糖和干酪乳杆菌对肉鸡肌肉脂肪和肌苷酸含量的影响
肌肉脂肪是影响鸡肌肉品质的重要因素。其原因在于肌肉脂肪利于结缔组织疏松和肌束分离,同时在氧化时能够溶解纤维束,从而在一定程度上增加肌肉的嫩度和多汁性。另外,肌肉脂肪主要由富含PUFA的磷脂组成,其氧化裂解产物及极性氨基基团可以通过参与美拉德反应,产生香味物质,改善肉的风味[30]。李菊等[28]研究发现,肉鸡饲喂乳酸杆菌(CAU6001)可以提高胸肌粗脂肪的含量。刘羽等[31]在幼建鲤的研究结果也表明,饲粮中添加乳酸杆菌能极显著提高机体脂肪含量。本试验研究发现,单独添加壳寡糖、干酪乳杆菌及二者共同添加提高胸肌和腿肌脂肪含量,对肉品质有一定的改善作用。
肌苷酸是畜禽肉中重要的鲜味物质,它来自肌肉收缩过程中肌细胞内三磷酸腺苷(ATP)的分解,肌肉内的ATP在ATP酶的作用下分解成为二磷酸腺苷(ADP),ADP再进一步降解成为一磷酸腺苷(AMP),AMP在腺苷脱氢酶的作用下形成肌苷酸。本试验研究发现单独添加壳寡糖、干酪乳杆菌及二者共同添加显著提高了胸肌和腿肌肌苷酸的含量,这与添加壳寡糖及干酪乳杆菌降低血浆CK活性有关,当血浆中CK活性降低时有助于体内ADP的生成[32]。
3.4壳寡糖和干酪乳杆菌对肉鸡胸肌脂肪酸组成的影响
根据饱和度的不同,脂肪酸分为SFA和不饱和脂肪酸(USFA),USFA又分为MUFA和PUFA。PUFA是指含有2个或2个以上双键且碳链长度为18~22个碳原子的直链脂肪酸,具有促进使胆固醇酯化、降低血中胆固醇和甘油三酯含量、降低血液黏稠度以及改善血液微循环等功能,有助于降低心脑血管疾病发生的风险。Zhou等[29]研究结果表明,壳寡糖显著提高肉鸡肌肉中MUFA和PUFA的含量,显著降低SFA含量。李菊等[28]研究发现,在肉鸡饲粮中添加乳酸杆菌制剂可以提高肌肉中C16∶1、C20∶2、C20∶3以及PUFA的含量。孙建广等[27]在生长育肥猪饲粮中添加发酵乳酸杆菌发现发酵乳酸杆菌可以提高肌肉C18∶2、C18∶3及PUFA含量。本研究也发现饲粮中单独添加壳寡糖、干酪乳杆菌及二者共同添加能降低肌肉SFA含量,增加肌肉中MUFA及PUFA含量。同时SFA的降低主要是由于C16∶0和C18∶0的降低引起,MUFA的上升主要是由于C16∶1和C18∶1的增加所致,其机理可能是壳寡糖和干酪乳杆菌增强了Δ-9脱氢酶(硬脂酰脱氢酶)的活性,其活性的增加加速了C16∶0转化为C16∶1和C18∶0转化为C18∶1的速度[33]。
3.5壳寡糖和干酪乳杆菌对肉鸡抗氧化功能的影响
动物机体防御体系抗氧化能力的强弱与健康程度存在着密切联系,MDA是脂质过氧化降解的主要产物,其含量多少可间接反映自由基的产生情况和机体组织细胞的脂质过氧化程度。超氧化物歧化酶(SOD)活性的高低间接反映了机体内清除氧自由基的能力,MDA含量的测定常与SOD活性相互配合。在机体防御体系中,T-AOC代表体内酶类和非酶类抗氧化物的总体水平,能全面反映动物机体的抗氧化状态。其作用主要是维持内环境活性氧的动态平衡,清除过高的活性氧,使机体处于氧化还原相对稳定的状态[34]。本研究中,单独添加壳寡糖或壳寡糖与干酪乳杆菌共同添加显著降低血浆、胸肌和腿肌MDA含量,显著提高血浆、胸肌和腿肌T-AOC及T-SOD的活性,表明壳寡糖可提高肉鸡的抗氧化能力。黄鑫玮等[6]对幼建鲤的研究表明,饲粮中添加壳寡糖可显著降低血浆MDA含量,显著提高血浆T-AOC。龙次民等[35]在对妊娠后期母猪的研究中发现,饲粮添加壳寡糖可显著提高妊娠母猪血浆T-SOD活性,同时也提高新生仔猪回肠过氧化氢酶(CAT)、空肠谷胱甘肽过氧化物酶等抗氧化基因的表达量。表明,饲粮中添加壳寡糖可以通过提高抗氧化基因在机体的表达量增强机体抗氧化能力。另外,李晓晶[3]研究指出壳寡糖分子结构中的葡萄糖胺链上带有四价铵离子,其提供的单电子对自由基有较好的清除效果,进而提高机体抗氧化性能。
本研究中,干酪乳杆菌能显著提高血浆、胸肌和腿肌T-SOD活性,显著降低血浆、胸肌和腿肌MDA含量,表明乳酸杆菌对肉鸡抗氧化功能有一定的增强作用,这与前人的研究结果一致。郭元晟[17]研究表明,单独饲喂干酪乳杆菌可降低肉鸡42日龄血浆MDA含量,提高42日龄血浆T-SOD活性。但关于乳酸杆菌促进抗氧化功能的机理尚不清楚。有研究表明,乳酸杆菌的菌体、菌体破碎离心得到的无细胞提取物、胞外分泌物对超氧阴离子自由基(·O2-)和羟基自由基(·OH-)等有较高的清除能力,从而提高了机体抗氧化性能[36-37]。另外,本研究发现壳聚糖和干酪乳杆菌在提高机体抗氧化性能方面存在一定的交互作用,其原因可能是二者的共同添加增强了对自由基的清除能力。
4结论
饲粮中添加壳寡糖、干酪乳杆菌或二者共同添加可提高肉鸡生长性能和抗氧化性能,改善肌肉品质,而单独添加120 mg/kg壳寡糖效果最佳。
参考文献:
[1]SWIATKIEWICZ S,SWIATKIEWICZ M,ARCZEWSKA-WLOSEK A,et al.Chitosan and its oligosaccharide derivatives (chito-oligosaccharides) as feed supplements in poultry and swine nutrition[J].Journal of Animal Physiology and Animal Nutrition,2015,99(1):1-12.
[2]王红卫,孙敏敏,孟晓,等.不同分子质量壳寡糖对蛋鸡生产性能、肠道微生物及脾脏白细胞介素-2和肿瘤坏死因子-α基因表达的影响[J].动物营养学报,2013,25(11):2660-2667.
[3]李晓晶.壳寡糖对肉仔鸡促生长、免疫调节和抗氧化作用的研究[D].硕士学位论文.北京:中国农业大学,2007.
[4]刘含亮,孙敏敏,王红卫,等.壳寡糖对虹鳟生长性能、血清生化指标及非特异性免疫功能的影响[J].动物营养学报,2012,24(3):479-486.
[5]马建爽,常文环,张姝,等.甜菜碱对肉鸡生长性能、脂质代谢及肌肉风味品质的影响[J].动物营养学报,2015,27(1):185-195.
[6]黄鑫玮,杨莎莎,刘毅,等.壳寡糖对幼建鲤生长性能、脂肪代谢、非特异性免疫功能和肠道健康的影响[J].动物营养学报,2015,27(7):2106-2114.
[7]LIU P,PIAO X S,KIM S W,et al.Effects of chito-oligosaccharide supplementation on the growth performance,nutrient digestibility,intestinal morphology,and fecal shedding ofEscherichiacoliandLactobacillusin weaning pigs[J].Journal of Animal Science,2008,86(10):2609-2618.
[8]ZHOU T X,CHO J H,KIM I H.Effects of supplementation of chito-oligosaccharide on the growth performance,nutrient digestibility,blood characteristics and appearance of diarrhea in weanling pigs[J].Livestock Science,2012,144(3):263-268.
[9]CHEN Y J,KIM I H,CHO J H,et al.Effects of chitooligosaccharide supplementation on growth performance,nutrient digestibility,blood characteristics and immune responses after lipopolysaccharide challenge in weanling pigs[J].Livestock Science,2009,124(1/2/3):255-260.
[10]TANG Z R,YIN L Y,NYACHOTI C M,et al.Effect of dietary supplementation of chitosan and galacto-mannan-oligosaccharide on serum parameters and the insulin-like growth factor-Ⅰ mRNA expression in early-weaned piglets[J].Domestic Animal Endocrinology,2005,28(4):430-441.
[11]WANG J P,YOO J S,KIM H J,et al.Nutrient digestibility,blood profiles and fecal microbiota are influenced by chitooligosaccharide supplementation of growing pigs[J].Livestock Science,2009,125(2/3):298-303.
[12]马现永,蒋宗勇,王志林,等.乳杆菌仔猪肠道黏膜免疫系统的调控及其分子机制[J].动物营养学报,2015,27(8):2317-2322.
[13]杨艳,潘宝海,孙笑非.植物乳杆菌的功能及在动物生产中的应用[J].饲料研究,2013(2):36-37.
[14]WILLIS W L,ISIKHUEMHEN O S,IBRAHIM S A.Performance assessment of broiler chickens given mushroom extract alone or in combination with probiotics[J].Poultry Science,2007,86(9):1856-1860.
[15]县怡涵,赵秀英,李晨博,等.植物乳杆菌和干酪乳杆菌对仔猪生长性能、器官指数及小肠形态的影响[J].动物营养学报,2015,27(12):3805-3811.
[16]LEE H W,PARK Y S,JUNG J S,et al.Chitosan oligosaccharides,dp 2-8,have prebiotic effect on theBifidobacteriumbifidiumandLactobacillussp.[J].Anaerobe,2002,8(6):319-324.
[17]郭元晟.乳酸杆菌对肉鸡生产性能、免疫机能及肠道菌群的影响[D].博士学位论文.呼和浩特:内蒙古农业大学,2011.
[18]徐基利,许丽.不同乳酸菌及其添加水平对肉仔鸡生长性能、免疫机能和肠道结构的影响[J].动物营养学报,2011,23(11):1976-1983.
[19]王秀武,林欣,张丽,等.壳寡糖对肉仔鸡生产性能、小肠组织结构和肌组织矿物质元素含量的影响[J].中国粮油学报,2005,20(2):83-88.
[20]HERICH R,RÉVAJOVV M,BOMBA A,et al.The effect ofLactobacillusparacaseiand Raftilose P95 upon the non-specific immune response of piglets[J].Food and Agricultural Immunology,2002,14(3):171-179.
[21]HUANG R L,YIN Y L,WU G Y,et al.Effect of dietary oligochitosan supplementation on ileal digestibility of nutrients and performance in broilers[J].Poultry Science,2005,84(9):1383-1388.
[22]LI X J,PIAO X S,KIM S W,et al.Effects of chito-oligosaccharide supplementation on performance,nutrient digestibility,and serum composition in broiler chickens[J].Poultry Science,2007,86(6):1107-1114.
[23]SAFALAOH A C L.Body weight gain,dressing percentage,abdominal fat and serum cholesterol of broilers supplemented with a microbial preparation[J].African Journal of Food Agriculture Nutrition and Development,2006,6(1):1-10.
[24]KALAVATHY R,ABDULLAH N,JALALUDIN S,et al.Effects of Lactobacillus cultures on growth performance,abdominal fat deposition,serum lipids and weight of organs of broiler chickens[J].British Poultry Science,2003,44(1):139-144.
[25]徐后国,艾庆辉,麦康森,等.饲料中添加枯草芽孢杆菌和壳寡糖对大黄鱼幼鱼血清免疫指标的影响[J].中国海洋大学学报,2011,41(7/8):42-47.
[26]徐俊光.壳寡糖对植物病原真菌的抑菌活性及其机理的初步研究[D].博士学位论文.大连:中国科学院研究生院,2007.
[27]孙建广,张石蕊,谯仕彦,等.发酵乳酸杆菌对生长肥育猪生长性能和肉品质的影响[J].动物营养学报,2010,22(1):132-138.
[28]李菊,张日俊.益生素对肉仔鸡生长性能、屠体性状及肉品质的影响[J].动物营养学报,2007,19(4):372-378.
[29]ZHOU T X,CHEN Y J,YOO J S,et al.Effects of chitooligosaccharide supplementation on performance,blood characteristics,relative organ weight,and meat quality in broiler chickens[J].Poultry Science,2009,88(3):593-600.
[30]崔焕先.肉鸡肌内脂肪形成的分子调控网络及相关基因研究[D].博士学位论文.北京:中国农业科学院,2011.
[31]刘羽,冯琳,陈岗富,等.饲料中添加乳酸杆菌对幼建鲤生长性能和消化吸收功能的影响[J].动物营养学报,2011,23(8):1386-1393.
[32]胡忠泽,王立克,周正奎,等.杜仲对鸡肉品质的影响及作用机理探讨[J].动物营养学报,2006,18(1):49-54.
[33]BRENNER R R.Factors influencing fatty acid chain elongation and desaturation[M]//VERGROESEN A J,CRAWFORD M.The Role of Fats in Human Nutrition.London:Academic Press,1989:45-79.
[34]黄风华,郑新民,张元珍,等.诊断超声波照射对大鼠睾丸总抗氧化能力、丙二醛及脂质过氧化物酶水平和生殖细胞凋亡的影响[J].武汉大学学报:医学版,2007,28(1):85-88.
[35]龙次民,谢春艳,吴信,等.妊娠后期母猪饲粮中添加壳寡糖对新生仔猪抗氧化能力的影响[J].动物营养学报,2015,27(4):1207-1213.
[36]张江巍,曹郁生.乳酸菌抗氧化活性的研究进展[J].中国乳品工业,2005,33(1):34-37.
[37]李维,孙开济,孙玉丽,等.乳酸菌缓解肠道氧化应激研究进展[J].动物营养学报,2016,28(1):9-14.
(责任编辑田艳明)
Effects of Dietary Chitosan Oligosaccharide andLactobacilluscaseion Growth Performance, Meat Quality and Antioxidant Function of Broilers
LI YangCHANG Wenhuan*ZHANG ShuZHENG AijuanLIU Guohua CAI HuiyiLIU Wei
(Key Laboratory of Feed Biotechnology of Agricultural Ministry, Feed Research Institute,Chinese Academy of Agricultural Sciences, Beijing 100081, China)
Abstract:This study was conducted to investigate the effects of dietary chitosan oligosaccharide (COS) and Lactobacillus casei on growth performance, meat quality and antioxidant function of broilers. A total of 240 1-day-old healthy Arbor Acres male broilers were randomly allotted to 4 groups with 6 replicates per group and 10 birds per replicate. The four diets included a basal diet and 3 experimental diets supplemented with 120 mg/kg COS, 2×106 CFU/g Lactobacillus casei, 120 mg/kg COS+2×106 CFU/g Lactobacillus casei, respectively. The trial lasted for 42 d. The results showed as follows: 1) compared with the control group, dietary supplementation with COS or COS and Lactobacillus casei significantly increased average daily gain, redness (a*) value of breast and thigh muscle, contents of intramuscular fat and inosinic acid, and contents of monounsaturated fatty acid (MUFA) and polyunsaturated fatty acid (PUFA) in breast muscle of broilers (P<0.05), significantly decreased saturated fatty acid (SFA) content in breast muscle and yellowness (b*) value of thigh muscle (P<0.05). 2) Supplementation with Lactobacillus casei in diet significantly increased intramuscular fat content in thigh muscle and MUFA content in breast muscle while decreased SFA content in breast muscle (P<0.05). 3) Dietary supplementation with COS, Lactobacillus casei or two together significantly decreased malondialdehyde (MDA) content in plasma, breast and thigh muscle (P<0.05), significantly increased the total superoxide dismutase (T-SOD) activity and total antioxidant capacity (T-AOC) in plasma, breast and thigh muscle (P<0.05), meanwhile decreased the creatine kinase (CK) activity in plasma (P<0.05). The results indicate that dietary supplementation with COS, Lactobacillus casei or both together can increase growth performance and antioxidant function and promote meat quality of broilers, and 120 mg/kg COS supplementation gets the best effect.[Chinese Journal of Animal Nutrition, 2016, 28(5):1450-1461]
Key words:chitosan oligosaccharide; Lactobacillus casei; broiler; growth performance; meat quality; antioxidant function
doi:10.3969/j.issn.1006-267x.2016.05.021
收稿日期:2015-12-10
基金项目:中国农业科学院科技创新工程(ASTIP)
作者简介:李阳(1989—),男,山东菏泽人,硕士研究生,从事动物营养与饲料科学研究。E-mail: ladderup@sina.cn *通信作者:常文环,副研究员,硕士生导师,E-mail: changwenhuan@caas.cn
中图分类号:S816.7
文献标识码:A
文章编号:1006-267X(2016)05-1450-12
*Corresponding author, associate professor, E-mail: changwenhuan@caas.cn

