中重症急性胰腺炎1 271例分析
杨星 郭克建 宋少伟 葛春林
中重症急性胰腺炎1 271例分析
杨星 郭克建 宋少伟 葛春林
目的 分析重症急性胰腺炎的病因、诊断、治疗及预后。方法 回顾分析中国医科大学附属第一医院胰腺外科2010年8月至2016年7月收治1 271例成人重症急性胰腺炎的临床资料。结果 中重症急性胰腺炎1 144例(90.0%),重症急性胰腺炎127例(10.0%)。保守治疗939例(73.9%),有创干预332例(26.1%)。有创干预包括超声或CT引导经皮穿刺置管引流(PCD)72例111人次(21.7%),行ERCP治疗42例(12.7%),开腹手术37例41人次(11.1%),经皮肾镜坏死组织清除引流3例,经后腹腔镜入路行感染坏死组织清除引流1例,腹腔镜或开腹胆囊切除术182例(54.8%)。共死亡64例(5.0%),治愈率为95.0%。中重症急性胰腺炎病死率为0.3%,重症急性胰腺炎病死率为48.0%。老年病人死亡28例(占该组病死率7.9%),非老年病人死亡36例(占该组病死率3.9%)。PCD病人死亡14例(19.4%),坏死组织清除术后死亡12例(32.4%)。结论 重症急性胰腺炎治疗需要根据病因、局部及全身并发症采取个体化、创伤递增式(Step-up)治疗,及时清除感染的坏死物,有利于降低重症急性胰腺炎的病死率。
重症急性胰腺炎; 病因; 治疗; 预后
近十几年来,急性胰腺炎的发病率逐年增高,约80%的病人很快康复,较少需要镇痛及液体复苏,病死率<1%[1]。一旦出现全身炎症反应综合征(systemic inflammatory response syndrome,SIRS)、器官功能障碍,胰腺实质或胰周并发症合并感染,病死率将聚增至30%以上[2]。回顾总结我院胰腺外科2010年8月至2016年7月收治1 271例成人中、重症急性胰腺炎的临床资料,并借此探讨其病因、诊断、治疗及预后。
资料与方法
一、临床资料
1.研究对象 收集我院胰腺外科2010年8月至2016年7月收治1 271例成人中、重症急性胰腺炎的临床资料。
2.诊断标准 根据中华医学会《急性胰腺炎诊治指南(2014版)》[3],中重症急性胰腺炎(moderately severe acute pancreatitis,MSAP)和重症急性胰腺炎(severe acute pancreatitis,SAP)主要区别在于器官衰竭持续时间不同,MSAP为短暂性(≤48 h),SAP为持续性(>48 h)。制定48 h这个时间点的原因是持续器官功能障碍存在更高的死亡风险[3-4]。本文所含病例均符合中、重症急性胰腺炎的诊断标准。
二、治疗
包含保守治疗及必要时的阶梯式有创治疗。所有病人入院后即根据临床症状、实验室检查及腹部影像学检查进行血流动力学评估,并对除患有心、肾并存病的病人进行目标导向(goal-directed)快速液体复苏。留置中心静脉导管,积极给予输注晶体及林格液扩容,监测中心静脉压(central venous pressure,CVP)及每小时尿量,实时调整补液速度。积极纠正液体不足,同时预防输液过快所致的肺水肿及腹内高压。对于存在SIRS、器官功能障碍甚至多器官功能衰竭综合征(multiple organ disfunction syndrome,MODS)的病人,积极转入监护室治疗或ICU行呼吸机辅助通气、心肺功能支持,对于持续高脂血症的病人给予血液净化治疗。对于存在胆系感染的病人,行经内镜逆行胰胆管造影(endoscopic retrograde cholangio-pancreatograph,ERCP)取石、鼻胆管引流,无感染风险者暂不处理,待病情平稳后择期行胆囊切除或胆道探查手术。胃肠减压,腹部外敷芒硝减轻腹胀。对于肠道功能恢复,无腹痛的病人早期经口给予短肽营养,较重的病人于数字减影血管造影(DSA)下留置空肠营养管,远端越过Treitz韧带,鼻饲短肽类营养,保护肠黏膜屏障,预防肠道细菌移位等并发症。对于长期无法耐受肠内营养者,给予肠外营养及谷氨酰胺。
经保守治疗症状未见好转甚至加重者(持续发热或腹部胀痛加重);血常规白细胞、血清降钙素原或C反应蛋白进行性升高者;影像学显示腹腔或者腹膜后坏死物存在感染迹象者行经皮穿刺引流(percutaneous catheter drainage,PCD)治疗。经超声或CT定位确定感染区域,选择穿刺点,避开重要血管及脏器,穿刺成功后置入导丝,根据内容物性状置入8.5F或10.2F猪尾管。留取引流液行细菌培养及药敏以选择抗生素,除因腹内高压或压迫症状者外,穿刺液培养均存在细菌感染,部分病人因长期应用广谱抗生素致多重细菌感染甚至真菌感染。定期复查CT,调整引流管位置或多次穿刺。对于坏死物引流不畅者,逐步扩张窦道,更换16F至24F套管。对于病程长、感染组织包裹局限者,行腔内持续灌洗、对冲引流。对于临床症状消失、引流管持续无液体引出、CT显示坏死感染区域消失者,逐步拔出各引流管。
对于经置管引流后症状未见缓解或缓解后再次加重者采取手术治疗。扩张窦道置入肾镜或腔镜器械,打开腔内分隔,清除坏死组织,留置套管充分引流。或沿导管轨迹切口探入坏死腔,行开放性坏死组织清除、引流术。
结 果
6年间,我科共收治中、重症急性胰腺炎1 271例,年龄18~91岁,平均49.8岁。中重症急性胰腺炎1 144例(90.0%),重症急性胰腺炎127例(10.0%)。男性803例(63.2%),女性468例(36.8%)。胆源性胰腺炎571例(44.9%),酒精性胰腺炎312例(24.6%),高脂血症性胰腺炎337例(26.5%),肿瘤所致45例(3.5%),创伤性胰腺炎2例(0.2%),妊娠期胰腺炎3例(0.2%)。保守治疗939例(73.9%),有创干预332例(26.1%)。有创干预包括超声/CT引导PCD72例111人次(21.7%),行ERCP治疗42例(12.7%),开腹手术37例41人次(11.1%),经皮肾镜坏死组织清除引流3例,经后腹腔镜入路行感染坏死组织清除引流1例,腹腔镜或开腹胆囊切除术182例(54.8%)。共死亡64例(5.0%),治愈率95.0%。中重症急性胰腺炎病死率0.3%,重症急性胰腺炎死亡率48.0%。老年病人死亡28例(占该组病死率7.9%),非老年病人死亡36例(占该组病死率3.9%)。PCD病人死亡14例(19.4%),坏死组织清除术后死亡12例(32.4%)。持续器官功能障碍伴胰腺或胰周坏死者,病死率为47.4%;伴感染性坏死者,病死率为48.4%。
讨 论
这些年来有很多预测工具用于预测急性胰腺炎的严重程度及预后。Ranson及APACHE-Ⅱ曾经是广为应用,并被认为是行之有效的预测工具,精细的结合应用准确度非常高。但也因为这些工具非常繁琐且需要待发病后48 h才能获得完整评分,限制了其临床应用[5-6]。SIRS是评估SAP预后的重要标准,最早用于评估脓毒血症、器官功能障碍的进展[7-8],其优点在于在疾病的极早期即可以确定危重程度,在急诊室即可评估。
发病第一个24 h之内的治疗是决定预后的关键,超过这段时间,补液的益处就不大了[4,9-10]。液体复苏旨在维持胰腺和肠道的微循环,预防肠缺血及由此带来的细菌移位,将全身炎症反应降至最低,减少器官功能障碍及降低病死率。
液体复苏首选乳酸林格液[3,9],依据中心静脉压、尿量及血尿素氮测定等指标调整补液速度。高钙血症病人复苏早期不能应用乳酸林格液[9]。美国胰腺协会建议补液速度为5~10 ml·kg-1·h-1。早期快速液体复苏需避免补液量不足或过多,补液量不足会导致肾衰竭,胰腺坏死加重,甚至感染等并发症。补液量过多会加重心脏负荷引起肺水肿、呼吸功能衰竭、胰周液体积聚、腹压增高甚至腹腔间隔室综合征(abdominal compartment syndrome,ACS)。充分液体复苏可用以下临床表现评估[1]:心率<120次/min;平均动脉压65~85 mmHg;尿量>1 ml·kg-1·h-1;红细胞压积(HCT)0.35~0.44。
出现重症急性胰腺炎表现时,胰腺即已出现坏死,在增强CT上仅少部分胰腺组织强化,这正符合胰腺坏死是由缺血所致。对于诊断明确的病例,不推荐立即行增强CT检查,因其结果并不影响治疗方案。当诊断困难或虽经积极治疗但病情恶化者,需行增强CT检查。胰周脂肪组织参与构成胰腺坏死,所以肥胖病人更容易发展成坏死性胰腺炎。
高脂血症性胰腺炎三酰甘油>11.3 mmol/L[3,9-10],这类病人需限用脂肪乳剂。可应用小剂量低分子肝素、胰岛素及降脂药物,提高脂蛋白酶的活性,加速乳糜微粒的降解;对于危重病人可行血液净化治疗。
坏死程度及是否合并感染与预后密切相关。坏死小于30%的病人,感染的发生概率为22.5%,然而,坏死超过50%的病人,感染概率为46.5%[11]。液体复苏及早期给予肠内营养维持肠黏膜屏障,降低肠道细菌移位风险。减少中心静脉导管的使用时间,降低细菌血行感染概率。ERCP胆管引流,降低胆系感染风险。胰腺及坏死物所感染的细菌多为单细菌感染,多重感染较少,多为大肠杆菌或葡萄球菌。早期最常见的感染机制为肠道细菌移位及胆系感染,细菌多为大肠杆菌。后期的感染则归咎于院内感染,大肠杆菌向葡萄球菌快速转变,可能与住院时间较长或针对革兰阴性细菌预防性应用抗生素有关[2,12-13]。长期应用广谱抗生素可能会导致多重耐药菌甚至真菌感染。
针对部分易感人群(如胆源性、高龄、免疫低下等),可预防性应用能通过血胰屏障的抗生素,如喹诺酮类、头孢菌素、碳氢酶烯类及甲硝唑等[2]。
本研究中,老年(60岁及以上)病人353例,死亡28例(7.9%),非老年病人918例,死亡36例(3.9%)。老年组病死率明显高于非老年组。心肺功能差,限制早期液体复苏速度,未能及时降低尿素氮水平,并存病加重,可能是病死率高的主要原因[5]。年龄可能是死亡的独立预测因子。
对于胆源性胰腺炎,梗阻的结石或胆泥通常可自行通过,缓解梗阻症状。若梗阻持续,存在胆管炎的风险,应行ERCP胆道引流。
ACS通常在发病1周内出现。液体向第三间隙转移、过激的液体复苏、液体积聚及腹水均可能引起腹内压升高。持续的腹内压升高(持续>20 mmHg)被认为是ACS的前兆,并新发器官功能衰竭[14]。
经胃管或肛管行肠减压,腹部外敷芒硝,调整补液为入出平衡甚至负平衡,并应用药物提高腹肌顺应性。对于机械通气的病人,可给予肌松剂,进一步松弛腹肌。对于出现腹内高压的液体积聚可行PCD治疗。开腹减压对预后没有益处,而且会增加了病原菌感染的风险。
PCD是处理局部并发症的重要手段。一旦感染形成,必须给予及时有效的处理,才能有较好的预后[1]。
Lancet的数据显示当重症急性胰腺炎出现感染性坏死时,病死率极高[5]。本研究的数据也显示开腹坏死组织清除的病例病死率均低于重症急性胰腺炎平均病死率,进一步说明存在感染性坏死时,通过分批分次更换更大直径导管持续引流有助于改善病人的一般状态,降低全身炎症反应,减少新发器官功能障碍。一旦出现难以通过抗生素及单纯穿刺引流控制的病情加重,积极手术可以降低病死率。本文中,持续器官功能障碍病人坏死伴感染与否,病死率无明显差异。反映出积极采取外科干预手段,有利于病人从中获益。
包裹性坏死常常与胰腺假性囊肿相混淆。前者在CT上表现为厚壁,均匀背景内见较高密度的实性碎片。如引流液涂片见病原菌或CT提示气泡征,即可诊断感染性坏死,需要有创干预。有创干预包括内镜经胃腔引流或坏死组织清除术、经皮肾镜、电切镜、腹腔镜或开腹坏死组织清除术[15]。如果可能,有创干预最好延迟到发病后4周,以利于坏死物包裹,易行坏死组织清除术。
如假性囊肿长径<6 cm,且无症状,可暂不处理。若出现压迫症状、继发感染或长径>6 cm,经过3个月仍不吸收则需要行PCD或经内镜引流。若引流不畅,需外科手术干预。术前可行MRCP或ERCP检查,明确囊腔是否与主胰管相通。
两种微创外科清创技术被广为认可[16-18]:经窦道内镜手术及内镜辅助坏死组织清除术。国外报道两种入路均沿PCD瘘道进行。与开腹相比,死亡率下降一半,由38%下降至19%,器官功能障碍的发生率也较低[18]。我们科室改进以上技术为术中超声引导穿刺、扩皮,一次置入肾镜,对坏死腔进行彻底清创,尽可能减少反复PCD及微创手术次数,术后3 d病人即可带管出院。后腹腔镜入路:腋中线肋缘下切口,于腹膜后建立人工隧道制造气腹,置入腹腔镜器械,经腹膜后入路到达胰周坏死区域,应用吸引器及无创抓钳清除坏死组织,并置引流管引流(图1、2)。
经典术式为开腹清创引流,打开后腹膜,钝性分离坏死组织,将其清除,尽可能多地保留健康的胰腺组织,减少周围器官损伤、术后出血、消化道瘘及胰瘘。开腹手术病死率较高,可能与对本已十分危重的病人进行手术打击所造成的应激状态加重有关,也可能与此时正逢持续器官功能障碍期有关。
重症急性胰腺炎的病程后期,无论是否进行有创干预,均需密切留意一些严重并发症。如脾静脉或门静脉血栓,胰源性门静脉高压,偶有脾动脉瘤破裂,可引起坏死腔腔内出血、消化道瘘等(图3、4)。后期出现肠梗阻也不容忽视(图5~7)。胰头区的炎症、包裹性积液或坏死物,致十二指肠梗阻,可置营养管,越过狭窄段,行肠内营养支持。对于胃瘫、肠梗阻及进食后腹痛、恶心呕吐的病人,建议通过外周中心静脉置管给予肠外营养。腹膜后及腹腔其他部位的炎症、坏死物甚至感染组织压迫导致纤维组织机化挛缩造成下消化道梗阻仍需要重视。腹部正位片或CT可见孤立的肠管扩张(左上腹或中腹部),甚至结肠中断征(结肠脾曲或降结肠内无气体影)。若经肠梗阻导管减压等积极保守治疗仍无法缓解,建议手术治疗。手术清除坏死物的同时,处理狭窄段肠管。但具体干预方式及时机尚无共识。
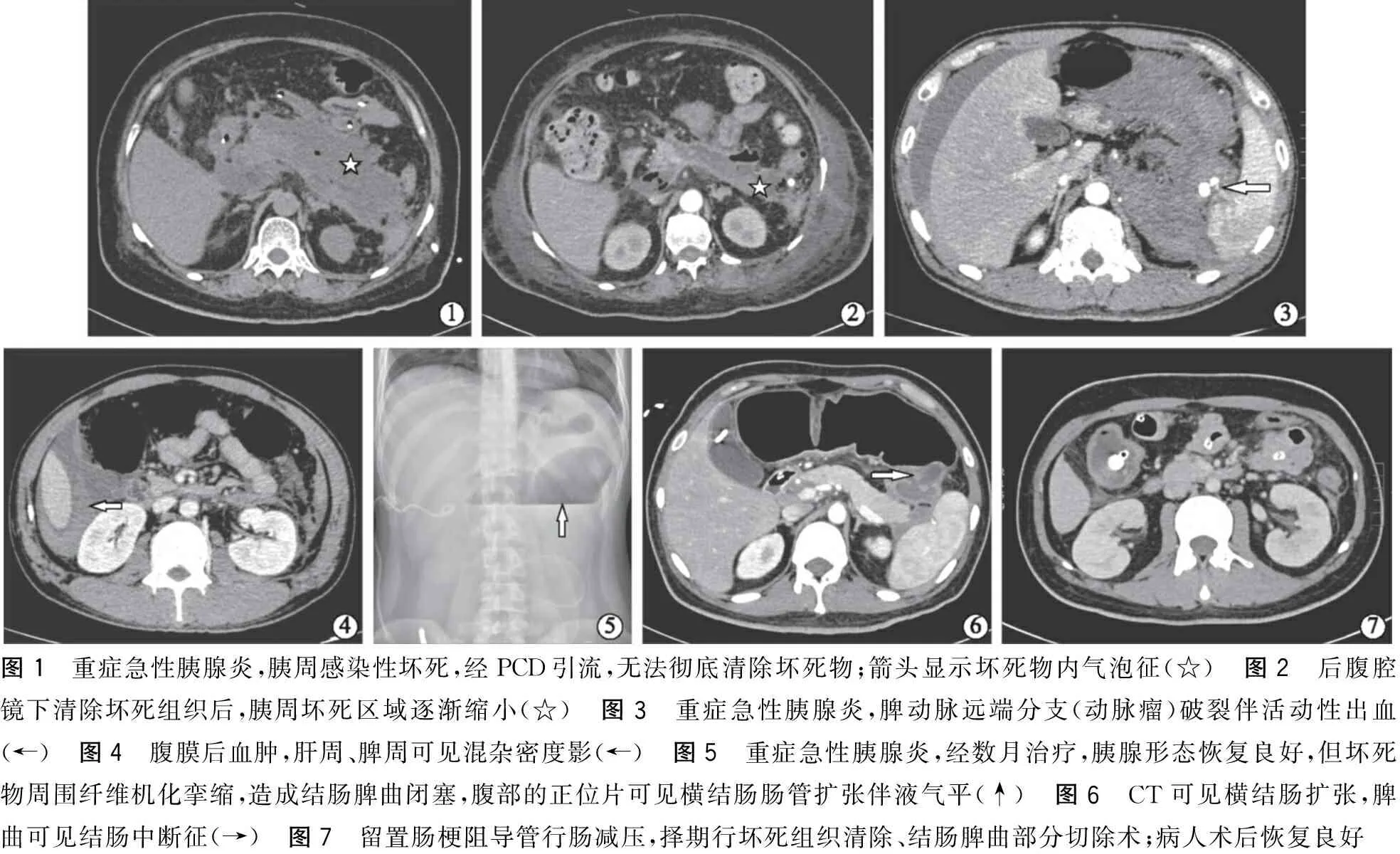
图1 重症急性胰腺炎,胰周感染性坏死,经PCD引流,无法彻底清除坏死物;箭头显示坏死物内气泡征(☆) 图2 后腹腔镜下清除坏死组织后,胰周坏死区域逐渐缩小(☆) 图3 重症急性胰腺炎,脾动脉远端分支(动脉瘤)破裂伴活动性出血(←) 图4 腹膜后血肿,肝周、脾周可见混杂密度影(←) 图5 重症急性胰腺炎,经数月治疗,胰腺形态恢复良好,但坏死物周围纤维机化挛缩,造成结肠脾曲闭塞,腹部的正位片可见横结肠肠管扩张伴液气平(↑) 图6 CT可见横结肠扩张,脾曲可见结肠中断征(→) 图7 留置肠梗阻导管行肠减压,择期行坏死组织清除、结肠脾曲部分切除术;病人术后恢复良好
1 Baron TH.Managing severe acute pancreatitis.Cleve Clin J Med,2013,80:354-359.DOI: 10.3949/ccjm.80gr.13001.
2 Cacopardo B,Pinzone M, Berretta S,et al.Localized and systemic bacterial infections in necrotizing pancreatitis submitted to surgical necrosectomy or percutaneous drainage of necrotic secretions.BMC Surg,2013,13 Suppl 2:S50. DOI:10.1186/1471-2482-13-S2-S50.
3 中华医学会外科学分会胰腺外科学组.急性胰腺炎诊治指南(2014版).中华消化外科杂志,2015,14:1-5.DOI:10.3760/cma.j.issn.1673-9752.2015.01.001.
4 Tenner S,Baillie J,DeWitt J,et al.American college of gastroenterology guideline: management of acute pancreatitis.Am J Gastroenterol,2013,108:1400-1416. DOI:10.1038/ ajg.2013.218.
5 Lankisch PG,Apte M,Banks PA.Acute pancreatitis. Lancet,2015,386:85-96.DOI:10.1016/S0140-6736(14)60649-8.
6 Tan YH, Rafi S, Tyebally Fang M,et al.Validation of the modified Ranson versus Glasgow score for pancreatitis in a Singaporean population.ANZ J Surg,2015.DOI:10.1111/ ans. 13139.
7 Minkov GA,Halacheva KS,Yovtchev YP,et al. Pathophysiological mechanisms of acute pancreatitis define inflammatory markers of clinical prognosis. Pancreas,2015,44:713-717.DOI:10.1097/MPA.0000000000000329.
8 Gress TM,El-Omar EM.Revision of the Atlanta classification of acute pancreatitis: the editorial perspective.Gut,2013,62:1.DOI:10.1136/gutjnl-2012-304051.
9 IAP/APA evidence-based guidelines for the management of acute pancreatitis.Pancreatology,2013,13:e1-15. DOI:10.1016/j.pan.2013.07.063.
10Yokoe M,Takada T,Mayumi T,et al.Japanese guidelines for the management of acute pancreatitis: Japanese Guidelines 2015.J Hepatobiliary Pancreat Sci,2015,22: 405-432.DOI: 10.1002/jhbp.259.
11Li JY,Yu T,Chen GC,et al.Enteral nutrition within 48 hours of admission improves clinical outcomes of acute pancreatitis by reducing complications: a meta-analysis.PLoS One,2013,8:e64926.DOI:10.1371/journal.pone.00 64926.
12Werge M,Novovic S,Schmidt PN,et al.Infection increases mortality in necrotizing pancreatitis:a systematic review and meta-analysis.Pancreatology,2016,16:698-707.DOI: 10.1016/j.pan.2016.07.004.
13Dupont B,Musikas M,Dao MT,et al.Timing and route of enteral nutrition in severe acute pancreatitis?.Pancreas,2016,45:e20.DOI:10.1097/MPA.0000000000000560.
14Smit M,Buddingh KT,Bosma B,et al.Abdominal compartment syndrome and intra-abdominal ischemia in patients with severe acute pancreatitis.World J Surg,2016,40:1454-1461.DOI:10.1007/s00268-015-3388-7.
15Kikuchi S,Watanabe Y,Sato K,et al.Minimally invasive necrosectomy using resectoscope for intractable necrotic abscess after severe acute pancreatitis: report of a case. Surg Today,2015,45:1442-1445.DOI:10.1007/s00595-014-1063-5.
16郭佐铭,孙备,白雪巍,等.经皮穿刺置管引流在重症急性胰腺炎继发腹腔感染中的应用.腹部外科,2013,26:158-160. DOI:10.3969/j.issn.1003-5591.2013.03.007.
17da Costa DW,Boerma D,van Santvoort HC,et al.Staged multidisciplinary step-up management for necrotizing pancreatitis.Br J Surg,2014,101:e65-e79.DOI: 10.1002/bjs.e9346.
18van Brunschot S,van Grinsven J,Voermans RP,et al.Transluminal endoscopic step-up approach versus minimally invasive surgical step-up approach in patients with infected necrotising pancreatitis (TENSION trial): design and rationale of a randomised controlled multicenter trial [ISRCTN09186711].BMC Gastroenterol, 2013,13:161.DOI: 10.1186/1471-230X-13-161.
Analysis of 1271 cases of moderately severe acute pancreatitis
YangXing,GuoKejian,SongShaowei,GeChunlin.
DepartmentofPancreaticSurgery,theFirstAffiliatedHospitalofChinaMedicalUniversity,Shenyang110001,China
Correspondingauthor:GeChunlin,Email:xingyang2001@163.com
Objective To investigate the etiology,diagnosis,treatment and prognosis of severe acute pancreatitis (SAP).Methods The clinical data of 1 271 adult cases of SAP were analyzed retrospectively from August 2010 to July 2016 in the Department of Pancreatic Surgery,the First Affiliated Hospital of China Medical University.Results 1 144 cases (90.0%) were diagnosed as moderately severe acute pancreatitis,and 127 cases (10.0%) as SAP.Invasive interventions were undertaken in 332 cases (26.1%),which included CT or ultrasonographic guided percutanous catheter drainage (72 cases,111 times),retrograde endoscopic sphincterotomy (42 cases),open approach (37 cases),percutanous nephroscopic necrosectomy (PCN) (3 cases),and retroperitoneal laparoscopic necrosectomy (1 case).182 cases (54.8%) of biliary pancreatitis were treated via laparoscopic or open cholecystectomy to prevent recurrent attacks.Sixty-four cases (5.0%) died,and the total cure rate was (95.0%).Mortality rate of MSAP and SAP was 0.3% and 48.0% respectively.Mortality rate of gerontal and non-gerontal cases was 7.9% and 3.9% respectively.Mortality rate of PCN and necrectomy was 19.4% and 32.4% respectively.There was no significant difference in mortality between sterile and infected necrosis.Conclusions Individualized step-up therapy of SAP should be performed according to the etiology,classification and local and/or systemic complications.Active intervention can reduce the total mortality rate of SAP.
severe acute pancreatitis; etiology; treatment; prognosis
·论 著·(重症急性胰腺炎专题)
沈阳市科学技术计划项目(F13-220-9-01)
110001 沈阳,中国医科大学附属第一医院胰腺外科
葛春林,Email:xingyang2001@163.com
R657.5+1
A
10.3969/j.issn.1003-5591.2016.06.003
2016-09-19)

