不同光照强度对格木苗木生长和生理生化特性的影响
林 凡,马松亚,潘 锋,龙秋宁,钟 宏,杨 梅*
(1.广西苍梧县白南林场,广西梧州 543000;2.广西大学林学院,广西南宁 530004)
不同光照强度对格木苗木生长和生理生化特性的影响
林 凡1,马松亚2,潘 锋1,龙秋宁2,钟 宏1,杨 梅2*
(1.广西苍梧县白南林场,广西梧州 543000;2.广西大学林学院,广西南宁 530004)
摘要[目的]研究不同光照强度下格木苗木生长和生理生化特性变化,探讨苗木对不同光照条件的响应特征。[方法] 对1年生格木实生苗进行自然全光照(NS)、60%NS、30%NS和15%NS 4种不同光照处理,处理结束后测定苗木生长与生理生化指标。[结果]①苗高及地径的生长量和生物量,在不同的光照下呈现不同的变化,在30%NS处理下达到最大,与全光照相比差异显著。②叶绿素a、b和总含量随着光照强度的减弱呈逐渐上升的趋势,在15%NS处理下达到最大,叶绿素a/b的变化比较缓和,随着光照强度的减弱呈现均匀下降的趋势;③可溶性蛋白和可溶性糖的含量随着光照强度的减弱先上升后下降,在30%NS处理下达到最大值,而游离脯氨酸含量受遮光强度的影响不显著;④SOD活性、CAT活性以及MDA含量均随着光照强度的减弱呈上升的趋势,在15%NS处理时达到最大值,POD活性在30%NS处理下最大。[结论]格木幼龄期需要适度遮阴,光强在不超过30%NS时苗木生长较好。
关键词格木;光照环境;生物量;生理生化响应
格木(ErythrophleumfordiiOliv)为苏木科格木属常绿高大乔木,主要分布于广东、广西、浙江、福建和台湾等地,生长于800 m以下的低山丘陵地带[1],是亚热带常绿珍贵用材树种。近年来由于人们乱砍滥伐,导致野生格木种群数量急剧减少,格木已被列为国家二级重点保护的珍稀濒危植物之一[2]。
格木幼龄稍耐阴,中龄后喜光,若幼树长期处于林荫下,则生长不良,甚至死亡[3]。目前对格木的研究主要集中在生物学特性、群落学特征、育苗造林技术、苗期生长变异、濒危机制和保护对策等方面[4-11],而对格木在不同光照环境下的适应性研究较少。光是植物生长必需的条件之一,其对植物的生长发育、生理生化和形态结构等方面有着重要的影响。何维明等指出,植物体可通过改变生物量分配和形态变化来适应光照强度的改变[12-13]。随着光照强度的减弱,植物叶绿素含量增加,其比例会发生改变,从而更好地利用环境光能对其生长进行补偿[14]。在很多情况下,幼苗更新与森林光环境异质性特别是与光照强度具有较强的关联性[15-17]。光照增强对于一些树种幼苗的生长和存活比较有利[18],也有一些树种在荫蔽的情况下生长较好[19]。然而,过于荫蔽也会导致幼苗的生长和存活率降低[20]。还有一些树种幼苗萌发与生长对光环境的反应比较弱,但长期生长离不开光环境的改善。研究发现1年生幼苗的存活率与光照强度只有微弱的正相关,长时间(10 a)生长幼苗的存活率却强烈受光照强度影响[21]。可见,探讨林木幼苗生长及生理生化特性对光照强度的响应具有重要的科学意义。该研究从生长及生理生化的变化等方面阐释了格木苗对不同光照强度的响应,筛选出较适合格木生长的光照强度,从而为格木苗木繁育、林分光照环境调控等提供参考,也为进一步研究格木光环境的响应及机理提供理论基础。
1材料与方法
1.1试验区概况试验于2014年6月1日~9月30日在广西大学林学院苗圃(108°17′14″E,22°51′20″N)进行,该区属湿润的亚热带季风气候,阳光充足,雨量充沛,霜少无雪,气候温和,夏长冬短,年平均气温为21.6 ℃左右,年均降雨量达1 304.2 mm,平均相对湿度为79%。
1.2试验设计试验材料为1年生格木实生苗,来自广西苍梧县白南林场。选择均匀一致、生长健康的格木幼苗种植在直径21 cm、高 17 cm的黑色营养杯中,以沙子∶珍珠岩(3∶1)作为栽培基质,每杯1株。试验采用随机区组设计,分为4组,每组15株,分别移入已搭建好的遮雨棚(1.5 m×2.0 m×1.5 m)中,每杯苗间隔0.3 m,待生长稳定后进行不同的遮光处理。以不覆盖遮阴网的处理为对照(即自然全光照,NS),其他3个处理的遮雨棚分别覆盖1、2、3层遮阴网(单层遮光率为40%,用遮阴网将遮雨棚的上方和四周进行遮挡,层数也相互一致),使这3个棚内光照强度分别降低至60%NS、30%NS和15%NS,棚间距1 m。试验期间每隔1 d统一浇水,使土壤含水量保持在70%~80%。遮光试验时间为2014年6月1日~9月30日。
1.3苗高、地径及生物量测定遮光处理开始时用钢卷尺、游标卡尺分别测量每株苗高、地径,之后每月20日定期进行生长监测,每处理定株测定8株[22]。遮光处理结束时,分别测定每株苗高、地径。收获植株经105 ℃、15 min 杀青后于70 ℃烘干至恒重,分别对叶、茎、根进行称重。
1.4生理生化指标测定生理生化指标的测定参照李合生[23]的方法进行。遮光处理结束后,选择生长一致成熟的功能叶片(从上往下数第3~5片叶子)进行生理生化指标的测定。采用95%乙醇提取叶绿体色素;超氧化物歧化酶(SOD)活性采用氮蓝四唑比色法测定;过氧化物酶(POD)活性采用愈创木酚法测定;过氧化氢酶(CAT)活性采用紫外吸收法测定;丙二醛(MDA)含量采用硫代巴比妥酸法测定;可溶性糖含量采用恩酮比色法测定;可溶性蛋白含量采用紫外光吸收法测定;游离脯氨酸含量采用酸性茚三酮法测定。
1.5数据处理采用SPSS 20.0 软件对数据进行统计分析。在方差具有齐性(P>0.05)的情况下,就遮光处理对各生长和生理指标的影响进行单因素方差分析,多重比较采用最小显著性差异法。在方差不齐时,对数据取对数转换后再进行方差分析和多重比较。
2结果与分析
2.1不同遮光处理对格木苗生长的影响
2.1.1苗高与地径生长量。由表1可知,苗高生长量在30%NS处理下最大,为5.34 cm,最小值是在NS处理下,为2.54 cm,二者差值是2.80 cm,差异显著(P<0.05);各处理格木苗高生长量从大到小排序是:30%NS、15%NS、60%NS、NS。各处理格木地径生长量变化趋势和苗高一致。总之,随着光照强度的降低,格木苗高和地径生长量呈先上升后下降的趋势,均在30%NS处理下最大,而在NS处理下最小。
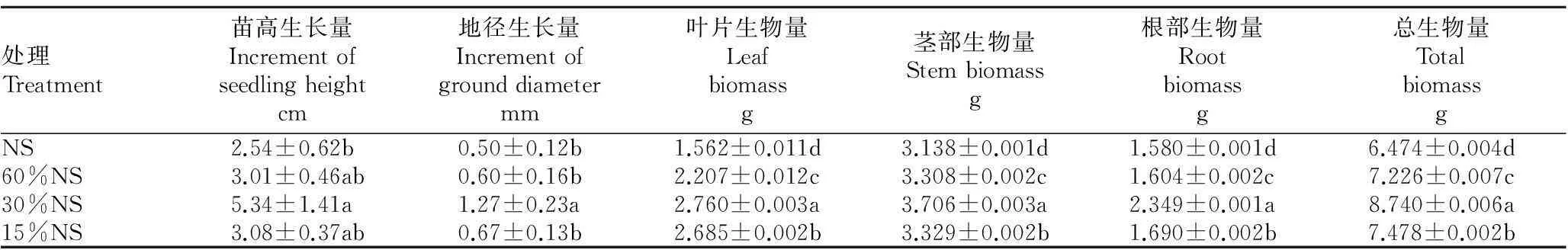
表1 不同遮光处理对格木苗生长的影响
注:同列数据后小写字母不同表示各处理差异显著(P<0.05)。下同。
Note: Lowercases in the same row indicated significant differences (P< 0.05),the same as follows.
2.1.2生物量。由表1可知,各处理格木苗叶片生物量、茎部生物量、根部生物量以及总的生物量从大到小排序均为:30%NS、15%NS、60%NS、NS,与不同光照对格木苗高和地径生长量的影响相一致。叶片、茎部和根部生物量以及总的生物量在不同处理间差异显著(P<0.05),30%NS处理下叶片、茎部及根部生物量和总的生物量分别是NS处理下的1.77倍、1.18倍、1.49倍和1.35倍。
2.2不同遮光处理对格木苗叶片叶绿素含量的影响由表2可知,不同处理间叶绿素a、叶绿素b和叶绿素总量均随着遮光强度的增加而持续增高,在30%NS和15%NS处理下叶片叶绿素值均较大,在NS处理下叶片叶绿素值最小,各处理间差异显著(P<0.05),叶绿素b含量的增加幅度比叶绿素a要大。叶绿素a、叶绿素b和叶绿素总量最大值分别是最小值1.87倍、2.12倍和1.93倍。叶绿素a/b随着遮光强度的增加而逐渐降低,15%NS处理下最小,在NS处理下最大。
表2不同遮光处理下格木苗叶片叶绿素含量
Table 2Chlorophyll content ofE.fordiileaves under different illumination treatments
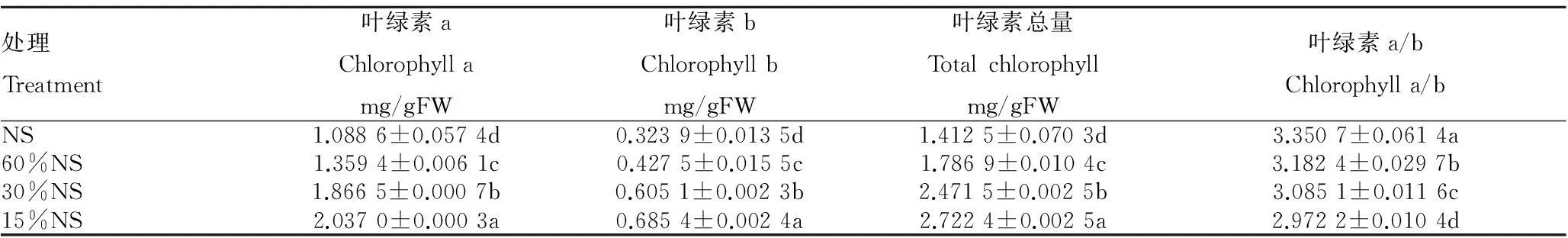
处理Treatment叶绿素aChlorophyllamg/gFW叶绿素bChlorophyllbmg/gFW叶绿素总量Totalchlorophyllmg/gFW叶绿素a/bChlorophylla/bNS1.0886±0.0574d0.3239±0.0135d1.4125±0.0703d3.3507±0.0614a60%NS1.3594±0.0061c0.4275±0.0155c1.7869±0.0104c3.1824±0.0297b30%NS1.8665±0.0007b0.6051±0.0023b2.4715±0.0025b3.0851±0.0116c15%NS2.0370±0.0003a0.6854±0.0024a2.7224±0.0025a2.9722±0.0104d
2.3不同遮光处理对格木苗叶片渗透调节物质含量的影响由表3可知,可溶性蛋白和可溶性糖均随着遮光强度的增加呈先上升后下降的趋势,并在30%NS处理下达到最大值,而游离脯氨酸含量变化不明显。当光照强度大于30%NS时,各处理间可溶性蛋白含量差异不显著,而在15%NS处理下显著减少;可溶性糖含量在30%NS处理下最大,是最小值(NS处理)的2.55倍。
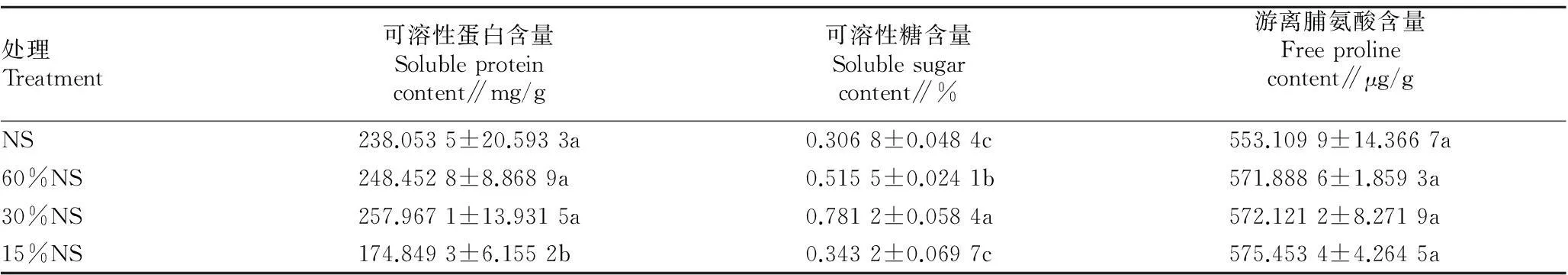
表3 不同遮光处理下格木苗叶片渗透调节物质的含量
2.4不同遮光处理对格木苗叶片抗氧化酶活性以及MDA含量的影响由表4可知,SOD和CAT活性和MDA含量均随着遮光强度的增加呈上升的趋势,POD活性随着遮光强度的增加先上升后下降,MDA含量、SOD活性、POD活性这3个指标在30%NS处理下与NS处理下差异显著(P<0.05)。SOD活性和MDA含量在15%NS处理时最大,而15%NS和30%NS处理间差异不显著;CAT酶活性在15%NS处理下大幅度升高,与其他处理差异显著;POD活性在30%NS处理下最大,达到NS处理下的3.15倍。
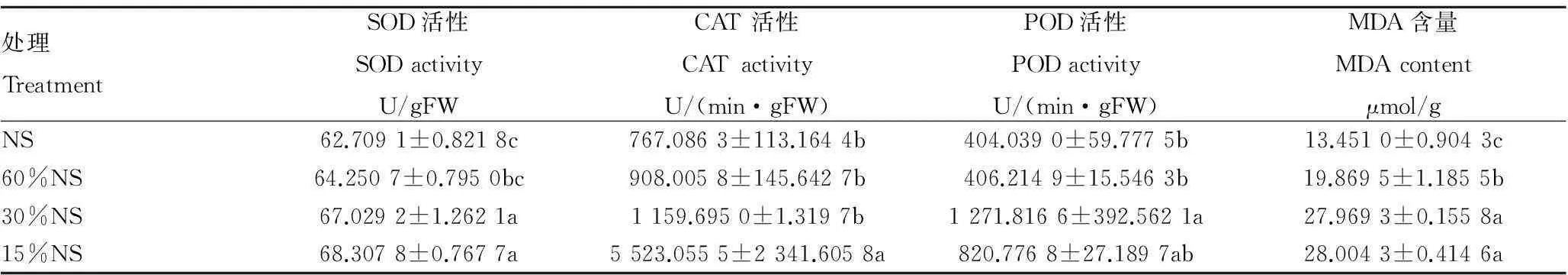
表4 不同遮光处理下格木苗叶片抗氧化酶活性以及MDA含量
注:SOD酶活力以NBT被抑制50%为1个酶活性单位(U/gFW);POD酶活力以1 min内A470变化0.01所需酶量为1个活性单位[U/(min·g FW)]; CAT酶活力以1 min内A240值变化0.01所需酶量为1个活性单位[U/(min·gFW)]。
Note: One unit of SOD enzyme activity was 50% inhibition of NBT (U/gFW).One unit of POD enzyme activity was the enzyme amount within 0.01 change ofA470in 1 min,which was denoted by U/(min·gFW).One unit of CAT enzyme activity was the enzyme amount within 0.01 change ofA240in 1 min,which was denoted by U/(min·gFW).
3结论与讨论
由于不同植物的生物学特性差异,有些植物生物量的积累随着光照强度的增加而增加,有些植物需要适度遮阴,过度遮阴或过度光照均不利于其生物量的积累[24-27]。Veenendaal等[28]报道了西非15种树种幼苗相对生长率在16%~27%全光照环境中最高,高于这一光照强度时幼苗相对生长率降低。该研究中当光照强度大于30%NS时,由于光照较强,抑制了格木苗的生长;当光照强度在15%NS~30%NS时,格木苗总体生长情况较好,植物固定CO2所合成的有机物质满足植株生长的需求。在不同处理下,随着光照强度的减弱,格木苗高、地径以及生物量呈现相同的变化规律,均在30%NS处理达到最大值,说明此光强最适合幼苗生长。
植物体内叶绿素的含量和比例是植物适应和利用环境因子的重要指标[29]。随着光强的减弱,植物为了更好地利用环境光能,通常会通过增加叶绿素含量来对生长进行补偿[14]。在光强减弱时,格木苗叶绿素a、b以及总含量不断增加,并在15%NS处理下值最大,且叶绿素b含量增加比叶绿素a显著,有利于提高植株的捕光能力,提高光能利用率,这是对弱光环境的一种适应,而且叶绿素a/b随着光照强度的减弱而降低,有利于对弱光的利用。格木苗叶片中可溶性糖和可溶性蛋白含量在30%NS处理下达最大,叶绿素含量也较高,促进了苗木的生长。可溶性糖和可溶性蛋白也是重要的有机渗透调节物质,格木苗通过增加其含量来降低细胞原生质的渗透势[30],维持植物体内的渗透平衡,以适应光照条件的变化,而格木苗叶片中游离脯氨酸含量没有显著变化,表明其对光照强度的变化不敏感。
在逆境胁迫下,植物叶片中超氧阴离子、过氧化氢等活性氧的含量明显升高,会引起膜脂过氧化,MDA即是膜脂过氧化的最终产物[31],植物清除体内的过量活性氧主要依赖于植株体内的抗氧化酶[32]。随着光照强度的下降,MDA含量升高,膜质过氧化程度加剧,同时SOD和CAT的活性也随之加强,在15%NS处理下活性达到最高,表明这2种酶在清除由弱光胁迫产生的活性氧时始终起到重要作用。 POD活性随遮光强度的增加先上升后下降,在30%NS处理下活性最强,光照强度持续下降时,超过POD活性的调节能力范围,导致其活性下降。可见,格木苗可通过自身的调节机制,维持较高的抗氧化酶活性,及时清除活性氧自由基,抑制膜脂过氧化产物MDA的大量生成,保护膜的结构和功能的完整,以适应弱光环境。
综上所述,不同的光照对格木苗木生长及生理生化特性产生了显著的影响。光照强度保持在30%NS和15%NS之间时,格木苗能够较好生长,当光照强度在30%NS时,格木苗生长最好,具有较好的生理适应性,有机物质积累较多。由于格木幼龄期较喜阴,因此在苗木培育时,应提供适宜的光照环境,在造林及林分经营过程中,选择合适的混交树种,适时调整林分密度或形成林隙,营造适宜的光照强度,以利于格木幼龄期的生长。
参考文献
[1] 火树华.树木学[M].2版.北京:中国林业出版社,1992:148-149.
[2] 傅立国,金鉴明.中国植物红皮书:第一册[M].北京:科学出版社,1992:378.
[3] 李胜强,许建新,陈波,等.珍稀植物格木的研究进展[J].广东林业科技,2008,24(6):61-64.
[4] 余栋华,黎新宇,陈耀辉,等.格木育苗技术研究[J].广东林业科技,2007,23(5):95-97.
[5] 余正国,罗建华.格木育苗技术试验研究[J].热带林业,2007,35(1):22-23.
[6] 易观路,罗建华,林国荣,等.不同处理对格木种子发芽的影响[J].福建林业科技,2004,31(3):68-70.
[7] 唐继新,麻静,贾宏炎,等.南亚热带珍稀濒危树种格木生长规律研究[J].中南林业科技大学学报,2015(7):37-44.
[8] 魏识广,李林,刘海岗,等.鼎湖山格木种群动态分析[J].生态环境,2008,17(1):285-289.
[9] 邓华格,温志滔,缪绅裕,等.广东罗浮山珍稀濒危植物多样性及格木群落特征[J].广东林业科技,2010(3):35-41.
[10] 赵志刚,郭俊杰,曾杰,等.广西大明山格木种群的空间分布格局与数量动态特征[J].林业科学,2014(10):1-7.
[11] 史军辉,黄忠良,蚁伟民,等.渐危植物格木群落动态及其保护对策[J].西北林学院学报,2005,20(3):65-69.
[12] 何维明,钟章成.攀援植物绞股蓝幼苗对光照强度的形态和生长反应[J].植物生态学报,2000,24(3):375-378.
[13] 张露,郭联华,杜天真,等.遮阴和土壤水分对毛红椿幼苗光合特性的影响[J].南京林业大学学报(自然科学版),2006,30(5):63-66.
[14] 王艺,韦小丽.不同光照对植物生长、生理生化和形态结构影响的研究进展[J].山地农业生物学报,2010(4):353-359,370.
[15] HAN Y Z,WANG Z Q .Spatial heterogeneity and forest regeneration[J].Chin J Appl Ecol,2002,13(5):615-619.
[16] SCHOLES J D,PRESS M C,ZILLERLEN S W.Differences in light energy utilization and dissipation between dipterocarp rain forest tree seedings[J].Oecologia,1997,109:41-48.
[17] THOMAS T L,MARTIN J L.Diverse responses of maple saplings to forest light regimes[J].Annals Bot,1998,82:9-19.
[18] DEKKER M,DE GRAAF N R.Pioneer and climax tree regeneration following selective logging with silviculture in Suriname[J].For Ecol Man,2003,172:183-190.
[19] BROWN N D,WHITMORE T C .Do dipterocarp seedings really partition tropical rain forest gaps?[J].Phil Trans R Soc Lond B,1992,335:369-378.
[20] JULIETTEM G B,PETER J G.Growth and mortality in high and low light:Trengs among 15 shade-tolerant tropical rain forest tree species[J].J Ecol,2003,91:77-85.
[21] BARKER G M.Photosynthetic characteristics of dipterocarp seeding in three tropical rain forest light environments:A basis for niche partitioning?[J].Oecologia,1997,112:453-463.
[22] 李大伟.山桐子主要性状变异及优株选择研究[D].北京:中国林业科学研究院,2010.
[23] 李合生.植物生理生化实验原理和技术[M].北京:高等教育出版社,2004:214-217.
[24] TOLEDO-ACEVES T,SWAINE M D.Biomass allocation and photosynthetic responses of lianas and pioneer tree seedlings to light[J].Acta oecologica,2008,34(1):38-49.
[25] 陈昕,张红星,张振英.黄山花楸幼苗对遮荫的形态、解剖和光合生理响应[J].东北林业大学学报,2012,40(10):24-27,33.
[26] 李冬林,向其柏.光照条件对浙江楠幼苗生长及光合特性的影响[J].南京林业大学学报(自然科学版),2004,28(5):27-31.
[27] 闫兴富,曹 敏.林窗对热带雨林冠层树种绒毛番龙眼幼苗生长的影响[J].应用生态学报,2008,19(2):238-244.
[28] VEENENDAAL E M,SWAINE M D,LECHA R T,et al Responses of West African forest tree seeding to irradiance and soil fertility[J].Functional ecology,1996,10:501-511.
[29] SUN T G,SHA W,LIU Y.The effects of compound heavy metal stress on some physiological characteristics of two moss species[J].Acta ecologica sinica,2010,30(9):2332-2339.
[30] 李衍素,高俊杰,陈民生,等.高温胁迫对豇豆幼苗叶片膜伤害与保护性物质的影响[J].山东农业大学学报(自然科学版),2007,38(3):378-382.
[31] CHAOUI A,MAZHOUDI S,GHORBAL M H.Cadmium and zinc induction of lipid peroxidation and effects on antioxidant enzyme activities in bean (PhaseolusvulgarisL.)[J].Plant Sci,1997,127(2):139-147.
[32] 刘凯歌,朱月林,郝婷,等.叶面喷施6-BA对高温胁迫下甜椒幼苗生长和叶片生理生化指标的影响[J].西北植物学报,2014(12):2508-2514.
Effects of Illumination Intensity on the Growth and Physiological Characteristics ofErythrophleumfordiiOliv Seedlings
LIN Fan1,MA Song-ya2, PAN Feng1, YANG Mei2*et al
(1.Bainan Forest Farm of Cangwu County,Wuzhou,Guangxi 543000; 2.College of Forest,Guangxi University,Nanning,Guangxi 530004)
Abstract[Objective] To study the growth and physiological changes of Erythrophleum fordii Oliv seedlings under the different light conditions and to discuss the responses of seedlings to these illumination intensities.[Method] The 1-year-old Erythrophleum fordii Oliv seedlings were treated under the condition of different illumination intensities,such as nature sunlight (NS),60% NS,30% NS and 15% NS.After the end of the treatment,seedling growth and physiological index were detected.[Result] (1) The seedling height,ground diameter growth and biomass showed different changes under different light intensities,and the maximum was achieved under 30% NS illumination.(2) With the decrease of light intensity,chlorophyll-a,chlorophyll-b and total chlorophyll increased gradually,and the maximum value were presented in 15% NS.The chlorophyll a/b declined gradually with the decrease of light intensity.(3) The content of soluble protein and soluble sugar increased firstly and then declined with the decrease of light intensity,and reached the maximum at 30% NS,while the free proline content was not significantly affected by the light intensity.(4) The SOD activity,CAT activity and MDA content increased with the decrease of light intensity,which were the highest in the treatment of 15% NS,and the activity of POD was the highest in 30% NS.[Conclusion] Moderate shade is needed for E.fordii at juvenility period,and the seedling grows better when the light intensity was 30% NS.
Key wordsErythrophleum fordii Oliv; Illumination environment; Biomass; Physiological and biochemical response
基金项目梧州市2015年科学研究与技术开发项目(梧科[2015]30号201501027);国家自然科学基金项目(31260176)。
作者简介林凡(1971- ),男,广西苍梧人,工程师,从事森林培育、木材加工生产与科研工作。*通讯作者,教授,博士,从事森林培育领域的教学与研究工作。
收稿日期2016-02-23
中图分类号S 718.51+2
文献标识码A
文章编号0517-6611(2016)08-170-04

