复合纳米颗粒中白藜芦醇-大麦醇溶蛋白相互作用研究
管 骁,刘 静,殷 婷,李景军,廖丽丽
1. 上海理工大学医疗器械与食品学院,上海 200093 2. 上海海事大学信息工程学院,上海 200135 3. 江苏长寿集团股份有限公司,江苏 如皋 226500 4. 桂林西麦食品集团,广西 桂林 541004
复合纳米颗粒中白藜芦醇-大麦醇溶蛋白相互作用研究
管 骁1,刘 静2*,殷 婷1,李景军3,廖丽丽4
1. 上海理工大学医疗器械与食品学院,上海 200093 2. 上海海事大学信息工程学院,上海 200135 3. 江苏长寿集团股份有限公司,江苏 如皋 226500 4. 桂林西麦食品集团,广西 桂林 541004
为阐明大麦醇溶蛋白包覆白藜芦醇形成纳米颗粒的分子机制,采用荧光光谱、紫外吸收光谱以及傅里叶红外光谱和差示扫描量热技术等研究了白藜芦醇与大麦醇溶蛋白分子间的相互作用。结果表明:白藜芦醇与大麦醇溶蛋白分子的相互作用,对其内源性荧光具有猝灭作用,结合差示扫描量热的结果,推测二者通过静态猝灭过程形成了新的复合物;计算出两者之间的结合常数与结合位点数分别为KA(298 K)=2.21×105L·mol-1,KA(310 K)=1.53×104L·mol-1和n298 K=1.23,n310 K=0.94;依据热力学参数和傅里叶红外光谱判断白藜芦醇与大麦醇溶蛋白之间的作用力为范德华力和氢键相互作用;根据Förster非辐射能量转移原理,计算出白藜芦醇与大麦醇溶蛋白的结合距离为3.25 nm,能量转移效率为0.227;同步荧光检测结果表明白藜芦醇结合大麦醇溶蛋白分子后对其构象产生了明显影响,且该影响是由色氨酸残基所处环境的疏水性变化所致。
白藜芦醇;大麦醇溶蛋白;相互作用
引 言
白藜芦醇是一种天然的多酚类蒽醌萜化合物,又称茋三酚,具有广泛的生理药理活性。然而,白藜芦醇也存在对光敏感、易氧化、水溶性差、生物利用度低等问题,影响其在食品、保健品及医药领域的广泛应用[1]。有研究报道指出,为提高酚类物质的生物利用度,采用纳米颗粒形式对其保护是目前有效的手段之一[2-5]。
大麦醇溶蛋白作为谷物类醇溶蛋白的一种,具有来源广泛、提取工艺简单、价格低廉、具有良好的生物相容性与可降解性, 同时可一定程度上抗胃酸分解,是一种纳米给药系统的理想载体材料[6]。本课题组前期已成功制备出白藜芦醇-大麦醇溶蛋白纳米级复合颗粒,但对两种物质形成纳米颗粒的机制及相互作用问题还不甚了解。荧光光谱法是研究生物大分子与小分子相互作用的重要手段之一[7]。国内外利用荧光光谱法对小分子与蛋白之间的相互作用已有大量研究[8-10],但大多是研究各种小分子与血清白蛋白之间的相互作用机制,体系多为水溶液。大麦醇溶蛋白与血清白蛋白在分子结构与性质方面存在很大差异,它们与小分子相互作用的方式与机理是否相同仍未可知。同时,将差示扫描量热技术和傅里叶红外光谱技术与荧光光谱结合,对分子之间相互作用机制进行探讨的实验方法还未见报道。鉴于此,本实验将荧光光谱法、差示扫描量热法及傅里叶红外光谱法等方法结合在一起,研究了异丙醇溶液环境下白藜芦醇与大麦醇溶蛋白之间的结合作用,并考察了白藜芦醇对大麦醇溶蛋白构象的影响。可对白藜芦醇与大麦醇溶蛋白形成纳米颗粒给药系统的作用机理提供参考数据,对纳米颗粒给药系统制备条件的优化具有指导意义。
1 实验部分
1.1 仪器与试剂
Aqualog○R吸收和三维荧光扫描光谱仪(HORIBA Scientific);Nicolet 6700傅里叶变换红外光谱仪(Thermofisher,美国);Q2000差示扫描量热仪(TA,美国)。
配制55%(V/V)的异丙醇(分析纯)水溶液;大麦醇溶蛋白(实验室自制,纯度91.7%)贮备液:称取0.2 g大麦醇溶蛋白,溶于55%异丙醇溶液并定容至100 mL,摩尔浓度为5×10-5mol·L-1;白藜芦醇(纯度≥98%,天津市尖峰天然产物研究开发有限公司)贮备液:称取28.5 mg白藜芦醇,溶于55%异丙醇溶液并定容至100 mL,摩尔浓度为1.25×10-3mol·L-1。
1.2 方法
往一系列5 mL大麦醇溶蛋白贮备液中依次加入0,100,200,300,400和500 μL白藜芦醇贮备液,并用55%异丙醇定容至25 mL,混匀后测定荧光光谱(Δλex=280 nm, Δλem=300~400 nm,298和310 K)、同步荧光光谱(298 K,Δλ=60 nm和Δλ=15 nm)及与蛋白质分子比为1∶1的白藜芦醇的吸收光谱(298 K)。混合液随之通过液-液分散法,自组装得到白藜芦醇-大麦醇溶蛋白复合纳米颗粒,颗粒粒径约为70 nm,zeta电位约为9 mV。
对大麦醇溶蛋白纳米颗粒、白藜芦醇及白藜芦醇-大麦醇溶蛋白复合纳米颗粒进行差示扫描量热分析。条件为:以空铝盒作为参比,升温速率为10 ℃·min-1,从室温加热到300 ℃。
对大麦醇溶蛋白纳米颗粒、白藜芦醇及白藜芦醇-大麦醇溶蛋白复合纳米颗粒进行衰减全反射傅里叶变换红外光谱分析,波数范围为400~4 000 cm-1,分辨率为4 cm-1。
2 结果与讨论
2.1 白藜芦醇-大麦醇溶蛋白纳米颗粒的形成机制
2.1.1 荧光猝灭机理法
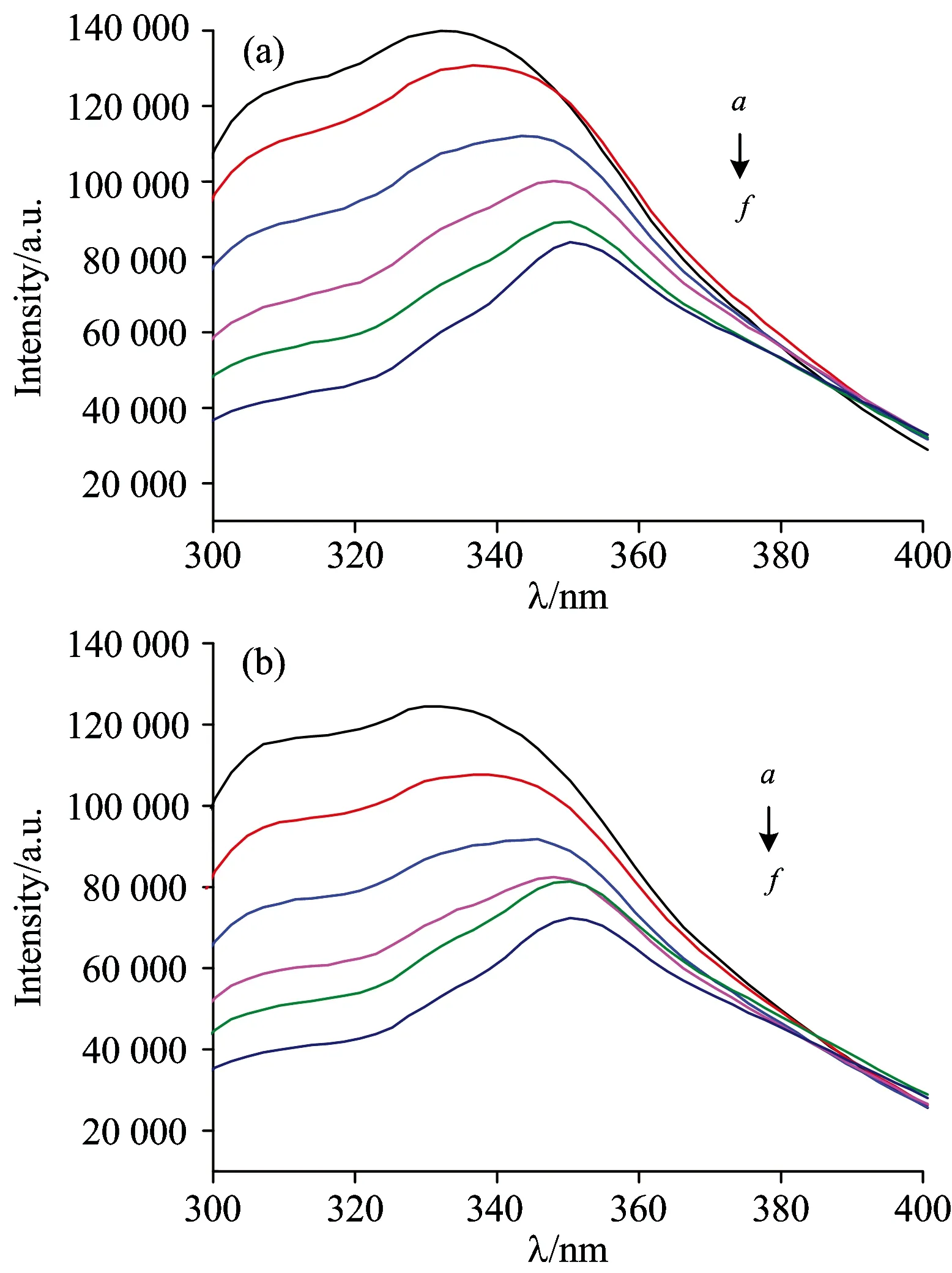
Fig.1 Fluorescence quenching spectra of hordein by various concentrations of resveratrol
向大麦醇溶蛋白溶液中加入白藜芦醇后,其荧光发生了规律性的猝灭,荧光猝灭光谱见图1。
荧光猝灭可分为动态和静态猝灭。蛋白质与小分子结合的相互作用关系遵循Stern-Volmer方程[11]
F0/F=1+Kqτ0c=1+KSVc
(1)
式中:F0和F分别为加入白藜芦醇前后大麦醇溶蛋白的荧光强度;Kq为双分子猝灭过程的速率常数;KSV为Stern-Volmer猝灭常数;τ0为猝灭剂(白藜芦醇)不存在时生物大分子(大麦醇溶蛋白)的平均寿命,一般为10-8s;c为猝灭剂的浓度。将实验数据处理后作图,如图2所示。

Fig.2 The Stern-Volmer curves of fluorescence quenching of hordein by resveratrol
由直线的斜率计算出猝灭常数,见表1。从表1中可以看出,随着温度的升高,KSV减小,根据猝灭常数随温度变化的趋势与猝灭类型的关系[12],说明白藜芦醇与大麦醇溶蛋白二者之间发生了静态猝灭,白藜芦醇与大麦醇溶蛋白形成了复合物。另一方面,298和310 K下对应的Kq远大于生物分子的最大碰撞扩散速率常数[2.0×1010L·(mol·s)-1][13],进一步推论,白藜芦醇对大麦醇溶蛋白的荧光猝灭是由于白藜芦醇与大麦醇溶蛋白形成的复合物引起的静态猝灭。

Table 1 Parameters of Stern-Volmer equation for the interaction between resveratrol and hordein
2.1.2 差示扫描量热法
差示扫描量热技术是一种检测多种成分之间的热力学兼容性的简便方法。对白藜芦醇纯品、大麦醇溶蛋白纳米颗粒及白藜芦醇-大麦醇溶蛋白复合纳米颗粒进行差示扫描量热分析,如图3、图4所示。
比较图4中的b和c可知,在形成白藜芦醇-大麦醇溶蛋白纳米颗粒后,体系的玻璃化转化温度由187 ℃降低到171 ℃,这可能是由于白藜芦醇作为一种低分子量的化合物,连接在了大麦醇溶蛋白的肽链之间,促进了肽链的流动性。另一方面,图3a中267 ℃处为白藜芦醇的熔融峰,而在纳米颗粒中,未观察到这一特征峰,可证实白藜芦醇与大麦醇溶蛋白不是简单的物理性混合,而是形成了复合物[14]。

Fig.3 DSC thermograms of resveratrola, hordein nanoparticlesband resveratrol-hordein nanoparticlesc

Fig.4 DSC thermograms of hordein nanoparticles band resveratrol-hordein nanoparticles c
2.2 白藜芦醇与大麦醇溶蛋白反应的结合常数及结合位点数
从以上讨论知白藜芦醇与大麦醇溶蛋白的猝灭作用属于静态猝灭,假设一个大麦醇溶蛋白分子与白藜芦醇结合的结合位点数为n,荧光强度与结合常数KA、结合位点数和猝灭剂浓度之间符合下列方程[15]
lg[(F0-F)/F]=lgKA+nlgcresveratrol
(2)
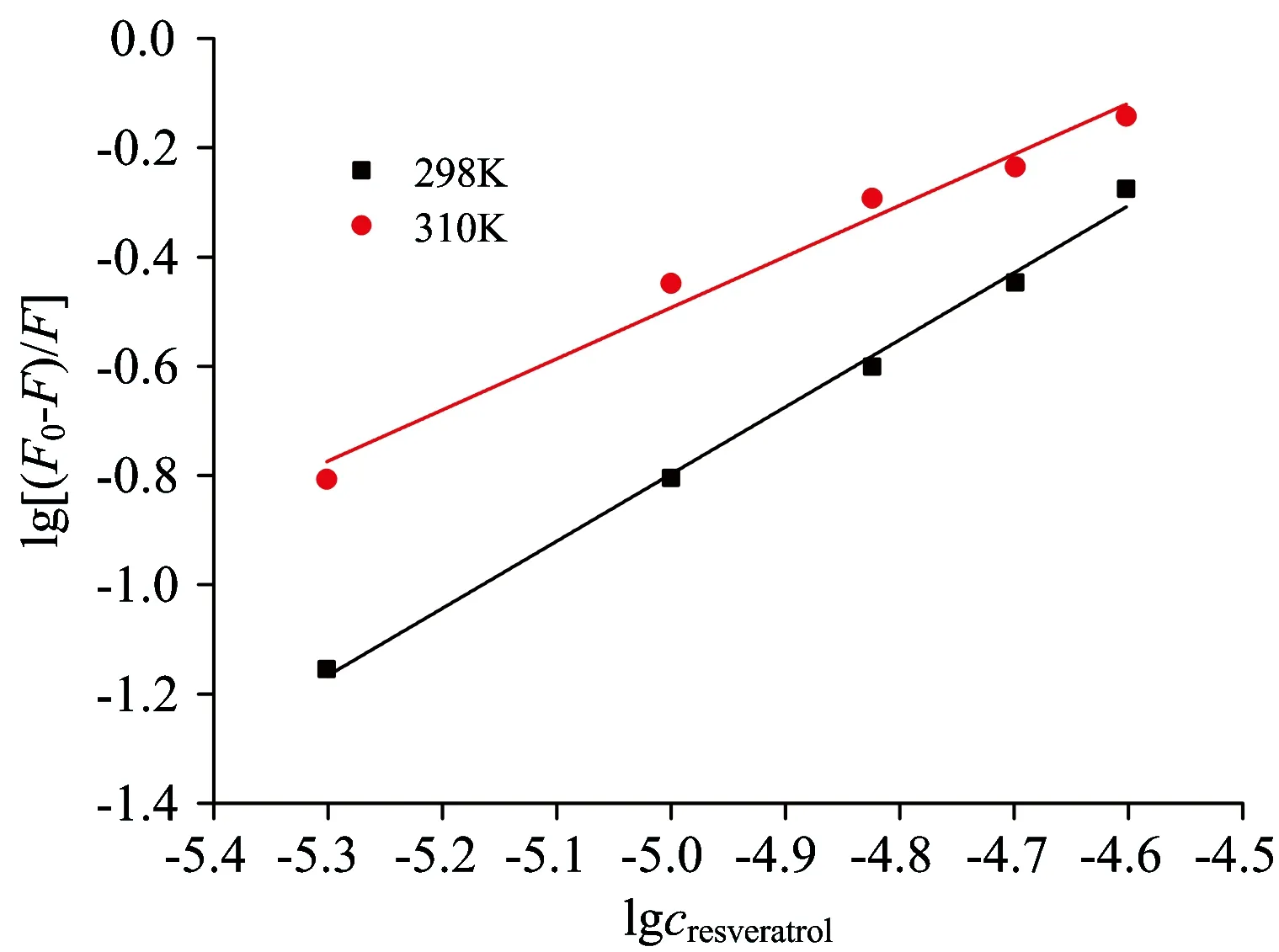
Fig.5 Plot of double logarithm for the fluorescence quenching of hordein by resveratrol
经数据处理作出双对数曲线,如图5所示。求得n和KA,列于表1中。结合位点数n约为1,表明1分子的大麦醇溶蛋白仅与1分子的白藜芦醇相互作用。
2.3 白藜芦醇与大麦醇溶蛋白的相互作用力类型
2.3.1 热力学参数法
根据分子相互作用前后热力学焓变ΔH和熵变ΔS的相对大小可判断药物与蛋白质之间的主要作用力类型。一般认为,ΔH>0,ΔS>0时,分子间以疏水作用力为主;ΔS<0,ΔH<0以氢键和范德华力作用为主;ΔH<0,ΔS>0为静电引力[16]。根据Van’s Hoff定律有
ΔG=-RTlnKA=ΔH-TΔS
(3)
lnKA=-ΔH/RT+ΔS/R
(4)
利用式(3)和式(4)求出白藜芦醇与大麦醇溶蛋白相互作用的热力学参数,结果列于表2中。
Table 2 The binding constants (KA) and relative thermodynamic parameters of the resveratrol-hordein system at different temperatures

T/K298310KA/(L·mol-1)2.21×1051.53×104ΔG/(kJ·mol-1)-30.28-24.63ΔH/(kJ·mol-1)-170.76-170.76ΔS/(J·mol-1·K-1)-471.40-471.40
由表2中的数据可知ΔG<0,表明大麦醇溶蛋白与白藜芦醇之间相互作用为自发进行过程;ΔH<0,ΔS<0表明白藜芦醇和大麦醇溶蛋白之间是通过范德华力和氢键的作用[17]而形成了复合纳米颗粒。
2.3.2 傅里叶红外光谱法
对白藜芦醇纯品、大麦醇溶蛋白纳米颗粒和白藜芦醇-大麦醇溶蛋白复合纳米颗粒进行傅里叶红外测试,结果如图6所示。对于图6a,3 240 cm-1处吸收峰代表酚类的缔合羟基,1 606,1 585,1 512以及1 450 cm-1附近的吸收峰代表苯环的骨架振动。比较大麦醇溶蛋白纳米颗粒(图6b)和白藜芦醇-大麦醇溶蛋白复合纳米颗粒(图6c)的傅里叶变换红外光谱图可知,大麦醇溶蛋白分子中的氢键所对应的3 424 cm-1处吸收峰在复合纳米颗粒中红移至3 405 cm-1,表明白藜芦醇与大麦醇溶蛋白之间形成了新的氢键,这在含有大量羟基的白藜芦醇与大量酰胺基的大麦醇溶蛋白之间是可能发生的;同时纯蛋白酰胺基的峰位置由1 541 cm-1红移至复合物中的1 514 cm-1,可能是白藜芦醇与蛋白之间存在的范德华力所致[17]。

Fig.6 FTIR spectra of resveratrola, hordein nanoparticlesband resveratrol-hordein nanoparticlesc
2.4 白藜芦醇与大麦醇溶蛋白之间的能量转移
根据Förster非辐射能量转移理论,能量转移效率E与供体-受体间距离r0以及临界能量转移距离R0之间的关系为
(5)
式中:F为大麦醇溶蛋白和白藜芦醇摩尔浓度比为1时大麦醇溶蛋白的荧光强度;F0为与白藜芦醇作用前大麦醇溶蛋白的荧光强度;R0是E=50%时的临界距离,满足下式

(6)
式中,K2为偶极空间取向因子,N为介质的折射指数,φ为供体的荧光量子产率,J为供体(大麦醇溶蛋白)荧光发射光谱与受体(白藜芦醇)吸收光谱间的重叠积分,可表示为
J=∑F(λ)ε(λ)λ4dλ/∑F(λ)dλ
(7)
其中F(λ)为供体(大麦醇溶蛋白)在波长λ处的荧光强度,ε(λ)为受体(白藜芦醇)在波长λ处的摩尔消光系数。

Fig.7 Overlap of fluorescence emission spectrum of hordein (a) and absorption spectrum of resveratrol (b)
T=298 K,chordein=cresveratrol=1.0×10-5mol·L-1
图7所示为白藜芦醇与大麦醇溶蛋白分子数比为1∶1时白藜芦醇的吸收光谱及大麦醇溶蛋白荧光发射光谱的重叠光谱图。利用origin软件求得重合积分J=1.454×10-14L·cm3·mol-1。通过同步荧光数据可知大麦醇溶蛋白的荧光由色氨酸和酪氨酸残基共同贡献,故取荧光量子产率φ为0.135,N取水和异丙醇的折射指数平均值1.36,K2取大麦醇溶蛋白-白藜芦醇各向随机分布的平均值2/3。把所有已知数据代入上述各式,求得E=0.227;R0=2.64 nm,r0=1.23R0=3.25 nm。由计算结果知白藜芦醇与大麦醇溶蛋白荧光性氨基酸残基间的空间距离r0<7 nm,且0.5R0 2.5 白藜芦醇对大麦醇溶蛋白构象的影响 同步荧光光谱常用来分析蛋白质构象的变化[20]。当激发波长与发射波长的间距Δλ=15 nm时,扫描得到Tyr的荧光峰,当Δλ=60 nm时,扫描得到Trp的荧光峰。另外,相应氨基酸残基周围微环境极性的改变会导致氨基酸残基荧光峰峰位的变化,故由荧光发射峰位的改变可判断蛋白质构象的变化。 固定大麦醇溶蛋白的浓度,逐渐增加白藜芦醇的浓度,绘制大麦醇溶蛋白的同步荧光光谱。图8(a)和(b)分别为大麦醇溶蛋白中的酪氨酸和色氨酸残基的荧光谱图。可看出此实验条件下大麦醇溶蛋白的荧光由酪氨酸和色氨酸残基共同贡献,且随着白藜芦醇浓度增大,大麦醇溶蛋白中的酪氨酸残基荧光峰位不变,而色氨酸残基的荧光峰位发生一定程度的红移(335→340 nm),表明白藜芦醇的加入引起大麦醇溶蛋白中色氨酸残基的微环境极性增大,疏水性减弱,推测大麦醇溶蛋白由天然折叠态逐渐去折叠,结构变得松散,构象发生变化。 Fig.8 Synchronous fluorescence spectra of hordein by various concentrations of resveratrol chordein=1×10-5mol·L-1;cresveratrol(a→f) are (0, 0.5, 1.0, 1.5, 2.0, 2.5)×10-5mol·L-1 利用荧光光谱法、紫外吸收光谱法、差示扫描量热法以及傅里叶红外光谱法,研究了白藜芦醇-大麦醇溶蛋白纳米颗粒中白藜芦醇与大麦醇溶蛋白的相互作用问题,结果表明白藜芦醇对大麦醇溶蛋白的荧光猝灭作用是由于形成复合物引起的静态猝灭和发生了非辐射能量转移作用。进一步计算了白藜芦醇与大麦醇溶蛋白之间的结合常数与结合位点数,分别为KA(298 K)=2.21×105L·mol-1,KA(310 K)=1.53×104L·mol-1和n298 K=1.23,n310 K=0.94,初步判断两者之间主要通过氢键和范德华力结合,因此可以考虑通过改变反应体系的溶剂类型、温度、pH值等来增大它们之间的氢键和范德华力,从而提高结合的强度和增强形成的复合纳米颗粒的稳定性。通过非辐射能量转移原理计算出白藜芦醇与大麦醇溶蛋白之间的结合距离为3.25 nm。同步荧光光谱法表明白藜芦醇的加入导致大麦醇溶蛋白的结构变得松散。本研究建立的白藜芦醇与大麦醇溶蛋白相互作用的体系,不仅有利于深入了解两者之间相互作用机制,同时对优化白藜芦醇-大麦醇溶蛋白复合纳米颗粒的制备条件具有重要指导作用。 [1] HAN Jing-jing, LIU Wei, BI Yu-ping(韩晶晶, 刘 炜, 毕玉平). Chinese Journal of Biotechnology (生物工程学报), 2008, 24(11): 1851. [2] YIN Cheng-xia(印成霞). Guide of China Medicine(中国医药指南), 2013, (23): 362. [3] GAO Jie, LIAN Xiao-yan, WEI Zhen-ping, et al(高 洁, 连潇嫣, 魏振平, 等). Chemical Industry and Engineering(化学工业与工程), 2012, 29(5): 64. [4] Dube A, Nicolazzo J A, Larson I. European Journal of Pharmaceutical Sciences, 2010, 41(2): 219. [5] Patel A R, Heussen P C M, Hazekamp J, et al. Food Chemistry, 2012, 133(2): 423. [6] LIU Gui-jin, WANG Hong-di, JIANG Yan-bin(刘贵金, 汪红娣, 江燕斌). CIESC Journal(化工学报), 2013, 64(10): 3493. [7] YIN Yan-xia, XIANG Ben-qiong, TONG Li(尹燕霞, 向本琼, 佟 丽). Experimental Technology and Management(实验技术与管理), 2010, 27(2): 33. [8] SUN Yang, FAN Jun, HU Xiao-yun, et al(孙 洋, 樊 君, 胡晓云, 等). Acta Chimica Sinica(化学学报), 2011, 69(8): 937. [9] XUAN Guang-shan, WU Xiao-nan, LI Yu-ping(玄光善, 吴效楠, 李玉平). Chinese Journal of Spectroscopy Laboratory(光谱实验室), 2005, 22(4): 861. [10] Zhang J, Yan Q, Liu J, et al. Journal of Luminescence, 2013, (134): 747. [11] Abou-Zied O K, Al-Shihi O I K. J. Am. Chem. Soc., 2008, 130(32): 10793. [12] HU Meng-yao, PENG Mao, WU Hui, et al(胡梦瑶, 彭 毛, 吴 辉, 等). Chinese Journal of Colloid and Polymer(胶体与聚合物), 2009, 27(3): 33. [13] Cui F C, Fan J, Li J L, et al. Bioorganic and Medicinal Chemistry, 2004, 12(1): 151. [14] Larissa A, Rodrigo C, Betina G Z, et al. Materials Science and Engineering, 2009, C(29): 524. [15] Ge Feng, Jiang Lixiang, Liu Diqiu, et al. Analytical Sciences, 2011, 27(1):73. [16] Ross P R, Subramanian S. Biochemistry, 1981, 20(11):9102. [17] Luo Y, Zhang B, Whent M, et al. Colloids Surf. B, 2011, 85(2): 145. [18] Baptista M S, Indig G L. J. Phys. Chem. B, 1998, 102(23): 4678. [19] ZHOU Neng, PAN Tong, LIANG Yi-zeng(周 能, 潘 彤, 梁逸曾). Lishizhen Medicine and Materia Medica Research(时珍国医国药), 2009, 20(12): 2964. [20] HE Li-fang, LIN Dan-li, LI Yao-qun(何立芳, 林丹丽, 李耀群). Progress in Chemistry(化学进展), 2004, 16(6): 879. *Corresponding author Study on the Interaction in Resveratrol-Hordein Nanoparticle GUAN Xiao1, LIU Jing2*, YIN Ting1, LI Jing-jun3, LIAO Li-li4 1. School of Medical Instruments and Food Engineering,University of Shanghai for Science and Technology, Shanghai 200093, China 2. College of Information Engineering, Shanghai Maritime University, Shanghai 200135, China 3. Jiangsu Changshou (Group) Co. Ltd., Rugao 226500, China 4. Guilin Ximai Food Company, Guilin 541004, China In order to clarify the interaction mechanism of the formation of the resveratrol-hordein nanoparticle, the fluorescence, UV-Vis spectroscopic, FTIR and DSCwere used to study the binding reaction between resveratrol and hordein. The fluorescent emission of hordein was inhibited by resveratrol in a dose dependent manner. Fluorescence spectroscopy and DSC indicated that resveratrol interacted with hordein and formed a new complex by a static process. The binding constant(KA(298 K)=2.21×105L·mol-1,KA(310 K)=1.53×104L·mol-1) and the number of binding sites(n298 K=1.23,n310 K=0.94)were calculated based on the quenching effect of resveratrol on hordein. Thermodynamic parameter and FTIR indicated that the interaction force between resveratrol and hordein was mainly hydrogen binding and van der Waals force. The binding distance(r0=3.25 nm)between resveratrol and hordein and the energy transfer efficiency (E=0.227) were obtained according to non-radiative energy transfer theory. The effect of resveratrol on the conformation of hordein was further analyzed by using synchronous fluorescence spectrometry. The results indicated that resveratrol changed the hydrophobicity of tryptophan residue, which caused an obvious influence on the conformation of hordein. Resveratrol; Hordein; Interaction Nov. 13, 2014; accepted Mar. 12, 2015) 2014-11-13, 2015-03-12 国家自然科学基金项目(31101348),上海市自然科学基金项目(14ZR1419200)资助 管 骁,1979年生,上海理工大学医疗器械与食品学院副教授 e-mail: gnxo@163.com *通讯联系人 e-mail: Jingliu@shmtu.edu.cn TS21 A 10.3964/j.issn.1000-0593(2016)01-0163-06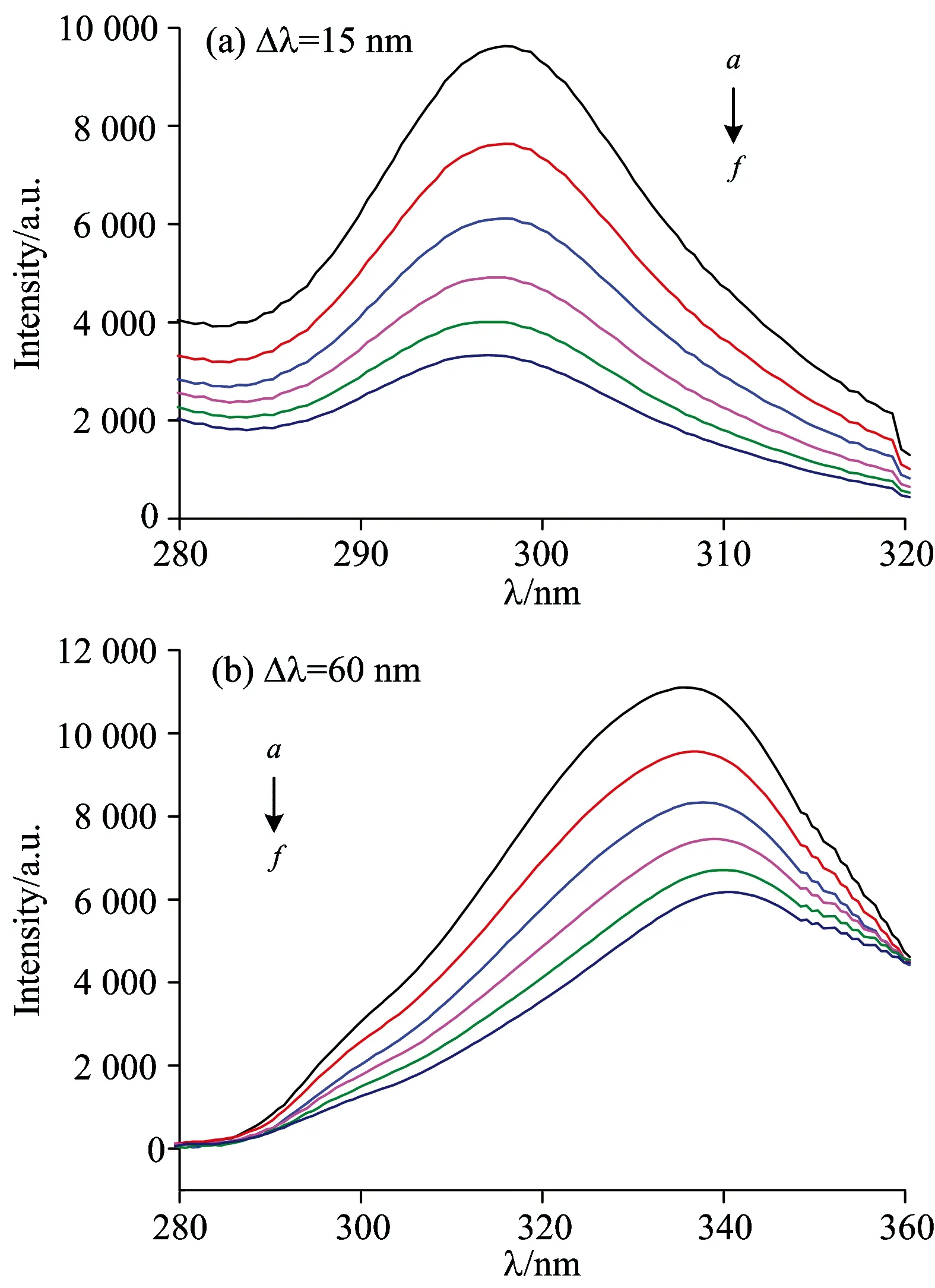
3 结 论
- 光谱学与光谱分析的其它文章
- Determination of Component Contents of Blend Oil Based on Characteristics Peak Value Integration
- Identification of Haploid Maize Kernel Using NIR Spectroscopy in Reflectance and Transmittance Modes: A Comparative Study
- 基于光谱吸收法和荧光法的甲烷和二氧化硫检测系统的研究
- 基于TDLAS-WMS的痕量甲烷气体检测仪
- 推扫误差对计算光谱成像数据重构的影响分析
- ICP-MS用于云南南部四种特色蜂蜜的植物源鉴别分析

