同步荧光光谱技术研究胶原基表面活性剂溶液中分子的聚集行为
李从虎,田振华,刘文涛,李国英*
1. 四川大学皮革化学与工程教育部重点实验室,四川 成都 610065 2. 安庆师范学院生命科学学院,安徽 安庆 246011
同步荧光光谱技术研究胶原基表面活性剂溶液中分子的聚集行为
李从虎1, 2,田振华1,刘文涛1,李国英1*
1. 四川大学皮革化学与工程教育部重点实验室,四川 成都 610065 2. 安庆师范学院生命科学学院,安徽 安庆 246011
基于胶原基表面活性剂(collagen-based surfactant,CBS)中酪氨酸(Tyr)和苯丙氨酸(Phe)的荧光特性,应用恒波长差(Δλ)为15 nm的同步荧光光谱技术研究CBS浓度、溶液pH值、NaCl浓度和温度对其在水溶液中分子的聚集行为的影响,并以温度为外扰,利用二维同步荧光相关分析研究CBS分子中Tyr残基和Phe残基随温度变化的响应顺序。结果表明,CBS分子在261和282 nm处出现了分别归属于Phe和Tyr的特征吸收峰。随着CBS浓度的升高,CBS分子中Phe残基和Tyr残基数量逐渐增多使CBS分子聚集程度增加,并导致荧光强度增强;CBS溶液pH值(pH 5.0)在等电点附近时,由于CBS分子的疏水作用和氢键形成能力加强,导致CBS分子聚集程度增强;CBS溶液中NaCl浓度的升高,则使CBS分子间排斥力减弱,从而导致CBS分子的聚集;然而温度升高,CBS由聚集状态逐渐变为单分子状态,因猝灭、变性以及氢键形成能力降低,荧光强度逐渐降低。以温度为外扰的二维同步荧光相关光谱分析可知:低温下(10~40 ℃ ),CBS聚集体随温度升高逐渐松散,位于聚集体内部的Phe残基比Tyr残基优先响应;而在45~70 ℃时,CBS由单分子状态逐步水解为无规卷曲构造,Tyr残基的间距变大,氢键形成能力大大降低,Tyr残基比Phe残基优先响应。
胶原;表面活性剂;同步荧光光谱;二维相关光谱;聚集行为
引 言
天然胶原是一种具有生物活性的高分子蛋白质,由于其具有低抗原性、生物相容性以及优良的保湿和促进表皮细胞生长繁殖的优异性能[1],而广泛应用于医药和组织工程等领域。作为纤维蛋白质,当环境条件如浓度、pH、温度和离子强度变化时,胶原在溶液中以聚集体形式存在[2]。因此,研究胶原或其衍生物在溶液中的聚集行为对胶原产品的生产、改善胶原的理化特性具有重要的指导意义[3]。
1978年,Willianms等[4]采用浊度法研究了胶原在生理条件下的自聚集行为,然而浊度法灵敏度较低限制了其应用范围。胶原含有苯丙氨酸(Phe)残基和酪氨酸(Tyr)残基,因此可利用Phe和Tyr的荧光特性对其进行荧光测定[5]。同步荧光光谱技术属于荧光分析法的一种,由于该法具有灵敏度高且可窄化谱带和提升分辨率的优点[6],被众多学者用于分析和推断胶原分子在溶液中的构象变化。应用该技术,Li等[7]发现甘油可促进胶原聚集体的分散,而异丙醇可促进胶原的聚集。
本研究曾利用胶原侧链自由氨基同时与月桂酰氯和琥珀酸酐反应制备得到一种新型的胶原基表面活性剂(CBS)[8-9],其结构简式如图1所示,其中月桂酰和琥珀酰残基分别作为疏水长链和亲水基团。CBS不仅维持了胶原的三股螺旋结构特征,而且具有良好的表面活性,对蛋白类生物质资源的高效利用具有良好的促进作用。利用同步荧光光谱技术考察CBS浓度、pH、NaCl浓度以及温度对CBS在水溶液中构象变化的影响。此外,以温度为外扰,采用二维荧光光谱技术,研究CBS分子在溶液中的变化情况。

Fig.1 Structural scheme of CBS[9]
1 实验部分
1.1 试剂与仪器
苯丙氨酸(Phe)、酪氨酸(Tyr):阿拉丁生物试剂有限公司;Cary Eclipse荧光分光光度计:G9800A,美国Agillent Technology公司;超级恒温槽:CH1006,上海衡平仪器厂。
1.2 方法及数据处理
1.2.1 CBS的制备
参照文献[8]制备CBS海绵,并将其置于4 ℃下保存备用。
1.2.2 标准氨基酸同步荧光光谱
精确称取一定质量的Tyr和Phe分别溶解于0.1 mol·L-1的HCl和水中得到浓度为0.1 mmol·mL-1的标准品溶液。将标准品溶液静置除泡后,在20 ℃下,用荧光分光光度计以波长差(Δλ)为15 nm对样品进行扫描,确立标准品吸收峰的位置。波长扫描范围为235~450 nm,狭缝宽度为5 nm。
1.2.3 CBS浓度对CBS聚集行为的影响
将CBS海绵溶于0.01 mol·L-1的PBS中(pH 7.4)得到浓度范围为0.1~0.9 mg·mL-1的样品溶液,浓度间隔0.1 mg·mL-1。在20 ℃下,用荧光分光光度计以Δλ=15 nm对样品进行扫描,得到样品的同步荧光光谱。
1.2.4 pH对CBS聚集行为的影响
将CBS溶液(0.4 mg·mL-1)的pH值调至3.0~9.0,pH间隔为1.0,考察不同pH值条件下CBS的同步荧光光谱。
1.2.5 离子强度对CBS聚集行为的影响
于0.4 mg·mL-1的CBS溶液(PBS, pH 7.4)中添加NaCl,使NaCl终浓度范围为20~140 mmol·L-1,浓度间隔20 mmol·L-1,随后以Δλ=15 nm测定CBS溶液的同步荧光光谱。
1.2.6 温度对CBS聚集行为的影响
将0.4 mg·mL-1的CBS溶液(PBS,pH 7.4)置于超级恒温槽中恒温30 min,测定不同温度下CBS溶液的同步荧光光谱,温度范围10~70 ℃,温度间隔5 ℃。
1.2.7 二维同步荧光光谱
根据不同温度下的CBS水溶液的同步荧光光谱数据,采用2Dshige软件(Kwansei Gakuin)生成以温度为外扰的CBS二维同步荧光相关光谱。
2 结果与讨论
2.1 标准氨基酸同步荧光光谱
虽然CBS分子没有色氨酸残基,但具有苯环的Tyr和Phe残基可以作为研究CBS在溶液中聚集行为的内源性分子探针。参照文献[7]选取Δλ=15 nm,研究了Tyr和Phe标准品的同步荧光谱图。从图2中可以看出,在Δλ=15 nm时,Tyr和Phe分别在282和261 nm处出现尖的吸收峰。
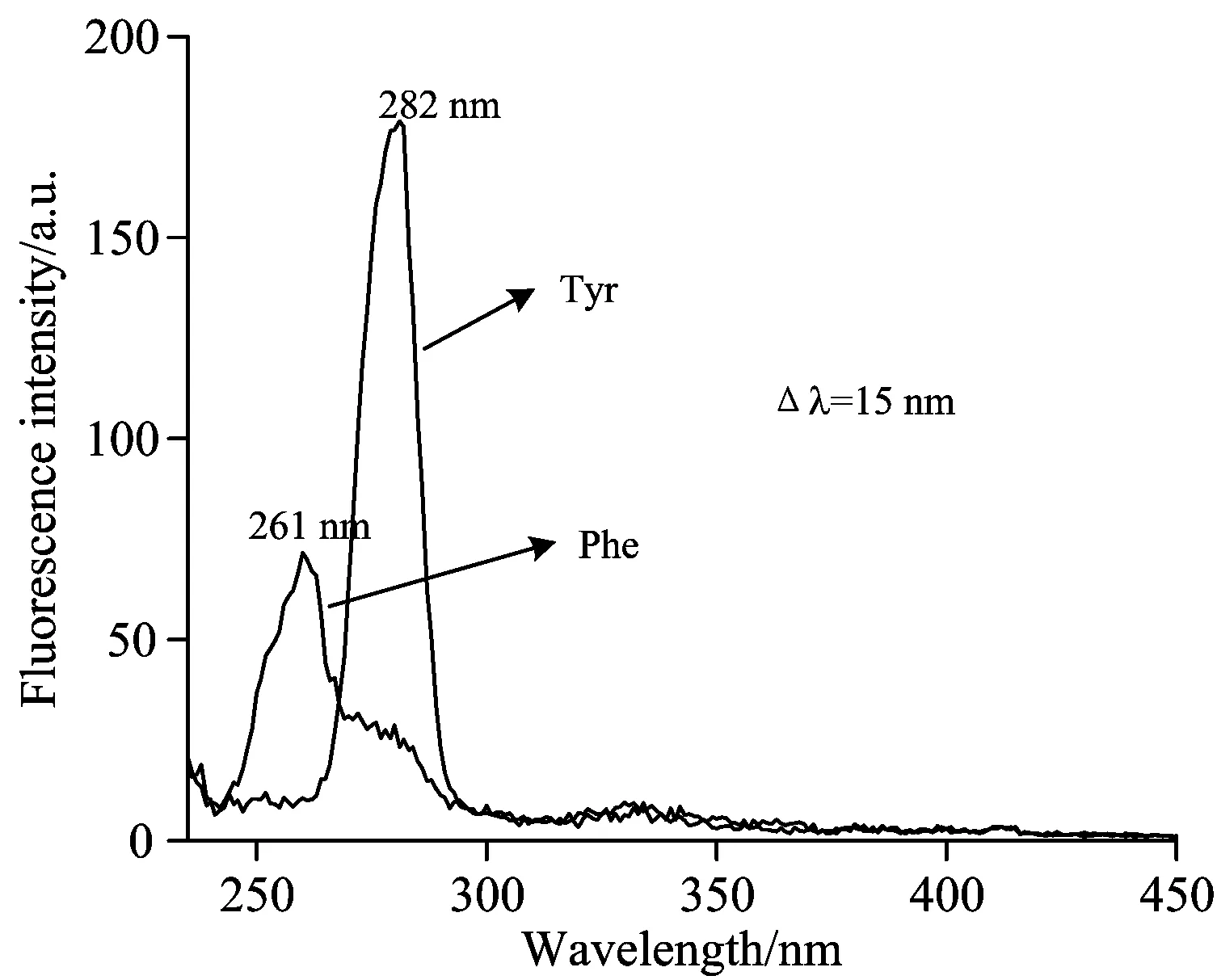
Fig.2 Synchronous fluorescence spectra of Tyr and Phe
2.2 CBS浓度对CBS聚集行为的影响
图3为CBS在Δλ=15 nm的同步荧光光谱图。由图可见,CBS在261和282 nm分别出现了属于Phe和Tyr的吸收峰。随着CBS浓度的升高,吸收峰不断增强,表明CBS聚集程度逐渐增加。Shi等[10]认为胶原聚集程度随其浓度增大而增强的机理是随着胶原浓度的增大,多肽链上的疏水氨基酸残基的疏水作用逐渐取代电子间的相互排斥作用,同时肽链上的肽键参与氢键的形成,最终促进了胶原的聚集。因此,随着CBS浓度的增加,具有疏水性的Phe残基含量不断增加并参与氢键的形成而生成疏水核,而具有亲水性的Tyr残基数量也逐渐增加,并在疏水核外部靠近形成大量氢键[11],最终使CBS分子不断聚集,从而导致吸收峰强度逐渐增强。
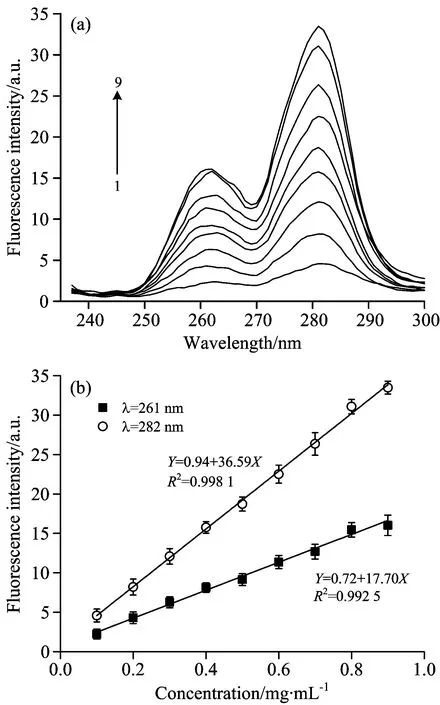
Fig.3 Synchronous fluorescence spectra (a) and fluorescence intensity (b) of CBS under various concentrations 1 to 9 denoted to the concentration from 0.1 to 0.9 mg·mL-1
图3(b)中可以看出,CBS浓度与其在261和282 nm的荧光强度呈线性关系,线性系数良好,表明在一定浓度范围内可利用同步荧光光谱技术对CBS进行定量检测。
2.3 pH对CBS聚集行为的影响
图4为pH对CBS荧光强度的影响。从图4(a)中可以看出,CBS在261和282 nm处有吸收峰,且峰位置不随pH值的变化而变化。在图4(b)中可以看出,CBS的吸收峰强度随pH值的升高,出现先增强而后降低的趋势。在pH 5.0时,CBS的吸收峰最强,表明其聚集程度最大。Yan等[3]发现当鳕鱼皮胶原溶液的pH值接近胶原等电点时,其分子聚集能力最强。CBS等电点为4.93[8],当溶液pH值接近等电点时,分子间电荷排斥力最弱。此时,疏水作用增强,CBS分子大量聚集形成疏水核,Phe残基聚集在疏水核内部参与氢键形成,而Tyr残基位于核外部并相互靠近形成氢键[11],最终导致荧光强度增加。

Fig.4 Synchronous fluorescence spectra (a) and fluorescence intensity (b) of CBS under different pH values
2.4 离子强度对CBS聚集行为的影响
NaCl浓度对CBS的荧光强度的影响如图5(a)和(b)所示。从图中可以看出,在261 nm处,吸收峰的峰强随NaCl浓度的增大,总体呈现增加的趋势,然而当NaCl浓度大于60 mmol·mL-1时,Phe吸收峰强度又出现不规律的趋势,可能是因为位于疏水核内部的Phe残基难以被激发造成的。在282 nm处,吸收峰强度随NaCl浓度的增大而增大,这可能是由于CBS分子的电子筛选作用使分子间排斥力减弱[12],导致CBS分子不断聚集,Tyr残基间的间距变短并形成相对稳定的氢键[11]从而使其荧光增强。

Fig.5 Synchronous fluorescence spectra (a) and fluorescence intensity (b) of CBS under various NaCl concentrations
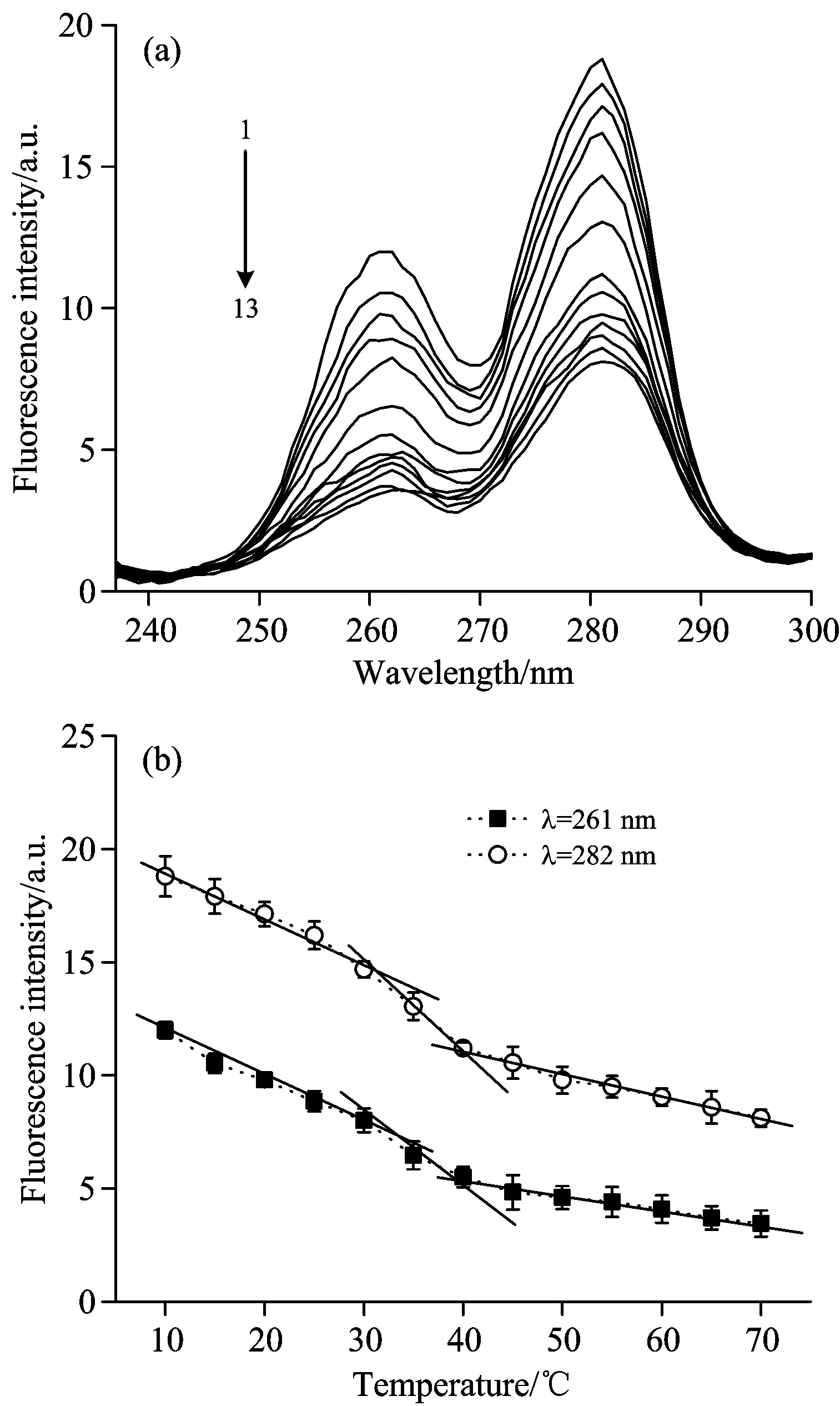
Fig.6 Synchronous fluorescence spectra (a) and fluorescence intensity (b) of CBS under different temperatures 1 to 13 denoted to the temperature of 10 to 70 ℃, temperature interval is 5 ℃
2.5 温度对CBS聚集行为的影响
图6为CBS在不同温度下的同步荧光光谱。从图6(a)中可以看出,CBS的吸收峰位置没有出现任何变化。随着温度的升高,261和282 nm处的荧光强度呈下降的趋势[图6(b)],且可分为3个阶段:低温区(10 ~30 ℃),Tyr和Phe的荧光强度降低;中温区(30~40 ℃),CBS的疏水区域被破坏,CBS分子束开始松散,部分Phe和Tyr残基间的氢键被破坏,因而荧光强度急剧下降,此阶段也可认为是CBS分子的变性阶段;高温区(40~70 ℃),CBS完全变性,亲水性增强,Tyr或Phe残基间的氢键被大量破坏,使其荧光强度继续降低。温度升高,荧光基团与溶剂分子之间的碰撞猝灭机会增大,影响了荧光基团的电子跃迁,并导致荧光强度降低。
2.6 二维同步荧光光谱分析
根据2.5温度对CBS聚集行为的影响可分为低温区、中温区和高温区三个阶段,因此,分别对三个温度区间的荧光强度进行二维处理以便更深入了解温度对CBS聚集行为的影响(如图7所示)。图7(a),7(c)和7(e)分别为CBS在10~25,30~40和45~70 ℃的同步相关谱图。同步相关谱图中存在自相关峰和交叉峰[φ(V1,V2)],自相关峰强弱代表微观环境对分子微结构运动的影响;交叉峰主要表明基团之间的协同作用[13]。改变温度源自Phe和Tyr的261和282 nm的荧光强度在溶液中变化方向相同,均产生正的自相关峰。同时也出现了正的同步交叉峰(261,282)和(282,261)。在10~25 ℃时,CBS结构未破坏,位于疏水核内部的Phe残基受温度影响较大,对温度更敏感,导致自相关峰(261,261)强度高于(282,282)处自相关峰;30~70 ℃时,CBS分子的三股螺旋结构逐步转变为无规卷曲构型,具有稳定三股螺旋构型的Tyr残基间的氢键受温度影响较大,对温度更敏感,因此自相关峰(282,282)更强。

Fig.7 2D fluorescence spectra of CBS during varying temperature from 10~70 ℃(a), (c), (e): Synchronous spectra; (b), (d), (f): Asynchronous spectra; (a), (b): 10~25 ℃; (c), (d): 30~40 ℃; (d), (e): 45~70 ℃
图7(b),7(d)和7(f)分别是CBS在10~25,30~40和45~70 ℃的异步相关谱图。异步相关谱图中主要存在异步交叉峰[φ(V1,V2)],它可辅助提供分子的基团变化的先后顺序。在10~40 ℃中,(261,282)均出现正的交叉峰;而在45~70 ℃中,(261,282)却出现负的交叉峰。根据Noda判断规则[14],CBS基团的变化顺序如表1所示:在10~40 ℃下,261 nm(Phe残基)优先于282 nm(Tyr残基);45~70 ℃下,282 nm(Tyr残基)优先于261 nm(Phe残基)。这可能是因为Phe残基的荧光效率及其形成氢键的能力较Tyr残基低,低温时,CBS聚集体逐步松散,疏水核内部的Phe残基优先响应。而45~70 ℃时,CBS由单分子状态水解为无规卷曲构型,Tyr残基的间距变大,不参与氢键的形成,导致Tyr残基优先响应。

Table 1 Synchronous, asynchronous 2D correlation intensities and the order of intensity variations between two bands of CBS
a:ν1先于ν2指在升温过程中,相对于ν2,ν1处的荧光强度值首先发生变化
3 结 论
采用同步荧光光谱技术研究CBS分子的聚集行为,发现其在261和282 nm处出现了Phe和Tyr的吸收峰。随CBS和NaCl浓度的增大,CBS分子聚集体体积逐渐增大;当CBS溶液pH值接近CBS等电点时,CBS聚集强度达到最大;然而,由于荧光效率降低和变性作用,温度的升高却降低了荧光强度。以温度为外扰的二维同步荧光光谱分析技术可知,CBS基团的优先顺序为:在10~40 ℃下,Phe残基优先于Tyr残基;而在45~70 ℃下,Tyr残基优先于Phe残基。
[1] Li G, Fukunaga S, Takenouchi K. International Journal of Cosmetic Science, 2005, 27: 101.
[2] Køster S, Evans H M, Wong J Y, et al. Biomacromolecules, 2008, 9: 199.
[3] Yan M, Li B, Zhao X, et al. Food Hydrocolloids, 2012, 29: 199.
[4] Williams B R, Gelman R A, Poppke D C, et al. Journal of Biological Chemistry, 1978, 253: 6578.
[5] Wu K, Liu W, Li G. Spectrochimica Acta Part A: Molecular and Biomolecular Spectroscopy, 2013, 102: 192.
[6] Digambara Patra, Mishra A K. Trends in Analytical Chemistry, 2002, 21(12): 787.
[7] Li J, Li G. International Journal of Biological Macromolecules, 2011, 48: 364.
[8] Li C, Tian H, Duan L, et al. International Journal of Biological Macromolecules, 2013, 57: 92.
[9] Li C, Liu W, Duan L, et al. Journal of Applied Polymer Science, 2014, 131: 40174.
[10] Shi X, Ma W, Sun C, et al. Biomaterials, 2001, 22: 1627.
[11] Pardrick S B, Miranker A D. J. Mol. Biol., 2001, 308: 783.
[12] Aewsiri T, Benjakul S, Visessanguan W, et al. Food and Bioprocess Technology, 2011, 6(3): 671.
[13] Tian H, Chen Y, Ding C, et al. Carbohydrate Polymers, 2012, 89: 542.
[14] Noda I. Applied Spectroscopy, 1993, 47: 1329.
*Corresponding author
Aggregation Behavior of Collagen-Based Surfactant Molecules in Aqueous Solutions Based on Synchronization Fluorescence Spectrum Technology
LI Cong-hu1, 2,, TIAN Zhen-hua1, LIU Wen-tao1, LI Guo-ying1*
1. The Key Laboratory of Leather Chemistry and Engineering of Ministry of Education, Sichuan University, Chengdu 610065, China
2. College of Life Sciences, Anqing Normal University, Anqing 246011, China
Due to the intrinsic fluorescence characteristic of tyrosine (Tyr) and phenylalanine (Phe), synchronization fluorescence spectrum technology which adopted the constant wavelength difference (Δλ=15 nm) was selected to investigate the effects of collagen-based surfactant (CBS) concentration, pH, NaCl concentration and temperature on the aggregation state of CBS molecules in aqueous solutions. Meanwhile, temperature-dependent two-dimensional (2D) synchronization fluorescence correlation analyses was used to investigate the variation order of Tyr and Phe residues in CBS molecules with the change of temperature. The results showed that the characteristic absorption peaks located at 261 and 282 nm were attributed to Phe and Tyr, respectively. With the increase of CBS concentration, the amount of Phe and Tyr residues increased gradually which resulted in the increase of aggregate degree of CBS molecules and then led to the increase of fluorescence intensity. When the pH value (pH 5.0) of CBS solutions was close to the isoelectric point of CBS, the aggregate degree of CBS molecules increased due to the increase of the hydrophobic interaction and the formation ability of hydrogen bond. Additionally, with the increase of NaCl concentration, the repulsion force for inter/intra-molecules of CBS decreased, which helped to improve the aggregation behavior of CBS molecules. However, with the increase of temperature, the aggregation state of CBS was changed to be monomolecular state, and then resulted in the decrease of the fluorescence intensity gradually due to the quenching, the denaturation and the decrease of hydrogen bond formation ability. Furthermore, temperature-dependent 2D synchronization fluorescence correlation spectroscopy demonstrated that at lower temperature (10~40 ℃), the aggregate state of CBS changed to be loose state and then Phe residues located in the inside of the aggregate varied before Tyr residues; while in the heating process of 45~70 ℃, the monomolecular state of CBS changed to be random coil conformation, the separation distance between Tyr residues increased and the hydrogen bond formation ability reduced strongly, which led to Tyr residues changed before Phe residues.
Collagen; Surfactant; Synchronous fluorescence spectroscopy;Two-dimensional correlation spectroscopy;Aggregation behavior
Sep. 30, 2014; accepted Dec. 18, 2014)
2014-09-30,
2014-12-18
国家自然科学基金项目(21276167;21076129) 资助
李从虎,1987年生,安庆师范学院生命科学学院讲师 e-mail: lch87108@163.com *通讯联系人 e-mail: liguoyings@163.com
O657.3
A
10.3964/j.issn.1000-0593(2016)01-0151-06
- 光谱学与光谱分析的其它文章
- Determination of Component Contents of Blend Oil Based on Characteristics Peak Value Integration
- Identification of Haploid Maize Kernel Using NIR Spectroscopy in Reflectance and Transmittance Modes: A Comparative Study
- 基于光谱吸收法和荧光法的甲烷和二氧化硫检测系统的研究
- 基于TDLAS-WMS的痕量甲烷气体检测仪
- 推扫误差对计算光谱成像数据重构的影响分析
- ICP-MS用于云南南部四种特色蜂蜜的植物源鉴别分析

