鼻咽癌组织拉曼光谱研究进展
许智宏, 黄 伟,2*, 林 多, 戈小松, 林学亮, 冯尚源, 李永增, 陈 荣
1. 医学光电科学与技术教育部重点实验室, 福建省光子技术重点实验室, 福建师范大学, 福建 福州 350007
2. 福建省计量科学研究院, 福建 福州 350003
鼻咽癌组织拉曼光谱研究进展
许智宏1, 黄 伟1,2*, 林 多1, 戈小松1, 林学亮1, 冯尚源1, 李永增1, 陈 荣1
1. 医学光电科学与技术教育部重点实验室, 福建省光子技术重点实验室, 福建师范大学, 福建 福州 350007
2. 福建省计量科学研究院, 福建 福州 350003
鼻咽癌是东南亚地区及中国南方地区高发的恶性肿瘤, 具有独特的地理、 种族分布特点, 并且存在恶性程度高、 预后差、 早期诊断困难等问题。 拉曼光谱技术是基于非弹性光散射基本原理的一种快速且无损的检测方法, 能够在分子振动水平上提供生化成分等信息。 综述基于拉曼光谱技术的鼻咽癌组织研究最新进展。 主要介绍了国内外小组采用拉曼光谱及表面增强拉曼光谱(SERS)进行鼻咽癌组织检测研究的概况, 其中重点介绍该研究小组近期在鼻咽癌组织的高波数拉曼光谱、 鼻咽癌组织涂片的拉曼光谱, 以及研发的人活体鼻咽癌组织内镜检测装置及其临床实验情况。 最后, 对鼻咽癌组织拉曼光谱研究的发展前景进行了展望。
鼻咽癌组织; 拉曼光谱; 高波数; 咽拭; 活体
引 言
鼻咽癌是一种发生在鼻咽顶部和侧壁粘膜的头颈部恶性肿瘤, 超过80%的鼻咽癌病例来自中国、 东南亚和一些亚洲国家。 常规鼻咽内窥镜白光检查、 磁共振成像、 计算机断层扫描等方法还不能够实现快速、 有效地对鼻咽癌进行诊断。 最终确诊还需依靠内镜下活检取样进行病理分析, 但这种方法对鼻咽部具有创伤性, 给病人带来痛苦, 同时还容易导致误诊和漏诊。 因而, 寻求一种无损、 快速的检测新方法是鼻咽癌诊断的重要研究课题。
拉曼光谱是一种无损、 快速、 有效的光学诊断技术。 拉曼光谱具有谱峰清晰尖锐、 拉曼频移与入射光频率无关、 水的影响小、 灵敏度高等优点, 它在生物医学研究领域备受关注。 将拉曼光谱应用于鼻咽癌等癌瘤疾病的研究一直是物理、 光学与医学领域的研究热点[1]。
1 离体鼻咽癌组织的拉曼光谱
2003年, 加拿大BC癌症研究中心Haishan Zeng等[2], 对鼻咽癌离体组织率先开展拉曼光谱研究, 发现鼻咽癌组织和正常鼻咽组织的拉曼光谱在1 290~1 320, 1 420~1 470和1 530~1 580 cm-1这三个波数范围存在明显差异。 2009年, 黄伟等通过对比鼻咽癌组织离体后1~4 h内不同时间的拉曼光谱差异, 指出应该尽可能地缩短被测组织离开人体的时间, 可获得到较满意的拉曼测试结果。 2012年郭周义等[3]利用显微共聚焦拉曼光谱仪对63位患者的鼻咽离体组织开展研究工作, 并结合基因算法(genetic algorithm, GA)和线性判别分析(linear discriminant analysis, LDA)对数据进行系统地分析, 其结果表现高特异性。 2013年本课题组李永增等[4]利用显微共聚焦拉曼系统测量了74例鼻咽离体组织块的拉曼光谱。 研究发现, 鼻咽正常组织和癌变组织表现几个明显的特征峰, 分别在853, 937, 1 094, 1 209, 1 268, 1 290, 1 340, 1 579和1 660 cm-1。 同年, Bingling Chen等[5]评估了拉曼光谱对鼻咽癌离体组织诊断的四种分类算法, 其中包括贝叶斯分类法(BC), LDA, 主成分分析(PCA), GA-LDA法。 通过分析, PCA-BC分类法显示出最高的灵敏度、 特异性和总体癌症诊断的准确性。 实验结果表明, 拉曼光谱结合BC方法在鼻咽癌的检测和诊断上具有足够大的潜力。 2015年李永增等[6]通过两种诊断算法PCA-LDA, 偏最小二乘法-判别分析(partial least squares-discriminant analysis, PLS-DA)对获取的拉曼数据进行归类分析, 其结果显示利用PCA-LDA诊断算法对鼻咽癌离体组织的检测灵敏度达81%, 特异性达87%; 而利用PLS-DA算法分析后, 可获得85%的诊断灵敏度, 88%的诊断特异性。 2016年邱素芳等[7]深入分析了鼻咽癌TNM综合分期的常规拉曼光谱测量, 发现早晚期鼻咽癌组织的拉曼光谱在1 004和1 209 cm-1峰位强度的显著差异。 他们还指出不论在组织、 细胞、 血液或者其他癌组织中, 归属苯基丙氨酸C—C键对称伸缩振动的1 004 cm-1谱峰位置都是稳定存在的, 它可作为鉴别鼻咽癌早晚期的特征标志拉曼峰。
2009年, 冯尚源等[8]基于金纳米粒子的SERS技术对鼻咽癌组织手术切片开展研究, 同时利用SERS成像技术分析病变组织和正常组织的生化成分(图1)。 研究发现, 涂有金胶的鼻咽癌切片组织的SERS光谱较常规拉曼光谱增强效果明显(图2), 正常和癌变鼻咽组织切片的SERS光谱谱峰位置和相对峰值强度上存在差异。
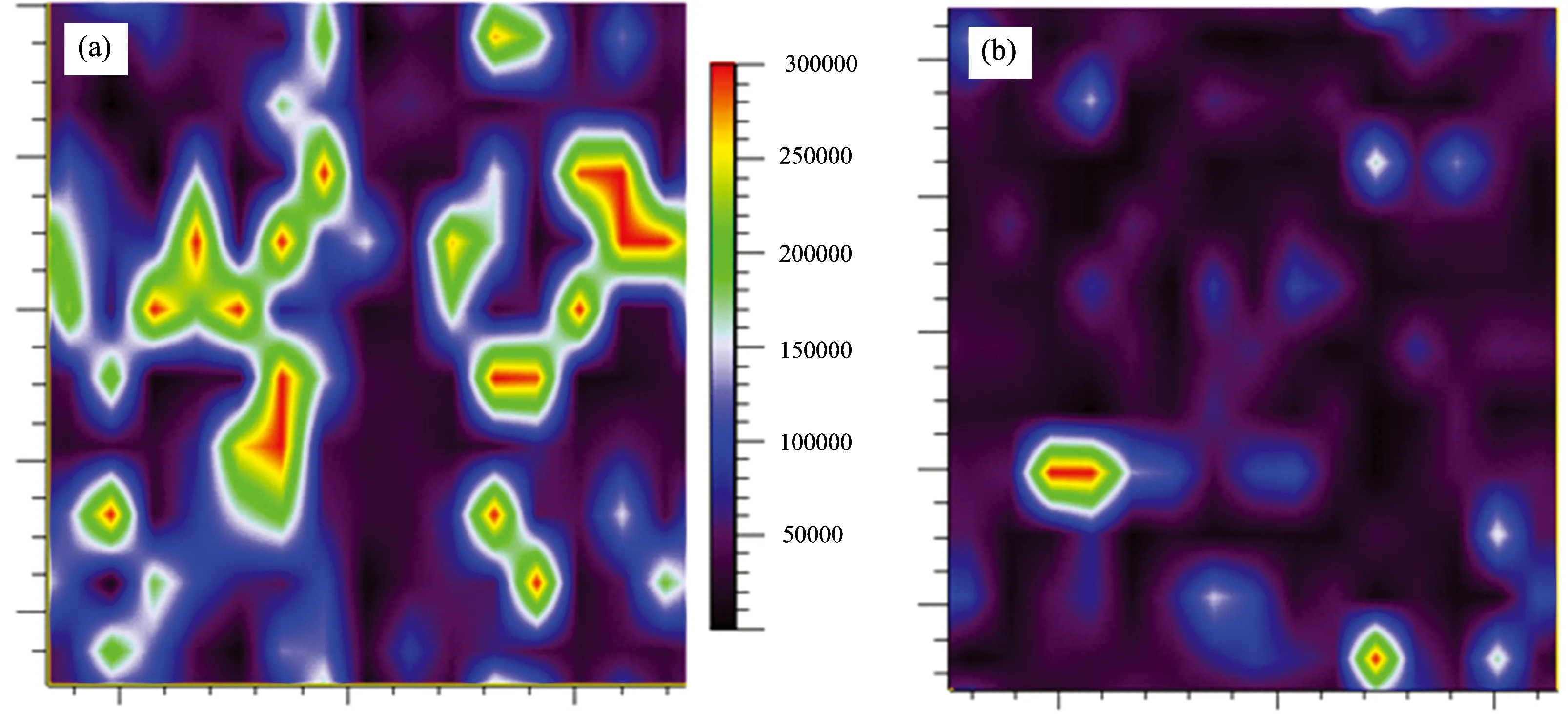
图1 (a)正常组织的962 cm-1(氨基酸分析)SERS成像图; (b)癌组织的962 cm-1(氨基酸分析)拉曼成像图

图2 (a)涂有金胶的鼻咽癌组织的近红外SERS光谱; (b) 未涂有金胶的鼻咽癌组织的拉曼光谱; (c) 金胶的拉曼背景信号
Fig.2 (a) NIR-SERS spectrum of the cancerous nasopharyngeal tissue section with Au colloid, (b) the Raman spectrum of cancerous nasopharyngeal tissue section without the gold sol, and (c) the background Raman signal of Au colloid[9]
以上针对离体鼻咽癌组织拉曼光谱的研究结果, 显示了拉曼光谱技术应用于鼻咽癌组织检测分析的可行性和巨大潜力, 为开展进一步研究提供了良好的基础。
2 鼻咽癌组织的高波数拉曼光谱
以上针对鼻咽癌离体组织拉曼光谱研究主要集中在低波数指纹区(400~1 800 cm-1), 该范围能揭示细胞或组织的蛋白质、 脂质、 核酸等主链结构的特定信息[4]。 然而, 人体组织的拉曼信号极其微弱, 易被人活体组织自体荧光信号湮没, 这将严重影响低波数区拉曼光谱检测效率。 而高波数(2 600~3 600 cm-1)拉曼光谱受自体荧光干扰较小, 已成为当前组织拉曼光谱研究的重要趋势之一[9-11]。
与组织低波数区域拉曼光谱相比, 结合低波数和高波数拉曼光谱对组织检测有以下优势: (1)低波数区域的组织拉曼光谱被强烈的组织自体荧光背景干扰湮没, 而高波数区域的拉曼光谱还仍然具有诊断信息的强烈拉曼峰; (2)低波数区和高波数区的拉曼光谱信号, 能提供相互补充的生物分子层面的信息; (3)高波数区的拉曼光谱信号与激光的波数间隔较远, 对滤光系统的要求较低。 因此将低波数和高波数区域的拉曼光谱相结合, 能提高对组织光谱特征描述及其诊断效果[10]。 2015年, 由黄伟等[11]首次结合低、 高波数拉曼光谱对78例鼻咽癌与非癌组织开展研究, 发现在2 800~3 100 cm-1拉曼光谱范围内, 存在明显的四个特征谱峰: 2 854, 2 874, 2 934和3 067 cm-1(图3), 这些特征可能与组织内的脂质、 蛋白质相关。 结果还显示, 与单独采用低波数拉曼光谱或单独采用高波数拉曼光谱进行鼻咽癌检测的结果相比, 将高波数和低波数的拉曼光谱相结合进行判别分析, 能得到更高的灵敏度和特异性[11]。
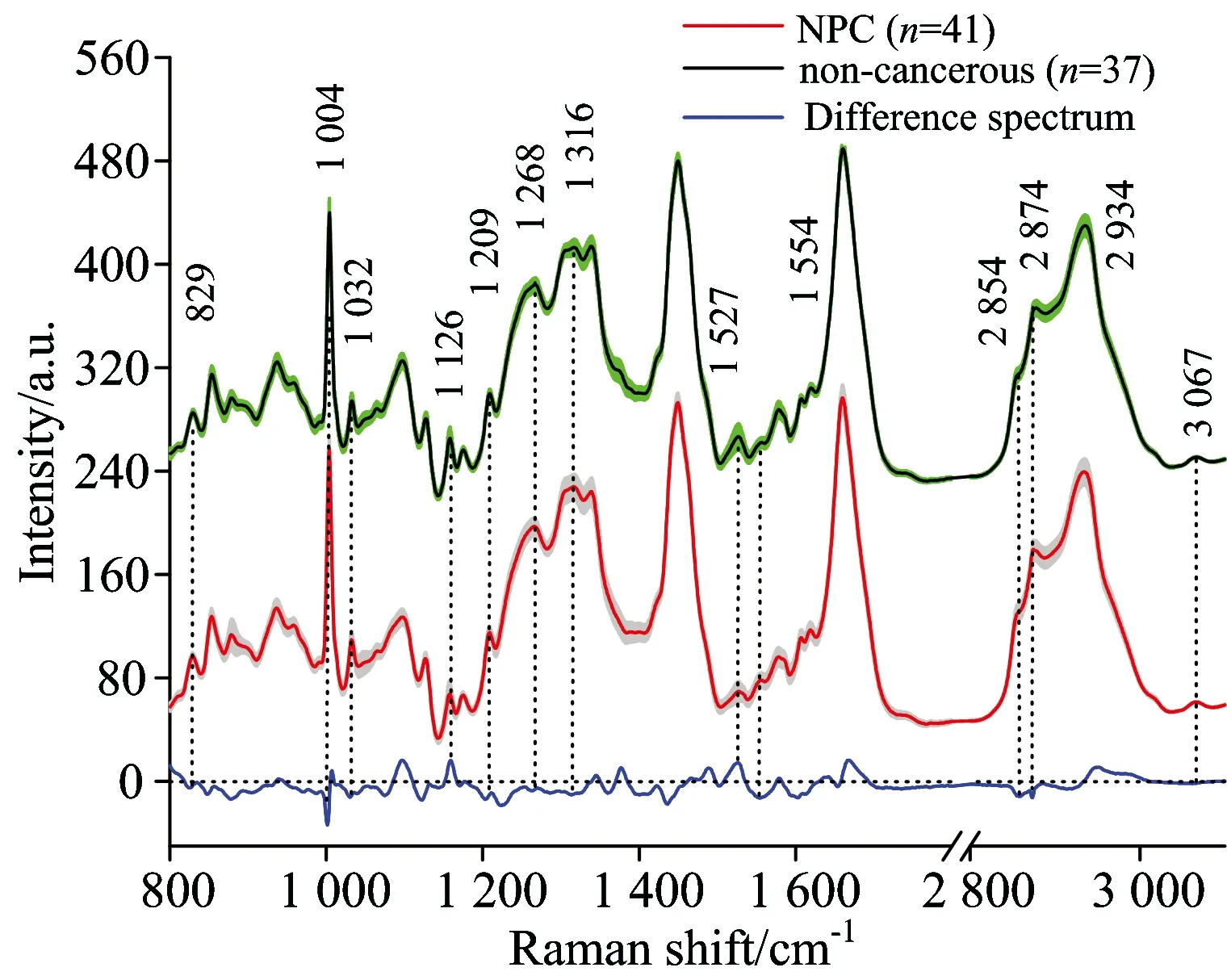
图3 鼻咽癌与非癌组织的低波数(800~1 800 cm-1)与高波数(2 800~3 100 cm-1)平均拉曼光谱图
Fig.3 Mean intensities of FP/HW Raman spectra from NPC tissue and non-cancerous tissue[12]
3 鼻咽癌组织涂片的拉曼光谱
通过内窥镜活检获取鼻咽癌组织进行组织病理学检查或进行离体拉曼光谱检测, 这些方法过程复杂, 成本较高, 并给病人造成创伤与痛苦。 最近, 本研究提出一种将拉曼光谱技术与鼻咽拭子相结合的方法, 以探索鼻咽癌筛查的无损检测方法。 2015年, 本研究与福州市第一医院孙丽清等结合低、 高波数拉曼光谱对鼻咽癌和非癌组织咽拭涂片进行了研究。 对74例鼻咽咽拭涂片样本进行光谱检测, 均能采集到较高质量的拉曼信号(图4)。 经过多元统计分析后发现, 鼻咽癌组织涂片通过采用常规拉曼方法, 分别能够实现87.2%的诊断灵敏度和85.7%的特异性[12]。 组织咽拭涂片拉曼光谱检测还有待进一步研究, 希望为鼻咽癌的无损(或微损)临床筛查提供新方法。
4 活体鼻咽癌组织的拉曼光谱
要实现鼻咽癌的拉曼光谱早期诊断与定位, 最关键的是应开展并实现人活体鼻咽癌组织的拉曼光谱检测。 由于人体组织荧光信号强度远大于拉曼光谱信号, 而探测系统如光纤中的石英产生的拉曼及荧光信号也会对检测造成干扰[11-12]。 人活体检测要求快速准确, 鼻腔组织检测还必须借助内窥镜进行, 而内窥镜活检孔又限制对光纤探头的尺寸。 人活体腔内组织, 包括鼻咽癌组织的拉曼光谱检测至今仍是国际性热点与难点。 2012年至今, 福建师范大学项目组与加拿大BC癌研究中心曾海山教授联合, 综合采用拉曼光谱、 反射光谱与荧光图像技术、 双波长激光激发技术(785与690 nm)、 高波数与低波数拉曼光谱检测技术, 研发了一种鼻咽癌内镜活
体组织快速检测装置, 并在福建省肿瘤医院投入实验研究, 首次测量获得了人活体鼻咽癌组织的拉曼光谱、 反射光谱与荧光图像信息[13-16]。 目前这一研究还在继续开展。
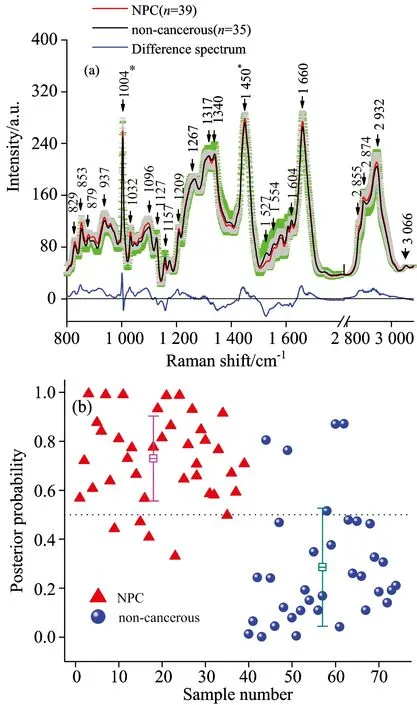
图4 (a)鼻咽组织咽拭涂片的平均拉曼光谱图, 阴影部分表示平均谱的标准偏差; (b) 鼻咽癌与非癌咽拭涂片拉曼光谱的晚验概率分布图
Fig.4 (a) Average Raman spectra of nasopharyngeal tissue smear samples, the shaded areas represent the standard deviations of the means; (b) Scatter plots of the posterior probability for noncancerous and cancerous nasopharyngeal tissue smear classification[12]
5 结束语
随着现代光机电技术的发展, SERS技术、 高波数拉曼光谱以及鼻咽拭子方法等新技术新方法的应用, 将大大促进鼻咽癌组织拉曼光谱研究的开展。 鼻咽癌组织拉曼光谱研究已从离体进入活体研究阶段, 研究已获重要进展。 根据本工作的初步研究, 活体鼻咽癌组织的拉曼光谱与离体状态有较大差异, 而达到最终临床实用, 还应实现对不同分期鼻咽癌, 特别是早期鼻咽癌的检测。 为此, 仍还面临着挑战。 但坚信, 在物理、 光学以及医学科学家的共同努力下, 拉曼光谱技术必将在鼻咽癌早期检测研究中发挥重要作用。
[1] CHEN Rong, LI Yong-zeng, FENG Shang-yuan, et al(陈 荣, 李永增, 冯尚源, 等). Laser & Optoelectronics Progress(激光与光电子学进展), 2008, (1): 16.
[2] Lau D P, Huang Z, Lui H, et al. Lasers in Surgery and Medicine, 2003. 32(3): 210.
[3] Li S X, Chen Q Y, Zhang Y J, et al. Journal of Biomedical Optics, 2012, 17(12): 125003.
[4] Li Y, Pan J, Chen G, et al. Journal of Biomedical Optics, 2013, 18(2): 027003.
[5] Chen B, Li S, Li J, et al. Journal of Applied Physics, 2013, 114(24): 244702.
[6] Li Y, Huang W, Pan J, et al. Molecular and Clinical Oncology, 2015, 3(2): 375.
[7] Qiu S, Huang Q, Huang L, et al. Oncology Letters, 2016, 11(4): 2590.
[8] Feng S, Lin J, Cheng M, et al. Applied Spectroscopy, 2009, 63(10): 1089.
[9] Duraipandian S, Zheng W, Ng J, et al. Analytical Chemistry, 2012, 84(14): 5913.
[10] Bergholt M S, Lin K, Wang J, et al. Journal of Biophotonics, 2015. 9999.
[11] Wang J, Lin K, Zheng W, et al. Scientific Reports, 2015. 5.
[12] Huang W, Wu S, Chen M, et al. Journal of Raman Spectroscopy, 2015, 46(6): 537.
[13] Sun L, Xu Z, Huang W, et al. Journal of Cancer Research and Clinical Oncology, 2016, 142(4): 823.
[14] CHEN Rong, HUANG Wei, FENG Shang-yuan, et al(陈 荣, 黄 伟, 冯尚源, 等). CN. Patent, 201410391362.8, 2014. 8.
[15] CHEN Rong, HUANG Wei, FENG Shang-yuan, et al(陈 荣, 黄 伟, 冯尚源, 等). CN. Patent, 201610375997. 8, 2016. 5. 30.
[16] CHEN Rong, HUANG Wei, FENG Shang-yuan, et al(陈 荣, 黄 伟, 冯尚源, 等). CN. Patent, 201620501385. 4, 2016. 5. 30.
[17] CHEN Rong, LIN Ju-qiang, FENG Shang-yuan, et al(陈 荣, 林居强, 冯尚源, 等). CN. Patent, 201620501385.4, 2016, 5: 30.
*Corresponding author
Advances in Raman Spectroscopy for Nasopharyngeal Carcinoma Tissue
XU Zhi-hong1, HUANG Wei1,2*, LIN Duo1, GE Xiao-song1, LIN Xue-liang1, FENG Shang-yuan1, LI Yong-zeng1,CHEN Rong1
1. Key Laboratory of OptoElectronic Science and Technology for Medicine, Ministry of Education, Fujian Normal University, Fuzhou 350007, China
2. Fujian Metrology Institute, Fuzhou 350003, China
Nasopharyngeal carcinoma is a unique malignant tumor that has a distinct geographic and racial distribution, with a high incidence in southeast Asia and southern China. High degree of malignancy, poor prognosis and difficulty in early diagnosis remain a problem in nasopharyngeal carcinoma. Raman spectroscopy technique based on inelastic scattering is a rapid and nonivasive detection method, which is capable of providing the information of biochemical components at molecular vibration level.This article reviewed the recent research progress of nasopharyngeal carcinoma based on Raman spectroscopy. It mainly introduces the study of detecting nasopharyngeal carcinoma tissue by using Raman spectroscopy as well as surface-enhanced Raman scattering spectroscopy (SERS). The emphasis is put on the latest works by our research group, including high wavenumber Raman spectroscopy of tissue, Raman spectroscopy of tissue smears, and a specially designed endoscopic device combined with Raman spectroscopy for in vivo nasopharyngeal cancerous tissue detection, which was firstly developed by our group. Finally, the prospects of the development of Raman spectroscopy for nasopharyngeal carcinoma were discussed.
Nasopharyngeal carcinoma; Raman spectroscopy; High wavenumber; Tissue smear; In vivo
Jun. 12, 2016; accepted Jul. 4, 2016)
2016-06-12,
2016-07-04
国家自然科学基金项目(61210016, 61178090, 61405036), 长江学者和创新研究团队项目(IRT15R10)资助
许智宏, 1991年生, 福建师范大学光电与信息工程学院硕士研究生 e-mail: xzh91715@163.com *通讯联系人 e-mail: huang84wei@163.com
O657.3
A
10.3964/j.issn.1000-0593(2016)08-2518-04

