药物流产对女性生殖激素的影响
张爱丹
药物流产对女性生殖激素的影响
张爱丹
目的 探讨米非司酮对早孕妇女生殖激素的影响。方法 选择自愿要求终止妊娠的早孕妇女为研究对象,随机分为药物流产组(204例)和人工流产组(200例),取2组人群外周血,药流组于口服米非司酮前、后及流产后14d、22d,人流组于术前及术后14d、22d,测定雌二醇(E2)、促黄体生成素(FSH)、促卵泡生成素(LH)、孕酮(P)和人绒毛膜促性腺激素(β-HCG)水平。结果 药流组服药后E2明显上升,差异有统计学意义(P<0.05);P无明显变化,差异无统计学意义;β-HCG呈上升趋势,但弱于人流组;2组FSH均下降,差异有统计学意义(P<0.05);LH无显著性变化,差异无统计学意义。流产后第14、22天2组E2均呈上升趋势,但是药流组较同期人流组,E2升高缓慢,差异有统计学意义(P<0.05);药流组β-HCG下降趋势较人流组平缓,差异有统计学意义(P<0.05);药流组P水平始终高于人流组,差异有统计学意义(P<0.05);2组FSH呈波动状态,LH均呈下降趋势,差异无统计学意义。结论 米非司酮对早孕妇女生殖激素水平确有影响。尤其当药流后阴道流血超过10d时,应检测血清E2、P、HCG水平,出现E2低于卵泡期水平,P高于卵泡期水平,HCG下降缓慢,提示不全流产,应及时清宫。
药物流产;生殖激素;早孕
米非司酮是孕酮受体水平的抗孕激素药物,通过阻止子宫蜕膜孕酮受体和孕酮的结合而拮抗孕酮的作用,从而使蜕膜变性、出血、坏死,导致流产。目前,米非司酮与米索前列醇联合应用对停经49天内的妊娠完全流产率达95%以上[1],然而该方法存在月经失调、流产后出血量多、出血时间长甚或部分患者因大出血仍需清宫等问题[2]。本项目通过检测早孕妇女在口服米非司酮前、后及流产后血清绒毛膜促性腺激素(β-HCG)、促卵泡生成素(FSH)、促黄体生成素(LH)、雌二醇(E2)、孕酮(P)和垂体泌乳素(PRL)水平,探讨米非司酮对早孕妇女生殖激素的影响。
1 资料与方法
1.1 一般资料 选择2013年6月~2015年5月沈阳市计划生育科研所自愿要求终止妊娠的早孕妇女为研究对象。要求:(1)年龄19~40岁,停经<49d;(2)经妇科检查、尿妊娠试验、B超诊断为宫内早孕;(3)孕前3个月及孕期未服用任何激素类药物,无吸烟、饮酒等不良嗜好;(4)无药物流产或手术流产禁忌证。患者随机分为药物流产组204例和人工流产组200例。2组妇女年龄、孕周、体质量、孕产次经统计学分析,差异均无统计学意义,具有可比性。
1.2 方法 药流组服药方法:第1天口服米非司酮,首剂50mg,之后每12h口服25mg,总量150mg。服药前后禁食2h。第3天早晨8时,空腹到门诊口服米索前列醇600ng。留诊观察8h。人流组常规施术。药流组在口服米非司酮前、后及流产后14d、22d采血,人流组在施术前及术后14d、22d采血,每次采静脉血3mL,制备血清。直接化学发光法测定血清雌二醇(E2)、促黄体生成素(FSH)、促卵泡生成素(LH)、孕酮(P)和人绒毛膜促性腺激素(β-HCG)含量。随访流产后阴道流血时间和流血量,转经时间。采用西门子ADVIA Centaur Cp全自动化学发光仪及试剂盒,批内误差<5%。
1.3 统计学方法 所有数据采用SPSS13.0统计软件进行处理,计量资料采用“±s”表示,组间比较采用单因素方差分析或t检验,双侧检验水准a=0.05,P<0.05为差异有统计学意义。
2 结果
2.1 药流组服药前后与人流组术前生殖激素水平变化比较 药流组完全流产169例,失败/不全流产清宫35例,人流组完全流产194例,清宫6例。与人流组比较,药流组服药后E2明显上升,差异有统计学意义(P<0.05);P无明显变化,差异无统计学意义;药流组服药后HCG呈上升趋势,但弱于人流组;2组FSH均下降(P<0.05);LH差异无统计学意义。见表1。

表1 药流组服药前后与人流组术前生殖激素水平变化比较(x±s)
2.2 2组流产后14、22d生殖激素水平变化比较 流产后第14、22天2组E2均呈上升趋势,但是药流组较同期人流组,E2升高缓慢(P<0.05);药流组β-HCG下降趋势较人流组平缓(P<0.05);药流组P水平始终高于人流组(P<0.05);2组FSH呈波动状态,LH均呈下降趋势,差异无统计学意义。见表2。

表2 2组流产后14、22d生殖激素水平变化比较(x±s)
2.3 2组阴道出血量、出血时间及转经情况比较 人流组完全流产者术后阴道出血量较药流组完全流产者明显减少,出血时间短,转经早,2组比较差异有统计学意义(P<0.05)。见表3。
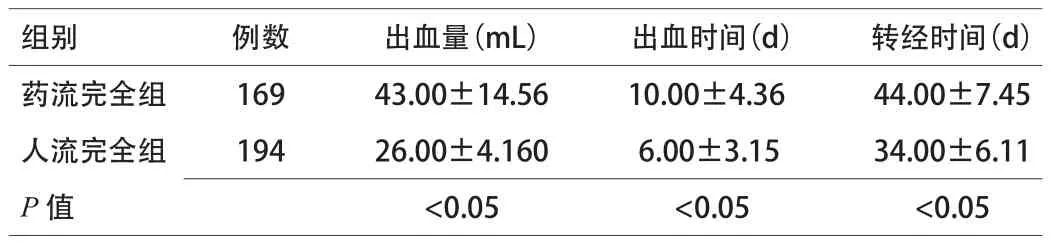
表3 2组阴道出血量、出血时间及转经情况比较(x±s)
3 讨论
本研究显示,服用米非司酮后E2有明显上升,与用药前相比差异有统计学意义,P无明显变化,服药后2组β-HCG均呈上升趋势,说明米非司酮促进E2分泌,而对P、β-HCG分泌无明显抑制作用;分析P在6~7孕周略有下降,是由于米非司酮抗早中孕的作用位点在蜕膜及黄体,孕8周前孕激素主要来源于妊娠黄体,米非司酮在受体水平拮抗孕酮的作用,致使孕8周前血清P浓度下降,促使蜕膜变性坏死,黄体溶解,继发绒毛受损。而孕8周后,妊娠黄体分泌孕激素的功能已逐渐被胎盘滋养层合体细胞所代替;有研究认为服用米非司酮后β-HCG变化非米非司酮的作用,而是β-HCG在早中期妊娠中正常的分泌动态,即早孕期持续上升,中孕后随孕周增加而下降并保持在某一稳定水平[3-4]。口服米非司酮后FSH下降,LH无明显改变,这可能与米非司酮直接作用于下丘脑和垂体引起FSH下降有关,部分原因可能与E2上升抑制其分泌有关[5]。
从流产后药流组E2缓慢升高、阴道流血时间、流血量以及转经等情况,分析E2值虽然显著高于人流组,但药流后子宫内膜呈现发育延迟的现象,75%为增生早、中期子宫内膜,说明米非司酮有抑制E2刺激子宫内膜再生的能力,导致卵巢高E状态与子宫内膜发育不同步的现象[6]。
药物流产后长时间出血已被公认的主要原因为不全流产,绒毛或蜕膜组织残留[7]。有学者认为,由于米非司酮可抑制卵巢功能,抑制卵泡的发育,且有微弱的孕激素活性,大剂量应用后,导致E2水平低下,影响子宫内膜修复,导致出血时间延长。又因E2水平低,减弱了前列腺素对子宫的收缩作用,使宫内残留物不易自宫壁剥脱,造成不全流产及药流后出血时间过长[8]。药流组P水平下降缓慢可能与孕囊排出后少量滋养叶细胞残留,HCG下降缓慢.黄体溶解不全,继续分泌孕酮有关。P水平高及E2水平低,又进一步影响了宫内残留物的排出,易造成不全流产及药流后出血时间过长[9]。
本研究提示,米非司酮对早孕妇女生殖激素水平确有影响。尤其当药流后阴道流血超过10d时,应检测血清E2、P、HCG水平,出现E2低于卵泡期水平,P高于卵泡期水平,HCG下降缓慢,提示不全流产,应及时清宫。
[1] 冉云霞,张俊鸿.影响药物流产效果相关因素的临床分析[J].山西医药杂志,2013,42(19):1155-1156.
[2] 林震然.药物流产后致不全流产98例临床分析[J].医学信息(下旬刊),2013,26(15):69.
[3] 刘东霞,刘英,杨勇.影响早孕药物流产结局的多因素分析[J].河北医学,2011,2(8):456-457.
[4] 孟亚丽,李川海,王立芹,等.产妇安胶囊治疗药物流产后出血的疗效分析[J].中国计划生育学杂志,2012,20(9):633.
[5] 张蕾,童英,吕佳会.药物流产后阴道出血治疗方法的探讨[J].中国妇幼保健,2012,27(34):5539-5541.
[6] 祝栋.雌孕激素治疗药物流产后阴道出血的效果分析[J].中国计划生育学杂志,2013,9(21):614-617.
[7] 王小汤.药物流产后阴道出血米索前列醇的治疗效果[J].浙江预防医学,2013,25(2):74-75.
[8] 艳锦,庄亚玲,钱志大,等.药物流产的可接受性及影响因素分析[J].中国计划生育学杂志,2012,11(7):398-399.
[9] 杨桂英,郑丽萍,李艳明.人工流产与药物流产所致继发不孕的对比分析[J].中国妇幼保健,2012(28):698-699.
Objective To study the effects of Mifepristone on early-pregnant women through examining the levels of human choionic gonadotophin(β-HCG), follicle-stimulating hormone (FSH), luteinizing hormone (LH), estradiol (E2), progesterone (P) and prolactin (PRL) in women of early pregnancy before, after taking Mifepristone and after abortion. Methods Women of early pregnancy who visited the clinic to opt for voluntary termination of their pregnancy were selected as target population for the study, and they were randomly divided into the medicaments abortion group (n=204)and the artificial abortion group (n=200). Peripheral blood samples were drawn from the medicaments abortion group before and after taking Mifepristone and 14 days and 22 days after abortion. Peripheral blood samples were also drawn from the artifi cial abortion group before and 14 days and 22 days after abortion. The blood samples were tested for levels of estradiol (E2), follicle-stimulating hormone (FSH), luteinizing hormone (LH), progesterone (P) and of human choionic gonadotophin (β-HCG). Results After taking Mifepristone, the E2level of the medicaments abortion group rose signifi cantly, with signifi cant difference (P<0.05); there was no signifi cant change in its P level, with no significant difference and the β-HCG level appeared to be on the rise, but lower than that of the artifi cial abortion group. The FSH levels of both groups were lower (P<0.05), LH showed no signifi cant change. On the 14th day and 22th day after abortion, the E2levels of both groups appeared on the rise, but E2level of the medicaments abortion group rose slower than that of the artifi cial abortion group in the same period (P<0.05). The β-HCG level of the medicaments abortion group declined more gently than that of the artifi cial abortion group. The P level of the medicaments abortion group maintained higher than that of the artifi cial abortion group throughout (P<0.05). The FSH levels of both groups appeared to fl uctuate, and the LH levels of both groups appeared to decline with no signifi cant difference. Conclusion Mifepristone does affect the levels of reproductive hormone in women of early pregnancy. The E2, P and HCG levels of blood serum should be tested, especially when vaginal bleeding after medicaments abortion is more than 10d. When E2level and P level are both lower than that of the follicular phase, and HCG level declines gradually, indicative of incomplete abortion, timely actions should be taken to clean the uterus.
Medicaments abortion; Female reproductive hormone; Early pregnancy
doi:10.3969/j.issn.1009-4393.2016.22.001
辽宁 110015 沈阳市计划生育科学研究所(张爱丹)

