126份番茄材料的抗性基因分子标记检测
陈宝玲 甘桂云 王先裕 于琴芝 龙安四*(广西大学农学院,广西南宁 50004;广西农业科学院蔬菜研究所,广西南宁50007;桂林市经济作物技术推广站,广西桂林5400)
126份番茄材料的抗性基因分子标记检测
陈宝玲1甘桂云2王先裕1于琴芝3龙安四1*
(1广西大学农学院,广西南宁 530004;2广西农业科学院蔬菜研究所,广西南宁530007;3桂林市经济作物技术推广站,广西桂林541001)
摘 要:利用分子标记技术,对56份大、中果型番茄进行烟草花叶病毒病抗性基因Tm-2a、番茄黄化曲叶病毒病抗性基因Ty-1、Ty-2、Ty-3、叶霉病抗性基因Cf-9、晚疫病抗性基因Ph-3、枯萎病抗性基因I-2和根结线虫病抗性基因Mi-1 8个抗性基因的检测,对70份小果型番茄进行Tm-2a、Ty-1、Cf-9、I-2、Mi-1 5个抗性基因的检测。共获得含烟草花叶病毒病抗性基因Tm-2a的材料71份;在番茄黄化曲叶病毒病的3个抗性基因方面,含纯合抗性基因Ty-1的材料7份,杂合16份;含杂合抗性基因Ty-2的材料1份;含纯合抗性基因Ty-3的材料5份,杂合7份。真菌性病害方面,含叶霉病抗性基因Cf-9的材料101份;含纯合晚疫病抗性基因Ph-3的材料1份,杂合6份;含枯萎病抗性基因I-2的材料68份;含根结线虫病抗性基因Mi-1的材料45份。供试番茄材料中,DHG-27同时含有7个抗性基因;含有6个抗性基因的材料有5份,分别为:DHG-11、DHG-20、DHG-34、ZHG-8、HG-4;含有5个抗性基因的有HG-3、XHG-35 2份材料。
关键词:番茄;分子标记;抗性基因检测
陈宝玲,女,硕士研究生,专业方向:蔬菜遗传育种与生物技术,E-mail:chenbl1990721@163.com
番茄(Solanum lycopersicum L.)是世界上重要的蔬菜作物之一,因其美味多汁、营养丰富,一直深受人们的喜爱,但是由于连年种植造成严重的连作障碍,番茄病害已达40多种(杜永臣 等,1999)。广西地区发生较为严重的有晚疫病、叶霉病、枯萎病、烟草花叶病毒病、番茄黄化曲叶病毒病、番茄根结线虫病等。选用番茄抗病品种是解决病害问题的根本途径之一(孔凡慧 等,2015)。赵杨等(2012)指出,目前我国针对番茄主要病害尚缺乏免疫和高抗品种,可能的原因是育成的番茄品种缺乏相关抗病基因。抗病性鉴定是抗病育种的首要工作,常规鉴定方法费时费力,易受环境及人为主观因素影响,且难以对多个抗性同时进行鉴定,随着分子标记技术的迅速发展,可以在苗期进行大量的抗病性鉴定,不受时间地域限制,显著加速育种进程(吴媛媛 等,2009)。本试验利用分子标记技术,对126份番茄材料进行抗性基因检测,以便追踪目标基因,在育种中实现分子标记辅助选择,为今后番茄聚合抗病育种提供依据。
1 材料与方法
1.1 试验材料
供试材料为广西大学农学院番茄课题组从国内外收集的126份番茄材料,经多代分离自交纯化的高代自交系(表1),每一代都严格筛选单株留种,于2015年3月种植在广西武鸣试验基地。其中56份大、中果型番茄进行烟草花叶病毒病抗性基因Tm-2a、番茄黄化曲叶病毒病抗性基因Ty-1、Ty-2、Ty-3、叶霉病抗性基因Cf-9、晚疫病抗性基因Ph-3、枯萎病抗性基因I-2和根结线虫病抗性基因Mi-1共6种病害8个抗性基因的PCR检测;70份小果型番茄检测Tm-2a、Ty-1、Cf-9、I-2、Mi-1 共5种病害的5个抗性基因。
1.2 DNA的提取及试验试剂
DNA提取采用改良的CTAB法(陈昆松 等,2004),取新鲜嫩叶作为样品提取番茄基因组DNA,利用核酸蛋白分析仪检测DNA浓度,用1.2%琼脂糖凝胶电泳检测纯度,将提取的DNA用TE稀释至400 ng·μL-1,-20 ℃保存备用。试验使用的dNTPs、Taq DNA聚合酶、DNA Marker、CTAB等分子试剂均购自Transgene公司。试验引物序列(表2)由深圳华大基因科技服务有限公司合成。

表1 126份番茄材料的类型及来源
1.3 抗性基因检测及PCR反应体系
叶霉病抗性基因Cf-9、烟草花叶病毒病抗性基因Tm-2a、根结线虫病抗性基因Mi-1的检测参照孙亚林(2008)开发的标记(表2)。PCR反应体系25 μL:2.5 μL 10× Buffer with Mg2+,0.5 μL dNTPs(2.5 mM),正反向引物各0.5 μL(100 μmol·L-1),0.5 μL DNA 模板(100 ng·μL-1),0.5 U Taq DNA聚合酶,ddH2O 补足25 μL。反应程序:94 ℃预变性5 min;94 ℃变性1 min,适宜Tm值退火1 min,72 ℃延伸80 s,32个循环;72 ℃延伸8 min,扩增产物4 ℃保存。
参照Matthew等(2010)、Merk和Foolad (2012)利用标记位点dTG328设计的CAPS引物检测番茄抗晚疫病Ph-3基因(表2)。PCR反应体系20 μL:2 μL 10×Buffer with Mg2+,0.4 μL dNTPs(2.5 mM),正反向引物各0.4 μL(100 μmol·L-1),1 μL DNA 模板(200 ng·μL-1),0.3 U Taq DNA聚合酶,ddH2O补足20 μL。反应程序:94 ℃ 3 min;94 ℃ 30 s,56 ℃ 30 s,72 ℃ 30 s,35个循环;72 ℃ 10 min。酶切反应体系25 μL:2.5 μL BstNI Buffer,0.3 μL BstN I内切酶,2.2 μL ddH2O,20 μL PCR反应产物,37 ℃酶切2 h。
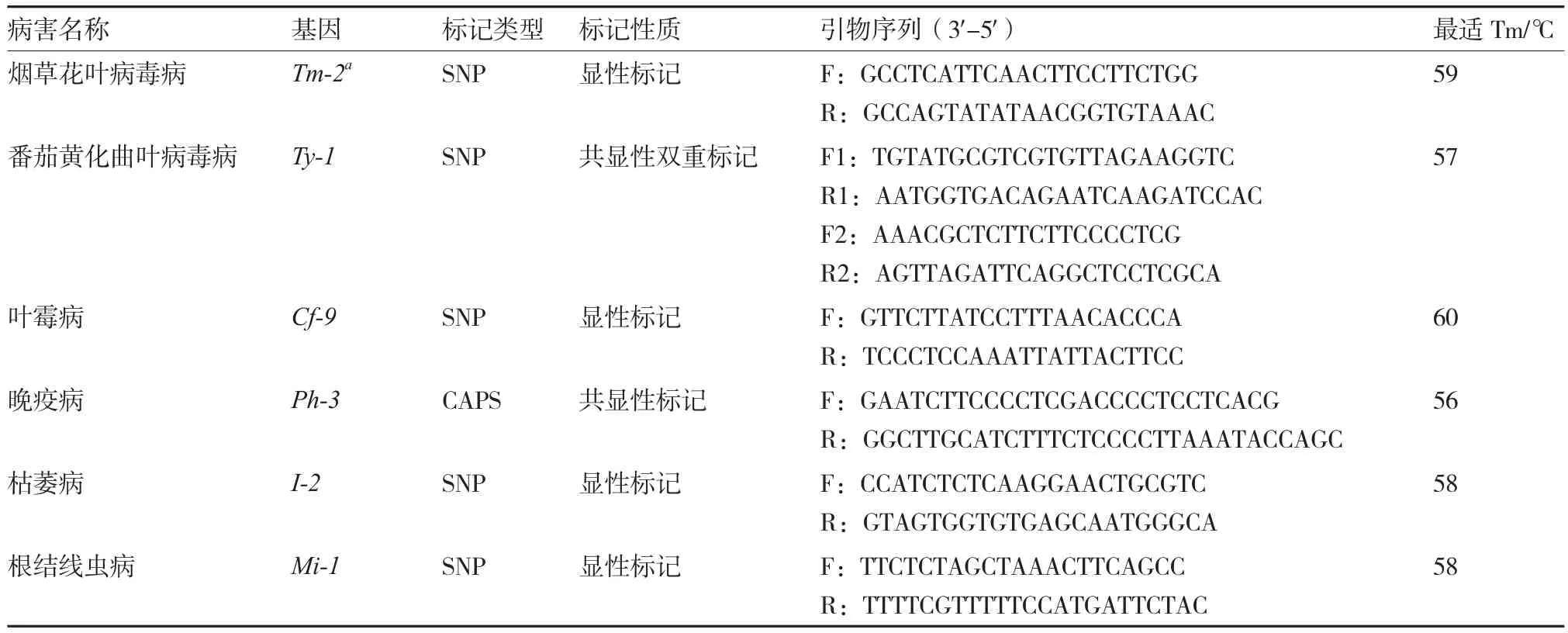
表2 用于分子标记的引物信息
枯萎病抗性基因I-2的检测参照徐薪惟(2012)开发的SNP标记(表2),PCR反应体系25 μL:2.0 μL 10× Buffer with Mg2+,2.5 μL dNTPs(2.5 mM),正反向引物各1.0 μL(10 μmol·L-1),0.5 μL DNA 模板(100 ng·μL-1),0.5 U Taq DNA聚合酶,ddH2O补足25 μL。反应程序:94 ℃ 5 min;94 ℃ 30 s,58 ℃ 30 s,72 ℃ 70 s,35个循环;72 ℃ 7 min,扩增产物4 ℃保存。
番茄黄化曲叶病毒病抗性基因Ty-1的检测参照华中农业大学番茄课题组葛乃蓬等(2014)开发的双重SNP标记(表2),PCR反应体系20 μL:2.0 μL 10× Buffer with Mg2+,0.4 μL dNTPs(2.5 mM),正反向引物(100 μmol·L-1)各0.4 μL,正反向引物(100 μmol·L-1)各0.2 μL,1.0 μL DNA 模板(200 ng·μL-1),0.2 U Taq DNA聚合酶,ddH2O 补足20 μL。反应程序:94 ℃ 5 min;94 ℃1 min,58 ℃ 1 min,72 ℃ 1min,35个循环;72 ℃10 min,扩增产物4 ℃保存。
番茄黄化曲叶病毒病抗性基因Ty-2、Ty-3的检测参照中国农业科学院蔬菜花卉研究所提供的引物进行(未列出)。PCR反应体系10 μL:2×Go Taq GreenMaster Mix 5 μL,正反向引物(100 μmol·L-1)各0.25 μL,DNA模板(200 ng·μL-1)0.5 μL,ddH2O 补足至10 μL。反应程序:94 ℃ 4 min;94 ℃ 40 s,55 ℃ 40 s,72 ℃ 90 s,35个循环;72 ℃ 8 min,扩增产物16 ℃保存。
上述PCR及酶切产物在含有核酸染料的1.2%琼脂糖凝胶中电泳40 min,120 V恒定电压,最终结果在ChemiDoc MP型凝胶成像系统上显示。
2 结果与分析
2.1 烟草花叶病毒病抗性基因Tm-2a的检测
图1为部分材料Tm-2a的PCR扩增结果。含Tm-2a基因的材料可以扩增出472 bp的特异性片段,不含该抗性基因的材料则无扩增产物。经检测,126份材料中,71份含有抗性基因Tm-2a,55份不含抗性基因。

图1 烟草花叶病毒病抗性基因Tm-2a检测结果M:Marker;CK1:阳性对照;CK2:阴性对照;1~22:不同番茄材料,下图同。
2.2 番茄黄化曲叶病毒病抗性基因Ty-1、Ty-2、Ty-3的检测
经Ty-1引物双重SNP扩增(图2),含纯合抗性基因的材料扩增出938 bp的特异性片段,含杂合抗性基因的材料扩增出948 bp和1 343 bp的特异性片段,不含抗性基因的材料扩增出1 343 bp的片段。经检测,126份材料中,含纯合抗性基因Ty-1的有7份,杂合的16份,103份材料不含Ty-1基因。
经Ty-2引物扩增(图3),含抗性基因的材料扩增出300 bp的特异性片段,不含抗性基因的材料扩增出600 bp的片段。经检测,56份大、中果型材料中,均不含纯合抗性基因Ty-2,仅DHG-34含有杂合抗性基因。经Ty-3引物扩增(图4),含纯合抗性基因的材料扩增出500 bp的特异性片段,含杂合抗性基因的材料扩增出500 bp和300 bp的特异性片段,不含抗性基因的材料扩增出300 bp的片段。经检测,56份大、中果型材料中,含Ty-3纯合抗性基因的有5份,杂合的7份,无抗性基因的材料44份。
2.3 叶霉病抗性基因Cf-9的检测
经Cf-9引物扩增(图5),含抗性基因的材料扩增出415 bp的特异性片段,不含抗性基因的材料则无扩增产物。经检测,126份材料中,有101份含有抗性基因Cf-9,25份不含抗性基因。
2.4 晚疫病抗性基因Ph-3的检测
经Ph-3引物扩增(图6),所有材料均可扩增出400 bp的特异性片段,经BstN I酶切后,含纯合抗病基因的材料扩增出250 bp和150 bp的特异性片段,含杂合抗病基因的材料扩增出150、250 bp 和400 bp的特异性片段,不含抗病基因的材料不存在酶切位点,呈现400 bp的片段。经检测,56份大、中果型番茄材料中,含纯合抗性基因Ph-3的材料有1份,材料编号为DHG-11;含杂合抗性基因Ph-3的有6份,其余不含抗性基因。
2.5 枯萎病抗性基因I-2的检测
经I-2引物扩增(图7),含抗病基因的材料扩增出1 300 bp的特异性片段,不含抗病基因的材料则无扩增产物。经检测,126份材料中,68份含有抗性基因I-2,58份不含抗性基因。
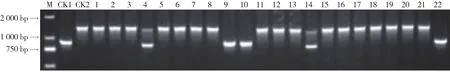
图2 番茄黄化曲叶病毒病抗性基因Ty-1检测结果
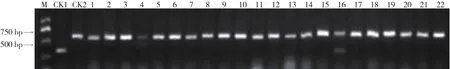
图3 番茄黄化曲叶病毒病抗性基因Ty-2检测结果

图4 番茄黄化曲叶病毒病抗性基因Ty-3检测结果

图5 叶霉病抗性基因Cf-9检测结果
2.6 根结线虫病抗性基因Mi-1检测
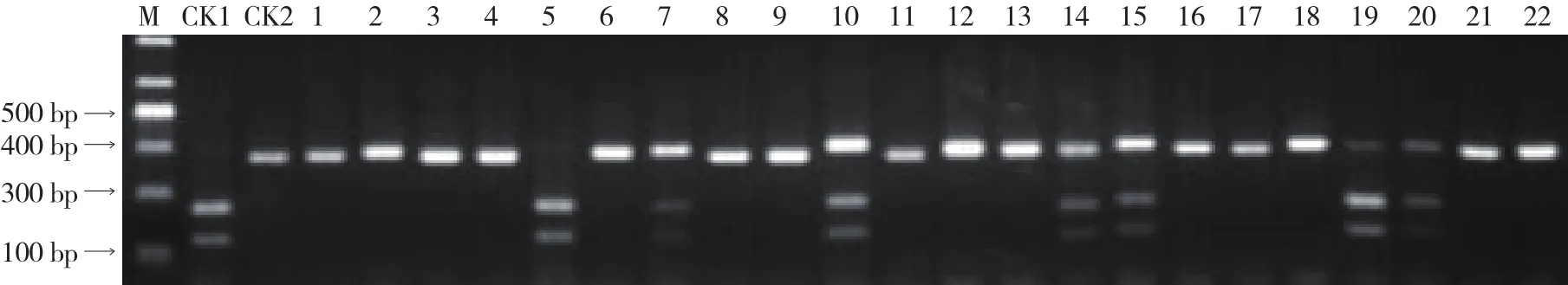
图6 晚疫病抗性基因Ph-3检测结果

图7 枯萎病抗性基因I-2检测结果
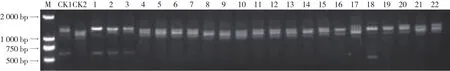
图8 根结线虫病抗性基因Mi-1检测结果
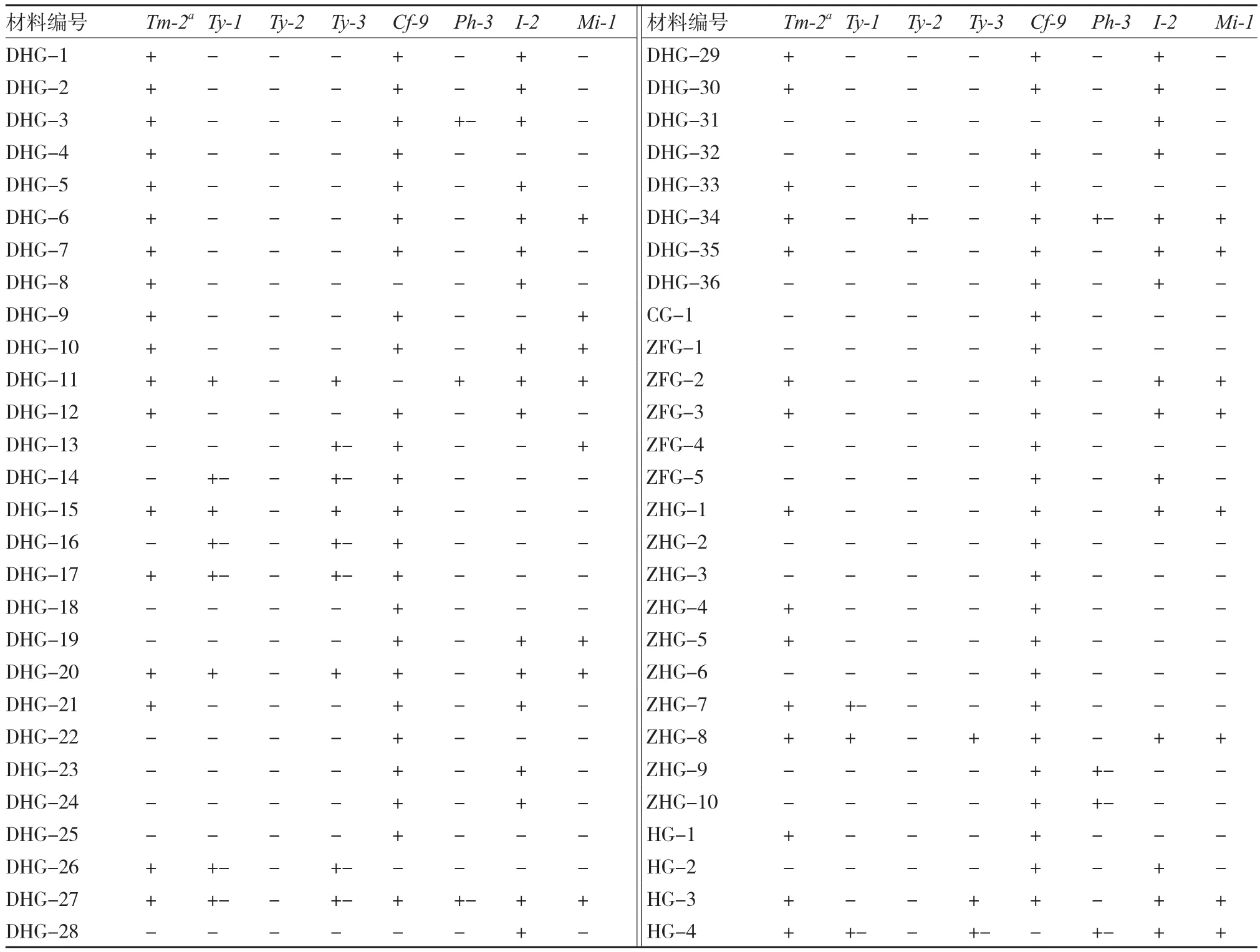
表3 大、中果型番茄材料抗性基因检测结果
经Mi-1引物扩增(图8),含抗性基因的材料扩增出1 353 bp和556 bp的特异性片段,不含抗性基因的材料扩增出1 287 bp的特异性片段。经检测,全部供试材料中,45份材料含有抗性基因Mi-1,81份不含抗性基因。
以上的试验结果表明(表3、4),126份供试材料中,含烟草花叶病毒病抗性基因Tm-2a的材料有71份。在番茄黄化曲叶病毒病的3个抗性基因方面,含纯合抗性基因Ty-1的材料7份,杂合16份;仅1份材料含杂合抗性基因Ty-2;含纯合抗性基因Ty-3的材料5份,杂合7份。在真菌性病害方面,含叶霉病抗性基因Cf-9的材料最多,有101份;含纯合晚疫病抗性基因Ph-3的材料1份,杂合6份;含枯萎病抗性基因I-2的材料68份;含根结线虫病抗性基因Mi-1的材料共45份。供试番茄材料中,DHG-27同时含有7个抗性基因;含有6个抗性基因的材料有5份,分别为:DHG-11、DHG-20、DHG-34、ZHG-8、HG-4;含有5个抗性基因的有HG-3、XHG-35 2份材料。
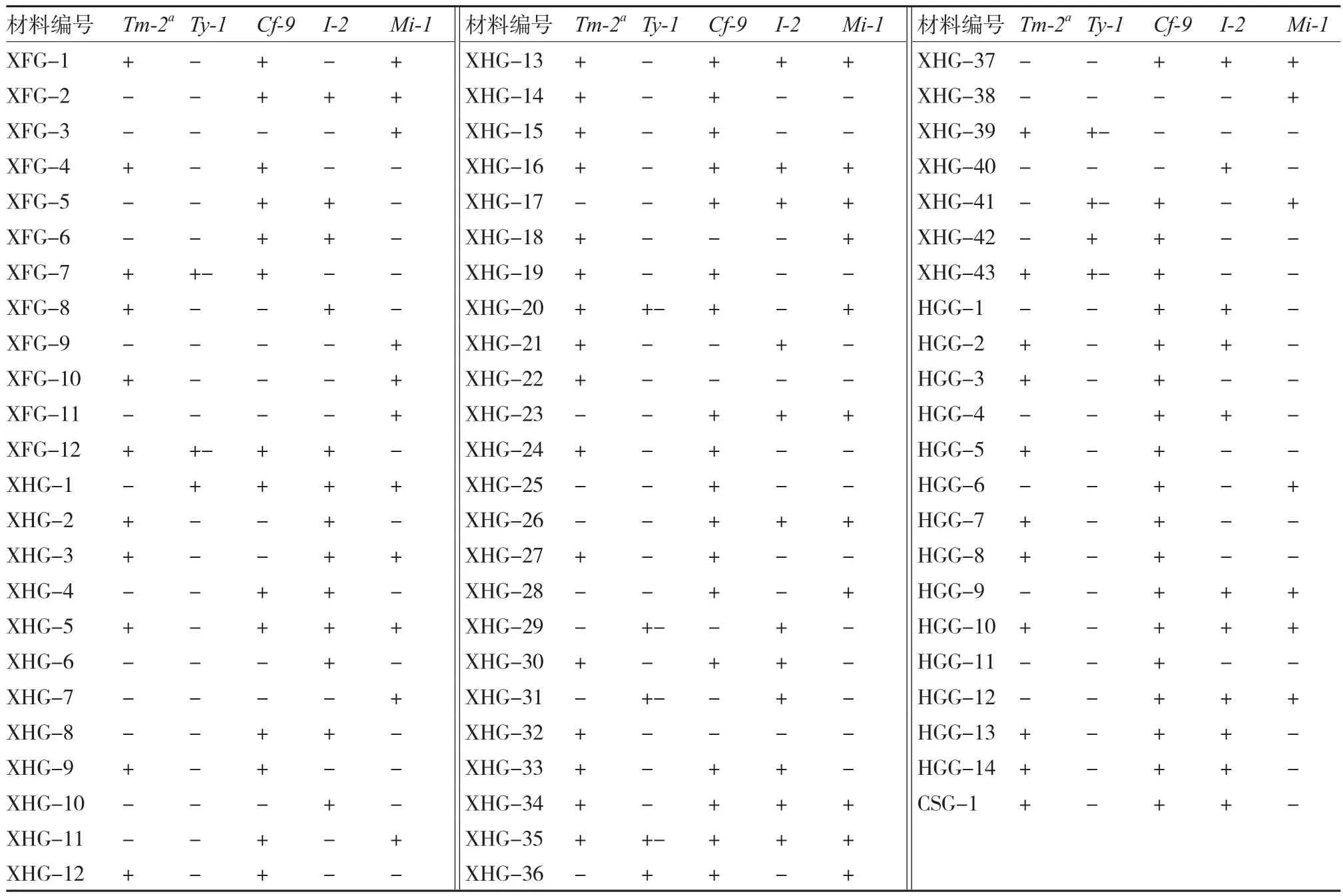
表4 小果型番茄材料抗性基因检测结果
3 结论与讨论
本试验从126份不同类型的番茄材料中筛选出多份兼抗多种病害的材料。其中含有抗性基因Tm-2a、Cf-9、I-2、Mi-1的材料较多,为今后培育多抗聚合番茄材料提供更多选择。
多份材料番茄黄化曲叶病毒病Ty-1和Ty-3抗性基因的检测结果一致,这可能与Ty-1和Ty-3基因都位于6号染色体有关。付蓉蓉等(2011)认为,同时含有纯合抗性基因Ty-1和Ty-3的番茄材料具有更高更稳定的抗性。曹永翔和张喜春(2007)指出,Cf-9抗性基因对中国目前的2个叶霉病优势生理小种具有较强抗性。含有Cf-9抗性基因的供试材料最多,对防御叶霉病有巨大优势。虽然国内外学者在番茄晚疫病抗病性鉴定方面取得了一定成果,但目前生产中还没有真正被应用的抗病品种(赵杨 等,2012)。根据本试验结果,含有晚疫病纯合抗性基因的材料只有DHG-11,后期试验应充分合理利用此材料。吴媛媛等(2010)报道,I-2基因可同时抗枯萎病生理小种1和生理小种2,在番茄抗枯萎病育种中应重视含有该基因的材料。曹永翔和张喜春(2007)还指出,Mi-1基因可抗南方根结线虫、花生根结线虫、爪洼根结线虫3种主要线虫,含有Mi-1基因的材料对番茄连作严重、根结线虫病高发地区具有重要意义。
分子标记技术以抗病基因研究为基础,具有操作简便、用时短的优点,可进行高通量的抗病筛选,这对缩短抗病育种年限及减少工作量具有重要意义。培育兼抗多种病害的番茄品种是防治番茄病害最经济有效的方法。本试验对126份番茄材料进行抗性基因的分子标记辅助选择,发现多数材料具有多种抗性基因。下一步试验应进行更多材料的相关抗性基因检测,尽可能检测更多的抗性基因,同时对部分杂合抗病基因材料进一步筛选纯化。
孙亚林(2008)指出,在育种过程中运用分子标记辅助选择对基因型进行选择时,所用标记大多与目标基因具有一定的遗传距离,分子标记会与目标基因发生连锁互换,从而在检测过程中出现假阳性,影响最后的选择效果。因此为了验证分子标记技术的准确性,在后期的试验中,应对材料进行室内及田间接种鉴定,进一步确定材料对病害的抗感程度,并且对农艺性状进行观测统计,从而筛选出抗多种病害且农艺性状优良的番茄材料,同时应继续收集番茄种质资源,为今后培育品质优良、兼抗多种病害的番茄品种奠定基础。
参考文献
曹永翔,张喜春.2007.分子标记技术在番茄抗性育种中的应用.中国农学通报,24(2):81-88.
陈昆松,李方,徐昌杰,张上隆,傅承新.2004.改良CTAB法用于多年生植物组织基因组DNA的大量提取.遗传,26(4):529-531.
杜永臣,严准,王孝宣,李树德,朱德蔚.1999.番茄育种研究主要进展.园艺学报,26(3):161-169.
付蓉蓉,刘杨,陈火英.2011.番茄黄化曲叶病的Ty-1和Ty-3抗性基因的PCR鉴定.分子植物育种(网络版),9:1647-1652.
葛乃蓬,崔龙,李汉霞,叶志彪.2014.番茄抗黄化曲叶病毒病抗病基因Ty-1的双重SNP标记的开发.园艺学报,28(1):195-200.
孔凡慧,李冬艳,许向阳,姜景斌,李景富.2015.多抗、耐贮存番茄育种材料的创制.中国蔬菜,(9):20-25.
孙亚林.2008.番茄四个抗病基因的基因标记的创建与辅助选择〔硕士论文〕.武汉:华中农业大学.
吴媛媛,李海涛,张子君,邹庆道,吕文书,杨国栋.2009.番茄抗晚疫病基因Ph-3的RAPD及CAPS标记.沈阳农业大学学报,40(6):716-719.
吴媛媛,李海涛,张子君,邹庆道.2010.番茄抗病基因分子标记研究进展.贵州农业科学,38(2):27-31.
徐薪惟.2012.番茄抗枯萎病I-2基因的SNP分子标记及种质资源的筛选〔硕士论文〕.哈尔滨:东北农业大学.
赵杨,苗则彦,李颖,白元俊.2012.番茄品种抗病性鉴定研究进展.辽宁农业科学.(6):38-44.
Matthew D R,Mohammed A T,Dilip R P,Randolph G G,David M F,Mikel R S.2010.Marker-assisted selection for coupling phase resistance to Tomato spotted wilt virus and Phytophthora infestans (Late Blight)in tomato.Hort Science,45(10):1424-1428.
Merk H L,Foolad M R.2012.Parent-offspring correlation estimate of heritability forLate blight resistance conferred by an accession of the tomato wild species Solanum pimpinellifolium.Plant Breed,131(1):203-210.
Molecular Marker Detection of Resistant Genes from 126 Tomato Varieties
CHEN Bao-ling1,GAN Gui-yun2,WANG Xian-yu1,YU Qin-zhi3,LONG An-si1*
(1Agronomy College of Guangxi University,Nanning 530004,Guangxi,China;2Vegetable Research Institute,Guangxi Academy of Agricultural Sciences,Nanning 530007,Guangxi,China;3Guilin City Cash Crops Technology Extention Station,Guilin 541001,Guangxi,China)
Abstract:Molecular marker technolocy was used to test 8 resistant genes from 56 tomato materials with large and middle fruit types including Tobacco mosaic virus disease resistant gene Tm-2a,Tomato yellow leaf curl virus disease resistant genes Ty-1、Ty-2、Ty-3,leaf mould resistant gene Cf-9,late blight resistant gene homozygous Ph-3,fusarium wilt resistant genes I-2,and root knot nematode resistant gene of Mi-1. Besides,5 resistant genes including Tm-2a、Ty-1、Cf-9、I-2、Mi-1 from 70 tomato materials of small fruit types were also tested. 71 materials with resistant gene Tm-2a,7 materials with pure resistant gene Ty-1,16 materials with heterozygosisbook=41,ebook=46resistant gene Ty-1,1 material with heterozygosis resistant gene Ty-2,5 materials with pure resistant gene Ty-3,7 materials with heterozygosis resistant gene Ty-3,101 materials with resistant gene Cf-9,1 material with pure resistant gene Ph-3,6 materials with heterozygosis resistant gene Ph-3,68 materials with resistant gene I-2,45 materials with resistant gene Mi-1.Among them,DHG-27 contains 7 resistant genes. There were 5 materials (DHG-11,DHG-20,DHG-34,ZHG-8,HG-4)containing 6 resistant genes. There were 2 materials(HG-3 and XHG-35)containing 5 resistant genes.
Key words:Tomato;Molecular marker;Resistant gene detection
*通讯作者(
Corresponding author):龙安四,男,农艺师,专业方向:园艺方面的试验和栽培技术研究,E-mail:longansi2005@163.com
收稿日期:2015-11-06;接受日期:2016-04-19
基金项目:广西科学研究与技术开发计划项目(桂科攻14121006-5-2、桂科合14123001-3、桂科攻13254002-2),国家大宗蔬菜产业技术体系桂林综合试验站项目(CARS-25-G-37),百色国家农业科技园区建设示范项目(桂科能 1598022-1-1)

