黄瓜CsaDMR6-2基因的克隆及特征分析
谢笑笑 顾兴芳Yuling aBi 苗 晗 张圣平* 闫滋福*(河南农业大学园艺学院,河南郑州 45000;中国农业科学院蔬菜花卉研究所,北京 0008;Wageningen University,The Netherlands)
黄瓜CsaDMR6-2基因的克隆及特征分析
谢笑笑1顾兴芳2Yuling aBi3苗晗2张圣平2*闫滋福1*
(1河南农业大学园艺学院,河南郑州 450002;2中国农业科学院蔬菜花卉研究所,北京 100081;3Wageningen University,The Netherlands)
摘 要:通过系统进化树和黄瓜霜霉病主效QTL分析,确定了与拟南芥抗霜霉病突变基因DMR6同源性较高的CsaDMR6-2基因为黄瓜霜霉病感病候选基因。以15份不同遗传背景的抗病和感病黄瓜自交系为材料克隆了CsDMR6-2基因,经过与已知功能的拟南芥基因DMR6、DLO1和DLO2的氨基酸进行多序列比对、蛋白质二级和三级结构的预测,结果显示:欧洲温室型的抗病材料K15和K58的CsaDMR6-2的CDS序列在856 bp处有1个碱基的突变,引起相应氨基酸由丝氨酸(TCA)变成丙氨酸(GCA),进而引起其部分蛋白质二级和三级结构的变化;CsaDMR6-2与拟南芥的DMR6、DLO1和DLO2基因具有很高的同源性,且同属于一类氧化酶,两者具有相同的结构域,而抗病材料的变异位点均发生在催化区。试验结果为进一步研究CsaDMR6-2的基因功能和利用感病基因获得霜霉病持久广谱抗性打下了良好的基础。
关键词:黄瓜;CsaDMR6-2;感病基因;同源克隆;霜霉病抗性
谢笑笑,女,硕士研究生,专业方向:黄瓜遗传育种与分子生物学研究,E-mail:xiaoxiao.xie@foxmail.com
黄瓜霜霉病是由霜霉病菌(Pseudoperonospora cubensis)引起的,俗称跑马干、黑毛等,是世界范围内黄瓜产区主要叶部病害之一(Thomas,1986;Lebeda,1992;曹清河 等,2007),已在70多个国家发生为害(王丽娟 等,2010)。近年来,国内外研究者对黄瓜霜霉病进行了比较深入的研究,发现了多个黄瓜霜霉病抗性主效QTL位点。丁国华(2004)采用抗病基因类似序列(resistance gene analog,RGA)克隆和标记基因方法,成功获得了15个RGA片段。李金鑫等(2008)以东农129(抗霜霉病黄瓜)为试验材料,利用差异显示反转录聚合酶链式反应(DDRT-PCR),研究黄瓜接种霜霉病菌前后基因表达的差异,成功鉴定出4个抗病相关基因。白智龙等(2008)利用S94和S06构建永久群体衍生的224个F6:7家系,在第1和第6连锁群上检测出黄瓜霜霉病抗性的3个QTLs位点;Zhang等(2013)利用K8 与K18为抗感亲本构建的F2群体及F2:3家系,分别在1号、5号、6号染色体上定位到5个QTLs;Pang 等(2013)以抗霜霉病渐渗系IL52与感病品种长春密刺为亲本得到的276个F2单株为作图群体,在第5号染色体上检测到2个与霜霉病抗性相关的QTLs。日本学者Yoshioka 等(2014)利用CS-PMR1和日本栽培种 Santou 构建的RIL群体,在1号、5号、6号染色体上找到多个QTLs,其中包括1个主效QTL。但目前还未见霜霉病抗性基因被克隆的报道(Panstruga & Dodds,2009)。
综合前人的研究发现,黄瓜霜霉病抗性均由隐性基因控制(Zhang et al.,2013)。由此推测黄瓜霜霉病抗性可能是由感病基因的缺失或突变导致的。感病基因(S)是指一些在植物防御过程中起消极作用的基因,与抗病基因(R)相对,它在原生功能上与R基因一样,是植物正常代谢所必须的基因,只有在病原物侵染植物后它们才表现出截然对立的次生功能(Eckardt,2002)。与R相比,在植物免疫系统里S基因更可能提供持久抗病的类型。1997年第1个植物感病基因大麦MLO(Mildew Resistance Locus O)基因被发现(Büschges et al.,1997)。之后研究工作者相继在拟南芥、番茄、豌豆、葡萄、辣椒等作物中也发现MLO基因(Consonni et al.,2006;Bai et al.,2008;Feechan et al.,2008;Pavan et al.,2011;Kim & Hwang,2012)。现已在双子叶和单子叶植物中发现30多个MLO同源基因(Panstruga,2005),且有学者以黄瓜、甜瓜和西瓜基因组数据为基础,利用生物信息学方法对MLO 基因家族进行鉴定与分析。结果发现,黄瓜、甜瓜和西瓜基因组中共含有42 个MLO 基因家族成员,每一个物种均含有14 个成员,且保守性强(徐坚 等,2014)。除MLO外,在拟南芥等植物上还发现与白粉病感病有关的基因PMR4、PMR5 和PMR6(Vogel et al.,2002;Nishimura et al.,2003;Vogel et al.,2004;Ellinger et al.,2013)。在番茄中发现PMR4同源基因SlPMR4表达量下调的时候,其感染白粉病的能力会降低(Huibers et al.,2013)。在拟南芥上发现的基因DMR1(Downy mildew resistance gene 1)、DMR6(Downy mildew resistance gene 6)、DLO1(DMR6-like Oxygenase 1)与霜霉病感病性相关,它们的突变体都能对霜霉病产生不同强度的抗性(Zeilmaker et al.,2015)。 图位克隆拟南芥的DMR6基因,发现其编码一种未知功能的 2-oxoglutarate(2OG)-Fe(Ⅱ)oxygenase,经EMS诱变,dmr6在基因序列的691 bp处发生1个碱基的突变(G-A),相应的密码子从色氨酸变为了终止密码子(第141氨基酸),致使后面的催化区域无法翻译,而使dmr6变成了无效的等位基因,使拟南芥dmr6突变体对霜霉病菌产生抗性(van Damme et al.,2008)。对于黄瓜霜霉病的研究,虽然发现了多个抗性主效QTL位点,但对感病基因的研究还很少。
本试验拟通过对拟南芥DMR6的氨基酸序列与黄瓜的同源序列比对,寻找黄瓜霜霉病的S基因,分析其基因结构,以期为基因功能分析及抗霜霉病育种实践奠定基础。
1 材料与方法
1.1 试验材料及抗病性鉴定
以中国农业科学院蔬菜花卉研究所黄瓜课题组提供的15份不同遗传背景的黄瓜纯合自交系为试验材料。其中包括12份抗霜霉病材料K5、K7、K8、K15、K18、K19、K38、K58、K70、K71、K78 和YRP1;3份感霜霉病材料K10、K45和YRP2。种子经0.3% 的双氧水处理后置于28 ℃人工培养箱中催芽,胚根伸出约3 mm后播于30孔穴盘中,在人工气候箱(RXZ智能型,宁波江南仪器厂)内培养。培养条件为:14 h 光照/10 h 黑暗,白天25 ℃/夜间18 ℃。待幼苗长到2~3片真叶时,取下幼叶用锡箔纸包裹,写上编号,迅速放入液氮冷冻,后放于-80 ℃冰箱备用。
2014年7月将上述抗、感霜霉病材料在中国农业科学院蔬菜花卉研究所病理组可控温室里进行霜霉病苗期人工接种鉴定。接种条件:10 h 光照/ 14 h 黑暗,白天22 ℃/夜间18 ℃。接种鉴定方法、病情调查方法及抗性评价标准均参考“中华人民共和国农业行业标准NY/T 1857.2—2010第1部分:黄瓜霜霉病鉴定技术规程”。接种7 d 后开始进行病情调查,计算病情指数。
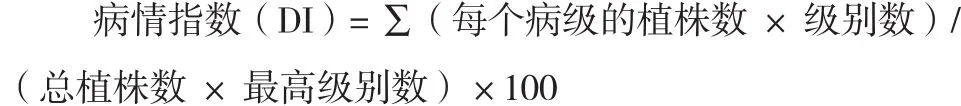
1.2 DNA 及RNA 的提取
采用改良的CTAB法提取DNA,使用TaKaRa MiniBEST Plant RNA Extraction Kit试剂盒〔购于宝生物工程(大连)有限公司〕提取黄瓜叶片总RNA。NanoDrop®ND-1000(NanoDrop Technologies,Inc.,USA)检测RNA的浓度及纯度。采用1.0%琼脂糖凝胶电泳检测其质量。
1.3 构建系统发育树及确定候选基因
为寻找同源基因,利用拟南芥抗霜霉病基因DMR6(基因编号:AT5G24530.1)的氨基酸序列分别在拟南芥基因组网站(http://www.arabidopsis. org/Blast/index.jsp)和黄瓜基因组网站(http://www. icugi.org/cgi-bin/ICuGI/tool/blast.cgi)(Huang et al.,2009)上进行Blast。将从黄瓜基因组上获得的同源性较高基因的氨基酸序列与拟南芥DMR6基因的氨基酸序列一起用MEGA 5.0构建系统进化树(Tamura et al.,2011)。 根据进化树结果再结合黄瓜霜霉病主效QTL位点,确定候选基因,然后将该候选基因的氨基酸序列在拟南芥基因组网站再次进行Blast,验证其准确性。
1.4 cDNA合成及目的基因克隆
利用TaKaRa Master Mix PrimeScriptTMRT〔宝生物工程(大连)有限公司〕合成 cDNA第一条链。根据目的基因cDNA序列用Primer Primier 6.0设计引物,上游引物序列:5′-ATGTCCGCTTCCGGC-3′;下游引物序列:5′-TTAAATCCTAAACAAATCTAA ACATCTTC-3′,扩增产物长度1 044 bp。扩增体系为:3 μL cDNA,10 μL mix(Promega),7 μL超净水。PCR反应条件:94 ℃预变性4 min;94 ℃ 变性15 s,55 ℃ 退火15 s,72 ℃延伸1.5 min,35个循环;72 ℃ 延伸5 min。1.0%琼脂糖凝胶电泳检测目的片段,PCR产物送到生工生物工程(上海)股份有限公司进行切胶纯化测序。测序上游引物:CsaDMR6-2_35_F为5′-CCACACCAAGTTGCT TGTCA-3′,CsaDMR6-2_231_F为5′-AACGCGACGG TTTCTTTCT-3′,CsaDMR6-2_713_F为5′-TCTCCT CCAAGACCAAGTCC-3′;下游引物:CsaDMR6-2_ 125_R为5′-GGAGTTTGGACGGTCAGAGA-3′,CsaDMR6-2_580_R为5′-AGCCCCAAGCTCTCAGAA AT-3′。以上引物均由生工生物工程(上海)股份有限公司合成。
1.5 序列比对及功能分析
序列拼接利用 Sequencher软件完成。利用在线网站 http://www.bio-soft.net/sms/index.html将测序结果翻译成氨基酸序列,并利用 ClustalX 2.1进行氨基酸的序列比对。
将拟南芥DMR6与目的基因的氨基酸序列在NCBI上进行Blastp分析预测保守域结构,并进行比较。基因的蛋白质二级、三级结构在网站phyre2(http://www.sbg.bio.i c.ac.uk/phyre2/html/page. cgi?id=index)上进行预测,并进行比较寻找差异。
2 结果与分析
2.1 系统进化树分析确定黄瓜霜霉病感病候选基因CsaDMR6-2

图1 黄瓜与拟南芥DMR6同源基因进化树分析
将拟南芥抗霜霉病基因DMR6(AT5G24530.1)氨基酸序列在黄瓜基因组网站上进行Blast,发现了5个同源性较高的基因,分别是:Csa4M091870.1、Csa5M146870.1、Csa7M378370.1、Csa7M375860.1 和Csa7M375850.1。从拟南芥基因组网站上Blast到的同源基因中挑选出8个同源性较高的基因:AT4G10490.1、AT4G10500.1、AT2G36690.1、AT2G44800.1、AT5G05600.1、AT3G60290.1、AT3G11180.2和AT3G11180.1。用MEGA 5.0软件采用邻近连接法构建系统发育树(图1)。从进化树可知:黄瓜7号染色体上的2个基因:Csa7M375850.1和Csa7M375860.1属于同一分支,且与拟南芥DMR6同源性最高,但至今并未有黄瓜7号染色体上存在霜霉病QTL位点的报道。此外同源性较高的还有Csa4M091870.1和Csa5M146870.1基因,分别命名为CsaDMR6-1、CsaDMR6-2 (Schouten et al.,2014)。CsaDMR6-1已经被克隆,该基因在拟南芥dmr6-1突变体中过表达,可使其很大程度地恢复感病能力,但该基因位于4号染色体,周围并未有抗黄瓜霜霉病QTL的发现(Zeilmaker,2012)。而位于5号染色体上部的2 个dm_5.1(Pang et al.,2013)和dm5.1(Yoshioka et al.,2014)与CsaDMR6-2连锁,中国农业科学院蔬菜花卉研究所黄瓜课题组在之前的研究中发现,在黄瓜5号染色体上有3个霜霉病QTL位点dm5.1、dm5.2和dm5.3,也与CsaDMR6-2在染色体上的物理位置较近,推测CsaDMR6-2为霜霉病感病基因的候选基因。利用CsaDMR6-2氨基酸序列在拟南芥基因组网站上进行Blast,结果显示,拟南芥DMR6(AT5G24530.1)与其同源性较高,再次验证两者具有较高的同源性。
2.2 黄瓜CsaDMR6-2的基因结构与氨基酸序列分析
通过同源克隆得到黄瓜CsaDMR6-2的CDS (coding domain sequence)序列。CsaDMR6-2的基因组序列为2 704 bp,CDS 序列全长1 044 bp,含有4个外显子,编码347个氨基酸。基因结构分析显示,CsaDMR6-2与拟南芥的DMR6 基因结构相似(图2:b-1,b-2)。AtDMR6的CDS序列为1 026 bp,编码341个氨基酸,两者包含2个相同的结构域,其中2OG-FeⅡ_Oxy是催化域。
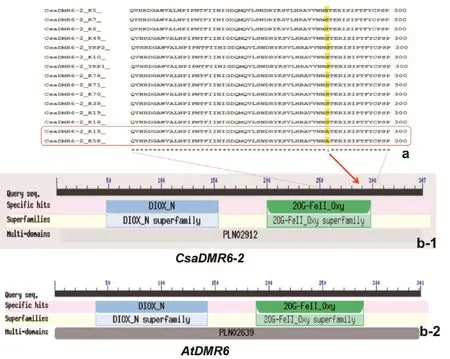
图2 15份材料CsaDMR6-2氨基酸序列比对(部分)及CsaDMR6-2和AtDMR6的基因结构彩色图版见《中国蔬菜》网站:www.cnveg.org,下图同。
克隆15份抗感材料的CsaDMR6-2基因,结果显示,抗性材料中仅欧洲类型K15和K58在CDS 第856 bp处存在1个碱基的差异:T突变为G,将该突变体命名为Csadmr6-2。该突变引起氨基酸序列上第286个氨基酸由丝氨酸(密码子为TCA,简写为S)变为丙氨酸(密码子为GCA,简写为A)。而且这2个突变位点,正好位于CsaDMR6-2基因具有功能作用的2OG-FeⅡ_Oxy催化域内。在15份材料中除欧洲温室型材料K15和K58的CsaDMR6-2有此突变外,其他类型的抗病品种及感病对照品种均无此突变(表1)。进一步对15份材料的氨基酸序列进行比对,结果如图2-a。
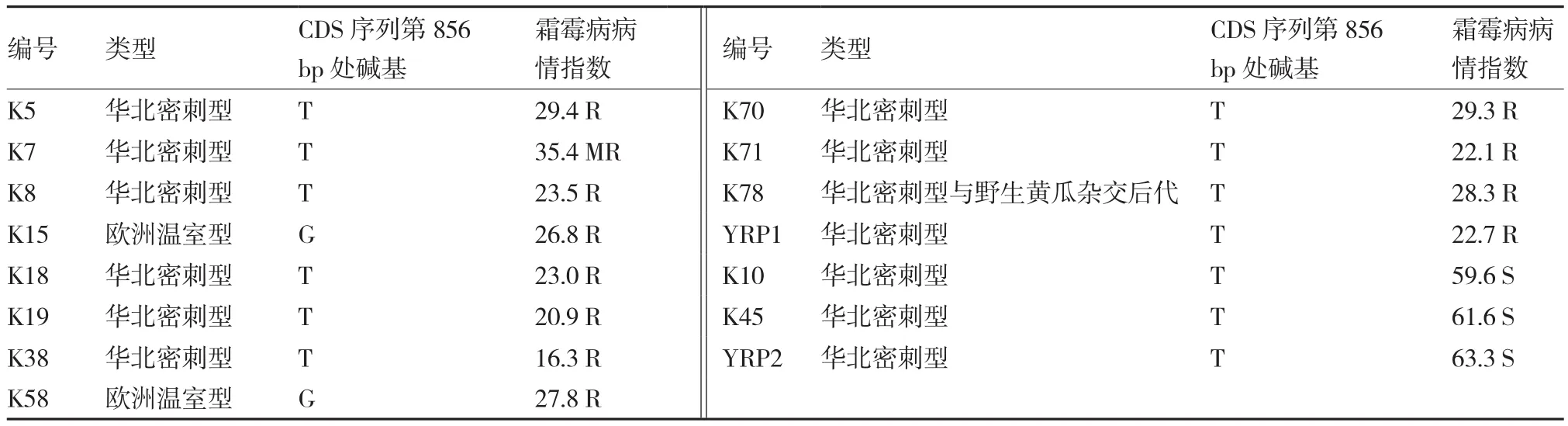
表1 试验材料类型、测序结果及霜霉病抗性
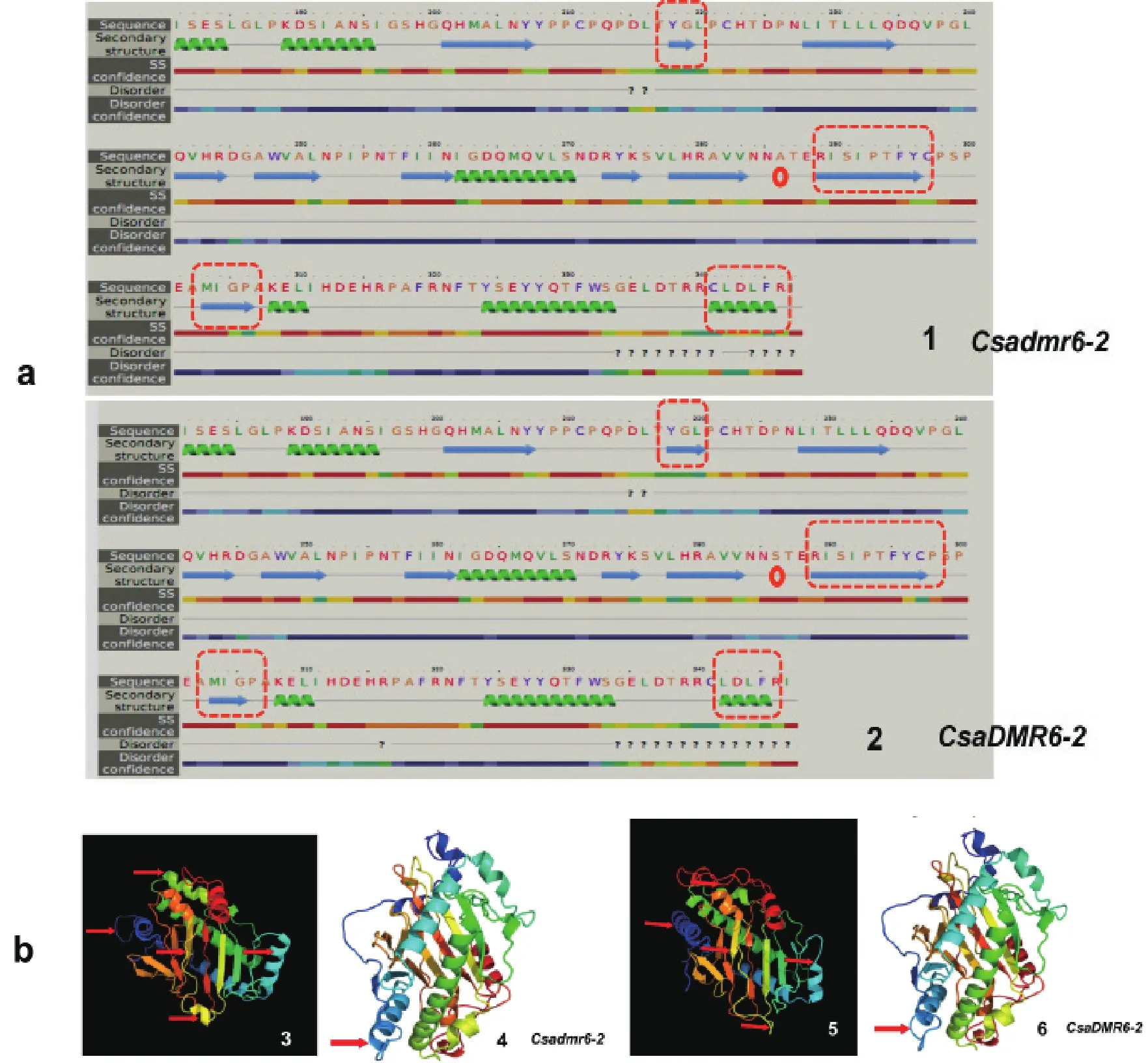
图3 CsaDMR6-2 与 Csadmr6-2 蛋白质二级、三级结构预测结果a:虚线内表示二者在二级结构上的差异,圆环处是氨基酸突变处;表示α螺旋,表示β折叠,表示无规则卷曲;b:二者在三级结构上的差异,以箭头表示。图片3和4为Csadmr6-2的三级结构;图片5和6为CsaDMR6-2的三级结构。
2.3 蛋白质二级和三级结构预测
对CsaDMR6-2 与 Csadmr6-2蛋白质二级、三级结构进行预测及比较(图3)。二者在蛋白质二级、三级结构上存在部分差异,特别是在蛋白质二级结构上突变处(图3-a圆环标明处)前后有4处明显差异,包括1个α螺旋、3个β折叠。这些二级结构的差异在三级结构上仍有体现(图3-b箭头处)。图4表示了CsaDMR6-2与AtDLO1、AtDLO2、AtDMR6的氨基酸序列比对结果。各基因的氨基酸序列长度基本一致,从同源性上看,拟南芥DMR6与CsaDMR6-2的同源性高于其与AtDLO1、AtDLO2的同源性。图4中下划部分为结构域:2OG-FeⅡ_Oxy,“△”上面为Csadmr6-2变异的位置。
3 讨论
前人已发现多个黄瓜霜霉病的抗性主效QTL位点,主要分布于5号染色体上,但发现的连锁标记与性状连锁不够紧密,不利于分子标记辅助育种,加之遗传基础狭窄和缺乏必要的基因组信息,目前还未见黄瓜霜霉病相关基因被克隆的报道。长期以来,人们关于植物抗病育种研究多是致力于寻找抗病基因。但是大量研究表明,R基因产生的抗性不持久(Panstruga & Dodds,2009)。近年来,对于S基因的研究为植物抗病育种开辟了新的道路(Pavan et al.,2010)。S基因编码一类受病原菌控制的蛋白质,以促进病原菌的繁殖使植物感病。因此,去除或使S基因的功能丧失会使病原菌的感病能力降低、丧失(Gust et al.,2010),这种植物免疫类型可能更持久(Gawehns et al.,2012)。Pavan等(2010)提出一种新颖的育种方法:使植物感病基因的功能丧失,进而使其产生持久、广谱的抗性。已有学者在黄瓜和番茄中发现DMR6同源基因,它们可使拟南芥dmr6突变体恢复部分感病能力,说明黄瓜、番茄中的DMR6-like基因促进其感染霜霉病(Zeilmaker,2012)。
本试验第一次通过同源克隆的方法在多份具有不同遗传背景且霜霉病抗性不同的材料中,根据拟南芥AtDMR6基因在黄瓜上同源克隆CsaDMR6-2基因,并获得全长cDNA序列。本试验结果显示仅欧洲温室型材料在该基因的CDS序列上有1个碱基的突变,并引起相应氨基酸的变化,而其他生态类型材料则不具有该突变位点。进一步比较CsaDMR6-2与拟南芥DMR6基因保守域,发现两者具有相同的两个结构域:DIOX_N和2OG-FeⅡ_ Oxy,属于2OG-Fe(Ⅱ)氧化酶,且欧洲温室型材料中该基因的突变部位发生在2OG-FeⅡ_Oxy结构域中。CsaDMR6-2与已知功能AtDLO1、AtDLO2、AtDMR6氨基酸序列比对,也发现它们具有很高的同源性。由此推测CsaDMR6-2很可能是欧洲类型黄瓜感染霜霉病的相关基因。
从黄瓜霜霉病抗病基因的研究可以发现:不同的试验材料所定位到的抗病QTL不完全相同。到目前为止,有6个QTLs分别可解释大于20%的变异(Schouten et al.,2014)。此外黄瓜霜霉病菌是否存在生理小种分化问题一直没有定论,但关于其具有小种分化现象的报道国外已有许多(Palti & Cohen,1980;Thomas,1986;Lebeda,1992;Shetty et al.,2002)。由此可以推测,不同生态类型、不同遗传背景的黄瓜可能拥有不同的霜霉病感病基因。本试验发现12份抗病材料中,只有欧洲温室型黄瓜的CDS序列发生了碱基突变,其他10份抗病材料中该基因的CDS不存在碱基突变,推测原因为不同来源和类型的抗病材料具有不同的遗传背景和不同的抗病或感病基因,CsaDMR6-2可能不是霜霉病唯一的S基因。
利用感病基因进行同源克隆的方法,将有助于加速黄瓜霜霉病抗性的研究,并可通过S基因沉默产生具有持久广谱抗性的黄瓜霜霉病新材料,为抗霜霉病育种奠定基础。本试验的CsaDMR6-2作为霜霉病感病基因的候选基因,是通过与已发现和证实的拟南芥的DMS-基因AtDMR6氨基酸序列比对获得的,它们具有较高的同源性,并且位于黄瓜霜霉病抗性QTL位点主要所在的5号染色体上。但要确认它是霜霉病的S基因需要进一步进行该基因的功能验证,利用基因编辑技术研究该候选基因的功能。后续可以选用更多的欧洲类型抗感霜霉病材料同源克隆CsaDMR6-2基因,并进行基因序列比对、表达分析、过表达及RNAi等研究来进一步验证该基因的功能。此外本试验在黄瓜7号染色体上还发现2个基因:Csa7M378370.1和Csa7M375860.1与拟南芥DMR6同源性较高,而目前还未有7号染色体上存在霜霉病抗病QTL位点的报道,因此也可作为今后研究的重点。
4 结论
本试验克隆出15份来源不同的黄瓜霜霉病抗病材料及感病材料的CsaDMR6-2基因的cDNA全长,通过序列比对发现,欧洲温室型材料K15和K58在CDS序列856 bp处有1个碱基的差异,且进一步引起第286个氨基酸的变化。经过蛋白质二级、三级结构的预测,该变化引起部分蛋白质结构的变化。将CsaDMR6-2与拟南芥DMR6基因保守域比较,与已知功能的AtDLO1,AtDLO2和AtDMR6氨基酸序列比对发现它们具有很高的同源性,都属于同一类氧化酶。结合同源比对、进化树分析和黄瓜霜霉病抗性QTL位点分析,CsaDMR6-2可作为主要的黄瓜霜霉病感病基因的候选基因。
参考文献
白智龙,袁晓君,蔡润,刘龙洲,何欢乐,周鸿飞,潘俊松.2008.黄瓜霜霉病抗性QTL分析.自然科学进展,18(6):706-710.
曹清河,万红建,陈劲枫.2007.黄瓜霜霉病抗性研究进展.中国瓜菜,(1):27-30.
丁国华.2004.黄瓜抗病基因同源序列的克隆及其对霜霉病抗病基因标记的研究〔博士论文〕.哈尔滨:东北农业大学.
李金鑫,秦智伟,丁国华,周秀艳.2008.黄瓜抗霜霉病相关基因cDNA片段的克隆及分析.园艺学报,35(3):371-376.
王丽娟,孙彩玉,牛德,秦智伟.2010.黄瓜抗霜霉病的分子生物学研究进展.中国蔬菜,(24):10-13.
徐坚,陈先知,王燕,史建磊,朱隆静,王克磊.2014.黄瓜、甜瓜和西瓜MLO 基因家族的比较基因组学分析.核农学报,28 (6):1006-1017.
Bai Y,Pavan S,Zheng Z,Zappel N F,Angelo R,Lotti C,Giovanni C D,Ricciardi L,Lindhout P,Visser R G F,Theres K,Panstruga R.2008.Naturally occurring broad-spectrum powdery mildew resistance in a Central American tomato accession is caused by loss of Mlo function.Molecular Plant-Microbe Interactions,21:30-39.
Büschges R,Hollricher K,Panstruga R,Simons G,Wolter M,Frijters A,van Daelen R,van der Lee T,Diergaarde P,Groenendijk J,Töpsch S,Vos P,Salamini F,Schulze-Lefert P.1997. The barley Mlo gene:a novel control element of plant pathogen resistance.Cell,88:695-705.
Consonni C,Humphry M E,Hartmann H A,Livaja M,Durner J,Westphal L,Vogel J,Lipka V,Kemmerling B,Schulze-Lefert P,Somerville S C,Panstruga R.2006.Conserved requirement for a plant host cell protein in powdery mildew pathogenesis.Nature Genetics,38:716-720.
Eckardt N A.2002.Plant disease susceptibility genes.Plant Cell,14:1983-1986.
Ellinger D,Naumann M,Falter C,Zwikowics C,Jamrow T,Manisseri C,Somerville S C,Voigt C A.2013.Elevated early callose deposition results in complete penetration resistance to powdery mildew in Arabidopsis.Plant Physiology,161:1433-1444.
Feechan A,Jermakow A M,Torregrosa L,Panstruga R,Dry I B. 2008.Identification of grapevine MLO gene candidates involved in susceptibility to powdery mildew.Functional Plant Biology,35:1255-1266.
Gawehns F,Cornelissen B J C,Takken F L W.2012.The potential of effector-target genes in breeding for plant innate immunity. Microbial Biotechnology,6:223-229.
Gust A A,Brunner F,Nurnberger T.2010.Biotechnological concepts for improving plant innate immunity.Current Opinionin Biotechnology,21:204-210.
Huang S,Li R,Zhang Z,Li L,Gu X,Fan W,Lucas W,Wang X,Xie B,Ni P,Ren Y,Zhu H,Li J,Lin K,Jin W,Fei Z,Li G,Staub J E,Kilian A,Van der Vossen E A G,Wu Y,Guo J,He J,Ji Z,Ren Y,Tian G,Lu Y,Ruan J,Qian W,Wang M,Huang Q,Li B,Xuan Z,Cao J,San A,Wu Z,Zhang J,Cai Q,Bai Y,Zhao B,Han Y,Li Y,Li X,Wang S,Shi Q,Liu S,Cho W,Kim J,Xu Y,Heller-Uszynska K,Miao H,Cheng Z,Zhang S,Wu J,Yang Y,Kang H,Li M,Liang H,Ren X,Shi Z,Wen M,Jian M,Yang H,Zhang G,Yang Z,Chen R,Liu S,Li J,Ma L,Liu H,Zhou Y,Zhao J,Fang X,Li G,Fang L,Li Y,Liu D,Zheng H,Zhang Y,Qin N,Li Z,Yang G,Yang S,Bolund L,Kristiansen K,Zheng H,Li S,Zhang X,Yang H,Wang J,Sun R,Zhang B,Jiang S,Wang J,Du Y,Li S.2009.The genome of the cucumber,Cucumis sativus L.Nature Genetics,41:1275-1281.
Huibers R P,Loonen A E H M,Gao D,van den Ackerveken G,Visser R G F,Bai Y.2013.Powdery mildew resistance in tomato by impairment of SlPMR4 and SlDMR1.PLoS One,8:e67467.
Kim D S,Hwang B K.2012.The pepper MLO gene,CaMLO2,is involved in the susceptibility cell-death response and bacterial and oomycete proliferation.The Plant Journal,72:843-855.
Lebeda A.1992.Screening of wild cucumis species against downy mildew(Pseudoperonospora cubensis)isolates from cucumbers. Phytoparasitica,20(3):203-210.
Nishimura M T,Stein M,Hou B H,Vogel J P,Edwards H.2003. Loss of a callose synthase results in salicylic acid-dependent disease resistance.Science,301:969-972.
Palti J,Cohen Y.1980.Downy mildew of Cucurbits (Pseudoperonospora Cubensis):the fungus and its hosts,distribution,epidemiology and control.Phytoparasitica,8:109-147.
Pang X,Zhou X H,Wan H J,Chen J F.2013.QTL mapping of downy mildew resistance in an introgression line derived from interspecific hybridization between cucumber and Cucumis hystrix. Journal of Phytopathology,161:536-543.
Panstruga R.2005.Serpentine plant MLO proteins as entry portals for powdery mildew fungi. Biochemical Society Transactions,33:389-392.
Panstruga R,Dodds P N.2009.Terrific protein traffic:the mystery of effector protein delivery by filamentous plant pathogens.Science,324:748-750.
Pavan S,Jacobsen E,Visser R G F,Bai Y.2010.Loss of susceptibility as a novel breeding strategy for durable and broadspectrum resistance.Molecular Breeding,25:1-12.
Pavan S,Schiavulli A,Appiano M,Marcotrigiano A R,Cillo F,Visser R G F,Bai Y,Lotti C,Ricciardi L.2011.Pea powdery mildew er1 resistance is associated to loss-of-function mutations at a MLO homologous locus.Theoretical and Applied Genetics,123:1425-1431.
Schouten H J,Krauskopf J,Visser R G F,Bai Y.2014.Identification of candidate genes required for susceptibility to powdery or downy mildew in cucumber.Euphytica,200:475-486.
Shetty N V,Wehner T C,Thomas C E,Doruchowski R W,Vasanth Shetty K P.2002.Evidence for downy mildewraces in cucumber tested in Asia,Europe,and North America.Scienta Horticulturae,94:231-239.
Tamura K,Peterson D,Peterson N,Stecher G,Nei M,Kumar S. 2011.MEGA5:molecular evolutionary genetics analysis using maximum likelihood,evolutionary distance,and maximum parsimony methods.Molecular Biology and Evolution,28:2731-2739.
Thomas C E.1986.Downy and powdery mildew resistant muskmelon breeding line MR-1.HortScience,21:329.
van Damme M,Huibers R P,Elberse J,van den Ackerveken G.2008. Arabidopsis DMR6 encodes a putative 2OG-Fe(Ⅱ)oxygenase that is defense-associated but required for susceptibility to downy mildew.The Plant Journal,54(5):785-793.
Vogel J P,Raab T K,Schiff C,Somerville S C.2002.PMR6,a pectate lyase-like gene required for powdery mildew susceptibility in Arabidopsis.The Plant Cell,14:2095-2106.
Vogel J P,Raab T K,Somerville C R,Somerville S C.2004. Mutations in PMR5 result in powdery mildew resistance and altered cell wall composition.The Plant Journal,40:968-978.
Yoshioka Y,Sakata Y,Sugiyama M,Fukino N.2014.Identificationof quantitative trait loci for downy mildew resistance in cucumber (Cucumis sativus L.).Euphytica,200:475-486.
Zeilmaker T.2012.Functional and applied aspects of the DOWNY MILDEW RESISTANT 1 and 6 genes in Arabidopsis〔PhD Thesis〕.The Netherlands:Univ of Utrecht:1-147.
Zeilmaker T,Ludwig N R,Elberse J,Seidl M F,Berke L,van Doorn A,Schuurink R C,Snel B,van den Ackerveken G.2015. DOWNY MILDEW RESISTANT 6 and DMR6-LIKE OXYGENASE 1 are partially redundant but distinct suppressors of immunity in Arabidopsis.The Plant Journal,81(2):210-222.
Zhang S P,Liu M M,Miao H,Zhang S Q,Yang Y H,Xie B Y,Wehner T C,Gu X F.2013.Chromosomal mapping and QTL analysis of resistance to downy mildew in Cucumis sativus.Plant Disease,97:245-251.
Cloning and Characteristic Analysis of Gene CsaDMR6-2 in Cucumber
XIE Xiao-xiao1,GU Xin-fang2,Yuling Bai3,MIAO Han2,ZHANG Sheng-ping2*,YAN Zi-fu1*
(1Horticultural College,Henan Agricultural University,Zhengzhou 450002,Henan,China;2Institute of Vegetables and Flowers,Chinese Academy of Agricultural Sciences,Beijing 100081,China;3Wageningen University,The Netherlands)
Abstract:The objective of the current study was to exploit susceptible gene (S-gene) for DM in cucumber,which will be provided as target S-gene for editing and functional analysis,leading to a new way of breeding for durable and broad-spectrum resistance to DM in cucumber. A total of 15 cucumber inbred lines of different genetic background of DM resistance (DMR) was used to identify and clone the homologs of DMR6,a DM S-gene in Arabidopsis,with the analysis of systematic evolutionary tree and major QTLs of cucumber DMR. A highly homologue candidate S-gene CsaDMR6-2 was identified. The alignment of the amino acid sequences and the prediction of secondary and tertiary protein structures between CsaDMR6-2 and Arabidopsis genes DMR6,DLO1 and DLO2 of known functions indicated that one base-pair mutation was found at 856 bp of CDS sequence of CsaDMR6-2 from K15 and K58 of European type with DMR,leading to the change of amino acids from serine (TCA) into alanine (GCA),which resulted in some changes of their protein secondary and tertiary structures. The results also indicated that CsaDMR6-2 and Arabidopsis genes DMR6,DLO1 and DLO2 have very high homologue in sequences. They are in the same group of oxidases,having the same domain and the same mutation location happened in catalytic region from the DMR genotype. The current study provided support to further function analysis of CsaDMR6-2 and the utilization of S gene for durable and broad-spectrum resistance to DM in cucumber.
Key words:Cucumber;CsaDMR6-2;Susceptible gene;Homologue gene cloning;Downy mildew resistance(DMR)
*通讯作者(
Corresponding authors):闫滋福,男,教授,硕士生导师,专业方向:黄瓜遗传育种研究,E-mail:zifu.yan@qq.com;张圣平,男,研究员,硕士生导师,专业方向:黄瓜遗传育种研究,E-mail:zhangshengping@caas.cn
收稿日期:2015-12-10;接受日期:2016-03-04
基金项目:国家自然科学基金项目(31272187),农业部园艺作物生物学与种质创制重点实验室资助项目,国家现代农业产业技术体系建设专项资金资助项目(CARS-25)

