术中自体血回吸收后不同温度下保存对红细胞无氧代谢的影响
史晓萍,李国辉,徐 涛,王 庚
(北京积水潭医院麻醉科 100035)
术中自体血回吸收后不同温度下保存对红细胞无氧代谢的影响
史晓萍,李国辉,徐涛,王庚
(北京积水潭医院麻醉科100035)
[摘要]目的对比术中回吸收自体血在室温(23 ℃)和低温(4 ℃)下保存对红细胞无氧代谢的影响。方法随机选取接受骨科手术患者40例,术中应用自体血回吸收,回吸收后的自体血分别在室温下(n=20)和低温下(n=20)保存4 h,在0 h(T0)、2 h(T2)、4 h(T4)时抽取2 mL自体血样本检测乳酸(Lac)、pH、动脉血氧分压(PaO2)。结果两组乳酸水平随时间的变化逐渐升高,T2和T4均高于T0(P<0.01),组间比较差异无统计学意义(P>0.05);两组pH随时间的变化逐渐降低,T2和T4均低于T0(P<0.01),组间比较差异无统计学意义(P>0.05);两组内PaO2随时间的变化逐渐降低,T2和T4均低于T0(P<0.01),组间比较差异无统计学意义(P>0.05)。结论自体血回吸收后的红细胞放置4 h无氧代谢仍可进行,室温与低温条件下保存对其的影响无差异。
[关键词]红细胞;无氧代谢;自体血;温度
自体血回吸收可以有效回收术中出血,及时补充患者术中丢失的红细胞,增加组织氧供,维持血流动力学稳定[1],与输注异体血相比,还可以减少异体输血所引发的发热、过敏、传染病等并发症[2]。有研究表明,血液在低温保存期间仍进行缓慢的代谢,释放的乳酸和二氧化碳等可以使血液的pH值降低[3]。但自体血回吸收后的红细胞悬液在室温(23 ℃)与低温(4 ℃)条件下放置对红细胞无氧代谢的影响未见报道,本试验收集一定数量的回吸收自体血在室温和低温下放置4 h,观察自体血中乳酸(Lac)、动脉血氧分压(PaO2)、pH的变化,为临床更有效管理自体血回输提供依据。
1资料与方法
1.1一般资料随机选取本院手术室接受骨科手术患者40例,术中均使用自体血回吸收,所用自体血回吸收机为Cell Saver 5+型(美国血液公司),具体操作为:先制备肝素抗凝(浓度50 IU/mL)的生理盐水1 000 mL作为抗凝液,在自体血回吸收前先向回吸收罐中注入抗凝液100 mL,然后回吸收手术野出血,抗凝液与回吸收血液按照体积比1∶5的比例混合吸入回吸收罐中(负压吸引压力为150 mm Hg),每15分钟轻轻摇动回吸收罐使抗凝液与血液充分混合。在手术结束前进行手术切口缝合时开始进行自体血离心、洗涤,具体操作由自体血回吸收机按照固定程序全自动完成,收集回吸收红细胞悬液于输血袋中储存。

表1 两组患者一般情况及术中回吸收血量比较±s)
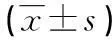
表2 两组间乳酸、pH、PaO2比较
*:P<0.01,组内与T0比较。
1.2标本放置与检测指标40例回吸收的红细胞悬液随机分为两组,即常温组(n=20)与低温组(n=20)。两组红细胞悬液储血袋分别在手术室中(23 ℃)和低温冰箱(4 ℃)放置4 h,在放置0 h(T0)、2 h(T2)、4 h(T4)时抽取2 mL自体血样本,用Premier 3000型全自动血气分析仪(实验仪器公司,美国)进行检测,检测指标包括:乳酸、pH、PaO2。
2结果
患者一般情况及自体血回吸收量比较差异无统计学意义(P>0.05),结果见表1。两组乳酸随时间的变化逐渐升高,T2和T4均高于T0(P<0.01),组间比较差异无统计学意义(P>0.05);两组pH随时间的变化逐渐降低,T2和T4均低于T0(P<0.01),组间比较差异无统计学意义(P>0.05);两组PaO2随时间的变化逐渐降低,T2和T4均低于T0(P<0.01),组间比较差异无统计学意义(P>0.05),结果见表2。
3讨论
红细胞功能为携氧与供氧,是机体内重要的血细胞[4]。红细胞结构简单,无线粒体,不能进行有氧代谢,仅能进行无氧糖酵解代谢提供自身能量并且产生乳酸,无氧代谢是红细胞生理功能的重要特征之一,即无氧代谢正常进行,红细胞才能发挥功能[5]。
术中自体血回吸收可以有效回吸收手术中的出血,回输患者后可以及时补充红细胞,增加组织氧供,维持器官功能稳定。加上近年来,血源日益紧张,使得对自体血回收、回输技术更加重视,并在临床中广泛应用[6]。以前有研究表明自体血回吸收后对红细胞形态学结构无明显影响,红细胞生理功能稳定,提示自体血回吸收是一种安全、有效的输血方法[7]。血液经离心、清洗可以清除93%以上的炎性因子、组织碎片、被破坏的细胞基质及抗凝剂等,衰老或变性的红细胞在处理过程中会发生溶血而被清除[8]。回吸收血中含有高浓度的2,3二磷酸甘油酸明显优于库存异体血[9]。自体血回吸收过程中,红细胞经过滤过、离心、洗涤后最终形成红细胞悬液,回输时机一般由麻醉师及护理人员共同决定,临床上并无严格的时间限定标准,对于保存的温度,目前也无统一的标准。有研究指出环境温度对红细胞有一定破坏力[10]。笔者认为由于自体血回吸收过程中为无菌操作,所以可以在室温下放置一定时间,待需要时再回输患者,但低温保存是否有益则需要实验验证。红细胞变形率在室温23 ℃和低温4 ℃保存6 h无明显差异[11]。本试验结果提示:在室温与低温下保存,红细胞无氧代谢并无差别,乳酸变化相同,又由于乳酸在机体内主要来源为肌肉组织和红细胞,所以在回吸收的红细胞悬液中乳酸来源仅能是红细胞,这就说明自体血中产生的乳酸量无差别,显示外界保存温度对红细胞无氧代谢并无差异。乳酸产生量增加,中和部分碱性物质,所以相应pH减小,但仍是碱性。试验中笔者也同时检测了PaO2变化,随放置时间延长,PaO2相应下降,但到4 h后仍大于150 mm Hg,自体血中氧气含量仍然充足。以上结果提示,自体血回吸收后在储血袋中可以放置4 h后再回输患者,室温与低温下保存均未对红细胞无氧代谢产生影响,红细胞原有生理功能回输后仍能发挥作用。但本试验仅局限于对红细胞无氧代谢的观察,对于回吸收自体血中其他生理生化指标的变化观察则未进行,在以后的研究中还需要进行更多方面的观察,这样才能更好地完善对术中自体血回输的管理。
总之,自体血回吸收后的红细胞放置4 h无氧代谢仍可进行,室温与低温条件下保存对其影响无差异。
参考文献
[1]刘彬,姚爱军,冯祝余,等.适度控制性降压联合术中自体血回输对老年全髋置换术患者的血液保护[J].实用医学杂志,2014,30(18):2936-2938.
[2]杜彦茹,赵砚丽.红细胞生化特性与形态功能的关系[J].河北医药,2008,30(2):216-217.
[3]宋波.血液回收机在手术室中的应用[J].中国医药指南,2012,10(14):140-141.
[4]王健美.自体血回输在骨科髋关节置换手术中的应用研究与护理[J].继续医学教育,2014,28(8):25-26.
[5]杨凤玲.术中洗涤式回收自体血与库存血红细胞携氧能力的比较[J].齐鲁护理杂志,2014,20(20):51-52.
[6]李建华,李斌,胡惠英,等.自体血回输对骨科手术患者组织氧代谢的影响[J].临床麻醉学杂志,2013,29(4):322-324.
[7]张东,赵砚丽,赵晓勇,等.术中自体血液回收对电镜下红细胞形态及膜蛋白二级结构的影响[J].中国输血杂志,2006,19(4):279-282.
[8]Gu YJ,Vermeijden WJ,De Vries AJ,et al.Influence of mechanical cell salvage on red blood cell aggregation,deformability,and 2,3-diphosphoglycerate in patients undergoing cardiac surgery with cardiopulmonary bypass[J].Ann Thorac Surg,2008,86(5):1570-1575.
[9]黄长顺.围术期血液保护[M].杭州:浙江大学出版社,2007:125-163.
[10]Schönberger JP,Van Oeveren W,Bredée JJ,et al.Systemic blood activation during and after autotransfusion[J].Ann Thorac Surg,1994,57(5):1256-1262.
[11]李国振,袁莉,刘陕岭,等.自体血贮存在不同温度时红细胞形态的变化[J].中国组织工程研究,2014,18(2):205-210.
doi:·经验交流·10.3969/j.issn.1671-8348.2016.08.025
作者简介:史晓萍(1976-),学士,主管护师,主要从事血液保护方面的研究。
[中图分类号]R446
[文献标识码]B
[文章编号]1671-8348(2016)08-1079-03
(收稿日期:2015-09-22修回日期:2015-11-05)

