限食水平和时间对黄鳝血细胞数的影响
阮国良+柯玉清+杨代勤
摘要:研究了不同水平和时间的限食对黄鳝(Monopterus albus)血细胞数量的影响,结果显示:(1)不同程度的限食未使黄鳝血液的红细胞数发生显著性减少(P>0.05),但使其白细胞数均呈显著增加趋势(P<0.05),且随着限食时间的延长其白细胞数增加更为明显;(2)随着限食时间的延长,黄鳝的淋巴细胞和血栓细胞比例显著上升(P<0.05),而单核细胞和中性粒细胞等吞噬细胞的比例显著下降(P<0.05)。因此,限食可迫使黄鳝产生防御性生理反应且可能使其非特异性免疫能力下降,从而提示在黄鳝的间歇性限食获得补偿生长的投喂模式中应避免长时间的持续限食。
关键词:黄鳝(Monopterus albus);限食水平;限食时间;血细胞
中图分类号: S966.4
文献标志码: A
文章编号:1002-1302(2016)04-0285-02
黄鳝(Monoperus albus)是我国重要的经济养殖鱼类[1],其网箱养殖在长江中游地区发展迅速并正朝着产业方向发展[2]。为节约饲料与劳力成本、提高养殖效益,我们的研究初步表明,黄鳝在合理的限食投喂模式中可获得良好的生长补偿效应[3],但在限食投喂过程中,黄鳝的健康状况与免疫功能有待加以评价。血细胞是鱼类重要的免疫细胞,其相关指标的变化与鱼体的营养、代谢状况及免疫功能等的动态变化密切相关[4-5]。李富乐等对洞庭湖区黄鳝的血细胞进行了分类与计数研究[6],但有关限食与黄鳝血细胞变化的相关性研究则尚未见报道。为此,本试验初步研究了不同水平和时间限食后黄鳝血细胞的变化,旨在评价限食程度对黄鳝免疫力的影响,从而为生产实践中制定可行的限食投喂方案提供依据。
1 材料与方法
1.1 试验鱼、饵料及饲养条件
试验用幼鳝(19.5±2.0)g来自长江大学黄鳝研究所。试验鱼经体质量筛选后转入实验室的塑料水族箱(70 cm×55 cm×36 cm)内进行饲养。在正式试验前进行7 d饱食投喂的适应性暂养。暂养和试验期间的饵料为鲜活的水蚯蚓。试验期间,养殖箱内的溶氧量>5.2 mg/L,氨氮量<0.09 mg/L,pH值 6.5~7.2,通过双制式空调将室温控制在(25.0±1.0) ℃。
1.2 限食试验设计
试验设对照组和限食处理组,每组随机放黄鳝20尾,每组3个重复,试验时间为64 d。对照组为饱食投喂组(S0F60),即连续每天饱食喂食1次,每天傍晚时分进行足量投喂并观察黄鳝的摄食情况,从投喂开始至 2 h后如水族箱中水蚯蚓略有剩余则视为饱食投喂。限食水平试验的处理组如下:禁食1 d饱食喂食2 d组(S1F2),共20个周期;禁食1 d饱食喂食3 d组(S1F3),共15个周期;禁食1 d饱食喂食4 d组(S1F4),共12个周期。限食持续时间试验的处理组如下:禁食1 d饱食喂食2 d组(S1F2),共20个周期;禁食2 d饱食喂食4 d组(S2F4),共10个周期;禁食4 d饱食喂食8 d组(S4F8),共5个周期。试验期间,每天17:00—18:00时进行饱食投喂1次,次日约09:00虹吸清理残饵。
1.3 血细胞的采集、计数与数据处理
限食投喂试验结束后,对各个重复的水簇箱分别随机取5尾黄鳝,采集血液样本进行各类血细胞计数。血液采集、血细胞的计数方法参照文献[7-8]。试验结果用x±s表示,采用Statistica 6.0软件进行单因素方差分析(ANOVA),当处理之间差异显著(P<0.05)时,用Duncans检验进行多重比较。
2 结果
2.1 限食水平对黄鳝血细胞数量的影响
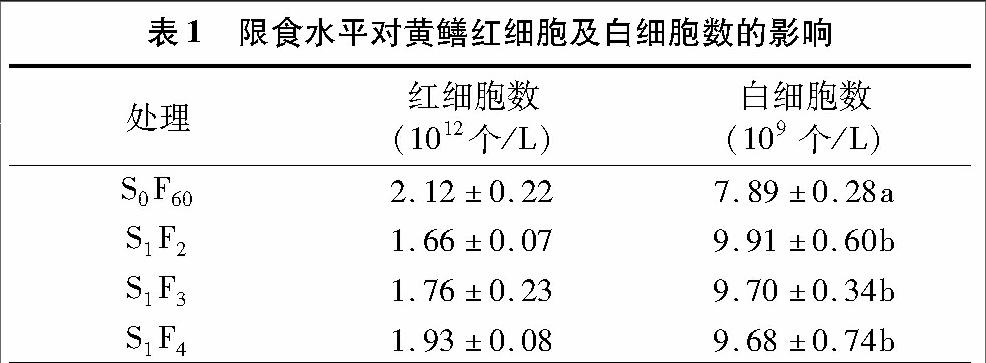
由表1可以看出,经过60 d的重复性“饥饿—投喂”养殖后,限食试验组黄鳝较正常投喂黄鳝的红细胞数少,并且随着限食水平的提高呈下降趋势,但下降不明显(P>0.05);各试验组白细胞数量均显著高于对照组S0F60(P<0.05),随着限食水平的提高白细胞数量在各处理组之间无显著差异。
2.2 限食水平对黄鳝白细胞分类计数的影响
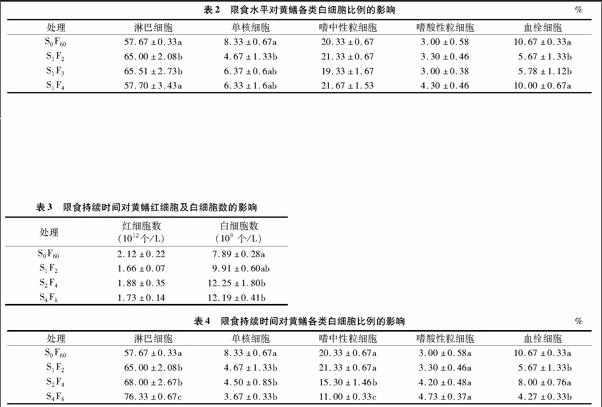
由表2可以看出,经过60 d的重复性“饥饿—投喂”饲养后,各试验组的黄鳝淋巴细胞比例均呈上升趋势,试验组S1F2和S1F3显著高于对照组S0F60(P<0.05),试验组S1F4与其他组比较均不显著(P>0.05);各试验组单核细胞比例均呈下降趋势,试验组S1F2比例显著低于对照组S0F60(P<0.05),但与其他组之间无显著差异(P>0.05);试验组S1F2和S1F3的血栓细胞比例显著低于对照组S0F60和试验组S1F4(P<0.05);试验组嗜中性粒细胞和嗜酸性粒细胞比例变化均不显著(P>0.05)。
2.3 限食持续时间对黄鳝血细胞数的影响
由表3可以看出,经过60 d的重复性“饥饿—投喂”饲养后,各试验组黄鳝红细胞数量均低于对照组S0F60,但无显著差异(P>0.05);各试验组白细胞数量均高于对照组S0F60,且试验组S2F4和S4F8显著高于对照组S0F60(P<0.05)。但各试验组之间不存在显著差异(P>0.05)。
2.4 限食持续时间对黄鳝白细胞分类计数的影响
由表4可以看出,经过60 d的重复性“饥饿—投喂”饲养后,试验组的淋巴细胞比例均显著高于对照组S0F60(P<005),且试验组S4F8显著高于试验组S1F2和S2F4(P<0.05);试验组单核细胞比例均显著低于对照组S0F60(P<0.05),且随着限食持续时间的延长,呈逐渐下降趋势;试验组嗜中性粒细胞均显著低于对照组S0F60(P<0.05),随着限食持续时间的延长,嗜中性粒细胞比例下降越来越明显,试验组S4F8显著低于试验组S1F2和S2F4(P<0.05);试验组嗜酸性粒细胞比例均有所上升,但变化不显著(P>0.05);各试验组血栓细胞均低于对照组S0F60,试验组S1F2和S4F8显著低于其他组(P<0.05)。
3 讨论
3.1 限食对黄鳝红细胞数和白细胞数的影响
血液作为鱼类重要的组织器官之一,主要具有运输、交换和防御三大生理功能。血液成分的相对恒定是鱼类生命活动正常进行的基本条件。鱼类血液生理指标变化与机体的新陈代谢、生理状况显著相关,因而被广泛地用来评价鱼体的健康状况及其对环境的适应。目前,对一些鱼类的研究表明,红细胞的数量随着饥饿时间的延长而下降[9-13]。陈晓耘等对饥饿南方幼鱼血液的研究表明,饥饿使南方幼鱼血液生理指标变化显著,红细胞数量显著减少[9];陈慧群等对鳗鲡的研究表明饥饿20 d后,鳗鲡红细胞数较正常鱼下降了39%[12]。本研究中,限食使黄鳝红细胞数下降,这与以上文献的许多研究结果基本一致,但这种下降与对照组相比差异不显著(P>0.05)。氧气运输是红细胞的重要生理功能之一,故限食程度可能不影响黄鳝红细胞携带和运输氧气的功能。本研究发现,不同水平的限食均引起黄鳝白细胞数有所增加,且随着限食持续时间的增加其白细胞数显著上升,这与持续饥饿可使某些鱼类的白细胞数显著上升[14-16]的结果基本一致。摄食不足或饥饿引起白细胞数上升很可能是鱼类为适应生存条件变化所发生的一种防御性生理反应。
3.2 限食对黄鳝各类白细胞比例的影响
白细胞与机体的免疫功能有关,通过对鱼类白细胞数量和各类白细胞比例的测定可以从某个侧面反映其生理状况的变化,同时白细胞数目的变化显示了机体的免疫系统受到影响。
李霞等发现,当饥饿时间少于20 d 时,红鳍东方鲀外周血中白细胞的数量明显增加,但随着饥饿时间的延长,白细胞的数量呈下降趋势;脾脏中淋巴细胞的转化率明显升高,淋巴细胞的增殖能力也增加,巨噬细胞的吞噬活性增加,吞噬力增强,但长时间饥饿后鱼体淋巴增殖能力和吞噬力会降低[17]。本研究中随着限食水平提高和限食持续时间的延长,黄鳝白细胞数及各类白细胞比例发生了不同程度的变化。限食水平试验组S1F2和S1F3淋巴细胞比例、血栓细胞比例显著上升,试验组S1F2单核细胞比例显著下降;限食持续时间试验组淋巴细胞比例均显著高于对照组,单核细胞、中性粒细胞比例均显著低于对照组S0F60。本研究表明,随着限食程度的加深,黄鳝的淋巴细胞和血栓细胞比例显著上升,而单核细胞和中性粒细胞等吞噬细胞的比例显著下降。因此,限食作为一种营养胁迫促使黄鳝非特异性免疫能力发生不同程度的下降,从而提示在黄鳝的间歇性限食获得补偿生长的投喂模式中应避免持续长时间的限食。
参考文献:
[1]Li W T,Liao X L,Yu X M,et al. Isolation and characterization of polymorphic microsatellites in a sex-reversal fish,rice field eel (Monopterus albus)[J]. Molecular Ecology Notes,2007,7(4):705-707.
[2]Chu Z J,Wu Y X,Gong S Y,et al. Effects of estradiol valerate on steroid hormones and sex reversal of female rice field eel,Monopterus albus (Zuiew)[J]. Journal of the World Aquaculture Society,2011,42(1):96-104.
[3]阮国良,刘家芳,杨代勤. 间歇性禁食对黄鳝生长、消化酶活性及血液生化指标的影响[J]. 水产学报,2013,37(7):1058-1065.
[4]周永灿,邢玉娜,冯全英. 鱼类血细胞研究进展[J]. 海南大学学报:自然科学版,2003,21(2):171-176.
[5]高泽霞,王卫民. 鱼类外周血红细胞研究进展[J]. 水利渔业,2008,28(2):1-3.
[6]李富乐,贺建香,陈 晨,等. 洞庭湖区黄鳝血细胞的分类与计数[J]. 内陆水产,2008(1):39-40.
[7]陈其才,严定友,吴政星. 生理学实验[M]. 北京:科学出版社,1995.
[8]铁槐茂,石 丹,银 龙,等. 瓦氏黄颡鱼血液生理指标与外周血细胞组成及显微结构[J]. 四川农业大学学报,2015,33(1):78-83.
[9]陈晓耘. 饥饿对南方鲇幼鱼血液的影响[J]. 西南农业大学学报,2000,22(2):167-169,176.
[10]张桂蓉,严安生,高玉芹,等. 饥饿对异育银鲫几项血液指标的影响[J]. 水利渔业,2003,23(1):9-10.
[11]胡一中,程宏毅,王鸿艳. 饥饿对月鳢几项血液指标的影响[J]. 生物学杂志,2009(1):81-83.
[12]陈惠群,杨文鸽. 饥饿对鳗鲡某些血液指标的影响[J]. 水产养殖,2002,20(5):32-33.
[13]钱云霞,陈惠群,孙江飞. 饥饿对养殖鲈鱼血液生理生化指标的影响[J]. 中国水产科学,2002,9(2):133-137.
[14]封功能,杨文平,王爱民,等. 饥饿胁迫对鲤形体、体成分及血液生理指标的影响[J]. 上海海洋大学学报,2011,20(6):814-819.
[15]周爱国,王 超,梁日深,等. 饥饿胁迫对杂交鳢血液指标的影响[J]. 水产养殖,2012,33(7):23-26.
[16]郑桂红,陈思如. 饥饿对乌鳢血液生理生化指标的影响[J]. 江苏农业科学,2012,40(2):186-188.
[17]李 霞,周宝祥,王茂林. 饥饿对红鳍东方鲀免疫细胞功能的影响[J]. 大连水产学院学报,2006,21(4):297-300.凌善锋,蔡福欢,刘彦文,等. 3.5 mg/L水杨酸诱导斜生栅藻积累虾青素的分子机理[J]. 江苏农业科学,2016,44(4):287-290.

