野生大豆根瘤GmGS1γ基因序列分析及原核表达
杨美英 岳胜天 韩红 孙合美 刘晶晶 卢冬雪
(吉林农业大学生命科学院,长春 130118)
YANG Mei-ying YUE Sheng-tian HAN Hong SUN He-mei LIU Jing-jing LU Dong-xue
(College of Life Sciences,Jilin Agricultural University,Changchun 130118)
野生大豆根瘤GmGS1γ基因序列分析及原核表达
杨美英 岳胜天 韩红 孙合美 刘晶晶 卢冬雪
(吉林农业大学生命科学院,长春 130118)
旨在明确大豆谷氨酰胺合成酶(Glutamine synthetase,GS)基因家族各成员的结构特点及功能。利用同源克隆的方法从野生大豆根瘤克隆GmGS1γ基因。生物信息学分析表明,ORF为1 071 bp,与大豆GS1γ(AF363022.1)部分序列的相似性为100%,与序列号为X81700.1相似性为99%。该序列具备植物GS的两个保守结构域,GS beta-Grasp功能区(17-97 aa)和GS催化功能区(103-350 aa)。系统发生树表明该基因编码的GS可能属于胞质2型同工酶。该基因可以在大肠杆菌DE3.0中表达,蛋白分子量为44 kD。
野生大豆;谷氨酰胺合成酶(GS);原核表达;序列分析
植物根系从土壤中吸收的NO3-,通过茎、叶柄运往叶片,在叶片中硝酸还原酶等的作用下转化为氨态氮,再在谷氨酰胺合成酶(Glutamine synthetase,GS)的作用下转化为谷氨酰胺(Gln),进入氮代谢。除此以外,根瘤中向上运输的酰脲在叶片中也代谢形成NH4+,经过GS 转化后进入氮代谢[1]。因此,GS在植物氮代谢中起着关键的作用,是植株氮素转化的关键酶[2]。
GS以多种形式存在于植物中,高等植物的种子、叶、根、根瘤和果实等器官中分布着多种GS的同工酶,GS的不同功能由不同的GS同工酶承担[3]。在叶片中,GS2的功能是通过硝酸盐还原和光呼吸过程来同化氨[4];根中GS1直接从土壤中吸收氨或者NO3-[5];胚中,吸收分解发芽期储存的含氮物释放的氨[6];根瘤中GS主要是快速的吸收氮,固定细菌侵染的细胞排泄到植物中的氨[7]。GS 的分子生物学研究始于1983 年,从蓝细菌克隆到GS 并完全测序分析。许多植物,如大麦[8]、水稻[9]、豌豆[10]等的GS cDNA已被克隆。
大豆作为一种重要的粮-油兼用作物,籽粒蛋白质含量明显高于玉米、水稻等作物[11],而且可以形成豆科植物-根瘤菌共生固氮体系。高蛋白野生大豆ZYD01251蛋白质含量可以达到53%以上,具有较强的氮素利用与贮藏机制。而且作者在前期的研究中发现高蛋白野生大豆根瘤衰老较慢,根瘤内氮代谢物含量丰富,生育后期仍具有较强的酰脲合成与运输能力是形成该类型大豆籽粒高蛋白质含量的原因之一[12]。 为了进一步明确根瘤的生长发育及其基因表达对野生大豆蛋白质含量的影响,本研究从野生大豆根瘤中克隆GmGS1γ基因序列,对该序列利用生物信息学方法进行预测并构建pET-28a-GmGS1γ原核表达载体,在大肠杆菌中表达目的蛋白,旨在进一步认识野生大豆GS基因家族各成员的结构特点及其在氮素代谢过程中的功能,明确不同GS同工酶在植物氨同化过程中的贡献以及为研究植物氮代谢机制奠定基础。
1 材料与方法
1.1 材料
1.1.1 菌株、质粒与试剂 大肠杆菌菌株DH5α、BL21(DE3)及载体pET28a(+)均为本实验室保存。Easy ScriptTMFirst-strand cDNA Synthesis Super Mix反转录试剂盒购自北京全式金生物技术有限公司;限制性内切酶、Ex Taq酶、T4 DNA连接酶、DNA分子量标准、蛋白质分子量标准和pMD18-T载体试剂盒以及琼脂糖凝胶DNA回收试剂盒均购于TaKaRa公司。其它试剂均为国产分析纯。
1.1.2 植物材料 本实验所用大豆材料为高蛋白野生大豆ZYD01251(原产于吉林省东辽县,生育期125 d,蛋白含量53.0%)。
1.2 方法
1.2.1 根瘤样品的采集及RNA的提取 将吉林农业大学大豆试验田土壤装入直径为20 cm的塑料盆,种植野生大豆ZYD01251,每盆3株。收集45 d苗龄的大豆根瘤,用蒸馏水将根瘤冲洗干净,快速用液氮处理后,-80℃冰箱保存。Trizol法提取大豆根瘤总RNA,752N紫外分光光度计测定OD260和OD280,选择OD260/OD280介于1.7-2.0 的样品,采用反转录试剂盒合成cDNA。1.2.2 GmGS1γ基因的PCR扩增 以野生大豆根瘤cDNA为模板,PCR扩增GmGS1γ基因。所用引物根据GenBank发表的大豆GmGS1γ序列(X81700.1)进行设计。GmGS1γF:5'-AAGAGTCTCCGCTGAAC -3';GmGS1γR:5'-AACAGGCGAGGTAGTCA-3'。引物合成与扩增产物的序列测定均由上海生工生物工程有限公司完成。
将野生大豆GmGS1γ基因测序结果进行分析。采用GenBank DNA 数据库进行BLAST同源性比较。采用NCBI在线软件对GmGS1γ蛋白的结构域进行预测(http://www.ncbi.nlm.nih.gov/Structure/cdd/wrpsb. cgi)。搜索NCBI蛋白库里所有大豆GS的全序列,利用DNAMAN软件构建系统发生树。
1.2.3 原核表达载体pET-28a-GmGS1γ的构建与鉴定 以测序为阳性的重组质粒pMD18-T-GmGS1γ为模板,两端具有Xho I/Sal I酶切位点的引物GmGS1-γF:5'-CGAGCTCATGTCGTTACTCTCCGATCTTA-3'和GmGS1γR:5'-CCGCTCGAGCGTTGCTTATGGTTTCC AAAG-3'(下划线部分为酶切位点)进行PCR,获得两端分别带有Xho I和Sac I酶切位点的目的片段。将目的片段和pET28a(+)分别用Xho I和Sac I双酶切,凝胶回收并连接。连接产物42℃热激转化大肠杆菌BL21(DE3)感受态细胞。PCR及Xho I/Sac I双酶切验证为阳性的克隆送上海生工测序。
1.2.4 重组质粒pET-28a-GmGS1γ在大肠杆菌BL21(DE3)体内的诱导表达 将鉴定为阳性的BL21(pET-28a-GmGS1γ)挑取单菌落到LB液体培养基中(含Kan),37℃,160 r/min,过夜培养。以1%的接种量将过夜培养的菌液转接到含有Kan抗性的 LB液体培养基中,37℃,160 r/min培养至OD600=0.6。加入IPTG使其终浓度为1.0 mmol/L,诱导2 h和4 h,各取1 mL菌液,10 000×g,离心10 min收集菌体。将收集到的菌体加入100 μL样品溶解液充分混匀。100℃处理10 min,裂解菌体细胞。12 000 r/min离心10 min,收集上清,上样20 μL,采用12%的分离胶和5%的浓缩胶进行SDS-PAGE电泳检测蛋白表达。
2 结果
2.1 根瘤总RNA的提取及GmGS1γ基因的克隆
为了克隆目的基因,从野生大豆的大豆根瘤中提取总RNA。总RNA提取及GmGS1γ基因扩增结果(图1)显示,RNA提取效果理想,可以看到清晰的3条带。提取的RNA可以进行下一步的RT-PCR实验。以反转录后得到的cDNA为模板进行PCR扩增,在约1 000 bp处有一条清晰的特异性片段,大小与预测值相符。用DNA凝胶回收试剂盒将扩增出的片段进行回收,并将回收片段克隆到pMD18-T载体上,转化E.coli JM109感受态细胞。

图1 大豆根瘤总RNA提取及GmGS1γ基因克隆
2.2 GmGS1γ基因的序列分析
对构建成功的pMD18-T-GmGS1γ重组质粒中的目的片段进行测序。结果表明,序列全长1 215 bp。将该序列利用GenBank中BLAST进行分析,发现与大豆GS1γ(AF363022.1)部分序列的相似性为100%,与引物设计时选择的GS参考序列(X81700.1)相似性为99%。利用NCBI的在线结构预测软件对序列的结构域进行预测,结果(图2)表明,这一序列包含一个1 071 bp编码356 aa的ORF,为GS的编码区,这个蛋白包含了一个GS beta-Grasp功能区(17-97 aa)和GS催化功能区(103-350 aa)。这些功能区在植物的GS中是保守的两个结构域,从而证实GmGS1γ基因克隆成功。2.3 大豆各类GS蛋白全序列系统发生树
从NCBI蛋白库里共搜索到21条包括GS同工酶和GS受体蛋白的全序列,与GmGS1γ基因所编码的蛋白序列,利用DNAMAN软件进行系统发生树的构建。结果(图3)显示,不同类的GS形成不同的簇。以胞质GS同工酶1型为主形成的第①簇,以GS前体为主形成的第②簇,而GmGS1γ基因序列所编码的GS分在了第③簇中,并且与序列号为CAA57346(核酸序列为X81700)的谷氨酸氨连接酶及序列号为AAC97935的根瘤特异性GS相邻,与序列号为XP_003519325的胞质GS 2型同工酶分成一个小的分支。

图2 GmGS1γ基因编码序列结构域及三维结构预测
2.4 原核表达载体pET-28a-GmGS1γ的构建
以重组质粒pMD18-T-GmGS1γ为模板,目的片段GmGS1γ基因ORF的扩增结果(图4-A)显示,大小约为1 000 bp。将该片段回收,限制性内切酶消化后,与pET-28a(+)进行连接获得重组质粒pET-28-GmGS1γ,酶切结果如图4-B所示。酶切获得的片段与PCR扩增片段大小一致,说明重组质粒构建成功,可以进行下一步实验。

图3 大豆GS系统发生树
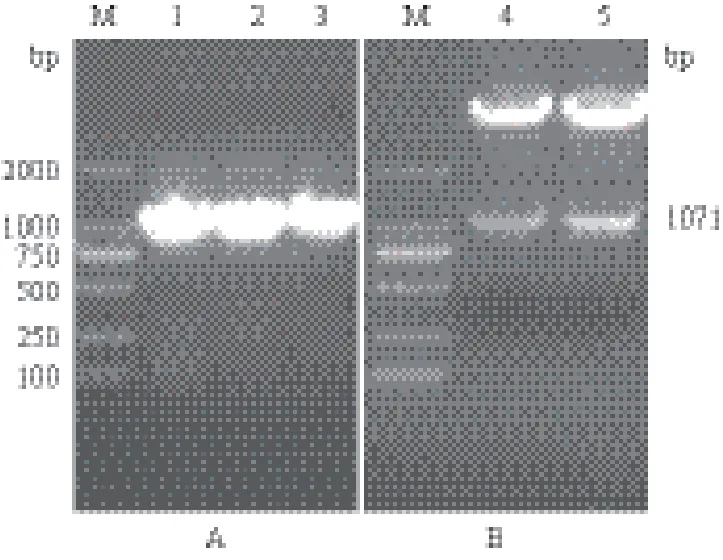
图4 GmGS1γ基因ORF的PCR(A)与酶切(B)结果
2.5 GmGS1γ基因在大肠杆菌中的诱导表达
将重组质粒pET-28-GmGS1γ转化到表达菌BL21中,同时以原核表达质粒pET-28a(+)转入表达菌BL21中作为对照。利用12%的SDS-PAGE对经1.0 mmol/L IPTG 诱导2 h和4 h的菌液进行分析。结果(图5)显示,两个时间段的菌液均在约44.0 kD处明显出现诱导表达的条带,与预期结果一致,说明该基因在菌株BL21中成功表达,而且4 h时的表达量明显高于2 h时的表达水平。

图5GmGS1γ蛋白的表达
3 讨论
根瘤中的根瘤菌(类菌体)利用宿主植物体提供的能量和内环境,将空气中的N2还原为氨,供宿主植物利用,形成了自然界效率最高的共生固氮作用[13]。1988年米山忠克[14]研究认为,根瘤固氮首先在类菌体中将N2还原为NH4+,然后在GS的作用下合成Gln,再在一系列酶的作用下形成酰脲向地上部运输。GS是高等植物氮素代谢的关键酶[15]。大豆GS1基因家族存在α、β、γ 3个组分[16,17],其中子叶和幼根中以α为主;虽然β是组成型表达,但其却在固氮根瘤中表达水平较高;γ1表现为根瘤特异表达[5],而γ2则在根瘤、子叶和花中被检测到[18]。王晓波等[19]研究发现,大豆根瘤中存在4个豆科植物特有的GS1基因。本研究从高蛋白野生大豆ZYD01251根瘤中成功克隆了GmGS1γ基因,BLAST结果显示该基因序列与大豆GS1γ(AF363022.1)的相似性为100%。而且该序列编码的氨基酸序列具有植物GS中保守的两个结构域,GS beta-Grasp功能区和GS催化功能区,说明本实验获得的序列具有编码大豆根瘤中GS的特征。而且从大豆GS系统发生树分析,该基因编码的氨基酸序列可能属于胞质GS 2型同工酶。
高等植物中GS全酶均为八聚体,每个亚基分子量为38-45 kD[2]。本实验中DE3.0(pET-28-GmGS1γ)表达的目的蛋白约为44 kD,该蛋白的大小符合GS亚基分子量的范围。
4 结论
从野生大豆根瘤中克隆到ORF为1 071 bp的GmGS1γ序列,生物信息学分析表明,该序列具备植物GS的两个保守结构域,GS beta-Grasp功能区(17-97 aa)和GS催化功能区(103-350 aa)。系统发生树表明该基因编码的GS可能属于胞质2型同工酶。该基因可以在大肠杆菌DE3.0中表达,蛋白分子量为44 kD。
[1]李姚, 马春梅, 龚振平. 春大豆谷氨酰胺合酶(GS)活性动态的研究[J]. 东北农业大学学报, 2006, 6:729-732.
[2]冯万军, 窦晨, 牛旭龙, 等. 玉米谷氨酰胺合成酶基因家族的生物信息学分析[J]. 玉米科学, 2015, 23(1):51-57.
[3]韩娜, 葛荣朝, 赵宝存, 等. 植物谷氨酰胺合成酶研究进展[J].河北师范大学学报:自然科学版, 2004, 28(4):407-423.
[4]Hanne CT, Dennis E, Inge SM, et al. Cytosolic glutamine synthetase:a target for improvement of crop nitrogen use efficiency[J]. Trends in Plant Science, 2014, 19(10):656-663.
[5]Lea PJ, Ireland RJ. Nitrogen metabolism in higher plants[J]. Annual Review of Plant Physiology, 1999:1-47.
[6]Swarup R, Bennett MJ, Cullimore JV. Expression of glutaminesynthetase genes in cotyledons of germinating Phaseolus vulgaris L.[J]. Planta, 1990, 183(1):51-56.
[7]Mariangela H, Glaciela K. Regulation of N fixation and NO-23/NH4+assimilation in nodulated and N-fertilized Phaseolus vulgaris L. exposed to high temperature stress[J]. Environmental and Experimental Botany, 2014, 98:32-39.
[8]Freeman J, Marquez A, Wallsgrove RM, et al. Moleular analysis of barley mutants deficient chloroplast glutamine synthetase[J]. Plant Mol Biol, 1990, 14(3):297-311.
[9]Li MG, Villemur R, Hussey PJ, et al. Differential expression of six glutamine synthetase genes in Zea mays[J]. Plant Molecular Biology, 1993, 23(2):401-407.
[10]Tingey SV, Tsai FY, Edwards JW, et al. Chloroplast and cytosolic glutamine synthetase are encoded by homologous nuclear genes which are differentially expressed in vivo[J]. J Biol Chem, 1988, 263(20):9651-9657.
[11]李喜焕, 常文锁, 张彩英. 中国大豆磷素营养及磷高效品种筛选最新进展[J]. 大豆科学, 2011, 30(2):322-327.
[12]杨美英, 王乾钦, 赵洪锟, 等. 不同蛋白质含量大豆结瘤特性与根瘤氮代谢物含量的比较分析[J]. 中国油料作物学报, 2011, 33(5):492-498.
[13]王彦章, 俞冠翘, 沈善炯, 等. 大豆早期结瘤素基因enod2B启动子在水稻中的表达受结瘤因子诱导[J]. 科学通报, 2004, 3:238-244.
[14]董钻. 大豆产量生理[M]. 北京:中国农业出版社, 2000:97-105.
[15]于瑶, 张汉尧, 杜建伟. 高等植物谷氨酰胺合成酶基因的研究进展[J]. 中国农学通报, 2012, 44(4):15-19.
[16]Kevin JM, Jose LO, Champa SG. Cytosolic glutamine synthetase in soybean is encoded by a multigene family, and the members are regulated in an organ-specific and developmental manner[J]. Plant Physiology, 2002, 128:182-193.
[17]Peterman TM, Goodman HM. The glutamine synthetase gene family of Arabidopsis thaliana:light-regulation and differential expression in leaves, roots and seeds[J]. Mol Gen Genet, 1991, 330:145-154.
[18]Ortega JL, Moguel ES, Potenza C, et al. The 3' untranslated region of a soybean cytosolic glutamine synthetase(GS1)affects transcript stability and protein accumulation in transgenic alfalfa[J]. The Plant Journal, 2006, 45(5):832-846.
[19]王晓波, 滕婉, 何雪, 童依平. 大豆谷氨酰胺合成酶基因的分类及根瘤特异表达GmGS1β2基因功能的初步分析[J]. 作物学报, 2013, 39(12):2145-2153.
(责任编辑 马鑫)
Sequence Analysis and Prokaryotic Expression of GmGS1γ Gene from Nodules of Glycine soja
In order to clarify the structures and functions of the members of the glutamine synthetase(GS)gene family,the GmGS1 gene was cloned from Glycine soja by homologous cloning. The bioinformatics analysis showed that,the ORF was 1 071 bp,and the similarity was 100% and 99% with the partial sequence of soybean GS1γ(AF363022.1)and X81700.1,respectively. The sequence had two conserved domains of plant GS,beta-Grasp GS functional area(17-97 aa),and GS catalytic functional area(103-350 aa). Phylogenetic tree showed that GS encoded by the gene GmGS1 probably belonged to glutamine synthetase cytosolic isozyme 2. The gene was expressed in Escherichia coli DE3.0,and the molecular weight of the protein was 44 kD.
Glycine soja;glutamine synthetase(GS);prokaryotic expression;sequence analysis
10.13560/j.cnki.biotech.bull.1985.2016.04.015
YANG Mei-ying YUE Sheng-tian HAN Hong SUN He-mei LIU Jing-jing LU Dong-xue
(College of Life Sciences,Jilin Agricultural University,Changchun 130118)
2015-07-07
国家自然科学基金项目(31201687)
杨美英,女,博士,副教授,研究方向:微生物的生化与分子生物学;E-mail:jlaumeiying@163.com

