花生温度诱导载脂蛋白基因AhTIL1的克隆和表达研究
钟瑞春李婷婷唐荣华王兴军李翠侯蕾赵传志
(1.广西农业科学院经济作物研究所,南宁 530007;2.山东省农业科学院生物技术研究中心 山东省作物遗传育种与生态生理重点实验室,济南 250100;3.山东大学生命科学学院,济南 250100)
花生温度诱导载脂蛋白基因AhTIL1的克隆和表达研究
钟瑞春1李婷婷2,3唐荣华1王兴军2,3李翠2侯蕾2赵传志2,3
(1.广西农业科学院经济作物研究所,南宁 530007;2.山东省农业科学院生物技术研究中心 山东省作物遗传育种与生态生理重点实验室,济南 250100;3.山东大学生命科学学院,济南 250100)
温度诱导的载脂蛋白(temperature induced lipocalins,TILs)与植物在热、冷、光、氧化等胁迫下的稳定性相关,旨在克隆花生中的温度诱导的载脂蛋白基因,分析其在响应低温、高温中的作用。从花生cDNA文库中筛选到一个TIL候选基因,命名为AhTIL1,通过PCR扩增获得了其基因组和候选启动子的序列,并利用实时定量PCR等方法检测了该基因在花生不同组织、种子不同发育时期和温度胁迫下的相对表达量。序列分析结果表明,该基因的开放阅读框(open reading frame,ORF)为 558 bp,编码185个氨基酸。生物信息学分析显示,推测的AhTIL1蛋白质相对分子质量为21.4 kD,等电点为6.78。序列比对结果显示,该蛋白氨基酸序列同其他物种TIL蛋白显示出很高的同源性。对候选启动子预测结果表明,该基因的候选启动子包含ACE、Box4、G-box、GAG-motif等与光反应相关的调控元件以及与ABA、水杨酸、赤霉素、厌氧等相关的顺式调控元件。基因芯片和RNASeq结果表明,该基因在花生的根、茎、叶、花、果针、种子中均有表达,在花中表达量最高,茎中次之,在根中表达量最低;AhTIL1在果针入土后表达量下降,随着荚果的膨大和种子的成熟,AhTIL1的表达量逐渐增加。实时定量PCR结果证明,AhTIL1在高温和低温诱导3、6、12和24 h后上调表达,在48 h后表达量下降。AhTIL1可能在花生响应低温、冷胁迫中发挥着重要的作用。
花生;温度诱导载脂蛋白;基因克隆;表达分析
花生(Arachis hypogaea L.)是我国重要的油料作物和经济作物,发展花生生产对于保障我国粮油安全具有重要意义。花生种植和生产过程中经常受到不利环境因素的影响,例如盐胁迫、高温胁迫等都严重影响花生的产量和品质[1-3],干旱胁迫不仅影响花生的产量,而且也容易造成黄曲霉毒素的污染[1]。越来越多的研究表明,温度诱导的载脂蛋白(TIL)对于植物响应温度胁迫具有重要的作用。
载脂蛋白广泛存在于动物、植物和微生物中,是一类具有多种功能的胞外分泌小分子蛋白质[4,5],最显著的特点是具有3个保守的SCR(Structurally conserved region)结构域以及由8条反向平行的折叠片层形成的β桶状结构[6]。在植物中,载脂蛋白可以分为温度诱导的载脂蛋白(Temperature induced lipocalins,TILs)和叶绿体载脂蛋白(Chloroplastic lipocalin,CHL)。植物TIL和CHL在序列上和哺乳动物的载脂蛋白(Apolipoprotein D)、细菌的载脂蛋白(Lipocalin Blc)和昆虫的Lazarillo protein蛋白同源[7]。植物在生长过程中会经常面对低温、高温、干旱、盐碱等各种不利的环境因素,在受到胁迫后,植物体内一些基因的表达会被诱导,间接或者直接地参与植物的抗逆反应。在拟南芥中,温度诱导的载脂蛋白(TIL)被认为是增加耐热性的必要因子[8]。Kawamura等[9]发现在低温诱导下拟南芥TIL蛋白的积累显著增加[9],随后的研究进一步表明在拟南芥和水稻中TIL基因在低温和高温下均上调表达[10]。反向遗传学证据表明,当TIL被敲除后,突变体对除草剂、温度和光照更加敏感,在温度骤然减低、除草剂处理,或将植物由黑暗环境转移到光照环境下存活率大大降低。相反,过量表达TIL能够增强拟南芥在冷冻、除草剂和光照胁迫下的适应性[11]。最近的研究证实,TIL蛋白可以通过调节离子的平衡保护叶绿体的稳定,被认为是增加植物耐盐性的重要因子[12]。叶绿体载脂蛋白基因(CHL)的表达也响应干旱、光照、除草剂、ABA等胁迫,但对盐胁迫和温度胁迫并不敏感[13]。TIL和CHL在响应逆境胁迫的分工不同,但两者在保护脂质和延长种子寿命上都发挥着重要的功能[14]。
载脂蛋白最基本的生物学功能是结合并转运脂肪酸、类固醇、信息素、类维生素A等输水的配体。越来越多的证据表明,载脂蛋白与植物的环境适应性密切相关。花生在种植和储存过程中,也会面对高温、低温、干旱等自然灾害,但对花生中的温度诱导的载脂蛋白却鲜有研究。本研究以花生栽培品种鲁花14号为材料,通过构建cDNA文库和高通量测序,克隆花生AhTIL1 cDNA的全长序列;进一步获得AhTIL1的基因组序列及其候选启动子序列,通过生物信息学手段对其候选启动子序列、蛋白结构等进行分析;通过实时定量PCR等手段对其在不同组织及在冷、热处理下的表达量进行分析,旨为花生TIL基因的功能鉴定和利用研究奠定基础。
1 材料与方法
1.1 材料
栽培花生品种鲁花14号、大肠杆菌DH5α由本实验室保存。高保真Taq酶购自北京全式金生物公司,RNA提取试剂、反转录试剂盒、普通Taq酶、pMD18-T Vector购自大连TaKaRa公司;引物由Invitrogen(上海)贸易有限公司合成;质粒提取和琼脂糖凝胶回收试剂盒购自Sangon(上海)工程技术有限公司;DNA Marker购自北京天为时代生物有限公司。
1.2 方法
1.2.1 构建花生cDNA文库并进行EST测序 收集花生中果针入土10-60 d的未成熟花生种子,依据RNAgent试剂盒(Promega)的方法提取总RNA和分离纯化mRNA,按pBluescript II cDNA(Stratagene,USA)的试剂盒构建花生种子的cDNA文库。花生EST的序列测定采用T3和T7通用引物,EST的常规测序由山东省农业科学院测序中心完成;EST序列的功能注释通过与已知蛋白进行BlastX比对完成。
1.2.2 AhTIL1基因的克隆 依据花生EST功能注释结果,挑取与其它植物的TIL同源的EST序列进行重新测序,结合与其它物种TIL基因的序列比对和在线软件ORF Finder(http://www.ncbi.nlm.nih. gov/projects/gorf)的预测结果确定AhTIL1的编码区。根据AhTIL1的序列设计基因克隆引物pAhTIL1F:5'-GAACAACAACAACTACAACAAAA-3'和pAhTIL1R:5'-TTTATTTATAACATGGAATAACTCT-3'。将AhTIL1的cDNA序列信息与花生二倍体野生种Arachis duranensis和Arachis ipaensis全基因组序列数据库进行比对(http://peanutbase.org/)。根据AhTIL1和野生花生基因组比对的结果设计启动子克隆引物ppAhTIL1F:5'-TGCTAATTTTATTGATTTTG-3'和ppAhTIL1R:5'-GAACATAGAACTTGACCTTGA-3'。利用CTAB法提取花生基因组DNA,分别以基因组DNA和cDNA为模板进行PCR,条件为:94℃ 3 min;94℃ 30 s,52℃ 30 s,72℃ 1.5 min,31个循环;72℃ 7 min;4℃结束反应。PCR后,用1%琼脂糖电泳检测结果。切胶回收目的条带DNA,连接到pMD18-T的克隆载体上进行DNA序列的测定。
1.2.3 AhTIL1的生物信息学分析 用DNAstar预测花生AhTIL1基因编码蛋白质的氨基酸数、分子量、等电点。用在线软件PlantCARE(http://bioinformati cs.psb.ugent.be/webtools/plantcare/html/)分析AhTIL1的候选启动子的顺式元件。用多序列比对软件ClustalW 1.83对AhTIL1和大豆、苜蓿、拟南芥等植物的TIL蛋白进行多序列同源比对和进化树分析,输出的文件通过BOXSHADE 3.21进行着色[15]。
1.2.4 AhTIL1基因的表达分析 花生cDNA芯片的制备和种子不同发育时期的表达谱分析由上海博星公司完成。在试验地中收集花生根、茎、叶、花、果针和成熟种子,以及花生果针入土后(Date after pegging,DAP)15、25、35、45和70 d的花生种子,提取总RNA进行芯片杂交。以营养钵中生长两个星期、长势比较一致的花生植株为材料,分别用高温(42℃)和低温(8℃)处理花生0、3、6、12和24 h。分别提取不同处理下花生叶片的总RNA, 用PrimeScriptTM1st Strand cDNA Synthesis Kit合成cDNA,根据AhTIL1基因的序列设计引物:ahTILRTF:5'-TCCATTCTTGCCTATCATCCC-3',ahTILRTR:5'-CTCCTCATCTAATCGGTTCTGC-3'。用Actin基因作为内参,引物为:ahActinF:5'-GTCATCGTCATCCTCTTCTC-3',ahActinR:5'-CATTCCTGTTCCATTGTCAC-3'。采用FastStart SYBR Green试剂盒(Roche)在ABI 7500荧光定量PCR仪上进行PCR反应,程序为:预变性95℃ 10 min;95℃ 30 s,59℃ 1 min,35个循环;测定熔解曲线95℃ 15 s,60℃ 15 s,95℃ 15 s。每个反应设3次重复,根据熔解曲线来检测PCR 产物的特异性,基因表达水平的测定使用相对表达,用2-△△CT的方法计算。
2 结果
2.1 基因序列克隆及序列分析
提取花生总RNA(图1-A),反转录后构建cDNA文库,从cDNA文库中筛选并克隆到1个TIL基因(662 bp),包含一个558 bp的开放阅读框,将其命名为AhTIL1。AhTIL1编码186个氨基酸,其中59个为疏水氨基酸。推测AhTIL1蛋白质的相对分子质量为21.4 kD,等电点为6.78。提取了花生基因组DNA(图1-B),通过在花生基因组中进行扩增,获得了AhTIL1基因的基因组序列,长度为790 bp,包含1个内含子和2个外显子(图1-C,图2)。
与其他植物TIL蛋白的比对结果(图3)表明,花生AhTIL1与其它植物的TIL具有较高的同源性,与番茄的同源性高达86%,与拟南芥AtTIL1(At5g58070)的同源性为77%。花生AhTIL1蛋白的第11-27位氨基酸为SCRI区,通过比较发现该区段包含一段非常保守的序列“RYMGRWYEIA”。SCRII和SCRIII的保守性较差,但是分别在各自特异氨基酸“D”和“R”上非常的保守(图3)。系统进化树结果(图4)表明,花生AhTIL1与番茄、烟草、蓖麻等物种中TIL的亲缘关系较近,与百脉根、大豆次之。
利用PlantCARE对候选启动子的预测结果表明,AhTIL1基因的候选启动子包含ACE、Box4、G-box、GAG-motif等与光反应相关的调控元件,候选启动子区域包含与ABA、水杨酸、赤霉素、厌氧等相关的顺式调控元件(表1)。

图1 花生AhTIL1基因的克隆

图2 花生AhTIL1基因组和cDNA的序列(阴影部分为外显子)
2.2 AhTIL1基因的表达分析
花生cDNA芯片的杂交结果(图5-A)显示,AhTIL1在花生根、茎、叶、花和种子中均有表达,在花中的表达量最高,茎中次之,在根中表达量最低,即地上部分(茎、叶、花、果针)的表达量要高于地下部分(根和种子)。芯片杂交检测花生果针入土(Days after pegging,DAP)15、25、35、45和75 d AhTIL1的表达量,结果(图5-B)显示DAP15和DAP25时期mRNA表达水平最低,在种子成熟的中后期,随着成熟度的增加AhTIL1的表达也随之增加。在种子成熟后期,种子内脂肪酸等脂类物质的积累增加,载脂蛋白表达量的增加可能与转运和保护脂类物质相关。我们通过RNA-seq的方法检测了在即将入土果针(S1)、刚刚入土后3 d左右还未膨大的果针(S2)、入土9 d左右刚刚膨大的果针(S3)中AhTIL1的表达量,结果显示,在S1、S2和S3中AhTIL1的相对表达水平(RPKM)分别为2.842 77、0.588 875和2.198 386。结果表明,在花生果针刚刚入土后,由于光照、机械刺激等因素的影响,AhTIL1的表达量迅速降低,但随着花生胚胎发育的启动和种子内物质的积累,AhTIL11的表达量又有所增加。这表明,花生AhTIL1的表达容易受到光信号的调控,同时也与种子脂质的积累相关。

图3 花生AhTIL1与其它植物同源蛋白的序列比对
用高温(42℃)和低温(8℃)处理花生0、3、6、12和24 h,用实时定量PCR检测AhTIL1的相对表达量。结果(图6)表明,AhTIL1在高温和低温诱导后的表达趋势一致,即在处理3、6、12和24 h后其表达量逐渐增加,在48 h后表达量下降。在高温和低温处理24 h后,AhTIL1基因的表达水平分别比对照上调6倍和3倍。结果提示,AhTIL1可能在花生响应高温和冷胁迫过程中发挥着重要的作用。
3 讨论
随着全球变暖,农业生态环境不稳定,温度、干旱等非生物胁迫成了制约农作物种植的重要因素。从植物中挖掘耐逆相关的基因资源,利用这些基因资源提高农作物的抗性是未来分子育种需要解决的问题。温度诱导载脂蛋白最基本的生物学功能是与配体结合,在人、动物和微生物中的研究表明TIL与细胞膜的稳定性相关[16-18]。近年来,植物中的TIL也陆续被报道。研究结果证实,在受到低温或高温胁迫后,拟南芥、小麦和番茄的TIL基因均上调表达[7,9]。拟南芥TIL1-GFP融合蛋白基因转化洋葱表皮瞬时表达实验表明,拟南芥TIL蛋白定位在膜上,表明植物TIL的功能可能也与膜的稳定性相关[10]。最新的研究表明,TIL还与保护种子内的脂类物质和延长种子寿命相关[14]。这些研究表明TIL可能在植物耐逆机理研究和作物分子育种中具有重要的应用潜力。花生是异源四倍体(AABB,2n= 4x=40)植物,是由两个祖先野生种A. duranensis(A基因组供体)和A. ipaensis(B基因组供体)杂交自然加倍的结果[19]。近年来随着分子生物学和测序技术的发展,花生功能基因组学研究取得了长足的进步,从花生中已经鉴定了大量的抗逆基因[20-23]。本研究从花生中克隆了花生的载脂蛋白基因AhTIL1及其候选启动子序列,发现该基因也响应低温和高温的胁迫。

图4TIL蛋白的进化树分析
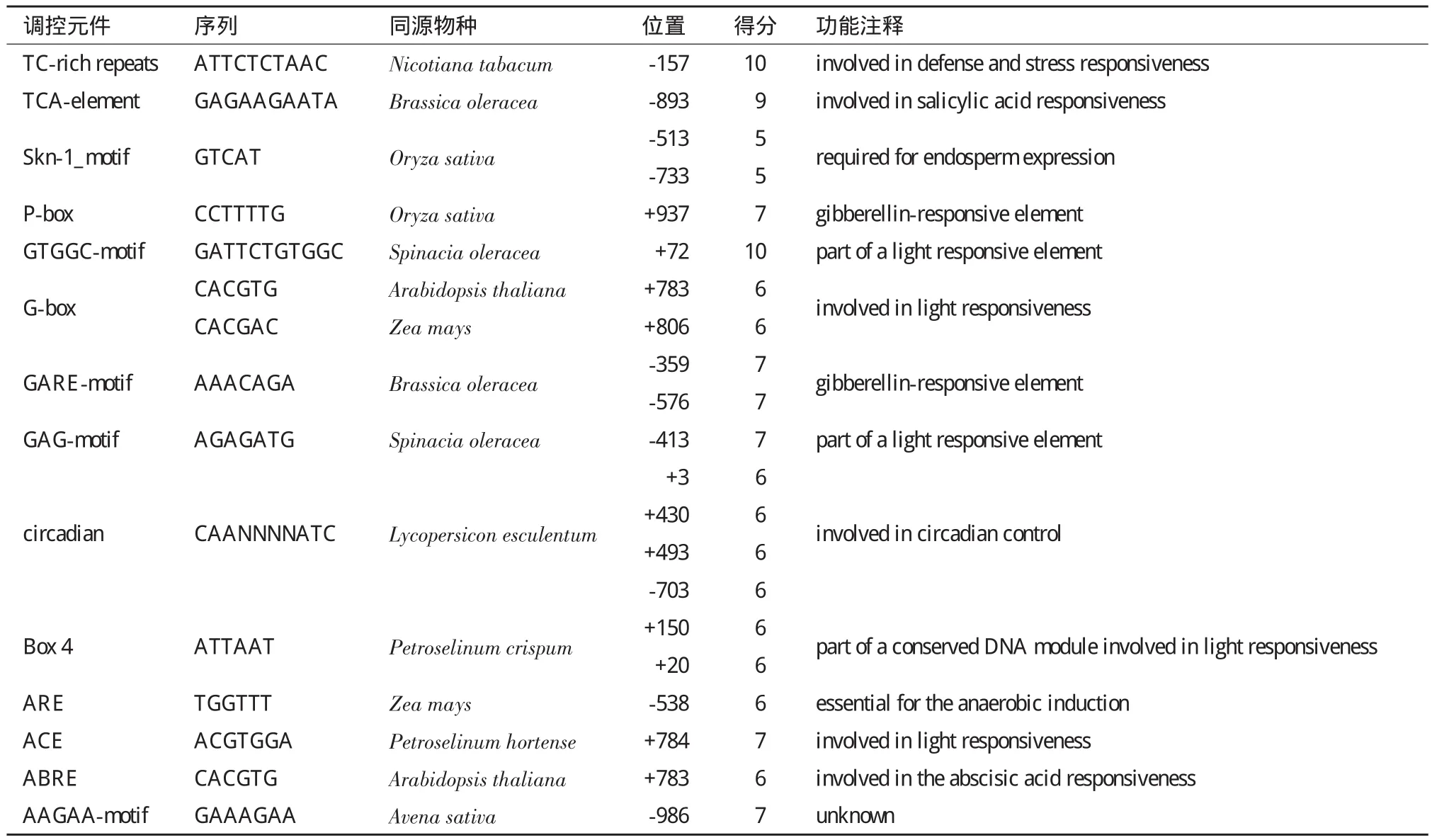
表1 花生AhTIL1候选启动子元件预测
在拟南芥中只有一个TIL基因,小麦中有TIL1和TIL2两个基因,研究发现只有TIL1响应温度胁迫,在序列上响应温度胁迫的TIL1和拟南芥的TIL有更高的同源性[10]。我们从花生中克隆的TIL基因在序列上与小麦的TIL1更接近,而且也能响应温度胁迫,因此,本研究将在花生中克隆的载脂蛋白基因命名为AhTIL1。我们的研究还发现,在花生野生种A. duranensis和A. ipaensis中均含有1个温度诱导载脂蛋白同源基因,与鲁花14号的AhTIL1的同源性均为97%,仅从编码区序列上很难判断该基因来源于哪一个野生种。然而,有意思的是在候选启动子区域,AhTIL1与野生种A. ipaensis 100%匹配,而与A. duranensis只有60%的一致性,这表明AhTIL1可能来源于花生的B亚基因组。尽管A. duranensis中同源基因的候选启动子在序列上与AhTIL1差异很大,但是在候选启动子区域也有与光、ABA等相关的调控元件,说明TIL的表达和功能在二倍体祖先种和栽培种中可能具有很高的保守性。另外,在栽培花生鲁花14号中可能还有一个AhTIL11的同源基因,这两个基因的同源性可能很高,揭示这两个基因的功能和分化将是我们下一步的工作。
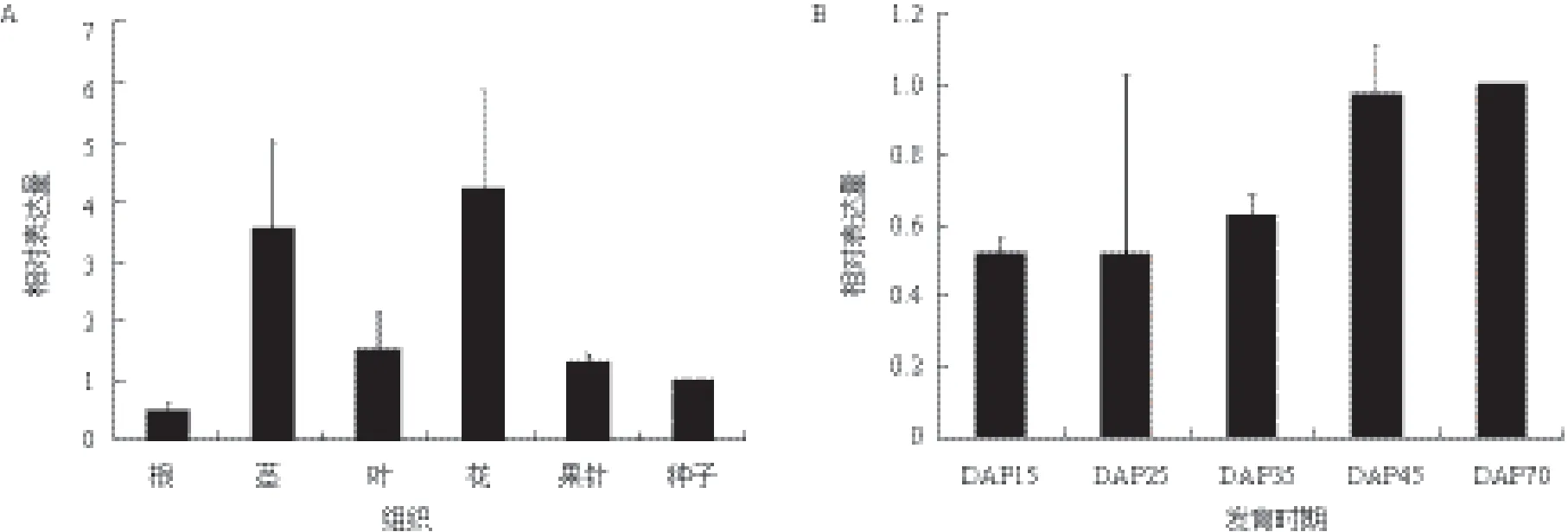
图5 花生AhTIL1在不同组织(A)和种子不同发育时期(B)的表达模式
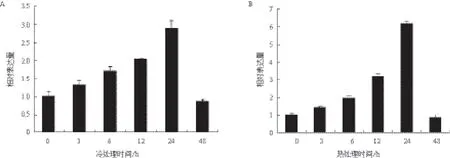
图6 花生AhTIL1在8℃(A)和42℃(B)处理下的表达模式
4 结论
本研究从花生中克隆了响应温度诱导的载脂蛋白基因AhTIL1,分析了该基因的结构和启动子元件,阐明了其在花生不同组织及种子发育不同时期的表达特性,证明该基因能够分别响应高温和低温胁迫。
[1]严美玲, 李向东, 林英杰, 等. 苗期干旱胁迫对不同抗旱花生品种生理特性、产量和品质的影响[J]. 作物学报, 2007, 33(1):113-119.
[2]宰学明, 钦佩, 吴国荣, 等. 高温胁迫对花生幼苗光合速率、叶绿素含量、叶绿体Ca2+-ATPase、Mg2+-ATPase及Ca2+分布的影响[J]. 植物研究, 2007, 27(4):416-420.
[3]陈建爱, 郭峰, 杨武汉, 等. 盐胁迫下黄绿木霉T1010对花生耐盐生理的影响[J]. 西南农业学报, 2014, 27(2):587-590.
[4]Sanchez D. Exon-intron structure and evolution of the lipocalin gene family[J]. Molecular Biology and Evolution, 2003, 20(5):775-783.
[5]Grzyb J, Latowski D, Strzałka K. Lipocalins-a family portrait[J]. Journal of Plant Physiology, 2006, 163(9):895-915.
[6]Flower DR, North AC, Sansom CE. The lipocalin protein family:structural and sequence overview[J]. Biochim Biophys Acta, 2000, 1482(1-2):9-24.
[7]Frenette CJ, Breton G, Badawi M, et al. Molecular and structural analyses of a novel temperature stress-induced lipocalin from wheat and Arabidopsis[J]. FEBS Lett, 2002, 517(1-3):129-132.
[8]Chi WT, Fung RW, Liu HC, et al. Temperature-induced lipocalin is required for basal and acquired thermo tolerance in Arabidopsis[J]. Plant Cell Environ, 2009, 32(7):917-927.
[9]Kawamura Y, Uemura M. Mass spectrometric approach for identifying putative plasma membrane proteins of Arabidopsis leaves associated with cold acclimation[J]. Plant J, 2003, 36(2):141-154.
[10]Charron JB, Ouellet F, Pelletier M, et al. Identification, expression, and evolutionary analyses of plant lipocalins[J]. Plant Physiol, 2005, 139(4):2017-2028.
[11]Charron JB, Ouellet F, Houde M, et al. The plant Apolipoprotein D ortholog protects Arabidopsis against oxidative stress[J]. BMC Plant Biol, 2008, 8(1):86.
[12]Abo-Ogiala A, Carsjens C, Diekmann H, et al. Temperatureinduced lipocalin(TIL)is translocated under salt stress and protects chloroplasts from ion toxicity[J]. Plant Physiology, 2014, 171(3-4):250-259.
[13]Levesque-Tremblay G, Havaux M, Ouellet F. The chloroplastic lipocalin AtCHL prevents lipid peroxidation and protects Arabidopsis against oxidative stress[J]. Plant J, 2009, 60(4):691-702.
[14]Boca S, Koestler F, Ksas B, et al. Arabidopsis lipocalins AtCHL and AtTIL have distinct but overlapping functions essential for lipid protection and seed longevity[J]. Plant, Cell & Environment, 2014, 37(2):368-381.
[15]全先庆, 高成香, 王兴军, 等. 花生金属硫蛋白基因AhMT3a的克隆及其表达[J]. 生物技术通报, 2012(3):75-79.
[16]Bishop RE. The bacterial lipocalins[J]. Biochim Biophys Acta, 2000, 1482(1-2):73-83.
[17] Fluckinger M, Haas H, Merschak P, et al. Human tear lipocalin exhibits antimicrobial activity by scavenging microbial siderophores[J]. Antimicrob Agents Chemother, 2004, 48(9):3367-3372.
[18]Ganfornina MD, Do Carmo S, Lora JM, et al. Apolipoprotein D is involved in the mechanisms regulating protection from oxidative stress[J]. Aging Cell, 2008, 7(4):506-515.
[19]Burow MD, Simpson CE, Faries MW, et al. Molecular biogeographic study of recently described B- and A-genome Arachis species, also providing new insights into the origins of cultivated peanut[J]. Genome, 2009, 52(2):107-119.
[20]Su L, Zhao C, Bi Y, et al. Isolation and expression analysis of LEA genes in peanut(Arachis hypogaea L. )[J]. Journal of Biosciences, 2011, 36(2):223-228.
[21]苏磊, 姜娜娜, 王兴军, 等. 花生AhLEA18蛋白基因的克隆与表达分析[J]. 中国农学通报, 2010, 26(17):47-50.
[22]朱岩, 彭振英, 范仲学, 等. 花生蛋白激酶基因AhSTK的克隆与序列分析[J]. 山东农业科学, 2013, 45(1):9-13.
[23]刘羽, 赵传志, 李长生, 等. 花生HIR基因的克隆表达与进化分析[J]. 山东农业科学, 2014, 46(5):1-6.
(责任编辑 马鑫)
Cloning and Expression Analysis of Temperature Induced Lipocalin Gene AhTIL1 of Peanut(Arachis hypogaea)
ZHONG Rui-chun1LI Ting-ting2,3TANG Rong-hua1WANG Xing-jun2,3LI Cui2HOU Lei2ZHAO Chuan-zhi2,3
(1. Cash Crops Research Institute,Guangxi Academy of Agricultural Sciences,Nanning 530007;2. Bio-tech Research Center,Shandong Academy of Agricultural Sciences,Shandong Provincial Key Laboratory of Crop Genetic Improvement,Ecology and Physiology,Ji’nan 250100;3. College of Life Sciences,Shandong University,Ji’nan 250100)
The temperature-induced lipocalins(TILs)is correlated with the stability of plant under stress environment of hot,cold,lighting,and oxidizing. This study intended to clone the TIL gene from peanut and analyze its function in response to temperature stress. A gene encoding TIL,designated as AhTIL1,was screened from the peanut cDNA library. The relative expressions of the gene in the different tissues of peanuts,at the different stages of seeds,and under the temperature stress were detected by quantitative PCR. The results of sequence analysis showed that the length of the ORF of AhTIL1 was 558 bp,encoding 185 amino acids. The bioinformatics analysis indicated that the predicted molecular mass of encoded protein was 21.4 kD,ad pI was 6.78. Sequence alignment displayed that the amino acids of AhTIL1 were in high homology with TIL of other species. The predicted results of candidate promoter showed that the candidate gene promoter contained regulatory elements associated with the light reaction such as ACE,Box4,G-box,GAG-motif etc.,and other related cis regulatory elements such as ABA,salicylic acid,gibberellin,anaerobic etc. Microarray and RNA-seq results showed that AhTIL1 expressed in roots,stems,leaves,flowers,peg,and seeds,the highest in the flowers,second highest in the stems,and the least in the roots. After the peg penetrating into soil,the expression level of AhTIL1 decreased immediately,and then increased gradually with the enlarging and maturing of seeds. Real time quantitative PCR result proved that the expression level of AhTIL1 increased after low or high temperature treatment for 3,6,12 and 24 h,however,decreased after 48 h. These results indicated that AhTIL1 may play an important role in peanut response to temperature stress.
peanut;temperature-induced lipocalin;gene cloning;expression analysis
10.13560/j.cnki.biotech.bull.1985.2016.04.013
2015-06-24
国家自然科学基金项目(31101427),国家“863”项目(2013AA102602),广西科学研究与技术开发计划项目(桂科攻1222009-2c),山东省生物资源创新项目,山东省农业科学院青年英才培养计划
钟瑞春,男,副研究员,研究方向:花生育种和栽培,E-mail:rczhong6501@163.com;李婷婷为本文并列第一作者
赵传志,男,副研究员,研究方向:花生基因组学和遗传育种;E-mail:chuanzhiz@126.com

