HPGPC检测固定化肠膜明串珠菌产葡聚糖的研究
王清,刘涛,陈山(.信阳农林学院食品学院,河南信阳464000;2.广西大学糖业工程技术研究中心,广西南宁530004)
HPGPC检测固定化肠膜明串珠菌产葡聚糖的研究
王清1,刘涛1,陈山2,*
(1.信阳农林学院食品学院,河南信阳464000;2.广西大学糖业工程技术研究中心,广西南宁530004)
摘要:葡聚糖是蔗糖经肠膜明串珠菌发酵所得产物,经水解纯化处理后具有一定分子量且均一度较高的小分子葡聚糖(又叫右旋糖酐)是国际公认的优质代用血浆。然而现行右旋糖酐制备工艺较难达到医药临床的相关要求,因此,探索能定向合成特定分子量分布右旋糖酐的新途径,具有十分明显的现实意义和理论价值。通过HPGPC在线检测固定化肠膜明串珠菌发酵产物——葡聚糖的重均分子量,发现可通过固定化技术实现对肠膜明串珠菌发酵产物的分子量控制;并且发现在相同发酵时间内,固定化菌发酵产生的葡聚糖含量比游离菌发酵略多;固定化菌发酵产生的葡聚糖重均分子量比游离菌发酵产生的葡聚糖重均分子量低。
关键词:固定化;肠膜明串珠菌;葡聚糖;HPGPC
低分子量的右旋糖酐具有较优良的药用价值,具有一定分子量分布且均一度较高的右旋糖酐是国际公认的优质人工血浆制品及器官保护剂[1],右旋糖酐40、右旋糖酐70已被收入到我国农村牧区合作医疗基本药物目录[2],右旋糖酐70在临床上常被用作代用血浆[3]。目前,葡聚糖的制备多是通过含高浓度蔗糖的培养基经微生物发酵而成,由于发酵过程难以控制,所得产物分子量很大,需再采用酸水解和乙醇分级沉淀的方法来实现葡聚糖的分离提纯[4]。该方法不仅乙醇用量大,而且耗时长、难控制,并且由于菌体与产物的缠绕,使菌体产物分离不彻底,从而降低了葡聚糖的质量[5]。在制备过程中引入固定化技术,能使菌体和产物得以有效分离,因此,固定化技术成为当前葡聚糖生产的热点。
本试验通过使用HPGPC(高效凝胶过滤色谱)在线检测培养基中固定化肠膜明串珠菌的发酵产物——葡聚糖的分子量分布情况,并与游离菌发酵产物的HPGPC谱图对比,找出两者异同点,探索固定化肠膜明串珠菌生物合成葡聚糖过程的一些规律,为发酵合成葡聚糖过程的控制及定向合成特定分子量分布的右旋糖酐的研究提供基础数据。
1 材料与方法
1.1试剂与设备
海藻酸钠、CaCl2、NaCl、葡聚糖标准品(Mw范围为667~778 000)、超纯水、蔗糖、KH2PO4、Na2HPO4、蛋白胨、5 mL无菌注射器、超净工作台、恒温培养振荡器、蒸汽灭菌器、离心机、TSK凝胶柱、Agilent G1362A示差折光检测器。
1.2方法
1.2.1培养基
培养基为蔗糖130 g、KH2PO40.3 g、Na2HPO41.4 g、蛋白胨2.0 g、蒸馏水1 000 mL、pH 7.0~7.2。
1.2.2HPGPC色谱条件
Agilent 1100液相系统;示差折光检测器(Agilent G1362A);色谱柱为TSK-4000PW凝胶柱,TSK-3000SW凝胶柱,TSK-Guard SW保护柱;以超纯水作为流动相,流速为0.8 mL/min;检测温度为25℃。
Hello Time 2 sec Max Age 20 sec Forward Delay 15 sec
1.2.3标准曲线的绘制
准确称取一定量的葡聚糖标准品,配制成系列标准溶液,每个标准品的进样量为10 μL,测得每个标准品谱图的最高峰的洗脱体积,记为Vp,绘制Vp-lgMw曲线。
1.2.4HPGPC检测固定化菌发酵的过程研究
于冰箱中取出斜面一支,平板划线,挑取长势好的单菌落,接入种子培养液,种子培养20 h后按2%接种量接入增殖培养基进行扩大培养,培养24 h后,10 000 r/min离心20 min,获得离心管底部菌体,将菌体悬浮于100 mL生理盐水,吸取5 mL生理盐水菌悬液,与一定浓度海藻酸钠充分混匀后滴制成固定化菌,接种于液体培养基,于恒温培养振荡器中25℃,150 r/min培养。
每隔一定时间,用无菌枪头取样,10 000 r/min离心10 min,吸取上清液,稀释至20倍,过0.45微滤膜,制成待测样品,用HPGPC检测其体系分子量变化情况,以反映固定化菌的发酵过程。
1.2.5固定化菌发酵与游离菌发酵的对比
在其他条件完全相同的条件下,按5%的接种量分别接种固定化菌和游离菌到100 mL相同的发酵培养基中,于恒温培养振荡器中25℃,150 r/min培养。
2 结果与分析
2.1标准曲线的绘制
通过HPGPC数据分析软件进行数据分析,绘制标准曲线,以lgMw为纵坐标,以Vp为横坐标,如图1所示。
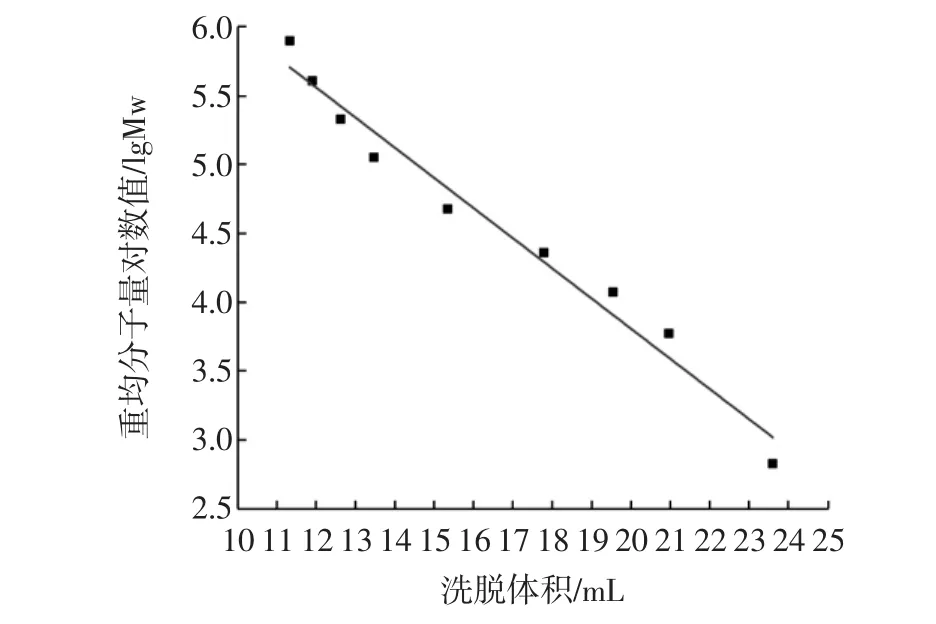
图1 葡聚糖分子量标准曲线Fig.1 Standard calibration of dextran with molecular weight
其线性回归方程为:
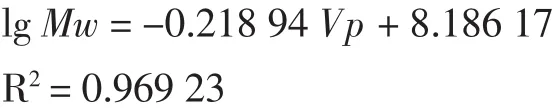
2.2固定化菌在液体培养基中发酵产物的HPGPC检测
将未接种菌体的液体培养基按照上述方法制成HPGPC进样样品,作为空白对照,其谱图如图2所示。
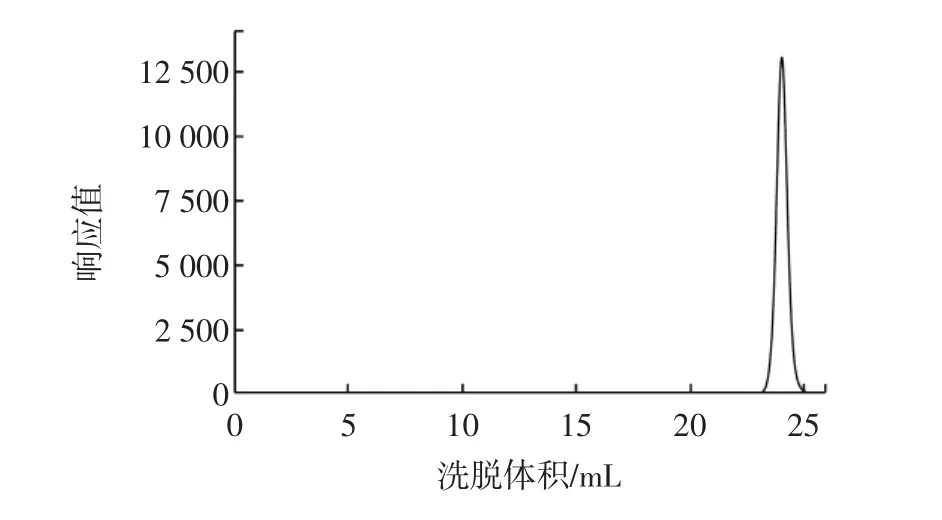
图2 空白样的HPGPC谱图Fig.2 The HPGPC chromatogram of the blank
根据蔗糖纯品出峰位置判断,在该处出峰的物质为体系中所含的蔗糖。空白样中其他物质在此柱条件下未被检出,可排除液体培养基本身所含物质对出峰体系的干扰。
制作固定化菌,按5%接种量接种于培养基,分别于19、31、144 h取样后制成HPGPC进样样品,其HPGPC谱图叠加图如图3所示。
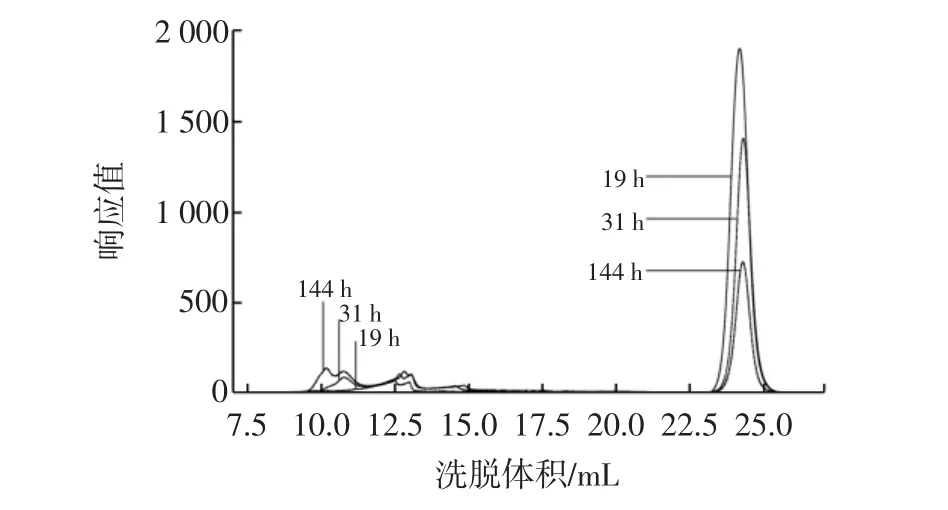
图3 固定化菌发酵19、31、144 h样品的HPGPC谱图叠加图Fig.3 The overlay HPGPC chromatogram of fermentation of immobilized bacteria after 19,31 h and 144 h
由图3可以看出,随着发酵时间的延长,后面的蔗糖峰峰高和峰面积在逐渐减小,前面的大分子峰在逐渐前移,说明在反应过程中,蔗糖被逐渐消耗,葡聚糖产物逐渐合成。
考虑到每个样品的葡聚糖出峰的洗脱体积都落在8mL~16mL区间范围内,故对出峰洗脱体积在8mL~16 mL之间的葡聚糖峰叠加部分着重研究,通过GPC分析软件及标准曲线对其进行分子量分析可知:
19h时体系中葡聚糖的平均出峰时间为16.165min,平均峰高为122.9,重均分子量为578 920;31 h时体系中葡聚糖的平均出峰时间为15.210 min,平均峰高为99.07,重均分子量为780 990;144 h时葡聚糖出峰的平均出峰时间为14.507 min,平均峰高为99.35,重均分子量为1 720 000。由此可以看出,通过控制发酵时间可以在一定程度上控制葡聚糖合成产物的重均分子量。
2.3固定化菌发酵和游离菌发酵的HPGPC检测与对比
将固定化菌按5%接种量接种于培养基,分别于31、55、120 h取样,制成HPGPC进样样品,其HPGPC谱图叠加图如图4所示。
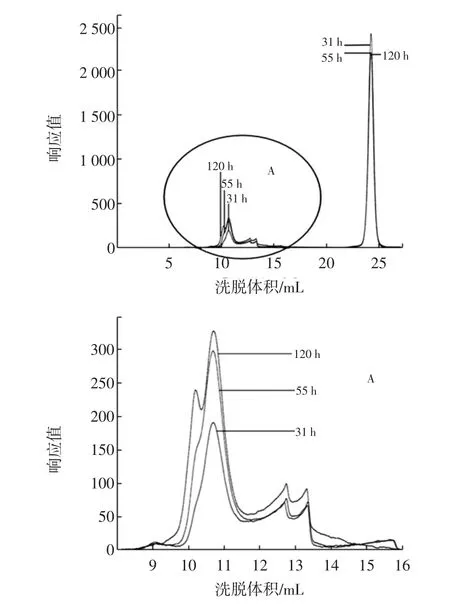
图4 固定化菌在培养基中发酵31、55 h和120 h的HPGPC谱图叠加图Fig. 4 The overlay HPGPC chromatogram of fermentation of immobilized bacteria after 31,55 h and 120 h in culture medium
对出峰洗脱体积在8 mL~16 mL之间的葡聚糖峰叠加部分着重研究,见图4中的A图。通过GPC分析软件及标准曲线对其进行分子量分析可知,31、55、120 h体系中产生的葡聚糖的出峰时间分别为:13.374、13.367、13.070 min,峰高分别为:196.5、302.9、336.9,重均分子量分别为:1 419 500、1 575 600、1 651 800。
将游离菌按5%接种量接种于液体培养基,分别于31、55、120 h取样,制成HPGPC进样样品,图5为其HPGPC谱图叠加图。
对出峰洗脱体积在8 mL~16 mL之间的葡聚糖峰叠加部分着重研究,见图5中的B图。通过GPC分析软件及标准曲线对其进行分子量分析可知,31、55、120 h体系中产生的葡聚糖的出峰时间分别为:14.049、12.744、12.679 min,峰高分别为:268.0、153.8、139.2,重均分子量分别为:1 020 900、1 960 300、2 456 500。
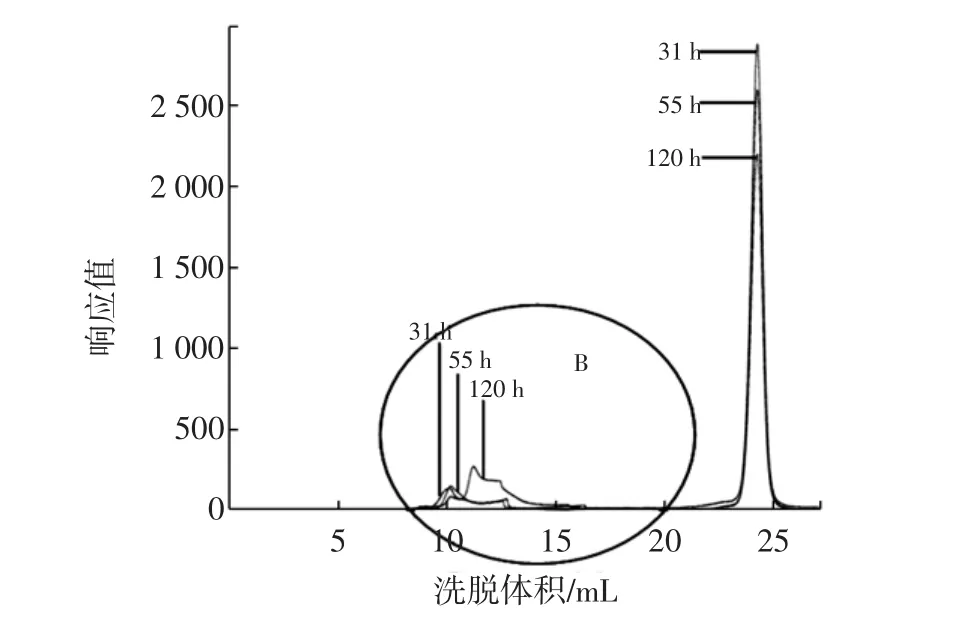
将图4和图5对比可以发现:相同培养基条件,相同的发酵时间内,固定化菌发酵与游离菌发酵在培养基中产生的葡聚糖产物的分子量大体一致,只是在发酵中后期(55、120 h),游离菌发酵产生的葡聚糖产物分子量稍高于固定化菌发酵;而且从峰高可以大致看出,固定化菌发酵的葡聚糖产量比相同时间内游离菌发酵的葡聚糖产量略多。
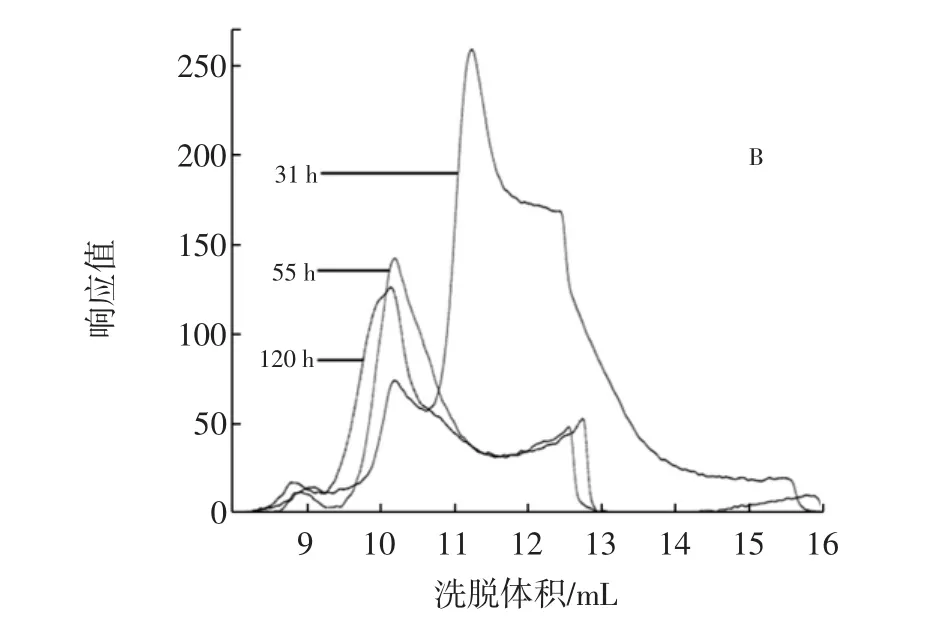
图5 游离菌在培养基中发酵31、55 h和120 h的HPGPC谱图叠加图Fig.5 The overlay HPGPC chromatogram of fermentation of free bacteria after 31,55 h and 120 h in culture medium
即相同时间内,固定化菌发酵产生的葡聚糖的量多于游离菌发酵,固定化菌发酵产生的葡聚糖的分子量低于游离菌发酵,这是因为菌体被固定化之后,在葡聚糖合成反应中起主要作用的葡聚糖蔗糖酶的稳定性提高,酶促反应的作用力较均一,因此形成的具有极大分子量的葡聚糖较少,具有极小分子量的葡聚糖也少。反映在谱图上,就表现为固定化菌发酵产生的葡聚糖产物的分子量低于游离菌发酵。
3 结论
通过固定化肠膜明串珠菌发酵蔗糖产葡聚糖的HPGPC检测与游离肠膜明串珠菌发酵蔗糖产葡聚糖的HPGPC检测对比,探索出一定规律,这说明通过HPGPC谱图的分析来反应发酵过程中的某些规律是可行的。所得的规律如下:1、通过控制发酵时间可以在一定程度上控制葡聚糖合成产物的重均分子量;2、相同培养条件和相同发酵时间内,固定化菌发酵产生的葡聚糖产物的量比相同时间内游离菌发酵略多,即固定化发酵效力优于相同条件下的游离菌发酵效力;3、固定化菌发酵产生的葡聚糖分子量低于同步游离菌发酵产生的葡聚糖分子量,说明通过肠膜明串珠菌的固定化,能在一定程度上对其葡聚糖产物的分子量进行调控。
以上试验初步探索了固定化肠膜明串珠菌生物合成葡聚糖的过程规律,可为今后实现右旋糖酐生物合成的定向控制研究提供试验数据和理论指导。
参考文献:
[1]Neu Bjoern,Wenby Rosalinda,Meiselman Herbert J. Effects of dextran molecular weight on red blood cell aggregation[J]. Biophysical Journal,2008,95(6):3059-3065
[2]国家药典委员会.中国药典[M].北京:中国医药科技出版社,2010:418
[3]晓原.血浆代用品国内市场.中国医药报[N].2006-02-09(B06)
[4]Kim Doman,Robyt John F,Lee So-Young,et al. Dextran molecular size and degree of branching as a function of sucrose concentration,pH,and temperature of reaction of Leuconostoc mesenteroides B-512FMCMdextransucrase[J].Carbohydrate Research,2003,338(11):1183-1189
[5]蓝平,蓝丽红,董智芳,等.合成右旋糖酐菌体固定化研究[J].化学世界,2009(11):669-67
Research of Producing Dextran from Immobilized Leuconostoc Mesenteroides by HPGPC Detection
WANG Qing1,LIU Tao1,CHEN Shan2,*
(1. Department of Food Science,Xinyang College of Agriculture and Forestry,Xinyang 464000,Henan,China;2. Center for Sugar Engineering and Technology Research,Guangxi University,Nanning 530004,Guangxi,China)
Abstract:Glucan is the production of sucrose ferment,small molecular weight glucan(which is also called dextran)obtained after hydrolisis and purification with certain molecular weight,and high homogeneous is the internationally recognized high quality blood plasma substitution. However,the present production technique of dextran can inaccessibility meet the clinical medicine standard,therefore,it has the very obvious practical significance and the theory value to develop a new way that can synthesize dextran with specific molecular weight distribution. By HPGPC on-line detection of molecular heavy weight of fermentation products,we can control the molecular weight of Leuconostoc Mesenteroides fermentation products by immobilization technology,we found that the amount of immobilized bacteria fermentation of glucan were more than the free bacteria fermentation in the same time;and the molecular weight of dextran from immobilized bacteria fermentation produce was lower than dextran from free bacteria fermentation in the same time.
Key words:immobilized;dextran;Leuconostoc Mesenteroides;HPGPC
DOI:10.3969/j.issn.1005-6521.2016.09.033
基金项目:国家自然科学基金项目资助(21264003);广西自然科学基金项目资助(2012GXNSFAA053029);广西自然科学基金项目资助(2013GXNSFAA019036)
作者简介:王清(1988—),女(汉),讲师,硕士,研究方向:食品营养与检测。
*通信作者:陈山(1968—),男(汉),教授,博士生导师。
收稿日期:2015-01-05

