中药黄连对鲢鱼消化酶和去毒酶活力及抗MC-LR作用的影响
韩光耀, 毕 潇, 余 飞, 孔德红, 朱炎坤, 周 亮, 谢丽玲
(汕头大学生物学系,广东汕头 515063)
中药黄连对鲢鱼消化酶和去毒酶活力及抗MC-LR作用的影响
韩光耀, 毕 潇, 余 飞, 孔德红, 朱炎坤, 周 亮, 谢丽玲*
(汕头大学生物学系,广东汕头 515063)
摘要[目的]研究中药黄连对鲢鱼消化酶和去毒酶活力以及铜绿微囊液MC-LR含量的影响。[方法]将黄连水提液作为饲料添加剂喂喂鲢鱼,检测鲢鱼的肠道消化酶(脂肪酶、胃蛋白酶和淀粉酶)和肝脏去毒酶(谷胱甘肽S-转移酶sGST及其底物谷胱甘肽GSH)活力以及铜绿微囊藻受到抑制后藻毒素MC-LR含量的变化。[结果]在普通水体中饲养,喂药组和对照组各酶活力没有显著差异(P>0.05 );放入铜绿微囊藻藻液饲养24 h后,脂肪酶活力升高,淀粉酶活力降低,差异极显著 (P<0.01),但胃蛋白酶活力差异不显著(P>0.05 )。喂药组与对照组肠道消化酶活力差异不显著 (P>0.05 );喂药组鲢鱼肝脏GSH和sGST活力升高(P<0.01),且高于对照组(P<0.01)。120 h,黄连水提液处理组铜绿微囊藻细胞内MC-LR含量降低了82.4%,空白组的铜绿微囊藻细胞内MC-LR含量增加了39.5%。[结论]在饲料中添加黄连鲢鱼在铜绿微囊藻环境下,黄连可诱导显著增强鲢鱼肝脏去毒酶活力,在富含铜绿微囊藻的水体中饲料中添加黄连鲢鱼的生存能力有所提高。
关键词黄连;MC-LR;消化酶;sGST;GSH
中草药作为饲料添加剂在水产养殖中得到了广泛应用,能够提高水产养殖业的经济与社会效益。中草药具有天然、高效、毒副作用小、抗药性不显著、资源丰富以及性能多样等优点,既能提高水产动物的生产性能和饲料利用率,又能防治水产动物病害,是其他禁用抗菌素和化学药物的替代产品,在水产养殖中的应用越来越受到人们的关注[1]。研究表明,黄连对非 01 群霍乱弧菌、温和气单胞菌、鲁氏不动杆菌、迟钝爱德华氏菌和嗜水气单胞菌具有明显的抑制作用[2]。因此,研究黄连对鱼类消化酶的作用在生理学具有重大意义。
鲢鱼是典型的滤食性鱼类,可滤食浮游动物和浮游植物,已经被用于控制水华污染[3-6]。鱼类消化酶主要有蛋白酶、脂肪酶、纤维素酶和淀粉酶等。在有胃鱼类胃中的胃蛋白酶活性最强[7],胃蛋白酶活性可受饲料蛋白质的影响[8]。淡水水体中常见的铜绿微囊藻(Microcystisaeruginosa)、水华鱼腥藻(Anabaenaflosaquae)、颤藻(Oscillatoria)等是产生微囊藻毒素(Microcystin,MC)的主要藻类,可产生1种或多种藻毒素[9]。水体中最常见的微囊藻毒素是MC-RR、MC-YR和MC-LR,其中MC- LR 毒性大于MC-RR、MC-YR[10]。可溶性谷胱甘肽S-转移酶催化微囊藻毒素(Microcystins,MCs)与还原型谷胱甘肽GSH的加合去毒代谢过程[11]。滤食微藻的鱼类在水华暴发时GST基因表达上调[12],sGST活力易受环境诱导。笔者以鲢鱼胃蛋白酶、肠道脂肪酶、淀粉酶和谷胱甘肽S-转移酶(sGST)及其底物还原型谷胱甘肽(GSH)为研究对象,研究了黄连对鲢鱼消化酶和去毒酶活力以及铜绿微囊藻液MC-LR含量的影响,以评价黄连水提液对鲢鱼抗铜绿微囊藻能力的影响,旨在为黄连应用于鱼类养殖提供科学参考。
1材料与方法
1.1试验材料试验所用铜绿微囊藻FACHB-940购自中国科学院武汉水生生物研究所淡水藻种库;黄连购自汕头市采芝林药店;试验用鲢鱼购自汕头市明记鱼苗场。
1.2仪器高效液相色谱仪Agilent 1100,为安捷伦科技有限公司产品;HH-2型数显恒温水浴锅,为国华电器有限公司产品;GXZ智能型光照培养箱,为宁波江南仪器厂产品;TDL-5-A型低速大容量离心机;JFSD-100型粉碎机,为上海嘉定粮油仪器有限公司产品;DZF-6020型真空干燥箱,为上海博讯实业有限公司产品。
1.3试验方法
1.3.1藻种的培养。将铜绿微囊藻转接到藻类BG11液体培养基中,置于光照培养箱中进行扩大培养,培养温度为25 ℃,光照强度为2 500 lx,光照周期为12 h∶12 h。所有试验操作均在无菌条件下进行。
1.3.2黄连饲料的制备。①将黄连研磨成粉(50目),与蒸馏水按一定比例混合放入圆底烧瓶,80 ℃水浴提取1 h,离心后取上清液,调整浓度为5 mg/mL,4 ℃下保存备用。②基础饲料的制备。将普通颗粒状饲料机械研磨成粉状(50目),干燥保存备用。③黄连饲料的制备。基础饲料与蒸馏水等量混合,每克饲料(干重)加入黄连药液1 mL,使饲料中药物含量为0.5%,60 ℃下烘干30 min,冷却后4 ℃保存。
1.3.3鲢鱼的饲养。鲢鱼先在净水中驯养5 d,随机分为对照组和喂药组,每组鲢鱼数≥50条,按鱼体重的3%投喂饲料(干重)分别投喂基础饲料和黄连饲料。饲养期间保持24 h供氧,每天换1次曝气12 h的自来水(普通水体)。鲢鱼饲养14 d后,将鲢鱼放入铜绿微囊藻水体(OD680=0.550)中24 h。夏季每天检查1次鲢鱼体表是否有寄生虫。通过观察发现未投喂饲料时水体清澈,底层鱼粪很少;投喂饲料过夜后,水体透明度下降,底层有大量鱼粪。这说明鲢鱼对配制的饲料摄食良好。
1.3.4鲢鱼消化酶和去毒酶的活性测定。
(1)鲢鱼肠道消化酶的测定。普通水体和铜绿微囊藻水体生长的鲢鱼,各组取3条体重约10 g的鲢鱼冰浴解剖,取肠道,冰浴研磨,用南京建成生物工程研究所的试剂盒测定鲢鱼胃蛋白酶、脂肪酶和淀粉酶活力。每组3个重复。
(2)鲢鱼肝脏GSH与sGST活性的测定。鲢鱼在普通水体中饲养14 d后,取3条体重约10 g的鲢鱼冰浴解剖,取肝脏,冰浴研磨,按照试剂盒说明书进行测定。每组3个重复。
1.3.5铜绿微囊藻MC-LR含量的测定。采用高效液相色谱法(HPLC)测定铜绿微囊藻细胞内MC-LR的含量。取铜绿微囊藻液30 mL,4 500 r/min离心10 min后收集藻细胞,用超纯水洗涤1次,12 000 r/min离心收集藻细胞,加入1 mL超纯水,沸水浴15 min,12 000 r/min离心10 min后取上清,4 ℃下保存备用。提取液用0.45 μm滤膜过滤,采用HPLC检测MC-LR的含量[13]。HPLC条件如下:柱温40 ℃;标准进样体积20 μL;流动相为乙腈-0.08%三氟乙酸溶液(42∶58);检测波长为238 nm。
1.3.6数据统计与分析。使用Excel绘图,利用SPSS软件进行单因素方差(ANOVA)分析,显著水平为0.05,极显著水平为0.01。
2结果与分析
2.1黄连饲料添加剂对鲢鱼消化酶活力的影响从图1~2可以看出,在普通水体条件饲养14 d后,喂药组与对照组鲢鱼的消化酶活力不存在显著差异(P>0.05)。将鲢鱼放入藻液24 h后,对照组鲢鱼的脂肪酶活力升高了1.99倍,胃蛋白酶活力升高了1.19倍;喂药组鲢鱼的脂肪酶活力则升高了2.58倍,胃蛋白酶活力升高了2.00倍,超过了对照组的正常水平。对照组和喂药组鲢鱼的脂肪酶活力显著升高(P<0.01),而胃蛋白酶活力无显著差异(P>0.05);对照组淀粉酶活力下降7.03倍,显著降低(P<0.05);喂药组淀粉酶活力下降了3.43倍,极显著降低(P<0.01)。这说明黄连饲料能提高鲢鱼在微囊藻水体中的脂肪酶和淀粉酶的活力,降低胃蛋白酶的活力。
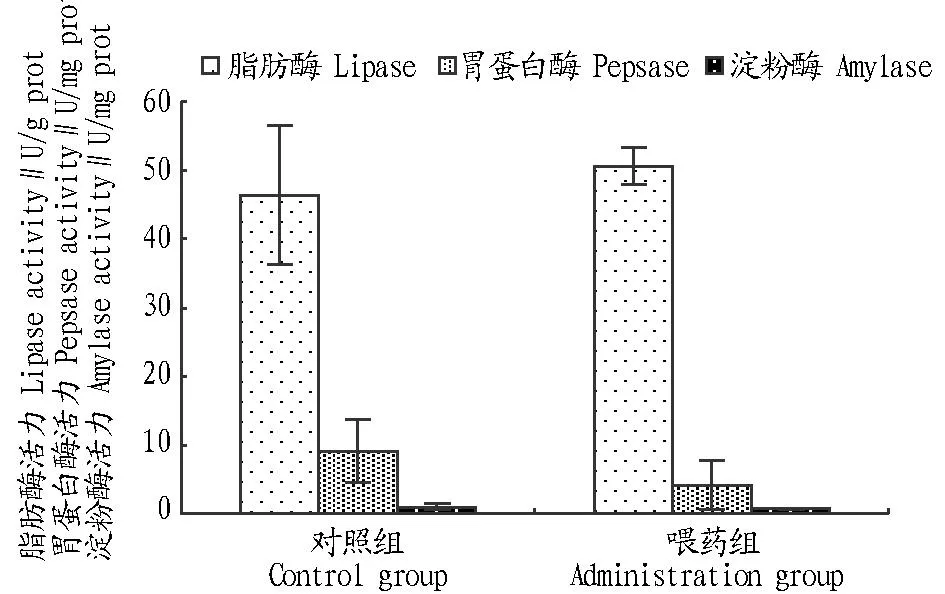
图1 黄连饲料对鲢鱼消化酶活力的影响Fig.1 Effects of Coptis chinensis feed on the activity of digestive enzymes of Hypophthalmichthys molitrix

注:*表示存在显著差异(P<0.05);**表示存在极显著差异(P < 0.01)。Note:* indicated significant differences (P< 0.05); and ** indicated extremely significant differences (P< 0.01).图2 黄连饲料对鲢鱼在铜绿微囊藻液中消化酶活力的影响Fig.2 Effects of C.chinensis feed on the digestive enzyme activity of H.molitrix in water body with M.aeruginosa
2.2黄连饲料添加剂对鲢鱼肝脏GSH和sGST活力的影响从图3和图4可以看出,在普通水体中,喂药组鲢鱼的GSH和sGST活力均低于对照组,但无显著差异(P>0.05)。将鲢鱼放养在微囊藻藻液24 h后,喂药组鲢鱼的肝脏去毒酶(GSH和 sGST)活力迅速升高。喂药组GSH活力提高了52.64%,sGST活力提高了34.41%,显著高于正常饲养期间水平(P<0.01)。对照组GSH活力下降了6.30%,sGST活力下降了19.67%,均低于正常饲养期间水平,无显著差异(P>0.05)。喂药组鲢鱼的GSH和sGST活力显著高于对照组(P<0.01)。这说明在铜绿微囊藻环境下黄连饲料能够提高鲢鱼GSH和sGST活力。
2.3黄连对铜绿微囊藻MC-LR含量的影响从图5可以看出,HPLC检测结果表明细胞内MC-LR出峰良好。从图6可以看出,黄连处理的铜绿微囊藻细胞内MC-LR含量随着抑制时间的延长而降低,120 h共降低82.4%,差异极显著(P<0.01)。空白组铜绿微囊藻细胞内MC-LR含量随着培养时间的延长而增加,120 h MC-LR含量增加了39.5%,差异极显著(P<0.01)。48~72 h,MC-LR含量有所下降,96 h MC-LR含量与72 h相比下降了2.3%,差异不显著(P>0.05)。
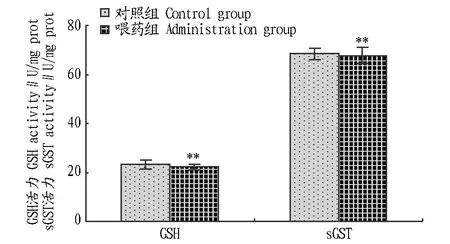
图3 黄连饲料对普通水体中鲢鱼的GSH和sGST活力的影响Fig.3 Effects of C.chinensis feed on GSH and sGST activities of H.molitrix in normal water body
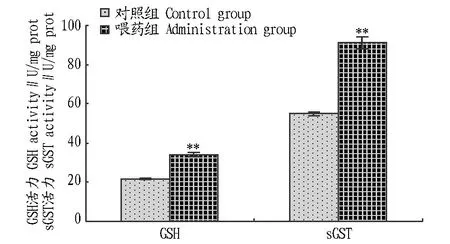
注:**表示与对照组存在极显著差异(P < 0.01)。Note:** indicated extremely significant differences (P < 0.01).图4 黄连饲料对蓝藻水体中鲢鱼GSH和sGST活力的影响Fig.4 Effects of C.chinensis feed on the GSH and sGST activities of H.molitrix in water body with M.aeruginosa

注:A:标准品MC-LR;B:空白组细胞内MC-LR;C:药物组细胞内MC-LR。Note:A.Standard substances MC-LR; B.Intracellular MC-LR of control group,C:Intracellular MC-LR of administration group.图5 微囊藻毒素MC-LR的HPLC图谱Fig.5 HPLC of microcystin MC-LR
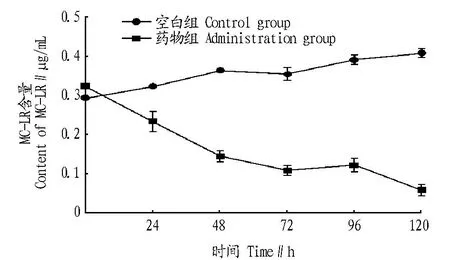
图6 黄连对铜绿微囊藻细胞内MC-LR含量的影响Fig.6 Effects of C.chinensis on intracellular MC-LR content of M.Aeruginosa
3结论与讨论
该研究结果表明鲢鱼在微囊藻水体中的脂肪酶和淀粉酶的活力升高,胃蛋白酶的活力降低。强俊等[14]认为饲料中低聚木糖添加量在0.033%左右时,可以提高奥尼罗非鱼(Oreochromisniloticus)幼鱼的消化酶活力和饲料转化率。胡忠泽等[15]研究发现姜黄素对草鱼生长具有明显促进作用,可以提高饲料利用率和肠道蛋白酶和淀粉酶的活性。何晓丽等[16]在饲料中添加黄连和大豆,发现添加0.5%黄连和10%大豆的饲料喂养可以提高鸡肠道的蛋白酶和淀粉酶活性,但黄连添加量对消化酶活力的影响则与该试验结果并不一致。陆开宏等[17]研究发现当鲢鱼以水华蓝藻为食,淀粉酶活力通常处于较低水平,与该研究结果相一致。
吴伟等[18]研究发现当罗非鱼暴露于2.0、3.0、5.0和10.0 μg/L 浓度的溴氰菊酯,其体内的GSH含量和GST活力先升高后降低,即先诱导后抑制。王奇等[19]研究发现罗非鱼GST在磺胺药物诱导下的响应敏感。该研究发现在普通水体中对照组和喂药组的鲢鱼肝脏GSH含量和sGST活力较低,原因可能是蓝藻浓度极低,对鲢鱼毒性较小,未达到黄连诱导GSH和sGST的水平。将鲢鱼放养在藻液中后,对照组鲢鱼未能快速适应环境的改变,其肝脏GSH含量和sGST活力低于正常饲养期间水平(P>0.05),而喂药组鲢鱼快速适应微藻突然升高的水体环境,其GSH和sGST活力高于正常饲养期间水平,并高于对照组,差异极显著(P<0.01)。这说明在正常饲养期间黄连对鲢鱼有一定的刺激作用,能够迅速适应发生改变的水体环境。相对于在饲料中添加GSH来增强鱼的解毒能力[20],黄连饲料添加剂更具有可行性。
利用化感作用除藻是目前的研究热点之一。植物中的抑藻物质以长链脂肪酸、简单酚酸类、酯类和生物碱最为常见。化感物质对藻类的抑制机理主要是影响光合作用、破坏细胞膜、影响酶活性[21-23]。黄连是一种对大多数细菌及藻类具有强烈抑制作用的中药材,研究人员对其抑制机理已有深入研究,如张树林[24]研究发现黄连对铜绿微囊藻的抑制是通过其主要成分生物碱的化感作用完成的,但对黄连抑制蓝藻后微囊藻毒素的变化尚无报道。笔者通过检测铜绿微囊藻细胞内MC-LR的含量,发现正常的铜绿微囊藻细胞内MC-LR随培养时间的延长而不断积累,黄连处理的铜绿微囊藻细胞内MC-LR含量随抑制时间的延长而降低。同时,黄连抑制120 h后仍然存在完整的藻细胞,而且离心收集到的藻细胞颜色发黄。据此推测,黄连抑制叶绿素a使得光合作用受到阻碍,进而导致细胞死亡。
该研究结果表明黄连饲料能提高鲢鱼在微囊藻水体中脂肪酶和淀粉酶的活力,降低胃蛋白酶的活力,能够促进鱼体对营养物质的消化吸收,抑制铜绿微囊藻细胞内合成MC-LR的含量,提高鲢鱼GSH和sGST活力水平,增强了鲢鱼抗微囊藻毒素的能力。
参考文献
[1] 武瑞,康世良.中草药饲料添加剂的免疫功能与应用前景[J].畜禽业,2001,1(9):10-12.
[2] 钟全福,樊海平.中草药对欧洲鳗病原菌的抑制作用研究[J].水利渔业,2002,22(4) :44-46.
[3] 蔡建楠,潘伟斌,王建华,等.鲢和奥尼罗非鱼对池塘蓝藻水华及水质的影响[J].水生态学杂志,2008,29(1):56-61.
[4] 王嵩,王启山,张丽彬,等.水库大型围隔放养鲢鱼、鳙鱼控藻的研究[J].中国环境科学,2009,29(11):1190-1195.
[5] 向文英,王晓菲.不同水生动植物组合对富营养化水体的净化效应[J].水生生物学报,2012,36(4):792-797.
[6] SCHROEDER G L,WOHLFARTH G,ALKON A.The dominance of algal-based food webs in fish ponds receiving chemical fertilizers plus organic manures[J].Aquaculture,1990,86:219-229.
[7] 徐宁,陈菊芳,王朝晖,等.广东大亚湾藻类水华的动力学分析Ⅱ.藻类水华与营养元素的关系研究[J].环境科学学报,2001,21(4):400-404.
[8] 陆开宏,晏维金,苏尚安.富营养化水体治理与修复的环境生态工程:利用明矾浆和鱼类控制桥墩水库蓝藻水华[J].环境科学学报,2002,22(6):732-737.
[9] HARADA K I,MAYUMI T,SHIMADA T,et al.Co-production of microcystins and aeruginopeptins by natural cyanobacterial bloom[J].Environmental toxicology,2001,16(4):298-305.
[10] GUPTA N,PANT S C,VIJAYARAGHAVAN R,et al.Comparative toxicity evaluation of cyanobacterial cyclic peptide toxin microcystin variants ( LR,RR,YR) in mice[J].Toxicology,2003,188(2/3):285-296.
[11] 王琳,梁旭方,廖婉琴,等.罗非鱼微囊藻毒素去毒相关基因克隆与活体表达研究[J].水生生物学报,2007,31(6):788-798.
[12] 李玺洋,梁旭方,程炜轩,等.水库鲮和罗非鱼谷胱甘肽转移酶基因表达量与水中蓝藻含量的关系[J].华中农业大学学报,2012,31(3):364-370.
[13] 邵国建,吴丹青,余娟.固相萃取HPLC法测定太湖水中3种微囊藻毒素[J].中国卫生检验杂志,2011,2(1):72-75.
[14] 强俊,王辉,李瑞伟,等.低聚木糖对奥尼罗非鱼幼鱼生长、体成分和消化酶活力的影响[J].淡水渔业,2009,39(6):63-68.
[15] 胡忠泽,杨久峰,谭志静,等.姜黄素对草鱼生长和肠道酶活力的影响[J].粮食与饲料工业,2003(11):29-30.
[16] 何晓丽,周蓉,蒋晶,等.中药添加剂对鸡肠道消化酶及微生物数量影响的研究[J].天津农业科学,2008,14(1) :25-28.
[17] 陆开宏,王扬才,蔡惠凤.2种摄藻鱼消化酶活性及消化器官组织形态比较研究[J].水利渔业,2005,25(5):37-39,64.
[18] 吴伟,陈家长,冷春梅,等.溴氰菊酯对罗非鱼谷胱甘肽及S转移酶的影响[J].中国环境科学,2006,26(4):474-477.
[19] 王奇,范灿鹏,陈锟慈,等.三种磺胺类药物对罗非鱼肝脏组织中谷胱甘肽转移酶(GST)和丙二醛(MDA)的影响[J].生态环境学报,2010,19(5):1014-1019.
[20] 董桂芳,朱晓鸣,杨云霞,等.黄颡鱼饲料中添加谷胱甘肽降低藻毒素毒性作用的研究[J].水生生物学报,2010,34(4):722-730.
[21] LI F M,HU H Y.Mechanism of phyto-allelchemical and its application for harmful algae control in nature water body[J].Water wastewater engineering,2004,30(2):1-4
[22] GROSS E M.Allelopathy of aquatic autotrophs[J].Critical reviews in plant sciences,2003,22(4):313-339.
[23] LI F M,HU H Y.Isolation and characterization of a novel antialgal allelochemical fromPhragmitescommunis[J].Applied and environmental microbiology,2005,71(11):6545-6553.
[24] 张树林.中草药对铜绿微囊藻的抑制作用及机理研究[D].青岛:中国海洋大学,2011:94-100.
Effects ofCoptischinensison the Digestive Enzymes and Detoxifying Enzymes Activities of and Anti-MC-LR ofHypophthalmichthysmolitrix
HAN Guang-yao,BI Xiao,YU Fei,XIE Li-ling*et al
(Department of Biology,Shantou University,Shantou,Guangdong 515063)
Abstract[Objective] To research the effects of Coptis chinensis on the digestive enzymes and detoxifying enzymes activities of and anti-MC-LR of Hypophthalmichthys molitrix.[Method] Water extracts of C.chinensis were used as a feed additive to feed H.molitrix.Activities of digestive enzymes (lipase,amylase and pepsin) and detoxifying enzymes (glutathione,S-transferase,sGST and its substrate glutathione GSH) were detected,as well as the microcystin MC-LR content change after restriction.[Result] In ordinary water feeding,there was no significant difference (P>0.05) in administration group and control group.After putting Microcystis aeruginosa solution for 24 h,the lipase activity enhanced,but amylase activity reduced.There were extremely significant differences among groups (P < 0.01); but the activity of pepsin showed no significant differences (P > 0.05).There were no significant differences in intestinal digestive enzyme activity between administration group and control group (P > 0.05).Liver GSH and sGST activities in administration group enhanced (P <0.01),which were higher than those in control group (P<0.01). MC-LR content in M.aeruginosa cells in C.chinensis water extract group reduced by 82.4% at 120 h,that in blank group enhanced by 39.5%.[Conclusion] When H.molitrix is fed by C.chinensis under the environment of M.aeruginosa,C.chinensis significantly enhances the liver detoxification enzyme activity of H.molitri; and the viability of C.chinensis improved in water body with M.aeruginosa.
Key wordsCoptis chinensis; MC-LR; Digestive enzymes; sGST; GSH
基金项目广东省海洋渔业科技推广专项(A201005D06-2);汕头大学校内科研基金项目(NFC14003);大学生创新实验项目(2012009)。
作者简介韩光耀(1990- ),男,河北邢台人,硕士研究生,研究方向:生物活性物质。*通讯作者,副教授,硕士,从事生物化学与分子生物学研究。
收稿日期2016-03-08
中图分类号S 816.7
文献标识码A
文章编号0517-6611(2016)10-144-04

