欧盟动物源性产品中药物残留限量沿革分析
程 坚
(安徽省食品药品检验研究院,安徽合肥 230051)
欧盟动物源性产品中药物残留限量沿革分析
程 坚
(安徽省食品药品检验研究院,安徽合肥 230051)
摘要欧盟经过多年的发展,制订了《食品卫生法》等多部食品安全领域的制度法规,这些制度法规是欧盟保障食品安全的法律基础。将我国与欧盟的动物源性产品中药物残留限量进行对比分析,结合我国国情及进出口大宗动物源性产品情况,学习并借鉴欧盟的药物残留限值设置方式方法,促进我国药物残留标准体系的健全完善。
关键词欧盟;动物源性产品;药物残留限量;沿革分析
欧盟法律体系规定了动物源性产品中的药物残留限量,其主旨是严格控制动物源性产品中药物的使用、残留,确保食品的安全。笔者重点对已有限量的动物源性产品中药物种类及残留限量值进行比较分析,结合我国国情及进出口大宗动物源性产品情况,提出可以借鉴的限值设置,为今后趋利避害,健全完善我国动物源性食品中药物残留法律法规、标准体系、检测手段,提高动物源性产品质量及扩大生产出口提供参考。
1欧盟兽药残留体系概况
1.1欧盟兽药残留相关法律法规2002年的《食品法》明确提出:①一切食物都是以安全为前提。②以风险分析作为食品安全的保障。③食物链必须具有透明性。④相关机构做好监督工作,便于消费者准确了解食品详细信息。⑤生产者需对食品的每一环节层层把关,确保食品安全,如触犯法律,有连带责任。
《食品法》与《食品卫生法》等相关法律,是欧盟设定药物残留的法律根本,同时也是保证其实施的法律根基,如图1。
图1 欧盟兽药残留体系法律法规概况Fig. 1 General situation of veterinary drug residue system in EU
1.2欧盟动物源性产品中药物残留标准
1.2.12377/90/EEC指令。该指令主要内容是动物源性食品中药物残留限量制定的共同体程序;同时给动物源性食品中的残留药物分类,分别为:最高残留限量有要求的物质、禁止使用的物质等。
1.2.22002/178/EC指令。规定了保护人类健康,保护消费者食品领域的利益,保障欧盟内部市场的高效运行。
1.2.396/22/EC指令。这项指令明确提出了禁止使用的药物,包括含有激素效果的物质。
1.2.496/23/EC指令。监管目前经常出现的禁止使用物及允许使用物的错误使用现象,形成更有效率和力度的监管体系。这项政策能够帮助欧盟各成员国进行药物残留控制,避免各国直接在交易方面的冲突,我国药物控制方案参考该指令[1]。
1.3欧盟2377/90/EEC兽药残留标准欧盟理事为了管理控制动物源性产品的兽药残留,并且更安全地管理各成员国的动物交易,要求每个国家都积极响应,实施了2377/90/EEC管理制度,而且颁布了《动物源性产品中兽药残留物控制》的相关指令,各成员国都依照该政策来管理药物残留量。
2377/90/EEC指令在欧盟兽药残留标准体系中是十分关键的。它的首要任务是确保食品安全,接着才是准许商品在内部流通。
在2377/90/EEC中,许多的药理活性物质已经规定了最高残留限量,具体包括6类激素药,29种磺胺类药品,30种抗寄生虫药,39类抗生素,还有17种其他类,到2006年底,总计是121种。欧盟对于这些新增的药物,共制定了909个药物残留的限量要求。
我国对于欧盟颁布的指令做出了积极回应并且合理监控,我国的相关部门规划了总体模式,总结药物和动物的种类、靶组织,在这些方面都依照欧盟的相关指令。不仅如此,我国还运用了欧盟的测评标准以及风险分析。
2欧盟动物源性产品中药物残留对比分析
欧盟兽药种类丰富,种类划分也更加细致。另外,根据限量多少可以看出,欧盟一部分兽药及其残留限量已基本上与CAC的要求接近。从平均每年十几次的修订频率来看,欧盟是时时关注市场,并及时更改兽药残留限量。通观欧盟相关法案整体进程可以知晓,欧盟兽药最高残留限量体系已相对完善。
2.1兽药种类的变化由表1可见,2000~2003年,欧盟动物源性产品中药物种类新增了头孢乙腈(Cefacetrile)、头孢呱酮(Cefoperazone)、喹菌酮(Oxolinic acid)、乙酰异戊酰泰乐菌素(Acetylisovaleryltylosin)等30种兽药品种。在新开发的所有药品里,甾类抗炎类有1种,激素药有2种,抗生素类的有13种,而抗寄生虫的多达14种[2]。

表1 2000~2003年欧盟动物源性产品中药物种类变动
2003~2006年,欧盟将金霉素(Chlortetracycline)列为禁用,除此之外最为显著的特点是增加了多种新药。进入21世纪以来,欧盟开发出大量的新药,比如各种青霉素类和头孢类药物等。在加入2377/90/EEC附录2之前,研发药物必须依据欧盟的相关标准拟定相关程序和规范以确定最高残留限量,并进行全面的评定。在2003年以后的3年内,欧盟研发了许多兽用药物,其中有6种抗生素,分别是:头孢吡硫钠、头孢克洛干混悬剂、拉沙里霉素、土拉菌素、康丝菌素、奥索利酸;2种激素类,具体是诺孕美特、四烯雌酮;杀虫药5种:甲噻嘧啶(Morantel)、亚灭宁(Alphacypermethrin)、氯氰菊酯(Cypermethrin)、氰戊菊酯(Fenvalerate)、吡虫隆(Fluazuron);还有3种消炎镇痛药。分析2000~2006年的动物药类可以得出,欧盟研究的重点领域包括3类,即激素、抗生素和杀虫剂。
2.2兽药残留限量的变化从整体上来看,在最高残留限量上,欧盟近些年作出的改变分成3类:其一,修订了药物残留限量;其二,规定了一些新添加的药物残留限量;其三,有关兽药方面的残留限量也随动物源产品种类的增加而不断变化。
第1种将药品残留限量进行修改。从2003年开始的3年内,萘夫西林在一切“反刍动物奶”的含量标准几乎降低了10倍。头孢唑啉在2003~2006年期间添加了“绵羊的肾脏和羊奶、山羊的肾脏和羊奶、牛的肾脏”的含量为50 μg/kg,其他相关药物残留限量变化详见表2[3]。

表2 欧盟2000~2005年药物残留限量变化
第2类是新添加药物残留限量。欧盟新增了烯丙孕素、头孢洛啉、头孢匹林等15种兽药的残留限量。
第3类是关于动物种类的变化。如,自2006年以来,喷沙西林由“牛、猪”增加成“所有哺乳动物”;甲氧苄氨嘧啶由“牛、猪、家禽”发展成“所有食品生产用肌肉、肝、肾、脂肪、奶”;而头孢喹咪增加了“马科动物肉、肝、肾、脂肪”;苯氧甲基青霉素也扩展了“禽的肌肉、皮+脂肪、肝、肾”等。头孢噻呋2006年从“牛、猪”扩展为“所有哺乳动物”;达氟沙星从2000到2003年,由“牛、猪、鸡”迅速发展成“牛、绵羊、公山羊、家禽”;氟沙星也由“鸡、火鸡”很快增加成“牛、绵羊、公山羊、家禽、猪”;如表3所反映的,林可、甲砜、泰乐、双氢链、巴龙霉素以及恩诺沙星、喹菌酮、替米考星、氟苯尼考、美洛昔康、甲苯三嗪酮、氯地孕酮、伊维与多拉菌素等都对动物种类有所增加[4]。
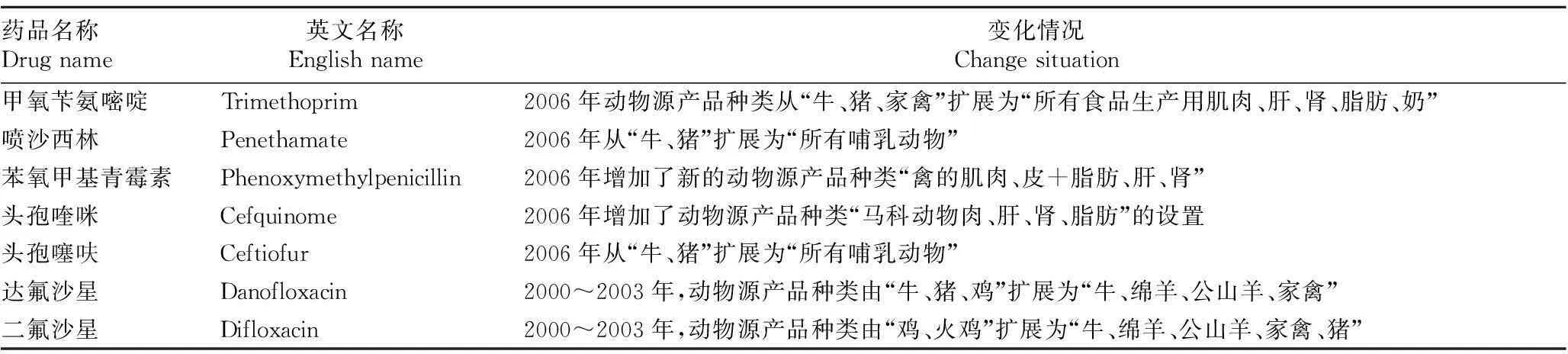
表3 欧盟2000~2006年动物源产品种类变化引起残留限量变化情况
观察2000年以后6年间的欧盟兽药残留最大值的变动情况可以看出,一是除新兽药、动物源产品品种增加会让上述最大值变动外,仅对残留限量修改的次数非常少。因为欧盟对来源于动物的商品中兽药残留评比资料十分完整,故最大值变化非常小,如巴奎普林(Ampicillin)等多个传统兽药,从2000~2006年没有变动。尤其对于一些没有经过科学检测的成分,如奈夫西林、头孢乙晴之类的,也可能是一些成分长期使用会使人类的生命受到威胁,欧盟就会对这些要求比较严格,要求这些成分占据的比例非常低,但是一旦经过科学检测是可用的,也会对这些成分的使用比例进行进一步调整。
二是在使用抗生素添加剂等药物时,我国与欧盟、日本都十分谨慎,但美国、CAC却持有不同态度。CAC觉得如果有证据表明激素对人体确实存在危险,就可以禁止应用,在我国、日本及欧盟等国家或地区在此类药的使用时也十分慎重。CAC会在激素类药品上有明文规定:“必须在国家许可的情况下才能使用,如用于保胎、呼吸疾病等,以避免药品的滥用。”如CAC规定,在牛肉和马肉中盐酸克伦特罗限量为0.2 μg/kg;我国对盐酸克伦特罗在不同的标准里有不同的要求,如我国在GB 19853—2005《原产地域产品 抚远鲟鱼子、鳇鱼子、大麻(马)哈鱼子》中,对该药物规定为“不得检出,检出限是0.01 mg/kg”,在NY/T 843—2004《绿色食品 肉及肉制品》中,对该药物规定为“不得检出,检出限<0.002 mg/kg”,在NY 5029—2001、NY 5146-2002中只规定“不得检出”,并没有明确检测限(表4)。CAC虽然允许使用,但相比CAC要求比我国更严格。

表4 我国标准对盐酸克伦特罗的不同要求
2.3动物种类及靶组织的变化2000年开始的6年内,对于动物药物遗留的物种,欧盟给出了不一样的规定,大多数是动物种类的变化。从2003~2006年则逐步凸显,由原来适用于的具体动物种类,扩展到适用这个动物所属的类群,也就是由个体增加到其对应的群体。以牛来说,就要拓展到能反刍的全部动物,其药品有:三氯苯咪唑、壮观霉素(Spectinomycin)等;从一个单一动物猪,扩展到所有的哺乳动物,具体药物有:甲苯三嗪酮(Toltrazuril)、伊维菌素等(Ivermectin),欧盟动物源性产品中药物残留涉及的动物种类基本覆盖了食用动物源性产品的种类。
欧盟2000年后每年都会对2377/90/EEC指令进行多次修订,其关键的原因是欧盟的畜牧产业发展迅速,在20世纪90年代后期,研发有关兽用的药物已经形成了相当的规模,也取得了良好的效果,自制了许多的新药品,包括各种杀虫剂、比多拉与依玛菌素等。就残留量的多少,欧盟也给出了相关的制度,然后经过测试和研讨以后就会开始实施。2000年之后,在附录1里的药物种类、药物残留相关的法律法规正在逐步健全。
3结论与讨论
我国一直是动物源性产品的生产消费大国,其相关的加工产品也有很多,随着时代的发展,除了满足内需之外,这些产品也在销往国外市场,但产品内检测出的药品残留却成为
出口的最大阻碍。该研究通过动物源性食品中药物种类、药物残留限量2个体系的纵向、横向对比分析,分析药物残留的原因。建议扩大标准覆盖范围,增强标准的系统性;清理整合国内动物源性产品药物残留检测方法标准,规范相关检测方法;注重标准的经济与贸易属性,借鉴吸收国际标准。研究可为政府相关部门统筹安排下一步工作计划,开展具有针对性的技术工作起到指导和规划作用。
参考文献
[1] 李小丽,蔡纯,陈胤瑜,等.国内外动物源性食品兽药残留法规标准研究[J].中国乳品工业,2011,39(8):37-39.
[2] 中国WTO/TBT-SPS通报咨询中心.预警通报数据库[DB/OL].(2008)[2016-01-25]. http://www.tbtsps.cn/page/tradez/WarningNews.action pageType=0.
[3] 中国WTO/TBT-SPS通报咨询中心.各国SPS通报查询数据库[DB/OL].(2008)[2016-01-25]. http://www.tbt-sps.gov.cn/tbtTbcx/getList.action pageType=2&tbtsps=2.
[4] 中国WTO/TBT-SPS通报咨询中心.各国TBT通报查询数据库[DB/OL].(2008)[2016-01-25].http://www.tbt-sps.gov.cn/tbtTbcx/getList.action pageType=0&tbtsps=1.
Evolution Analysis of Drug Residues in Animal Derived Products in EU
CHENG Jian
(Anhui Institute for Food and Drug Control, Hefei, Anhui 230051)
AbstractAfter years of development, EU establishes many laws and regulations in the field of food safety, such as Food Hygiene Law. These laws and regulations are legal basis for EU to ensure the safety of food. In this research, we compared the residue limits of Traditional Chinese Medicine in animal-source products between China and EU, so as to learn from the design method for drug residues in EU. According to the situation of main animal-source products and the current situation of China, drug residues standard system could be improved by referring to the design of limit value in EU.
Key wordsEU; Animal-source products; Drug residue limits; Evolution analysis
作者简介程坚(1962- ),男,福建闽侯人,教授级高级工程师,从事食品安全标准化研究及监测。
收稿日期2016-03-11
中图分类号S 851.34+7
文献标识码A
文章编号0517-6611(2016)10-092-03

