线粒体靶向抗肿瘤药物及其分类
潘凌立,李东巍,雷克林
(1.鄂东医疗集团黄石市中心医院(湖北理工学院附属医院)急诊科,湖北 黄石 435002;2.武汉大学化学与分子科学学院,湖北 武汉 430072;3.湖北文理学院化学工程与食品科学学院,湖北 襄阳 441053)
线粒体靶向抗肿瘤药物及其分类
潘凌立1,李东巍2,雷克林3
(1.鄂东医疗集团黄石市中心医院(湖北理工学院附属医院)急诊科,湖北 黄石 435002;2.武汉大学化学与分子科学学院,湖北 武汉 430072;3.湖北文理学院化学工程与食品科学学院,湖北 襄阳 441053)
摘要:线粒体是真核细胞重要的细胞器,在细胞代谢中发挥主要作用。线粒体与疾病的发生、发展、治疗密切相关,线粒体靶向抗肿瘤药物分子的设计和研究已成为药学、化学和生命科学等领域的关注热点。分别简述了8类线粒体靶向抗肿瘤药物的作用机制和特征,介绍了2类新型多功能线粒体靶向抗肿瘤药物,并展望了抗肿瘤药物未来的发展方向。
关键词:线粒体;靶向药物;抗肿瘤;分类
现今,恶性肿瘤已成为发展中国家死亡率第二的疾病,在发达国家中更是居于首位。随着人口老龄化的加剧以及生活方式的改变(如吸烟、缺乏锻炼、“西化”的饮食习惯等),发展中国家的肿瘤发病率逐年升高。
线粒体是细胞程序化死亡中重要的细胞器。细胞凋亡分为2条途径[1]:一条通过配体与细胞表面的死亡因子结合而引发;另一条为线粒体。在线粒体凋亡途径里,引发凋亡的早期事件之一是线粒体外膜渗透性的增强以及凋亡因子细胞色素c(Cytc)的释放,随后线粒体内的一系列事件激活了天冬氨酸蛋白家族的水解酶,最终导致细胞的部分自我消解。有关Cytc释放的机理,目前还存在较大争议。多种不同的途径,如Bak/Bax通道、线粒体渗透转换孔和膜损伤等,都会引发Cytc等凋亡因子的释放[2]。与之相反,Bcl-2和Bcl-XL会抑制凋亡程序的启动。
肿瘤细胞“逃避”死亡,特别是肿瘤细胞对自身死亡途径的阻止,是现今抗肿瘤治疗的最大难题之一[3]。因而,激活并开启肿瘤细胞死亡程序成为十分有效的抗肿瘤治疗手段。这类死亡程序由一系列代谢水解酶(大多为蛋白酶和核酸酶)组成,但由于缺少激活蛋白,这些酶的活性在多数情况下是抑制状态。
研究发现,肿瘤在基因表达水平上存在明显差异,同一类型的肿瘤在不同患者身上有着不同的突变类型,甚至在同一肿瘤上也出现了不同的突变体。国际著名学术期刊Nature也以“Cancercomplexityslowsquestforcure”[4]为题阐述了这类问题的严重性。表明,仅仅针对单独的基因或代谢途径的抗肿瘤治疗是无法解决问题的。因此,寻找一种稳定、不易突变且具有肿瘤病理学广泛适用性的靶标,是抗肿瘤治疗亟待解决的问题。
线粒体在细胞的存活和死亡过程中均起着十分重要的作用。一方面,线粒体作为“能量工厂”,是真核细胞存活时不可或缺的细胞器;另一方面,线粒体也是细胞凋亡内源途径的关键调控因素,通过调控促凋亡蛋白从线粒体膜间腔到细胞质的转运过程控制着细胞凋亡效应器的激活。另外,在多种非凋亡性细胞死亡尤其是调节性坏死过程中,线粒体也起着主要作用。因此,线粒体靶向药物代表了一种抗肿瘤治疗(特别是针对耐化疗的细胞系)的新方向。而许多被大家所忽视的化合物也重新发现了其破坏线粒体稳定并最终杀死肿瘤细胞的能力。无独有偶, 1920年提出的Warburg假说因其对线粒体靶向抗肿瘤药物分子机理的解释,再次进入了人们的视野[5]。
肿瘤细胞线粒体与正常细胞线粒体相比,在结构与功能方面均有显著差异[6]。肿瘤细胞因代谢更为活跃,较正常细胞更容易受到线粒体的影响。因此,线粒体靶向药物便成为了一种选择性靶向肿瘤细胞的手段,可以直接或间接地诱导线粒体膜渗透性转化,进而使得肿瘤相关的线粒体功能异常得到修复,并使肿瘤细胞重新开启细胞凋亡途径。这类线粒体靶向抗肿瘤药物的基本机理已经得到了广泛的研究[7]。
1常见线粒体靶向抗肿瘤药物
1.1己糖激酶抑制剂
己糖激酶(hexokinase,HK)是一种催化葡萄糖磷酸化并转化为葡萄糖-6-磷酸(G-6-P)的酶类,G-6-P作为底物进入代谢机制最终会参与ATP的合成反应(底物磷酸化)。HK在肿瘤细胞中起着非常重要的作用,HK活性与肿瘤细胞生长之间存在着直接联系。在肿瘤细胞中,HK大量表达,HK-Ⅱ型会同时与ATP和葡萄糖结合,从而导致G-6-P的大量生成;HK还与位于线粒体外膜上的电压依赖性阴离子通道(voltage-dependentanionicchannel,VDAC)胞质位点结合[8],虽然消耗了葡萄糖,但结合在线粒体上的HK却限制了细胞的呼吸作用,其不断地使葡萄糖与ATP发生磷酸化过程,从而导致氧化磷酸化过程中所需的磷酸盐缺乏,进而使细胞无法获得最大速率的呼吸状态。
如果HK与线粒体上的VDAC结合,则会抑制线粒体MPTP孔的开放,进而抑制Cytc释放等一系列的凋亡,从而达到阻止细胞凋亡的作用。因此,HK通过与肿瘤细胞线粒体的结合,不仅稳定了肿瘤细胞线粒体,抑制了肿瘤细胞的凋亡,而且还促进了肿瘤细胞的生长[9]。
2-脱氧葡萄糖(2-DG)与3-溴丙酮酸(3-BP)是两种典型的HK抑制剂。其中,2-DG的机理为抑制HK活性并发生糖酵解,从而阻止HK与VDAC的结合,促使肿瘤细胞更易受到其它治疗手段的影响[10]。2-DG与另一种糖尿病药物metformin组合使用可以促使肿瘤细胞凋亡[11],该研究现已进入临床测试阶段。3-BP是一种烷基化试剂,在肿瘤细胞中可以抑制HK活性和线粒体复合物Ⅱ。研究表明,3-BP通过与HK共价结合,促使HK与VDAC解离[12]。3-BP会促进ATP的大量消耗,导致肿瘤细胞的死亡并抑制肿瘤细胞的生长。有关3-BP的研究也已进入临床测试阶段。
1.2Bcl-2家族蛋白靶向药物
Bcl-2家族线粒体靶向药物大多模拟Bcl-2同源结构域BH3。在细胞中,当Bcl-2家族中的促凋亡蛋白大量表达时,细胞就会死亡;反之,当Bcl-2家族中的抗凋亡蛋白大量表达时,细胞就不会死亡。在肿瘤细胞中,Bcl-2家族中抗凋亡蛋白与促凋亡蛋白在它们的BH3结构域会发生相互作用,导致线粒体外膜上的促凋亡蛋白Bak/Bax无法形成较大通路和孔道[13]。若抗凋亡蛋白(如Bcl-2、Bcl-XL、Mcl-1)大量表达,便会导致肿瘤细胞逃离凋亡。因此,针对诸如BH3的类似物或能影响抗/促凋亡蛋白相互作用的小分子的研究,具有十分重要的临床医学意义[14]。
棉子酚(gossypol,图1a)是一种典型的BH3类似物,它会与BH3结构域结合从而干扰抗凋亡蛋白Bcl-2、Bcl-XL、Mcl-1与促凋亡蛋白Bak、Bax的相互作用,促凋亡蛋白Bak、Bax低聚化形成通路可激活凋亡途径[15]。研究者以棉子酚为先导化合物合成了更加有效的BH3类似物ABT-737。目前,ABT-737和其口服版本ABT-263均已进入临床测试阶段。ABT-263已成功通过淋巴癌和白血病的临床一期测试,进入临床二期的设计阶段[16]。ABT-263在实体肿瘤的临床测试方面也取得了很好的结果,其在小细胞肺癌和肺部良性肿瘤患者身上均有很好效果,这也进一步促进了此药的临床二期研究。
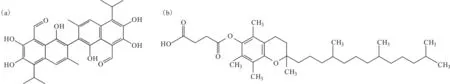
图1 棉子酚(a)与α-生育酚琥珀酸酯(b)的结构式
α-生育酚琥珀酸酯(α-TOS,图1b)是另一种促凋亡的小分子,通过与Bcl-2、Bcl-XL的BH3结合域作用,抑制Bcl-2、Bcl-XL与Bak的相互作用,从而抑制前列腺肿瘤细胞的增殖,并通过细胞凋亡进一步诱导肿瘤细胞死亡[17]。此外,α-TOS还与线粒体复合物Ⅱ的泛醌位点直接作用引发肿瘤细胞线粒体凋亡,线粒体复合物Ⅲ的Qi位点抑制剂抗霉素A也是一种BH3模拟物。从更广泛的水平上讲,靶标在线粒体电子传递链泛醌位点的化合物,也可能是一种BH3模拟物。Bcl-2家族的BH3结合位点,也可能是泛醌结合位点[18]。
1.3巯基氧化还原抑制剂
肿瘤细胞与正常细胞相比,有着更高浓度的活性氧物质(ROS)。巯基氧化还原抑制剂与VDAC/ANT靶向药物利用肿瘤细胞与正常细胞氧化还原环境的不同,即肿瘤细胞的抗氧化能力相对较弱,因而能引起细胞内氧化压力升高的化合物可导致肿瘤细胞变得容易死亡[19]。例如,能够氧化巯基及消耗线粒体内谷胱甘肽的化合物会引起肿瘤细胞的凋亡[20];三氧化二砷和以异硫氰酸苯乙酯(PEITC)为代表的异硫氰酸酯类化合物,均具有扰动细胞内氧化还原环境并最终选择性杀死肿瘤细胞的功能[21]。据报道,PEITC对耐药性白血病有十分显著的疗效。
1.4VDAC/ANT靶向药物
线粒体膜渗透转换孔复合物(PTPC)由镶嵌于线粒体外膜的VDAC与镶嵌于线粒体内膜的ANT组成。PTPC连接线粒体基质与细胞质,并调控一系列溶质与小分子(如ADP、ATP)的运输[22]。VDAC/ANT的功能紊乱会导致肿瘤细胞凋亡。调控PTPC功能的药物包括氯尼达明(lonidamine,图2)、亚砷酸盐类及以CD437为代表的类固醇相似物[23]。GSAO作为一种类固醇相似物通过与半胱氨酸残基交联来抑制ANT的功能。且GSAO只会对处于增殖状态的血管生成内皮细胞产生氧化压力并引发凋亡,而对生长抑制状态的细胞(即正常细胞)不会造成影响[24]。表明,GSAO只会以抗血管生成的方式选择性地杀死肿瘤内皮细胞。
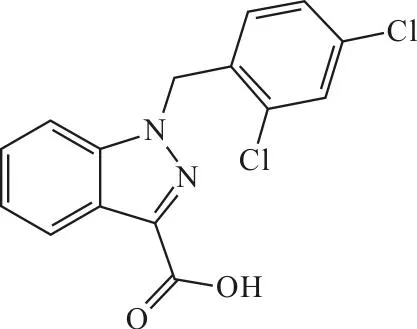
图2 氯尼达明的结构式
1.5电子氧化还原链靶向药物
电子氧化还原链靶向药物由以线粒体电子传递链复合物为靶向的化合物组成。最近有许多关于该类药物的报道[25]。
线粒体能量生产是通过电子从NADH或FADH2(TCA循环底物产生)传递到最终受体氧分子并产生水的方式实现的。线粒体电子传递链上的5种大分子蛋白质复合物嵌在线粒体内膜上,这些复合物在电子载体辅酶Q(UbQ)和Cyt c的帮助下,将电子从复合物Ⅰ和Ⅱ经Ⅲ传递到Ⅳ,以产生维持线粒体内膜两侧电化学质子梯度的能量。然后,通过这种质子梯度,电子传递链复合物Ⅴ(即F1F0-ATP酶)以ADP和磷酸为底物合成细胞基本供能物质ATP。电子的大量流动,使电子传递链成为线粒体ROS的主要来源,而复合物Ⅰ和Ⅲ被认为是最主要的超氧化物产生位点,研究表明复合物Ⅱ也起了复杂作用[26]。当ROS的产生被细胞氧化还原系统严格调控时,这种超氧化物副产物对细胞是有益无害的,因为细胞必须将ROS调控在合适的水平以维持细胞信号传递过程。然而,当这种调控能力被削弱时,长期高浓度的ROS最终会导致细胞偏向癌变[27]。相比之下,ROS浓度突然地大幅上升对细胞有更强的即时影响,而且会导致细胞凋亡。
他莫昔芬(tamoxifen,三苯氧胺)是一种通常用来治疗雌激素阳性乳腺癌细胞的药物[28],能够通过线粒体电子传递链复合物Ⅰ来诱导细胞凋亡,这种效应很可能是通过干扰线粒体内FAD结合位点引起的。近年来,对抗肿瘤药物的研究发现,维生素E类似物α-TOS能够选择性地杀死癌细胞。呼吸链复合物Ⅰ和Ⅱ很可能是α-TOS的作用位点[29]。对哺乳动物呼吸链复合物Ⅱ的晶体构型研究表明,α-TOS能够干扰复合物Ⅱ邻近和末梢的辅酶Q结合位点Qp和Qd。
Dong等[30]仿照Murphy和Smith早期对辅酶Q的工作将α-TOS用三苯基膦(TPP+)标记。结果发现,这种线粒体靶向的维生素E丁二酸钠(MitoVES)能够选择性地与线粒体结合,而且能更加有效地抑制各种癌细胞线粒体生长,其抑制能力高出没有靶向的前体1~2个数量级。小鼠临床模型研究发现,MitoVES对HER2恶性乳腺癌和结肠直肠癌表现出很强的抗癌活性。MitoVES和复合物Ⅱ的分子机制研究表明,MitoVES抑制了复合物Ⅱ上琥珀酸脱氢酶的活性(半抑制浓度约为70 μmol·L-1),同时抑制了琥珀酸醌还原酶(SQR)的活性(半抑制浓度约为1.5 μmol·L-1)。表明,MitoVES的分子靶标已经被理想放置了,这样琥珀酸脱氢酶活性受到轻微的抑制,允许柠檬酸循环进行,也就是将琥珀酸转变为延胡索酸伴随着2个电子从琥珀酸脱氢酶B上的[Fe-S]簇输送到复合物Ⅱ的线粒体内膜部分。由于MitoVES干扰了辅酶Q与琥珀酸脱氢酶C和琥珀酸脱氢酶D的结合,电子不能被拦截和形成超氧化物,也就不能通过激活Mst1激酶来诱导细胞凋亡,这样反过来磷酸化了转录因子FoxO1,引起BH3域蛋白Noxa上调,然后驱使促凋亡蛋白Bak/Bax在线粒体外膜的形成。与GSAO相似,α-TOS和MitoVES能够杀死内皮肿瘤细胞同时对正常细胞无害。这是因为,正常细胞较低的跨膜电势ΔΨm使得MitoVES不能有效地进入,加入TPP+基团后,MitoVES表现出阳离子性质,当跨膜电势ΔΨm更高时,能够有效地进入肿瘤细胞线粒体[31]。线粒体氧化还原链靶向药物加上TPP+基团是一种新的癌症治疗有效途径,TPP+标记的药物能够直接送到靶点附近,因而相当程度地增加了作用区域的药物浓度。将TPP+标记在多酚类化合物上能够诱导细胞凋亡[32]。
1.6靶向内膜的亲脂性阳离子
亲脂性阳离子能够靶向线粒体是基于线粒体内膜两侧的跨膜电位(ΔΨm,i)。肿瘤细胞线粒体相比正常细胞线粒体,由于生物功能的改变而具有非常高的线粒体膜电位[33],使得作用于线粒体内膜的线粒体靶向抗肿瘤药物更具选择性。根据能斯特定律,每增加60 mV线粒体膜电位,聚集在线粒体内膜中的亲脂性阳离子化合物浓度就会增加10倍[34]。
罗丹明-123(图3a)是最典型的亲脂性阳离子线粒体靶向抗肿瘤药物。研究表明,罗丹明-123能积聚在SCR转化细胞的线粒体中,并表现出对肿瘤细胞的选择性[35]。此后,一大批离域亲脂性阳离子试剂的线粒体靶向抗肿瘤作用逐步被发现。通过高通量筛选,一种被称为F16(图3b)的离域正电荷的线粒体靶向化合物被发现,其对HER2表达水平高的乳腺癌组织具有高效的靶向抗肿瘤作用[36]。
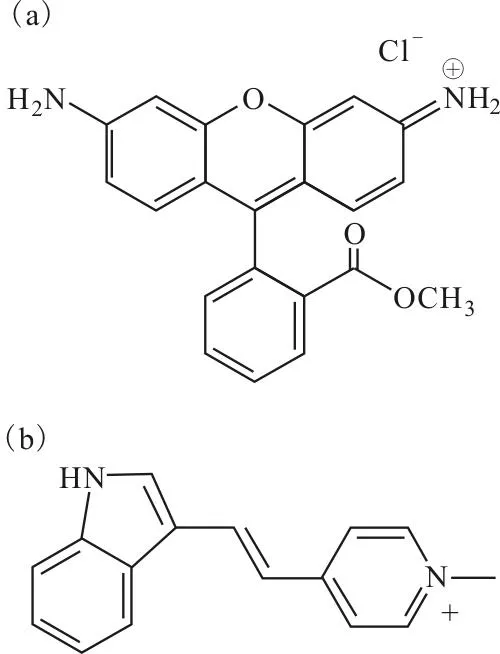
图3 罗丹明-123(a)和F16(b)的结构式
1.7三羧酸循环靶向药物
三羧酸循环(TCA)也称为柠檬酸循环或Kreb循环,是电子传递链及驱动电化学质子梯度的电子来源。柠檬酸循环的机理大致是由丙酮酸转化的乙酰辅酶A(由丙酮酸脱氢酶催化,在线粒体基质中形成)与草酰乙酸形成柠檬酸;柠檬酸经过一系列反应转变成草酰乙酸,并增加一个分子的乙酰辅酶A。在此过程中,释放电子以驱动质子浓度梯度,偶联生成ATP。柠檬酸循环中涉及到SDH(复合物Ⅱ),HK抑制剂3-BP也是SDH的抑制剂[37]。因此,3-BP同时作用于TCA循环和电子传递链。它抑制了琥珀酸盐转化为延胡索酸盐,从而减缓了TCA循环,同时也抑制了经复合物Ⅱ供给复合物Ⅲ电子的生成。
一些化合物靶向到丙酮酸转化为乙酰辅酶A的反应是丙酮酸进入线粒体和TCA循环的先决条件。催化该反应的丙酮酸脱氢酶是通过丙酮酸脱氢酶激酶(PDK)调控。PDK的抑制会导致丙酮酸脱氢酶和TCA循环活性的增加。碱性化合物二氯乙酸(DCA)能选择性地通过抑制PDK活性杀死肿瘤细胞[38]。通过促进丙酮酸脱氢酶的活性,DCA能够选择性地使肿瘤细胞代谢反应从无氧糖酵解转变为有氧糖酵解,并伴随着ΔΨm,i的减小、活性氧的产生和K+通道的打开[38]。DCA已经在临床上用于治疗有线粒体缺陷的患者,因此以其作为抗癌药物的开发过程相对较容易。
1.8线粒体DNA靶向药物
靶向线粒体DNA(mtDNA)的药物是一类线粒体靶向抗肿瘤药物。线粒体是独特的细胞器,其自身携带遗传信息并编码于一个小的圆形基因组(mtDNA)中。哺乳动物线粒体有超过16 kb的基因,其中包括参与编码13个线粒体的亚基,复合物Ⅰ、Ⅲ、Ⅳ和Ⅴ,24个tRNA,12S和16S rRNA,还包含一个D-loop区,此区对调控DNA的复制很重要[39]。
一些化合物能够干扰mtDNA的功能和稳定性,一些化合物则会影响线粒体DNA聚合酶γ的活性。如:靶向线粒体的维生素K3(甲萘醌),通过抑制线粒体DNA聚合酶γ的活性,从而诱导细胞凋亡[40]。同样的效果出现在非阿尿苷诱导线粒体结构性缺陷的过程中。通过破坏线粒体D-loop的结构,帕金森毒素1-甲基-4-苯基吡啶可以引起mtDNA的复制数目减少[41]。
2新型多功能线粒体靶向抗肿瘤药物分子
2.1新型pH敏感双功能(抗氧化、抗肿瘤)分子
现阶段很多研究都集中在开发现有抗肿瘤药物的自由基清除能力上,以期使原有的抗肿瘤药物具有新的抗氧化能力。然而,设计出一种更加直接的抗肿瘤-抗氧化的连接物小分子,迄今为止还很少报道。本课题组设计并合成了一种pH敏感的双功能(抗肿瘤、抗氧化)药物维生素E-5-氟尿嘧啶连接物,此化合物可以在酸性环境中释放并表现出抗肿瘤和抗氧化的双重活性,而在中性和碱性环境中无此活性。该研究为基于抗氧化的胃部化疗研究提供了一种潜在的思路[42]。
2.2具有荧光示踪功能的线粒体靶向抗肿瘤分子
将线粒体靶向抗肿瘤活性基团与其它小分子(如卟啉、BODIPY等)共价连接,赋予原有小分子新的线粒体靶向抗肿瘤活性,是目前靶向药物化学的研究热点之一。本课题组通过柔性连接基团将线粒体靶向抗肿瘤小分子F16与卟啉连接,但线粒体靶向效果不甚理想。基于此,将连接基团更换为共轭结构,设计并合成了一种通过苯乙炔键连接的小分子,使其具有较明显的线粒体靶向效果。实现了一个分子同时具有荧光示踪、线粒体靶向、抗肿瘤等功能[43]。
3结语
目前,已有很多以线粒体上特异结合位点为靶点或以线粒体功能结构区域为靶点,具有抗肿瘤活性的小分子化合物的研究报道。随着研究工作的深入,新的靶点将会被发现,线粒体靶向抗肿瘤药物将会被重新分类。
大部分化合物的抗肿瘤活性仅限于体外细胞水平或动物实验上,对这些化合物进行临床药效和长期作用的研究是十分必要的。
肿瘤的发生、发展机理十分复杂,影响肿瘤的因素也很多,因此,不同种类的抗肿瘤药物的联用及多功能药物分子的研发,也是抗肿瘤药物研究的发展方向之一。
参考文献:
[1]HENGARTNER M O.The biochemistry of apoptosis[J].Nature,2000,407(6805):770-776.
[2]MARTINOU J C,DESAGHER S,ANTONSSON B.Cytochrome c release from mitochondria:all or nothing[J].Nat Cell Biol,2000,2(3):E41-E43.
[3]HANAHAN D,WEINBERG R A.The hallmarks of cancer[J].Cell,2000,100(1):57-70.
[4]HAYDEN E C.Cancer complexity slows quest for cure[J].Nature,2008,455(7210):148.
[5]CAIMS R A,HARRIS I S,MAK T W.Regulation of cancer cell metabolism[J].Nat Rev Cancer,2011,11(2):85-95.
[6]GOGVADZE V,ORRERENIUS S,ZHIVOTOSKY B.Mitochondria in cancer cells:what is so special about them?[J].Trends C-ell Biol,2008,18(4):165-173.
[7]GOGVADZE V,ORRERENIUS S,ZHIVOTOSKY B.Mitochondria as targets for cancer chemotherapy[J].Semin Cancer Biol,2009,19(1):57-66.
[8]PEDERSEN P L.Voltage dependent anion channels (VDACs):a brief introduction with a focus on the outer mitochondrial compartment′s roles together with hexokinase-2 in the “Warburg effect” in cancer[J].J Bioenerg Biomembr,2008,40(3):123-126.
[9]MATHUPALA S P,KO Y H,PEDERSEN P L.Hexokinase Ⅱ:cancer′s double-edged sword acting as both facilitator and gatekeeper of malignancy when bound to mitochondria[J].Oncogene,2006,25(34):4777-4786.
[10]SIMONS A L,AHMAD I M,MATTSON D M,et al.2-Deoxy-D-glucose combined with cisplatin enhances cytotoxicityviametabolic oxidative stress in human head and neck cancer cells[J].Cancer Res,2007,67(7):3364-3370.
[11]BEN S I,LAURENT K,GIULIANO S,et al.Targeting cancer cell metabolism:the combination of metformin and 2-deoxyglucose induces p53-dependent apoptosis in prostate cancer cells[J].Cancer Res,2010,70(6):2465-2475.
[12]CHEN Z,ZHANG H,LU W,et al.Role of mitochondria-associated hexokinase Ⅱ in cancer cell death induced by 3-bromopyruvate[J].Biochim Biophys Acta,2009,1787(5):553-560.
[13]YOULE R J,STRASSER A.The Bcl-2 protein family:opposing activities that mediate cell death[J].Nat Rev Mol Cell Biol,2008,9(9):47-59.
[14]KANG M H,REYNOLDS C P.Bcl-2 Inhibitors:targeting mitochondrial apoptotic pathways in cancer therapy[J].Clin Cancer Res,2009,15(4):1126-1132.
[15]OLIVER C L,MIRANDA M B,SHANGARY S,et al.(-)-Gossypol acts directly on the mitochondria to overcome Bcl-2- and Bcl-XL-mediated apoptosis resistance[J].Mol Cancer Ther,2005,4(1):23-31.
[16]ROBERTS A W,SEYMOUR J F,BROWN J R,et al.Substantial susceptibility of chronic lymphocytic leukemia to BCL2 inhibition:results of a phase I study of navitoclax in patients with relapsed or refractory disease[J].J Clin Oncol,2012,30(5):488-496.
[17]SHIAU C W,HUANG J W,WANG D S,et al.α-Tocopheryl succinate induces apoptosis in prostate cancer cells in part through inhibition of Bcl-XL/Bcl-2 function[J].J Biol Chem,2006,281(17):11819-11825.
[18]NEUZIL J,DONG L F,RAMANATHAPURAM L,et al.Vitamin E analogues as a novel group of mitocans:anti-cancer agents that act by targeting mitochondria[J].Mol Aspects Med,2007,28(S5/6):607-645.
[19]HUANG P,FENG L,OLDHAM E A,et al.Superoxide dismu-tase as a target for the selective killing of cancer cells[J].Nature,2000,407(6802):390-395.
[20]FULDA S,GALLUZZI L,KROEMER G.Targeting mitochondria for cancer therapy[J].Nat Rev Drug Discov,2010,9(6):447-464.
[21]TRACHOOTHAM D,ZHOU Y,ZHANG H,et al.Selective ki-lling of oncogenically transformed cells through a ROS-mediated mechanism byβ-phenylethyl isothiocyanate[J].Cancer Cell,2006,10(3):241-252.
[22]ZHIVOTOVSKY B,GALLUZZI L,KEPP O,et al.Adenine nucleotide translocase:a component of the phylogenetically conserved cell death machinery[J].Cell Death Differ,2009,16(11):1419-1425.
[23]BELZACQ A S,HAMEL E C,VIEIRA H L,et al.Adenine nucleotide translocator mediates the mitochondrial membrane permeabilization induced by lonidamine,arsenite and CD437[J].Oncogene,2001,20(52):7579-7587.
[24]DON A S,KISKER O,DILDA P,et al.A peptide trivalent arsenical inhibits tumor angiogenesis by perturbing mitochondrial function in angiogenic endothelial cells[J].Cancer Cell,2003,3(5):497-509.
[25]FULDA S,GALLUZZI L,KROEMER G.Targeting mitochondria for cancer therapy[J].Nat Rev Drug Discov,2010,9(6):447-464.
[26]RALPH S J,MORENO-SANCHER R,NEUZIL J,et al.Inhibitors of the succinate:quinine reductase/complex Ⅱ regulate production of mitochondrial reactive oxygen species and protect normal cells from ischemic damage but induce specific cancer cell death[J].Pharm Res,2011,28:2695-2730.
[27]MURPHY M P.How mitochondria produce reactive oxygen species[J].Biochem J,2009,417(1):1-13.
[28]HIGGINS M J,STEARNS V.Pharmacogenetics of endocrine th-erapy for breast cancer[J].Annu Rev Med,2011,62(1):281-293.
[29]SANTOS G A,ABREU L R S,PESTANA C R,et al.(+)α-Tocopheryl succinate inhibits the mitochondrial respiratory chain complex Ⅰ and is as effective as arsenic trioxide or ATRA against acute promyelocytic leukemiainvivo[J].Leukemia,2012,26(3):451-460.
[30]DONG L F,JAMESON V J A,TILLY D,et al.Mitochondrial targeting of vitamin E succinate enhances its pro-apoptotic and anticancer activityviamitochondrial complex Ⅱ[J].J Biol Ch-em,2011,286(5):3717-3728.
[31]ROHLENA J,DONG L F,KLUCKOVA K,et al.Mitochondrially targetedα-tocopheryl succinate is antiangiogenic:potential benefit against tumor angiogenesis but caution against wound healing[J].Antioxid Redox Signal,2011,15(12):2923-2935.
[32]SASSI N,BIASUTTO L,MATTAREI A,et al.Cytotoxicity of a mitochondriotropic quercetin derivative:mechanisms[J].Biochim Biophys Acta,2012,1817(7):1095-1106.
[33]MODICA-NAPOLITANO J S,APRILLE J R.Basis for the selective cytotoxicity of rhodamine 123[J].Cancer Res,1997,47(16):4361-4365.
[34]WANG F,OGASAWARA M A,HUANG P.Small mitochondri-atargeting molecules as anti-cancer agents[J].Mol Aspects Med,2010,31(1):75-92.
[35]LAMPIDIS T J,BEMAL S D,SUMMERHAYES I C,et al.Selective toxicity of rhodamine 123 in carcinoma cellsinvitro[J].Cancer Res,1983,43(2):716-720.
[36]FANTIN V R,BERARDI M J,SCORRANO L,et al.A novel mitochondriotoxic small molecule that selectively inhibits tumor cell growth[J].Cancer Cell,2002,2(1):29-42.
[37]SUN F,HUO X,ZHAI Y,et al.Crystal structure of mitochondrial respiratory membrane protein complex Ⅱ[J].Cell,2005,121:1043-1057.
[38]BONNET S,ARCHER S L,ALLALUNIS-TUMER J,et al.A mitochondria-K+channel axis is suppressed in cancer and its normalization promotes apoptosis and inhibits cancer growth[J].Cancer Cell,2007,11(1):37-51.
[39]ANDERSON S,BANKIER A T,BARRELL B G,et al.Sequence and organization of the human mitochondrial genome[J].Nature,1981,290(5806):457-465.
[40]SASAKI R,SUZUKI Y,YONEZAWA Y et al.DNA Polymerase gamma inhibition by vitamin K3 induces mitochondria-mediated cytotoxicity in human cancer cells[J].Cancer Sci,2008,99(5):1040-1048.
[41]UMEDA S,MUTA T,OHSATO T,et al.The D-loop structure of human mtDNA is destabilized directly by 1-methyl-4-phenylpyridinium ion (MPP+),a parkinsonism-causing toxin[J].Eur J Biochem,2000,267(1):200-206.
[42]LI D W,TIAN F F,GE Y S,et al.A novel pH-sensitive (±)-α-tocopherol-5-fluorouracil adduct with antioxidant and anticancer properties[J].Chem Commun,2011,47(38):10713-10715.
[43]HE H,LI D W,YANG L Y,et al.A novel bifunctional mitochondria-targeted anticancer agent with high selectivity for cancer cells[J].Scientific Reports,2015,5:13543.
Anti-tumour Drug Targeting to Mitochondrion and Its Classification
PAN Ling-li1,LI Dong-wei2,LEI Ke-lin3
(1.DepartmentofEmergency,HuangshiCenterHospital(AffiliatedHospitalofHubeiPolytechnicUniversity),EdongHealthcareGroup,Huangshi435002,China;2.CollegeofChemistryandMolecularSciences,WuhanUniversity,Wuhan430072,China;3.SchoolofChemicalEngineeringandFoodScience,HubeiUniversityofArtsandScience,Xiangyang441053,China)
Abstract:Mitochondrion is an important organelle in eukaryotic cells and plays a central role in cellular metabolism.The mitochondria are closely related to the occurrence,development and treatment of diseases.Design and research on anti-tumour drug molecules targeting to mitochondrion have become a hotspot in pharmacy,chemistry and life sciences,etc..In this paper,interaction mechanism and characteristics of eight species of anti-tumour drugs targeting to mitochondrion are introduced.Two species of new multifunctional anti-tumour drugs targeting to mitochondrion are also introduced.And the directions for future development of anti-tumour drugs are prospected.
Keywords:mitochondrion;targeting drug;anti-tumour;classification
基金项目:湖北省自然科学基金资助项目(2013CFC027)
收稿日期:2016-01-17
作者简介:潘凌立(1969-),女,湖北阳新人,副主任医师,研究方向:内科学、药物化学,E-mail:pll-3@163.com;通讯作者:雷克林,教授,E-mail:kelinlei@yeah.net。
doi:10.3969/j.issn.1672-5425.2016.05.002
中图分类号:R 730
文献标识码:A
文章编号:1672-5425(2016)05-0006-06

