抗停乳链球菌GapC1-150aa单克隆抗体的制备及生物活性
魏玉华,张丽萌,周雪,樊自尧,于永忠,吴志军,孙虎男,于立权,崔玉东(.黑龙江八一农垦大学动物科技学院,大庆6339;.黑龙江八一农垦大学生命科学技术学院)
抗停乳链球菌GapC1-150aa单克隆抗体的制备及生物活性
魏玉华1,张丽萌1,周雪2,樊自尧2,于永忠2,吴志军2,孙虎男2,于立权2,崔玉东2
(1.黑龙江八一农垦大学动物科技学院,大庆163319;2.黑龙江八一农垦大学生命科学技术学院)
摘要:为了深入研究停乳链球菌GapC蛋白的抗原性,用原核表达的GapC免疫优势片段—GapC1-150aa蛋白免疫BALB/c小鼠,采用杂交瘤技术制备获得3株抗停乳链球菌GapC1-150aa蛋白不同表位的单克隆抗体1F2、1E11和5B7。经鉴定确定,3株单抗均IgG1亚型,其轻链均为κ链,3株单克隆抗体均能与停乳链球菌、无乳链球菌和乳房链球菌的GapC发生特异性反应而不与其他细菌蛋白发生反应,均具有显著的调理活性,并且具有一定的被动免疫保护作用。
关键词:停乳链球菌;GapC;单克隆抗体
奶牛乳房炎是公认的对奶牛业造成惨重损失的重要疾病之一,不仅发病率比较高,且常常是反复发生,严重危害奶牛的健康并影响乳制品的质量[1-3]。随着抗生素的大量使用以及耐药菌株的出现,使奶牛乳房炎防治变得尤为困难。引起奶牛乳房炎的主要病原菌为无乳链球菌、停乳链球菌、乳房链球菌、金黄色葡萄球菌和大肠杆菌等,其中3种链球菌引起的奶牛乳房炎能够占到发病率的30%以上。研究表明[4],停乳链球菌GapC蛋白作为一种保护性抗原能够有效地预防停乳链球菌、乳房链球菌和无乳链球菌引起的感染,具有交叉免疫保护作用,且GapC1-150aa是GapC蛋白的免疫优势片段。但有关链球菌抗原检测鉴定和GapC1-150aa免疫优势片段的抗原性缺乏研究。为此,研究制备和筛选了停乳链球菌GapC1-150aa蛋白的3株单克隆抗体,并深入研究了其生物学特性,为进一步研究停乳链球菌GapC1-150aa蛋白的B细胞表位和建立以单抗为基础的链球菌快速检测及鉴别诊断方法提供依据。
1 材料和方法
1.1菌株和质粒
E.coli DH5α、BL21(DE3)、S.dysgalactiae、S.a-galactiae和S.uberis由实验室提供;重组菌Rosetta (DE3)/pET-32a(+)/gapC1-150aa、Rosetta(DE3)/pET-30a (+)/trap、Rosetta(DE3)-/pET32a(+)/gapc、Rosetta (DE3)/pQE30/isdA、BL21(DE3)/pET-32a(+)/clfA、BL21(DE3)/pET-32a(+)/can、BL21(DE3)/pET-32a (+)/fnbpA、BL21(DE3)/pET30a-GapC和BL21(DE3)/pET32a-GapC由黑龙江八一农垦大学生命科学技术学院细胞生物学实验室构建保存。
1.2实验动物及细胞
6~8周龄SPF级雌性BALB/c小鼠和骨髓瘤细胞SP2/0均由中国农业科学院哈尔滨兽医研究所提供。
1.3主要试剂
培养基改良型RPMI-1640购自Therom公司;胎牛血清购自GIBCO公司;蛋白Marker购自Fermentas公司;融合剂PEG1500/DMSO、HRP标记的羊抗鼠IgG、弗氏完全佐剂(CFA)和弗式不完全佐剂(IFA)和氨苄青霉素购自Sigma公司;Ni-NTA His-Band Resin购自Novagen公司;单克隆抗体亚类鉴定试剂盒购自Southern Biotech公司。
1.4抗原制备与动物免疫
将Rosetta(DE3)/pET32a(+)/gapC1-150aa重组菌划线接种于含有氨苄青霉素抗性的LB琼脂平板,37℃恒温过夜培养,次日挑取单菌落接种于含100 μg·mL-1Amp的LB液体培养基中,37℃180 rpm振荡培养至OD600值为0.5~0.6,加入终浓度为100 μg·mL-1的IPTG诱导3 h。取诱导后的菌液,离心收集菌体,并用PBS清洗3次,以40%的功率并破碎10 s停10 s的方法进行超声破碎,4℃12 000 rpm离心30 min,收集上清。按照Ni-NTA His-Bind Resin试剂盒说明书纯化蛋白,然后进行SDS-PAGE电泳。
按Sanyal等方法[5],选取6~8周龄的雌性BALB/c小鼠,三次免疫剂量均为每只小鼠100 μg Gapc1-150aa蛋白,采用背部皮下多点注射,首次免疫注射将蛋白溶液与完全弗氏佐剂等体积乳化,此后两次免疫注射用弗式不完全佐剂乳化,每次免疫间隔2周;三次免疫之后的第10 d检测抗体水平,效价达到1∶10 000以上时可用于细胞融合。在进行融合细胞的前3 d,以纯化的重组蛋白50 μg腹腔注射单独抗原对小鼠进行加强免疫。将免疫后小鼠的脾细胞与SP2/0按照一定比例融合,然后用选择培养基进行筛选。
1.5MAb亚类的鉴定
按照Southern Biotech公司亚类鉴定试剂盒进行鉴定。
1.6间接ELISA
用一定浓度的纯化后抗原蛋白100 μL包被96孔酶标板,4℃条件下包被过夜。用PBST洗涤3次,用5%脱脂乳作为封闭液,封闭1 h,用PBST洗涤5次,以筛选的阳性杂交瘤细胞上清为一抗,SP2/0作为一抗阴性对照,每孔加入100 μL,在37℃培养箱中孵育1 h,用PBST洗涤5次,用HRP标记的羊抗鼠IgG(1∶5 000)100 μL为二抗,同样在37℃培养箱中孵育1 h,在用PBST洗涤5次,采用TMB显色,于波长450 nm测定OD值,阳性血清孔的OD450 nm值接近1.0,阴性血清OD450 nm值<0.2,P/N>2.1判为阳性[6]。
1.7Western blot分析
将纯化的重组蛋白与5×SDS-PAGE Loading Buffer按一定比例混合,使蛋白浓度达到1 μg·μL-1,在沸水浴中3 min后,吸取5 μL,在浓缩胶为5%和分离胶为12%的聚丙烯酰胺凝胶中进行蛋白质电泳,浓缩胶和分离胶分别以80 V和120 V的电压进行电泳,结束后转印到NC膜,以110 mA的稳流进行75 min的转膜[7],转印结束后,用含5%的脱脂奶粉进行封闭2 h,PBST(Tween-20,0.05%)洗涤3次,加入三种单抗的腹水和SP2/0腹水,室温感作1 h,PBST洗涤3次,然后加入HRP标记的羊抗鼠IgG (1∶5 000),室温感作1 h,PBST洗涤3次,用3,3′二氨基联苯胺(DAB)底物溶液进行显色,蒸馏水终止反应。
1.8单抗的调理活性检测
首先将小鼠巨噬细胞系RAW264.7细胞调整到2×105个·mL-1,分别将细胞分到6孔细胞板中,放入37℃、5%CO2培养箱中培养2 h,备用。将甘油保存的停乳链球菌LS0312株、无乳链球菌LS0310株、乳房链球菌SD0306株细菌分别在BHI培养板上划线37℃培养,第二天挑取单菌落接入2 mL无抗性液体BHI培养基中培养至OD600 nm值为0.5~0.6,将这三种链球菌按照1∶100接入200 mL BHI液体培养基中扩大培养后,通过倍比稀释进行平板计数。将大量培养的细菌用PBS洗涤3次后,用DMEM重悬分装到离心管中,将细菌量浓度调整为1×108cfu·mL-1,每管200 μL菌液。将单抗各10 μg加入含有200 μL细菌管中,在37℃培养箱中共孵育培养15 min。然后将每200 μL混合液加入每个贴壁的6孔细胞培养板的实验孔中,在37℃、5%CO2的细胞培养箱中共培养30 min,促进吞噬。30 min后从培养箱中取出6孔板,用无菌的PBS反复洗涤并倒掉上清液体,加入冰浴的去离子水2 mL,在室温条件下放置30 min,促使细胞溶解。最后吹打6孔板中的细胞裂解物,按1∶10,1∶100,1∶1 000进行系列稀释,取出100 μL涂BHI培养板计数。
1.9小鼠被动免疫保护作用试验
将培养的新鲜菌液收集离心,用无菌PBS洗3次,通过平板计数后,用无菌PBS将细菌稀释为6× 108cfu·mL-1,备用。选择6~8周龄的雌性BALB/c小鼠,分为5组,即每株单抗为一组,共三组;另设GapC1-150aa血清阳性对照组和SP2/0上清阴性对照组。每组10只小鼠,每只小鼠尾静脉注射单抗200 μg,24 h之后通过腹腔注射菌液100 μL,每天观察小鼠攻毒后死亡情况。
2 结果
2.1MAb杂交瘤细胞株的建立
分别以纯化的0.5 μg Gapc1-150aa和FnBPA(含有与Gapc1-150 aa相同标签作为阴性对照)作为包被抗原包被酶标板,用间接ELISA检测杂交瘤细胞生长孔上清,被检抗体效价大于阴性对照OD450 nm值2倍以上者判为阳性,经3次克隆化筛选获得了3株能稳定分泌抗GapC1-150 aa蛋白的MAb杂交瘤细胞株,分别命名为1F2、1E11和5B7;给每只BALB/c小鼠腹腔注射0.5 mL弗式不完全佐剂,7天后每只小鼠注射杂交瘤细胞5×106个,待小鼠腹部膨大后抽取腹水,用间接ELISA测定抗体效价,结果腹水效价均能达到1∶128 000。
2.2MAb亚型鉴定
按照Southern Biotech公司亚类鉴定试剂盒对MAb的亚型进行鉴定,结果为3株单克隆抗体的重链均为IgG1、轻链均为κ链,经进一步表位鉴定,三株单抗针对的表位序列分别为为TRINDLT、TGFFASK、DTTQGRFDGT。
2.3单抗分泌的稳定性
以0.5 μg·孔-1的GapC1-150 aa蛋白为抗原包被酶标板,通过间接ELISA方法检测原始和冻存后的杂交瘤细胞上清,结果原始杂交瘤细胞单抗效价为1∶2 560、1∶640和1∶320,冻存后杂交瘤细胞上清效价均为1∶320,原始杂交瘤细胞经过体外连续传代10代以上,单抗效价不变,证明筛选出的三株杂交瘤细胞具有稳定分泌抗体的能力。
2.4抗体特异性检测
分别以0.5 μg·孔-1的重组GapC1-150 aa蛋白和金黄色葡萄球菌的ClfA、Trap、FnBPA、IsdA以及Cna蛋白作为抗原包被酶标板,用间接ELISA检测3株单抗与各抗原的反应,以确定单抗的特异性。结果,三株单抗均能与重组GapC1-150aa蛋白发生特异性反应,而与金黄色葡萄球菌ClfA、Trap、FnBPA、IsdA以及Cna蛋白均不发生反应,表明实验得到的3株单克隆抗体是针对GapC1-150aa蛋白。
为了鉴定所获得的三株MAb的特异性,将重组GapC1-150aa蛋白进行SDS-PAGE电泳,以三株单抗作为一抗进行western blot检测,同时设和SP2/0上清作为对照。三株单抗杂交瘤细胞分泌上清均与GapC1-150aa蛋白发生反应,在约35KD处出现特异性条带,而SP2/0则没有反应。在此基础上,进一步用western blot方法检测了三株单抗与停乳链球菌GapC、停乳链球菌GapC1-150aa、无乳链球菌GapC、乳房链球菌GapC以及金黄色葡萄球菌GapC的特异性反应,结果,获得的三株MAb均能与停乳链球菌、无乳链球菌、乳房链球菌的GapC蛋白和停乳链球菌GapC1-150aa蛋白发生特异性反应,但不与金黄色葡萄球菌的GapC蛋白发生反应,详见图1。
2.5单抗相对亲和能力
以2 μg·mL-1浓度的GapC1-150aa蛋白(100 μL·孔-1)抗原包被酶标板,分别将3株单抗稀释成0.5 μg·mL-1、0.25 μg·mL-1和0.125 μg·mL-1的浓度作为一抗进行ELISA检测。结果所获得的三株单抗均具有较强的亲和能力,结果详见图2。
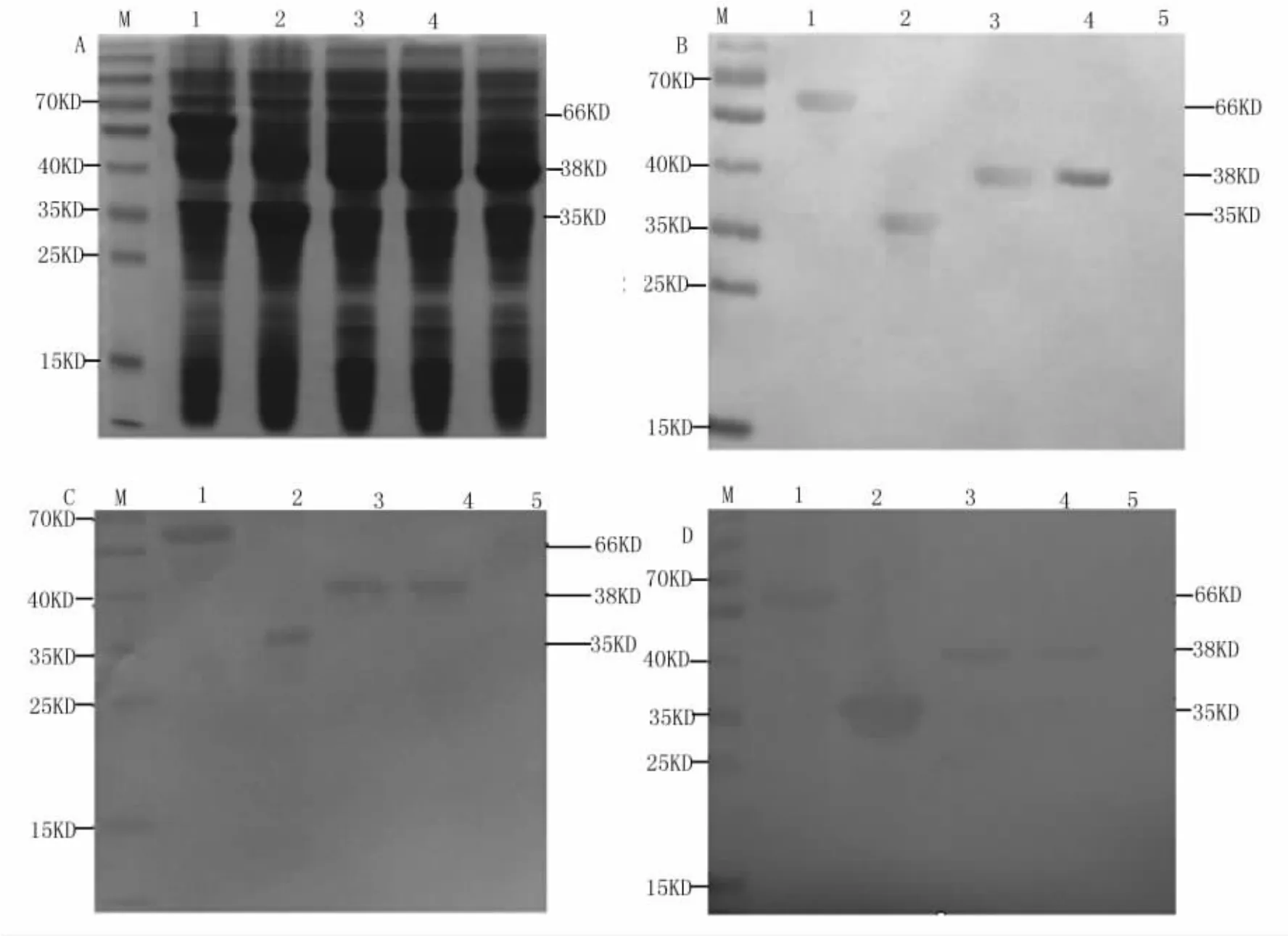
图1 3株单抗与不同菌株GapC之间的交叉反应Fig.1Cross reaction between 3 McAbs and recombinant GapC from different strains
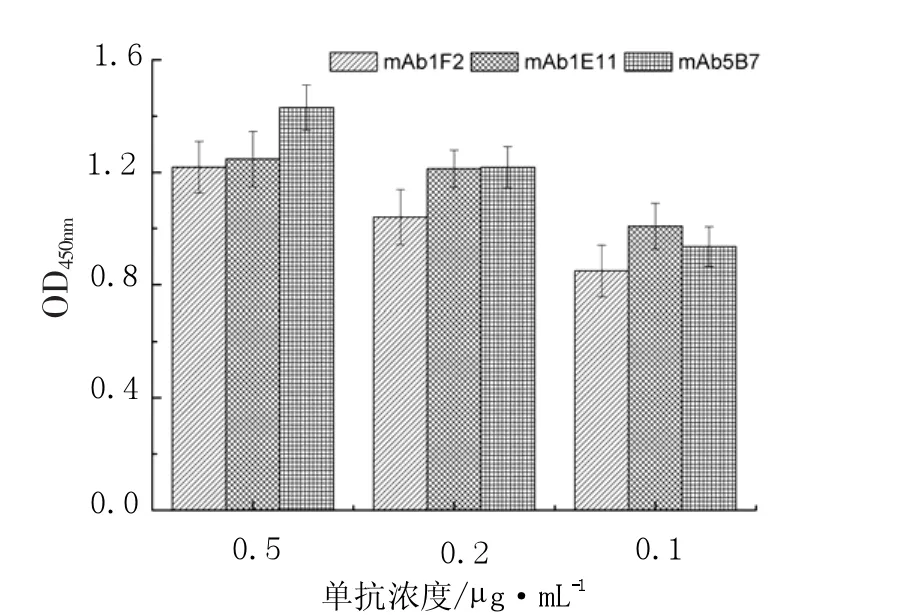
图2 单抗亲和能力的测定Fig.2Affinity of monoclonal antibodies
2.6单抗与全菌体反应
用培养4 h小时的停乳链球菌、无乳链球菌和乳房链球菌全菌体以108cfu·mL-1的浓度作为抗原包被酶标板(100 μL·孔-1),分别以单抗1F2、1E11、5B7、抗GapC1-150aa血清和抗Trap单抗作为一抗,进行全菌体ELISA检测。结果,1F2、1E11与阴性对照组差异显著,而5B7与阴性对照组差异极显著,结果详见图3。结果说明这三株单抗均与全菌体发生结合,也说明三株单抗所对应的抗原位点位于菌体表面。
2.7单抗的调理活性
为了检测单抗的调理功能,我们分别用三株单抗与停乳链球菌、无乳链球菌和停乳链球菌进行调理吞噬试验。结果,三株单抗1F2、1E11和5B7对三种链球菌的调理作用与阴性对照相比差异显著,但弱于GapC1-150aa的调理作用,结果详见图4。说明三株单抗1F2、1E11和5B7具有明显的调理活性。

图3 3株单抗与3种不同链球菌的全菌体反应Fig.3 ELISA results of 3 MAb and 3 different Streptococcus
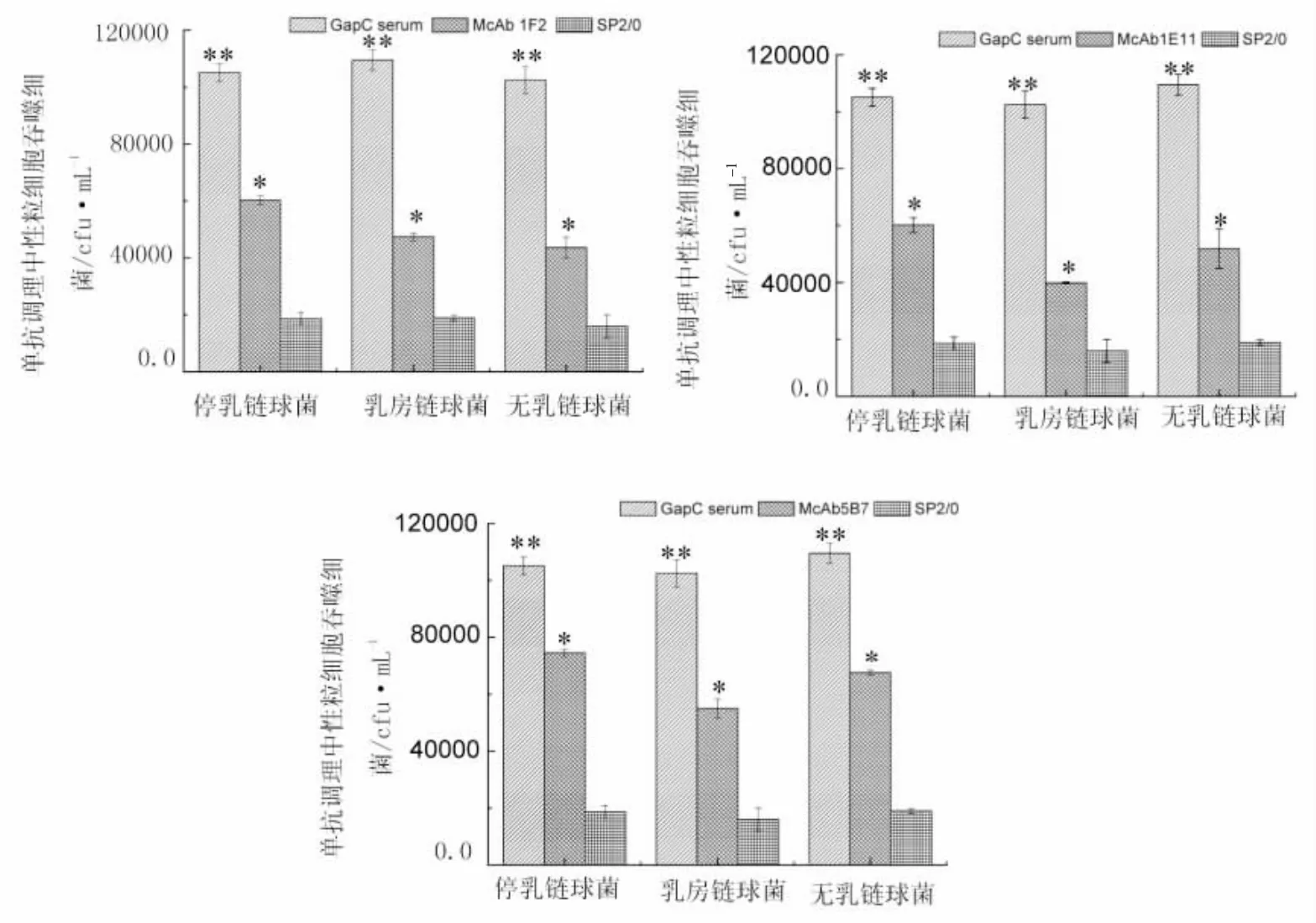
图4 3株单抗对3种链球菌的调理吞噬结果Fig.4Opsonization of three mAbs to different streptococcus
2.8单抗的被动免疫保护作用
为了检测三株单抗在体内的是否能够为机体提供抗链球菌感染作用,用小鼠采进行了被动免疫保护试验。结果,SP2/0腹水对照组小鼠在致死性攻毒后17 h全部死亡,而单抗1F2组小鼠在致死性攻毒后存活36 h,单抗1E11组小鼠在致死性攻毒后存活34 h,单抗5B7组小鼠在致死剂量攻毒后存活44 h, GapC1-150aa抗血清组小鼠存活96 h,说明3株单克隆抗体在体内对链球菌感染具有一定的抑制作用,如表1所示。

表1 实验小鼠S.dysgalactiae LS0312株攻毒后存活时间Table 1Survival time of mice to S.dysgalactiae LS0312
3 讨论
甘油醛-3-磷酸脱氢酶(glyceraldehyde-3-phosphate dehydrogenase,GAPDH)是生物能量代谢途径中的关键酶,它将可逆性的转化为1,3-二磷酸甘油酸,具有转铁蛋白活性和纤溶酶活性,转铁蛋白为链球菌提供铁离子,纤溶酶结合有利于葡萄球菌侵入宿主的组织细[8-9]。有研究证明存在高度保守的GAPDH活性蛋白有两种:GapC和GapB蛋白,所有的链球菌中都含有GapC基因,它的GAPDH活性能够刺激T、B细胞的增殖和分化,增加细胞因子IL-10和CD69的表达,对细菌的生存起到很重要的作用[9-10]。已有研究表明乳房链球菌GapC蛋白对小鼠进行免疫,对乳房链球菌的保护率高达70%,而全菌体免疫组的保护率仅为30%,表明GapC蛋白具有很高的免疫原性[11]。本文筛选出抗停乳链球菌GapC1-150aa三株单克隆抗体,单克隆抗体的初步纯化主要用饱和辛酸—硫酸铵沉淀法,然后利用rProteinG试剂盒对筛选出的三株单克隆抗体进行进一步纯化,纯度能达到95%以上。实验通过间接ELISA和Western blot实验方法说明,筛选出的1F2、1E11和5B7单克隆抗体对GapC1-150aa具有特异性,并且三株单克隆抗体能够与三种链球菌的GapC发生特异性反应,说明在停乳链球菌GapC1-150aa上的三株单抗所针对的抗原位点在引起奶牛乳房炎的三种链球菌中高度保守,而且位于菌体表面,是引起机体长生抗体应答的重要抗原位点[12],通过比较停乳链球菌、无乳链球菌和乳房链球菌GapC的氨基酸序列显示,三种链球菌GapC氨基酸序列高度保守,其同源性分别为90%、93%和94%。该研究所获得的三株单克隆抗体可用于检测和鉴定奶牛乳房炎链球菌病原菌的感染,因此具有重要应用价值;而且三株单抗可用于进一步研究和鉴定奶牛乳房炎链球菌GapC抗原的B细胞抗原表位,为进一步研究预防链球菌感染引起的奶牛乳房炎表位疫苗提供一定的基础。
抗体功能研究显示,三株单克隆抗体具有较高的相对亲和活性和显著的调理作用,能够介导明显的吞噬细胞吞噬细菌;被动免疫保护实验证明三株单抗在小鼠体内具有一定的抵抗链球菌感染的能力。这些结果进一步说明,该三株单抗和其对应的抗原表位具有深入研究和开发应用价值。因此,对奶牛乳房炎的防治中始终坚持“预防为主,治疗为辅”的基本原则,从安全、经济、高效等多方面因素积极考虑,采取科学、合理、规范、严格的综合防治措施,才能从根本上预防奶牛乳房炎的发生[13]。
参考文献:
[1]Keefe G P.Streptococcus agalactiae mastitis:a review[J]. Can Vet J,1997,38(7):429-437.
[2]Kossaibati M A,Esslemont R J.The costs of production diseases in dairy herds in England[J].Vet J,1997,154 (1):41-51.
[3]程振涛,奶牛隐性乳房炎的诊断方法与细菌学研究[J].贵州:贵州大学,2006.
[4]Yu L,Fan Z,Ma J,et al.Cross-protective effect of a novel multi-antigen-chimeric vaccine against Streptococcus and Staphylococcus aureus infection in mice[J].J Med Microbiol.,2014,63(12):1732-1740.
[5]Sanyal A,Venkataramanan R,Pat tnaik B.Antigenic feat ures offoot-and-mouth disease virus serotype Asial as revealed by monoclonal antibodies and neut ralization-escape mutants[J].Virus Research,1997(4):168-173.
[6]陆桂丽.鸡传染性贫血病毒VP2蛋白单克隆抗体的制备与鉴定[J].中国兽医科学,2007,37(5):396-400.
[7]杜红丽,王嵩,王宇鹏,等.干酪乳杆菌表面展示IBDV VP2蛋白[J].黑龙江八一农垦大学学报,2014,26(5):39-43.
[8]Rosey E L,Lincoln R A,Ward P N,et al.PauA:a novel plasminogen activator from Streptococcus uberis[J].FEMS Microbiol Lett,1999,178(1):27-33.
[9]Fang W,Oliver S P.Identification of lactoferrin-binding proteins in bovine mastitis-causing Streptococcus uberis [J].FEMS Microbiol Lett,1999,176(1):91-96.
[10]Goji N,Potter A A,Perez-Casal J.Characterization of two proteins of Staphylococcus aureus isolated from bovine clinical mastitis with homology to glyceraldehyde-3-phosphate dehydrogenase[J].Vet Microbiol,2004,99(3-4):269-279.
[11]Madureira P,Baptista M,Vieira M,et al.Streptococcus agalactiae GAPDH is a virulence-associated immunomodulatory protein[J].J Immunol,2007,178(3):1379-1387.
[12]张辉.奶牛乳房炎性链球菌GapC重组蛋白的免疫保护性研究[J].中国预防兽医学报,2014,10(36):810-812.
[13]叶倩.奶牛乳房炎防治的研究进展[J].现代畜牧兽医,2014(1):59-61.
Preparation and Biological Activities of 3 Monoclonal Antibody Strains Against GapC1-150aafrom Streptococcus dysgalactiae
Wei Yuhua1,Zhang Limeng1,Zhou Xue2,Fan Ziyao2,Yu Yongzhong2,Wu Zhijun2,Sun Hunan2,Yu Liquan2,Cui Yudong2
(1.College of Animal Science and Technology,Heilongjiang Bayi Agricultural University,Daqing 163319;2.College of Life Science and Technology,Heilongjiang Bayi Agricultural University)
Abstract:In order to futher study the antigenicity of GapC1-150aafrom Streptococcus dysgalactiae,three monoclonal antibodies (McAbs)specific to GapC1-150aafrom Streptococcus dysgalactiae were developed by cell fusion with the BALB/c mice immunized with purified prokaryotic expression GapC1-150aaprotein based on indirect-ELISA.The specific study demonstrated that 1F2,1E11 and 5B7 were identified as subclass IgG1 and the light chain belongs κ chain.Results of western-blotting with purified GapC from three dysgalactiae indicated that the McAbs 1F2,1E11 and 5B7 had specific characters against GapC while they had no reactivity with other proteins.Passive immunity protection experiment had proved that 3 McAb can provided a degree of protection.
Key words:Streptococcus dysgalactiae;GapC;monoclonal antibody
中图分类号:S852.655
文献标识码:A
文章编号:1002-2090(2016)01-0053-06
doi:10.3969/j.issn.1002-2090.2016.01.012
收稿日期:2015-03-06
作者简介:魏玉华(1989-),女,黑龙江八一农垦大学动物科技学院2012级硕士研究生。
通讯作者:崔玉东,男,教授,博士研究生导师,E-mail:1016856109@qq.com。

