产绿原酸内生菌细胞色素P450基因的克隆和功能研究
王川李丽魏丕伟黄非
(1. 四川理工学院生物工程学院,自贡 643000;2. 四川大学生命科学学院,成都 610064)
产绿原酸内生菌细胞色素P450基因的克隆和功能研究
王川1李丽1魏丕伟1黄非2
(1. 四川理工学院生物工程学院,自贡 643000;2. 四川大学生命科学学院,成都 610064)
以一株产绿原酸的内生枯草芽孢杆菌为基础,对其绿原酸途径的关键酶基因进行克隆和功能研究。克隆该内生菌的细胞色素P450基因并进行原核表达,对重组蛋白进行肉桂酸羟基化酶(C4H)酶活测定。结果显示,从内生菌中克隆了4个细胞色素P450酶系基因并进行了原核表达,其中P-4重组蛋白具有C4H活性,产生的香豆酸与LC-MS检测的结果一致,该酶的最适温度范围较宽,产物香豆酸对该酶有抑制作用。该内生菌可能利用其细胞色素P450酶系作为C4H的同工酶从而将产物导入绿原酸合成途径。
绿原酸;细胞色素P450;C4H;表达;活性
内生菌是一种几乎存在于所有植物,且不引起植物外在病害症状的微生物。已有的研究表明,一些药用植物中的内生菌可产生与宿主相同或相似的活性成分[1],因此内生菌可能具有与植物大致相同的代谢途径和相应的酶类,这就使内生菌成为了开发药用植物功能基因的新资源。绿原酸是多种药用植物中的活性成分,在绿原酸合成途径中,有两步羟基化反应,分别是肉桂酸羟基化生成对香豆酸和香豆酰奎尼酸羟基化生成绿原酸,由肉桂酰羟基化酶(C4H)和香豆酰3'-羟基化酶(C3'H)催化,这两种酶均属于植物细胞色素P450体系,是合成绿原酸途径的限速酶[2]。细胞色素P450广泛存在于动植物及细菌、真菌中,P450催化的反应广泛而复杂,包括羟化、环氧化、去烷基化、磺化等氧化反应和异构化、脱水等还原反应,在植物的次生代谢物的合成方面有非常重要的功能[3-5]。
目前对植物P450的研究较多,而对原核生物P450的研究还处在起步阶段,报道较少,本研究以一株分离自金银花的产绿原酸的内生枯草芽孢杆菌为基础,从该内生菌中克隆出细胞色素P450的几种同工酶基因,并进行基因的表达和功能研究,旨在了解该内生菌的绿原酸代谢途径特点,为该内生菌的进一步利用奠定理论基础。
1 材料与方法
1.1 材料
1.1.1 材料 内生枯草芽孢杆菌RP1(GenBank 登录号:KF053071)由本实验室分离并保存,大肠杆菌BL21(DE3)、pET28a质粒、E. coli JM109 化学感受态细胞。
1.1.2 试剂 胶回收试剂盒,Omega;内切酶Nhe I、Sac I,T4连接酶,Fermentas;pMD19-T vector,EX Taq 及PCR试剂,TaKaRa;IPTG,Amresco;Taq酶及试剂、BCA蛋白定量试剂盒、质粒小量提取试剂盒,Tiangen;Ni-His亲和层析柱,Merk;引物由上海英潍捷基公司(invitrogen)合成。
TEGN缓冲液:20 mmol/L Tris-HCl(pH 7.0),5 mmol/L EDTA(pH8.0),5% 甘油,50 mmol/LNaCl。Binding buffer:0.5 mol/L NaCl,200 mmol/L Tris-HCl,5 mmol/L 咪唑 pH 7.9。Wash buffer:0.5 mol/L NaCl,200 mmol/L Tris-HCl,60 mmol/L 咪唑 pH 7.9。Elute buffer:0.5 mol/L NaCl,10 mmol/L Tris-HCl,1mol/L咪唑 pH7.9。
1.1.3 仪器 PCR仪,电泳仪(Biorad)。
1.2 方法
1.2.1 内生菌P450基因的克隆 内生菌枯草芽孢杆菌RP1基因组DNA提取采用DNA提取试剂盒提取。由于在枯草芽孢杆菌中没有C3'H和C4H的同名或同源基因的报道,因此通过比对几种植物中C3'H和C4H的活性中心保守片段,确定了枯草芽孢杆菌的4个功能近似的单氧化酶基因,在此基础上设计引物如表1。
PCR反应条件如下:94℃ 变性5 min;94℃ 30 s,56℃ 30 s,72℃ 2 min,5 个循环;94℃ 30 s,53℃ 30 s, 72℃ 2 min,5个循环;94℃ 30 s,50℃ 30 s,72℃2 min,20个循环;72℃ 10 min;16℃保温。扩增产物经琼脂糖凝胶电泳检测后以胶回收试剂盒回收。回收片段连接pMD19-T 载体,连接产物转化E. coli JM109 感受态细胞,以菌落PCR筛选,阳性子送上海华津生物公司测序。

表1 引物序列
1.2.2 P450基因原核表达载体的构建 测序正确的阳性子以质粒提取试剂盒提取质粒,将质粒与载体pET28a分别以Nhe I和Sac I双酶切过夜,酶切产物以T4连接酶连接后转化E. coli JM109感受态细胞,以菌落PCR筛选阳性子并进行双酶切验证,构建4个P450-pET28a原核表达载体。
1.2.3 P450基因的表达和纯化 提取阳性子质粒转化E. coli BL21(DE3)细胞,转化子接种于LB液体培养基,30℃培养至OD600≈ 0.4-0.6,以250 μmol/L IPTG 诱导并在18℃培养12 h,菌液经TEGN缓冲液重悬后以溶菌酶破碎30 min,取上清进行SDS- PAGE电泳检测重组蛋白表达情况。重组蛋白以镍亲和层析柱进行纯化,依次以Binding buffer,Wash buffer和Elute buffer洗脱,纯化蛋白经SDSPAGE检测后以20 mmol/L Tris-HCl(pH7.5)加5%甘油透析过夜,以BCA蛋白定量试剂盒测定含量。
1.2.4 P450重组蛋白的酶学性质 对纯化的4个P450重组蛋白进行C4H活性测定,C4H活性测定按文献[4]进行略有改动,测定肉桂酸羟基化后NAPDH在340 nm下的吸光值变化,2 mL反应体系如下:50 mmol/L Tris-HCl(pH8.0),20 μmol/L肉桂酸,20 μmol/L NADPH,5 μL纯化蛋白,以10 μL水为空白对照,加入酶后立即测定OD340值,30℃反应30 min后测定OD340值。将在该测定条件下每分钟催化反应消耗1 μmol NADPH所需要的酶量定义为1个酶活性单位。
米氏常数的确定:设置不同肉桂酸浓度(2、5、10、20、25、35和50 μmol/L)下反应测定OD340变化,以双倒数作图法确定酶促反应的Km值和Vmax。
酶促反应的影响因素:上述反应体系分别置于不同温度、不同pH,以及加入不同体积的纯化蛋白或不同浓度的香豆酸,测定相应酶活力,确定酶促反应的最适温度、最适pH,以及酶浓度和产物浓度对酶促反应的影响。
2 结果
2.1 内生菌RP1的P450基因的克隆
从内生枯草芽孢杆菌RP1中提取基因组,以该基因组DAN为模板,以引物1,2,3,4通过PCR扩增获得了内生枯草芽孢杆菌RP1的4个相应的目标基因(图1),分别为P-1,P-2,P-3和P-4。测序结果表明4个目标基因大小分别为1 294 bp(P-1),1 109 bp(P-2),1 217 bp(P-3)和1 190 bp(P-4),符合预期片段大小。GenBank比对结果显示,4个目标基因均属于细胞色素P450家族。其中P-1与Bacillus subtilis的细胞色素P450(Cytochrome P450)有99%相似性。P-2基因与Bacillus subtilis的细胞色素P450 YjiB(Cytochrome P450 YjiB)有99%相似性。P-3基因与Bacillus subtilis的细胞色素单氧化酶(monooxygenase)有99%相似性,P-4基因Bacillus subtilis的 细 胞 色 素P450 YjiB(Cytochrome P450 YjiB)有98%相似性,这表明目标基因克隆成功,以上4个基因的GenBank登录号分别为KC561925,KC561926,KC561927,KC561928。
2.2 内生菌P450同工酶基因的原核表达和纯化
将各P450同工基因片段和表达载体pET28a构建成重组表达载体,经NheⅠ和SacⅠ双酶切验证,得到分别与载体pET28a和各基因片段大小相符的两条带(图2),表明各P450同工基因的重组表达载体构造成功。
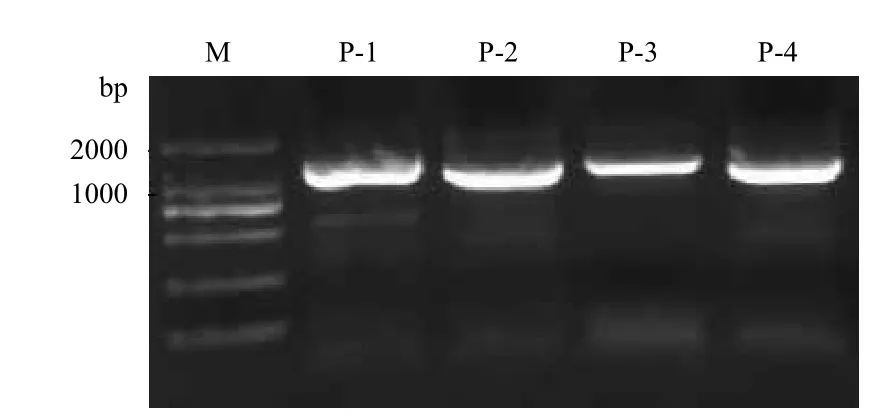
图1 内生菌细胞色素P450基因克隆

图2 重组质粒pET28a-P450酶切鉴定
将连接成功的表达载体转化大肠杆菌BL21,经IPTG诱导后,以SDS-PAGE电泳检测,结果(图3)显示,在诱导条件下,4个P450同工基因的表达载体均获得了符合预期分子量大小的重组蛋白,而对应的非诱导条件和pET28a/BL21空白裂解液,均未出现目的重组蛋白,这表明重组蛋白表达成功,4种P450同工酶蛋白均可进行可溶性表达。进一步对4种同工蛋白进行镍亲和层析纯化,结果(图4)显示纯化成功,对4种重组蛋白经BCA蛋白定量分别为 342 μg/mL(P-1)、403 μg/mL(P-2),331 μg/mL(P-3),375 μg/mL(P-4),纯化的蛋白用于酶活测定。
2.3 P450重组蛋白的酶学性质
对4种P450重组蛋白的酶活性测定结果表明,反应体系中加入P-1、P-2和P-3三种重组蛋白后的OD340没有变化,因而没有C4H活性。而P-4重组蛋白显示出了C4H活性,其Km值和Vmax分别为5.6 μmol/L和2.08 μmol/min,为米氏酶。P-4重组蛋白酶的最适合温度的范围比较广,在25-40℃之间(图5),最适pH为7.5,耐受酸碱的能力较弱(图6)。酶促反应随酶浓度先增加后降低,在酶浓度达到一定程度后,反应速度趋于稳定(图7)。反应产物对香豆酸对酶促反应有反馈抑制作用,在对香豆酸低浓度时抑制作用较弱,产物达到一定浓度(100 μmol/L)能大大降低酶活力(图8)。P-4蛋白序列经比对为属于枯草芽孢杆菌细胞色素P450家族,与枯草芽孢杆菌的P450YjiB有98%相似性,以上活性测定结果表明内生枯草芽孢杆菌RP1可能通过属于P450酶系的P-4蛋白的C4H活性进行绿原酸合成途径的肉桂酸羟基化反应,P-4基因可能是植物的C4H基因的同工酶基因。

图3 四种重组蛋白不同条件的表达

图4 重组蛋白P450的纯化
3 讨论

图5 重组蛋白P-4的最适温度

图6 重组蛋白P-4的最适pH

图7 酶浓度对重组蛋白P-4活性的影响
在植物中,绿原酸主要由苯丙氨酸通过苯丙烷途径产生,其中苯丙烷途径的两步羟基化反应分别由属于植物细胞色素P450体系的肉桂酰羟基化酶(C4H)和香豆酰3'-羟基化酶(C3'H)催化,这两种酶具有功能上的相关性,是苯丙烷途径合成绿原酸的限速酶,目前对细胞色素P450的研究多集中在对植物来源的P450的克隆和表达,而对细菌来源的P450的研究较为缺乏。本研究以一株分离自金银花的产绿原酸的内生枯草芽孢杆菌RP1为对象,通过以枯草芽孢杆菌上的4个单氧化酶基因为基础设计引物,克隆的4个基因均属于枯草芽孢杆菌细胞色素P450家族,对4个基因的原核表达产物也符合预期蛋白大小。其中重组蛋白P-4具有肉桂酸4-羟基化酶(C4H)的活性,该酶的最适温度范围较宽,从25℃到40℃的活力都维持在较高的水平,这个结果与已报道的一些植物的C4H的性质相似[6,7]。同时,通过添加不同浓度的酶和产物香豆酸,表明重组蛋白P-4的C4H活性能够被产物反馈抑制,这个结果也与多数报道中的植物C4H相一致[7,8]。在一些植物中,苯丙烷途径的苯丙氨酸解氨酶(PAL)和C4H共同构成一个调控复合体,在植物遇到环境胁迫时能被诱导协同表达,在这个调控系统中,香豆酸也是催化第一步反应的苯丙氨酸解氨酶的抑制剂,因此苯丙烷途径受PAL,C4H活性的双重调控[9-11]。由于C4H产生的香豆酸可以进入各分支途径,产生各种活性物质,因此内生菌采用与植物相似的策略,通过产物浓度对苯丙烷途径前两步酶的调控,能更好的分配碳流,以应对环境的胁迫。
原核生物的P450是一个多功能酶系,能够催化羟化、氧化、脱水等多种反应,该内生枯草芽孢杆菌正是以P450酶系的P-4作为C4H的同工酶,通过其C4H活性进行苯丙烷途径的肉桂酸羟基化反应产生香豆酸,最终产生绿原酸,这符合在RP1发酵液中检测到的肉桂酸和香豆酸的结果。但另外的3个P450酶是否具有C3'H活性,需要进一步实验进行验证。本课题组在以往的研究中,已确定了该内生菌通过组氨酸解氨基酶(HAL)双功能活性中的苯丙氨酸解氨基酶活性来使产物进入苯丙烷途径[12],本研究结果则证实,内生菌进一步利用细胞色素P450家族的酶作为同工酶进行绿原酸合成的C4H反应。
从以上研究结果来看,从产绿原酸的内生枯草芽孢杆菌中克隆得到的两个基因都具有绿原酸合成途径的关键酶(PAL和C4H)基因活性,产生的相应催化产物(肉桂酸和香豆酸)也与对内生菌发酵液的LC-MS检测结果一致,这说明该内生菌的绿原酸合成途径可能与植物的相似。内生菌基因组远比植物小,相比植物庞大的基因组以及大量的备用基因资源,内生菌可供利用的资源极其有限,利用同工酶和多功能酶的形式,内生菌就可以在专用酶分化较少的情况下,合成一些次生代谢产物以应对环境变化的胁迫。这可能是由于和植物长期共生的内生菌通过基因水平的传递,从植物中获取了相应的基因功能片段[13,14],是内生菌长期和植物共生进化而来的策略。

图8 产物香豆酸浓度对重组蛋白P-4活性的影响
4 结论
通过对一株产绿原酸的内生枯草芽孢杆菌的P450基因的克隆和功能研究,表明该内生菌能利用其细胞色素P450酶系作为C4H的同工酶从而形成绿原酸合成的前导物——对香豆酸。
这种方式是内生菌扩大基因功能的一种策略,同时也表明该内生菌可能具有和植物相似的绿原酸合成途径。
[1] Ambrose C, Varghese C, Subhash JB. Endophytic bacteria as a source of novel antibiotics:An overview[J]. Pharmacognosy Reviews, 2013, 7(13):11-16
[2]Niggeweg R, Michael AJ, Martin C. Engineering plants with increased levels of the antioxidant chlorogenic acid[J]. Nature Biotechnology, 2004, 22(6):746-754.
[3]McDonnell AM, Dang CH. Basic review of the cytochrome P450 system[J]. Journal of the Advanced Practitioner in Oncology, 2013, 4(4):263-268.
[4]Urlacher VB, Girhard M. Cytochrome P450 monooxygenases:an update on perspectives for synthetic application[J]. Trends inBiotechnology, 2012, 30(1):26-36.
[5]Huang Y, Jiang HB, Shen GM, et al. Molecular characterizations of two cytochrome P450 genes encoding CYP6A41 and CYP 6EK1 from the oriental fly, Bactrocera dorsalis(Diptera:tephritidae)[J]. Archieves of Insect Biochemistry and Physiology, 2012, 79(1):31-46 .
[6]Hübner S, Hehmann M, Schreiner S, et al. Functional expression of cinnamate 4-hydroxylase from Ammi majus L[J]. Phytochemistry, 2003, 64(2):445-452.
[7]Kim J, Choi B, Natarajan S, Bae H. Expression analysis of kenaf cinnamate 4-hydroxylase(C4H)ortholog during developmental and stress responses[J]. Plant Omics, 2013, 6(1):65-72 .
[8]Zhao H, Lu J, Lü S, et al. Isolation and functional characterization of a cinnamate 4-hydroxylase promoter from Populus tomentosa[J]. Plant Science, 2005, 168(5):1157-1162.
[9]梁良, 韩晓敏, 张争, 郭庆梅, 等. 白木香肉桂酸-4-羟基化酶(C4H)基因的克隆及表达分析[J]. 中国中药杂志, 2014, 39(10):1767-1771.
[10] Baldoni A, Von Pinho EVR, Fernandes JS, et al. Gene expression in the lignin biosynthesis pathway during soybean seed development[J]. Genetics and Molecular Research, 2013, 12(3):2618-2624.
[11]Bell-Lelong DA, Cusumano JC, Meyer K, et al. Cinnamate-4-hydroxylase expression in Arabidopsis. Regulation in response to development and the environment[J]Plant Physiology, 1997, 113(3):729-738.
[12]王川, 李丽, 魏丕伟, 黄非. 产绿原酸内生菌的分离及绿原酸合成途径关键基因的克隆和功能研究[J]. 微生物学通报, 2015, 42(10):1888-1894.
[13]翟中和. 细胞生物学[M]. 北京:高等教育出版社, 1995
[14]Omacinia M, Semmartin M, Pérez LI, Gundel PE. Grass-endophyte symbiosis:A neglected aboveground interaction with multiple belowground consequences[J]. Applied Soil Ecology, 2012, 61(5):273-279.
(责任编辑 李楠)
Cloning and Function of Gene for Cytochrome P450 from a Chlorogenic Acid-producing Endophytic Bacterium
WANG Chuan1LI Li1WEI Pi-wei1HUANG Fei2
(1. College of Bioengineering,Sichuan University of Science & Engineering,Zigong 643000;2. College of Life Sciences,Sichuan University,Chengdu 610064)
Based on a chlorogenic acid-producing endophytic Bacillus subtilis,cloning and function of a key gene in the synthetic pathway of chlorogenic acid was studied. The cytochrome P450 gene of the endophyte was cloned and expressed in prokaryotic vector,and the cinnamate 4-hydroxylase(C4H)activity of the recombinant proteins were determined. Four cytochrome P450 genes were cloned and expressed in prokaryotic vector,and the recombinant protein P-4 presented C4H activity. The coumarate produced by the C4H activity was the same as the result measured by LC-MS. The activity of P-4 existed in a broad optimal temperature and was inhibited by product coumarate. It is supposed that,taking cytochrome P450 as isozyme of C4H,the endophyte led the product coumarate to the synthetic pathway of chlorogenic acid.
chlorogenic acid;cytochrome P450;C4H;expression;activity
10.13560/j.cnki.biotech.bull.1985.2016.06.026
2015-10-27
四川省教育厅理工科重点项目(14ZA0211)
王川,男,博士,研究方向:资源微生物,生物反应器;E-mail:watpc57944@163.com

