DC-CIK细胞联合化疗治疗非小细胞肺癌的近期疗效观察
吴梅 魏思亮 王效静
DC-CIK细胞联合化疗治疗非小细胞肺癌的近期疗效观察
吴梅 魏思亮 王效静
目的 探讨DC-CIK细胞治疗联合化疗在治疗非小细胞肺癌中的临床意义。方法 随机选取70例非小细胞肺癌患者,分为实验组(35例,行DC-CIK细胞治疗联合TP方案化疗)和对照组(35例,单纯行TP方案化疗)。观察2组患者治疗前后的影像学判定有效率(response rate,RR)及临床获益率(clinical benefit rate,CBR)、卡式评分及主要并发症改善情况、外周血T细胞亚群结果。DC、CIK细胞由自体外周血单核细胞诱导而成,应用流式细胞术检测外周血T细胞亚群。结果 实验组影像学判定有效率与临床获益率高于对照组(P﹤0.01)。实验组生活质量及主要并发症改善情况高于对照组(P﹤0.01)。实验组T细胞亚群:CD3+、CD3+CD8+、CD3+CD4+、CD3-CD16+CD56+、CD3+CD16+CD56+高于对照组(P﹤0.01);CD4+CD25+低于对照组(P﹤0.01)。较治疗之前,治疗组治疗15天后CD3+、CD3+CD4+、CD3+CD8+、CD3-CD16+CD56+、CD3+CD16+CD56+升高,到60天时,维持在较高水平;CD4+CD25+在治疗15天时降低,到60天时维持在较低水平。结论 DC-CIK细胞治疗联合化疗对于改善非小细胞肺癌患者免疫功能状况、提高生活质量,增加临床疗效方面具有积极意义。
肺癌;生物治疗;树突状细胞;细胞因子诱导的杀伤细胞
目前,肺癌的发病率和死亡率在世界各国均呈明显的上升趋势,是我国最常见的恶性肿瘤之一。手术治疗、放疗、化疗及分子靶向治疗等已使肿瘤缓解率有所提高,但肺癌患者的总体生存率并无明显改善,五年生存率仍不足15%[1]。有研究发现肺癌的发生与患者机体免疫功能下降有密切关系[2]。因此细胞免疫生物治疗已成为当今肺癌综合治疗的重要组成部分。本研究通过DC-CIK(dendritic cells-cytokine induced killer cells)细胞免疫生物治疗联合化疗治疗中晚期非小细胞肺癌(non-small cell lung cancer)患者,观察治疗前后患者免疫功能指标的动态变化,原发病灶和转移灶的改变,患者生存质量的改善等。 探讨细胞免疫生物治疗联合化疗在治疗非小细胞肺癌中,改善患者生活质量、增强免疫功能、延长生存期和提高肿瘤综合治疗疗效中的意义。
1 资料与方法
1.1 一般资料 按在本科入院顺序选取经病理证实、卡氏评分>60分、预计生存期大于3个月的中晚期NSLC患者70例,随机分为实验组对和照组,每组35例。实验组为生物治疗加TP方案化疗,对照组单纯行TP方案化疗。2组患者资料差异无统计学意义。见表1。

表1 入组患者基本临床资料(n)
1.2 主要仪器及试剂 COBE-Spectra血细胞分离机,美国Terumo公司产品;Guava easycyte流式细胞仪,美国默克密理博公司产品;流式检测试剂盒,CD3、CD4、CD8、CD56、CD25单抗,美国BD公司。
1.3 DC-CIK制备 由本院生物中心制备并提供,方法同参考文献[3]。
1.4 治疗方法 2组患者入院后完成常规检查的同时,先作T细胞亚群检测,以备对照。实验组于检查完成后先行静脉采血,开始DC-CIK细胞培养,次日行化疗;第11天皮下注射DC细胞1×107,第12~16天每天静脉输注CIK细胞4×109,21天为1个周期,4周期后开始疗效评估。对照组常规静脉化疗4个周期后开始进行疗效评估。伴胸水的患者实验组在抽胸水后以
CIK细胞4×109胸腔内灌注,对照组于抽胸水后以80 mg顺铂加50 mL生理盐水胸腔内灌注。
1.5 影像学判定客观缓解率 参照WHO对实体瘤近期疗效评价标准,分为完全缓解(CR)、部分缓解(PR)、无变化(SD)和进展(PD),以CR+PR统计客观缓解率(OR)。
1.6 生活质量及主要并发症的评估:生活质量按国际通用的Karnofsky评分评价,主要并发症按治疗前后临床表现资料判定。
1.7 免疫功能评估 患者分别于治疗结束后第15 d、30 d和60 d抽血行T细胞亚群检测,观察CD3+(总T细胞)、CD3+CD8+(细胞毒T细胞)、CD3+CD4+(辅助性T细胞)、CD4+/CD8+(Th/Ts比值)、CD4+CD25+(调节T细胞)、CD3-CD16+CD56+(自然杀伤细胞NK)、CD3+CD16+CD56+(NK-T细胞)值,并与治疗前指标进行对照。
1.8 统计学方法 所有数据采用SPSS 17.0统计分析软件进行处理,率的比较采用χ2检验,以P<0.05为差异有统计学意义。
2 结果
2.1 2组患者影像学判定近期客观缓解率 经影像学检查,实验组35例患者中,完全缓解9例,部分缓解17例,稳定6例,恶化3例。有效率(response rate,RR)为74.2%,临床获益率(clinical benefit rate,CBR)为91.4%;而对照组35例患者中完全缓解6例,部分缓解12例,稳定9例,恶化8例,有效率为
51.4 %,临床获益率为77.1%。实验组有效率和临床获益率显著高于对照组(P﹤0.01)。见表2。
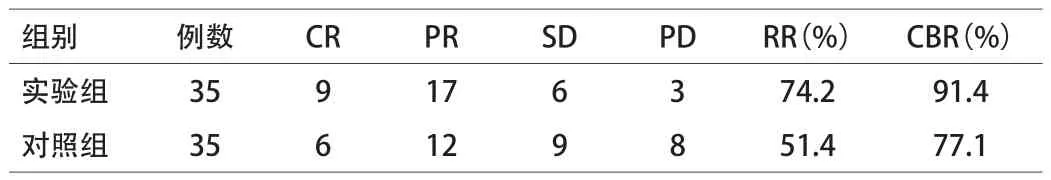
表2 实验组与对照组近期客观缓解率(n)
2.2 患者生活质量及主要并发症改善情况 实验组35例患者治疗后Karnofsky评分增加10分以上的27例(77.1%),对照组为24例(68.5%),实验组高于对照组,但差异无统计学意义。NSLC伴脑转移患者实验组7例,对照组8例经上述治疗加头部放疗后病变都得到控制,颅内高压表现消退,无统计学意义。NSLC伴胸水实验组13例,经治疗后胸水全部消退,有效率
100%;对照组12例,经治疗后8例胸水消退,有效率为66.6%,差异有统计学意义(P<0.01)。NSLC伴肝转移实验组6例经治疗后2例转移灶完全消失,3例转移灶缩小,大的转移灶缩小超过50%,1例转移灶进展,有效率为83.3%;对照组4例肝转移治疗后1例转移灶消失,2例稳定,1例进展,有效率为25%,2组比较差异有统计学意义(P<0.01)。
2.3 免疫学评价 实验组治疗后外周血T细胞亚群改变情况见图1。35例患者CD3+:治疗后15、30、60天分别是(43.7±2.14)、(52.1±6.95)、(53.6±6.06),与治疗前(38.5±2.8)比较有所升高并且差异有统计学意义(P<0.01)。CD3+CD8+:治疗后15、30、60天分别是(25.5±3.09)、(31.1±4.56)、(33.3±5.75),与治疗前(14.8±2.7)比较有所升高并且差异有统计学意义(P<0.01)。CD3+CD4+:治疗后15、30、60天分别是:(18.2±3.86)、20.8±6.82)、(20.3±4.7)与治疗前(19.4±2.7)比较有所升高,但差异无统计学意义。CD4+CD25+:治疗后15、30、60天分别是:(8.4±1.3)、(7.2±1.4)、(6.7±1.5)与治疗前(6.7±1.5)比较有所升高并且差异有统计学意义(P<0.01)。CD3-CD16+CD56+:治疗后15、30、60天分别是:(15.9±2.07)、(16.8±2.6)、(18.9±2.07)与治疗前(12.2±2.3)比较有所升高并且差异有统计学意义(P<0.01)。CD3+CD16+CD56+:治疗后15、30、60天分别是:(2.8±1.46)、(4.0±1.7)、(4.2±1.69)与治疗前(2.0±1.06)比较有所升高并且差异有统计学意义(P<0.01)。对照组治疗后外周血T细胞亚群检测结果与治疗前比较差异无统计学意义。实验组与对照组各亚群检测结果对照见表3。

图1 实验组治疗前后T细胞亚群检测结果
3 讨论
非小细胞肺癌是常见的肺部恶性肿瘤,全身化疗带来的毒副作用是治疗不易延续的重要原因之一。寻求新的综合抗肿瘤途径,以延长进展期肺癌患者的生成期、改善生存质量,具有非常积极的意义。近年随着分子生物学的发展,免疫治疗已成为肿瘤治疗的新方法。肿瘤生物免疫治疗具有符合生理、低毒和有效的特点,有着巨大的临床研究和应用价值,是未来肿瘤治疗的发展方向。树突状细胞(dentritic cell,DC)和细胞因子诱导的杀伤细胞(cytokine induced killers,CIK)是肿瘤细胞免疫治疗的两种重要细胞,前者识别抗原,激活获得性免疫应答,后者通过细胞毒作用和分泌细胞因子杀伤肿瘤细胞,两者联合可高效杀伤肿瘤细胞[4]。
DC是体内功能最强的抗原提呈细胞(antigen precenting cells,APC)。成熟的DC是唯一能激活幼稚T淋巴细胞的专职抗原提呈细胞,在诱导高效而特异的抗肿瘤免疫中起关键作用[5]。DC是启动、调控并维持免疫应答的中心环节,有研究表明,包括肺癌在内的恶性肿瘤患者体内往往存在DC功能缺陷,无法有效地提呈肿瘤抗原给T细胞,造成了免疫忽视或免疫逃逸[6],是肿瘤发生发展和恶化的重要免疫学基础。CIK是一类非主要组织相容性复合物(MHC)和非T细胞受体(T cell receptor,YCR)限制性的免疫活性细胞[7]。CIK细胞含有大量的分泌颗粒,当与靶细胞结合后,CIK细胞脱颗粒,释放其中的穿孔素和颗粒酶,前者在靶细胞膜上形成穿膜样结构,从而改变细胞的渗透压和通透性;后者具有胰蛋白酶等丝氨酸蛋白酶的特性,同时表达酶活性破坏细胞膜结构,以上两者的共同作用可导致肿瘤细胞坏死[8]。因此,目前DC、CIK细胞是肿瘤过继免疫治疗的首选方案,它可以在不损伤机体免疫系统结构和功能的前提下,直接杀伤肿瘤细胞,调节和增强机体的免疫功能,产生持久的抗肿瘤作用,清除微小残留灶,成为肿瘤手术、放化疗后的重要辅助治疗用段。而化疗可以最大限度地减少肿瘤细胞,达到肿瘤负荷与T细胞应答之间的平衡,使之有利于T细胞作用。化疗可以用来改变肿瘤微环境,以利于维持有效的抗肿瘤免疫应答。化疗可以用来选择全身性免疫调节通路,以使免疫最大化和/或效应T细胞扩增。
研究显示:DC、CIK细胞免疫生物治疗联合化疗组四疗程后,影像学客观评价其有效率和临床获益率显著高于对照组,差异有统计学意义(P<0.05)。生活质量及主要并发症改善情况高于对照组。实验组35例患者CD3+、CD3+CD8+、CD3-CD16+CD56+、CD3+CD16+CD56+分别于治疗后15天开始上升,1个月后维持在较高水平,与对照组比较差异有统计学意义(P<0.05)。CD3+CD4+:治疗后与治疗前比较有所升高,但差异无统计学意义;CD4+CD25+:治疗后15天回调到正常水平,60天时仍保持稳定状态,显著优于对照组。结果表明:接受DC、CIK治疗的实验组患者特异性和非特异性免疫功能均增强,临床有效率提高,且无毒副作用。提示DC-CIK细胞治疗联合化疗对于改善非小细胞肺癌患者免疫功能状况、提高生活质量,增加临床疗效方面有积极意义,具有很好的临床应用前景。

表3 实验组与对照组T细胞亚群检测结果(x±s)
[1] Swisher SG,Roth JA.Clinical update of AD-P53gene therapy for lung cancer[J].Surg Oncol clin N AM,2002 11(3):521-535.
[2] Van Cruijsen H,Gallegos Ruiz M,Van der Valk P,et al.Tissue microarray analysis of ganglioside N-glycolyl GM3 expression and signal transducer and activator of transcription(STAT)-3 activation in relation to dendritic cell infiltration and microvessel density in non-small cell lung cancer[J]. BMC Cancer,2009,9(1):180-181.
[3] 盛春华,鲍锋,徐爽,等.化疗联合DC-CIK细胞治疗非小细胞肺癌的临床研究[J].细胞免疫治疗,2013(2):37-40.
[4] Marten A,Ziske C,Schottker B, et al.Interactions between dentritic cells and cytokine-induced kellr cells lead to an activation of both populations[J]. J Immunol,2001,24(6):502-510.
[5] Babatz J,Rolling C,Lobel B,et al.Induction of celler immune responses against carcinoma bryonic antigen in patients with metastatic tumors after vaccination with alteved peptide ligand baded dendrtic cells[J]. Cancer Inmunol Immunothers,2006,55(3):268-276.
[6] Jefford M,Maraskovsky E,Cebon J,et al.The use of dentritic cells in cancer therapy[J].Lancet Oncol,2001,2(6):343-353.
[7] Flieger D,Kufer P,Beier L,et al.A bispecific digle-clain antibody directed against RPCAM/CD3 in combination with the cytokines interferon alpha and interleukin-2 efficiently retargets and CD+3CD+56 nuturalliller-like T lymphocytes to EPCAM-expressing tumor cells[J].Cancer Immunol Immunolter,2000,49(8):441-448.
[8] 赵光强,叶联华,段林灿,等.全身化疗和支气管动脉灌注联合CIK过继免疫治疗III期非小细胞肺癌的临床研究[J].中国肺癌杂志,2009,6(12):493-494.
Objective Discussing the Clinical effects of dendritic cells (DC) and cytokine induced killer (CIK) cells combined with chemotherapy in patients with non-small cell lung cancer (NSCLC). Methods Randomly selected 70 cases of non-small cell lung cancer patients, divided into experimental group (35 Cases, take dendritic cells and cytokine induced killer cells combined with TP chemotherapy regimens) and control group (35 Cases, take chemotherapy alone). Compare the effectiveness of the experimental group and control group about response rate (RR) and clinical benef i t rate (CBR), Karnofsky performance score(KPS), improvement of complications, T lymphocyte subtypes in peripheral blood. dendritic cells (DC) and cytokine induced killer (CIK) induced by peripheral blood mononuclear cells (PBMC). Application Flow Cytometry(FCM) to detect T lymphocyte subtypes from peripheral blood. Results The level of response rate (RR) and clinical benef i t rate (CBR), Karnofsky performance score (KPS), improvement of complications from experimental group better than control group (P<0.01). The level of CD3+, CD3+CD8+, CD3+CD4+, CD3-CD16+CD56+, CD3+CD16+CD56+from experimental group are higher than control group (P<0.01), CD4+CD25+is lower than control group (P<0.01). Compared with before treatment, in experimental treatment after 15 days, the level of CD3+, CD3+CD4+, CD3+CD8+, CD3-CD16+CD56+, CD3+CD16+CD56+are increase, when to 60 days,the level maintain at a high line; the level of CD4+CD25+is decreases after 15 days, when to 60 days, the level maintain at a low line. Conclusion DC and CIK cells combined with chemotherapy is of an positive signif i cance in improving immune status and quality of life ,increasing the clinical curative effect.
Lung carcinoma; Biotherapy; Dendritic cells; Cytokine induced killer cells
10.3969/j.issn.1009-4393.2016.36.005
安徽 233030 蚌埠医学院第一附属医院呼吸科 (吴梅 魏思亮王效静)

