shRNA干扰卷曲蛋白-7基因对HepG2肝癌细胞增殖和凋亡的影响
刘瀚阳,薛宇洋,高 凯,印竹胜,牛林军,顾玉明
徐州医学院附属医院介入放射科,江苏 徐州 221003
shRNA干扰卷曲蛋白-7基因对HepG2肝癌细胞增殖和凋亡的影响
刘瀚阳,薛宇洋,高 凯,印竹胜,牛林军,顾玉明
徐州医学院附属医院介入放射科,江苏 徐州 221003
目的 探讨抑制卷曲蛋白-7(FZD-7)受体基因对肝癌细胞增殖和凋亡的影响及其机制。方法 实验分3组:空白组(Blank)、阴性对照组(shNC)、FZD-7干扰组(shFZD-7)。用shNC、shFZD-7转染HepG2细胞,应用细胞计数试剂盒(CCK-8)检测细胞增殖能力,流式细胞仪Annexin V-FITC/PI双染法观察细胞凋亡率的变化,Western blotting检测 FZD-7、β-连环蛋白(β-catenin)、Pro-caspase-3、cleaved caspase-3、X连锁凋亡抑制蛋白(XIAP)、cIAP-1、cIAP-2、Bcl-2、Bcl-xL、Bax、Bad、β-肌动蛋白(β-actin)的表达。结果 转染后96 h,shFZD-7组HepG2细胞吸光度值 (0.97±0.10)较Blank组(1.49±0.06)和shNC组(1.42±0.05)明显下降(P<0.01);流式细胞仪检测细胞凋亡率显示shFZD-7组(43.90±2.61)%较Blank组(14.12±1.39)%和shNC组(16.82±1.26)%明显升高(P<0.01);灰度分析显示shFZD-7组cleaved caspase-3蛋白表达量较Blank组和shNC组明显升高(P<0.01);shFZD-7组β-catenin、XIAP、cIAP-1、cIAP-2、Bcl-2、Bcl-xL蛋白表达量较Blank组和shNC组明显降低(P<0.01);shFZD-7组Bcl-2或Bcl-xL与Bax蛋白表达量比值(Bcl-2/Bax或Bcl-xL/Bax)与Blank组和shNC组比较明显降低(P<0.05)。结论 抑制 FZD-7受体基因,可抑制HepG2肝癌细胞株增殖活性并促进细胞凋亡。这一过程可能与下调凋亡抑制蛋白(IAPs),导致caspase-3的活化增加有关;凋亡相关蛋白Bcl-2家族在此过程中也扮演了重要角色。
肝癌;凋亡;增殖;卷曲蛋白-7
原发性肝癌是成人最严重的恶性肿瘤之一,且近年来呈年轻化趋势。目前手术切除、肝动脉化疗栓塞(TACE)、射频消融治疗、肝移植被认为是有效的治疗方法。然而,这些治疗仅对极少数患者有效,且很难维持患者的生活质量[1]。因此,生物分子靶向治疗以其高效的抗肿瘤作用及其相对微弱的毒副作用,进入了人们视线。
Wnt/β-catenin信号通路是调控细胞生长、增殖和凋亡的关键通路,在胚胎发育和肿瘤发生中起着重要作用[2]。FZD-7是Wnt/β-catenin信号通路的重要受体[3]。90%的肝癌有Wnt受体FZD-7的高表达[4]。我们通过小片段发夹RNA表达载体干扰FZD-7基因,靶向抑制Wnt/β-catenin信号通路,观察HepG2肝癌细胞株增殖和凋亡的变化,并初步探讨其可能的发生机制,为FZD-7基因成为肝细胞癌有效的治疗靶点提供理论依据。
1 材料与方法
1.1 材料 人肝癌HepG2细胞株购自中国科学院上海生命科学研究院,脂质体(LipofectamineTM2000转染试剂)购自美国Invitrogen公司,胎牛血清购自杭州四季青公司,细胞计数试剂盒(CCK-8)购自南通碧云天公司,Annexin VFITC/PI细胞凋亡试剂盒购自南京凯基生物公司,兔抗人FZD-7、Pro-caspase-3、β-actin一抗购自bioworld公司,鼠抗人β-catenin、Bcl-2,兔抗人XIAP、cIAP-1、cIAP-2一抗购自美国Santa Cruz公司,兔抗人Bcl-xL、Bax、Bad一抗购自美国Cell Signaling 公司,兔抗人 cleaved caspase-3一抗购自安博生物有限公司,荧光二抗购自美国Odyssey公司,真核表达质粒shFZD-7和阴性对照质粒shNC由上海吉玛公司构建合成,质粒shFZD-7序列为:5′-GCCGTCAAGACCAT CACTATC-3′。
1.2 细胞培养和转染 实验分为3组:空白组(Blank)、阴性对照组(shNC)、FZD-7干扰组(shFZD-7)。HepG2在含10%胎牛血清的DMEM培养基中于37 ℃、5% CO2条件下培养,待细胞融合至90%时开始转染,shNC组转染shNC,FZD-7组转染shFZD-7,用LipofectamineTM2000介导,具体操作参照试剂盒说明进行。转染48 h后,进行后续流式细胞仪测凋亡率、Western blotting蛋白分析实验。
1.3 细胞增殖实验(CCK-8) 分组如前,取转染后的HepG2细胞接种于96孔培养板,每孔5×103个细胞,每组设4个复孔,在转染后24、48、72、96 h,弃去旧培养基,每孔加入10 μl CCK-8试剂和100 μl 培养基的混合液,继续培养2 h,酶标仪测定在450 nm处的吸光度值,实验重复3次。
1.4 流式细胞仪Annexin V-FITC/PI双染法观察细胞凋亡率 收集转染48 h后的各组细胞,加入碘化丙锭(PI)及Annexin VFITC染液混匀,4 ℃避光作用30 min,1 h 内进行流式细胞仪检测。
1.5 Western blotting 裂解转染48 h后的各组细胞提取总蛋白,二喹啉甲酸(BCA)试剂盒测定蛋白浓度,常规处理样品,电泳,转膜。硝酸纤维素(NC)膜在5%的脱脂牛奶中封闭2 h,然后分别加入FZD-7、β-catenin、Pro-caspase-3、cleaved caspase-3、XIAP、cIAP-1、cIAP-2、Bcl-2、Bcl-xL、Bax、Bad、β-actin一抗孵育,4 ℃过夜后加入荧光标记的二抗室温孵育2 h,缓冲液漂洗后避光用Odessey红外激光成像系统扫描条带,实验重复3次。Image J分析各条带灰度值,以各目的蛋白与相应内参条带的灰度值比值进行统计学分析(Bcl-2取两条带的平均值)。

2 结果
2.1FZD-7干扰对HepG2肝癌细胞株增殖的影响 增殖实验显示,与Blank组和shNC组比较,随着转染时间的延长,shFZD-7组细胞的吸光度值下降幅度逐渐增大,其中转染后96h降低最明显。转染后96h,shFZD-7组HepG2细胞吸光度值 (0.97±0.10)较Blank组(1.49±0.06)和shNC组(1.42±0.05)明显下降(F=48.25,P<0.01);shNC组与Blank组比较,细胞凋亡率差异无统计学意义(P>0.05,见图1)。
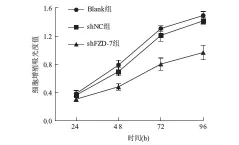
图1 CCK-8实验检测各组细胞增殖情况
2.2 FZD-7干扰对HepG2肝癌细胞株凋亡的影响 shFZD-7干扰HepG2细胞48 h后,Annexin V-FITC/PI双染法流式细胞仪检测细胞凋亡率显示Blank组、shNC组、shFZD-7组凋亡率分别为(14.12±1.39)%、(16.82±1.26)%、(43.90±2.61)%;shNC组与Blank组比较,细胞凋亡率差异无统计学意义(P>0.05);shFZD-7组较其他两组细胞凋亡率明显升高,差异有统计学意义(F=236.34,P<0.01,见图2)。

图2 流式细胞仪检测各组细胞凋亡情况 A:Blank组;B:shNC组;C:shFZD-7组
2.3 FZD-7干扰对HepG2细胞FZD-7、β-catenin、Pro-caspase-3、cleaved caspase-3蛋白表达的影响 灰度分析显示shFZD-7组FZD-7蛋白表达水平(0.41±0.02)较Blank组(0.82±0.03)和shNC组(0.79±0.05)明显降低(F=134.30,P<0.01);shFZD-7组β-catenin蛋白表达(0.44±0.03)较Blank组(0.90±0.02)和shNC组(0.94±0.02)明显降低(F=541.03,P<0.01);Pro-caspase-3蛋白表达水平在各组之间差异无统计学意义(P>0.05);cleaved caspase-3蛋白在shFZD-7组表达(0.38±0.04)较Blank组(0.11±0.02)和shNC组(0.13±0.02)明显升高(F=112.29,P<0.01);各蛋白Blank组与shNC组比较差异均无统计学意义(P>0.05,见图3)。

图3 Western blotting检测FZD-7、β-catenin、Pro-caspase-3、cleaved caspase-3蛋白表达
Fig 3 The protein expression levels of FZD-7, β-catenin, Pro-caspase-3, cleaved caspase-3 determined by Western blotting
2.4 FZD-7干扰对HepG2细胞XIAP、cIAP-1、cIAP-2蛋白表达的影响 灰度分析显示shFZD-7组XIAP蛋白表达水平(0.07±0.02)较Blank组(0.21±0.03)和shNC组(0.23±0.02)明显降低(F=44.61,P<0.01);shFZD-7组cIAP-1蛋白表达(0.13±0.04)
较Blank组(0.31±0.03)和shNC组(0.29±0.02)明显降低(F=30.21,P<0.01);cIAP-2蛋白在shFZD-7组表达(0.20±0.04)较Blank组(0.43±0.02)和shNC组(0.42±0.02)明显降低(F=65.43,P<0.01);各蛋白Blank组与shNC组比较差异均无统计学意义(P>0.05,见图4)。

图4 Western blotting检测XIAP、cIAP-1、cIAP-2蛋白表达
Fig 4 The protein expression levels of XIAP, cIAP-1, cIAP-2 determined by Western blotting
2.5 FZD-7干扰对HepG2细胞Bcl-2、Bcl-xL、Bax、Bad蛋白表达的影响 灰度分析显示shFZD-7组Bcl-2蛋白表达水平(0.33±0.04)较Blank组(0.65±0.03)和shNC组(0.60±0.04)明显降低(F=78.64,P<0.01);shFZD-7组Bcl-xL蛋白表达(0.29±0.03)较Blank组(0.80±0.04)和shNC组(0.75±0.03)明显降低(F=221.57,P<0.01);Bax、Bad蛋白表达水平在各组之间差异无统计学意义(P>0.05);各蛋白Blank组与shNC组比较差异均无统计学意义(P>0.05);shFZD-7组Bcl-2与Bax蛋白表达量比值Bcl-2/Bax(0.25±0.02)较Blank组(0.51±0.01)和shNC组(0.48±0.02)明显降低(F=170.96,P<0.01);shFZD-7组Bcl-xL与Bax蛋白表达量比值Bcl-xL/Bax(0.23±0.03)较Blank组(0.62±0.02)和shNC组(0.59±0.03)明显降低(F=180.61,P<0.01,见图5)。

图5 Western blotting检测Bcl-2、Bcl-xL、Bax、Bad蛋白表达
Fig 5 The protein expression levels of Bcl-2, Bcl-xL, Bax, Bad determined by Western blotting
3 讨论
FZD-7作为Wnt/β-catenin信号通路的一种重要受体,已被发现在许多恶性肿瘤中过度表达[5-6]。许多研究表明,抑制Wnt/β-catenin信号通路可降低细胞增殖活性并促进细胞凋亡[7]。Nambotin等[8]报道,药物抑制FZD-7受体可以通过调节蛋白激酶Cδ (PKCδ)和β-catenin促进肝癌细胞的凋亡。但是,关于FZD-7调节细胞增殖和凋亡的具体分子机制尚不清楚。本实验中,我们通过shRNA特异性干扰FZD-7基因,发现HepG2肝癌细胞株增殖活性明显下降,凋亡明显增加。凋亡抑制蛋白(IAPs)表达的降低、caspase-3的活化、抗凋亡Bcl-2和Bcl-xL表达的抑制在这一过程中发挥了重要作用。
本实验结果显示应用shRNA干扰HepG2肝癌细胞株FZD-7基因后, shFZD-7组FZD-7、β-catenin蛋白表达量明显降低,表明shRNA干扰FZD-7基因成功,Wnt/β-catenin信号通路得到有效抑制。
Caspase家族是凋亡发生和调控机制中最重要的组成部分。caspase-3是凋亡过程级联反应中起共同作用的下游分子,因此又被称为凋亡级联反应的最终执行者。caspase-3活化水解片段(cleaved caspase-3)的出现说明caspase酶级联反应的激活。IAPs家族是一类高度保守的内源性抗细胞凋亡因子家族,主要通过其自身结构域直接与caspase结合,抑制caspase3、7、9 的催化活性,阻断细胞凋亡进程[9]。Bcl-2 家族在细胞凋亡调控中也起到重要作用,Bcl-2 家族中抑制凋亡蛋白主要包括 Bcl-2、Bcl-xL、Bcl-w 等,促进凋亡蛋白主要包括 Bad、Bax、Bid 等[10]。Bcl-2家族蛋白既能形成同二聚体,也能和其他蛋白形成异二聚体。其中Bcl-2或Bcl-xL蛋白可与Bax形成异二聚体并使之失活,所以Bcl-2或Bcl-xL/Bax的比值可能是决定细胞对凋亡刺激信号的敏感性的重要因素之一[11]。此外,通常认为在凋亡信号传导的过程中,Bcl-2可作用在caspase-3激活的上游,通过抑制caspase-3激活而发挥作用[12]。Caspase-3可以在Asp34的位置切割Bcl-2蛋白,破坏其抗凋亡活性,切割后的羧基端片段却具有促凋亡作用[13]。
本研究结果显示,shFZD-7组Pro-caspase-3蛋白表达无明显变化,cleaved caspase-3明显增多,XIAP、cIAP-1、cIAP-2蛋白表达明显受到抑制。这可能是由于沉默FZD-7基因,抑制了Wnt/β-catenin信号通路,减少了IAPs的表达,使caspase-3受其抑制作用减弱而水解为有活性的cleaved caspase-3,细胞凋亡增加。Western blotting显示shFZD-7组Bcl-2 家族中Bcl-2、Bcl-xL蛋白表达量明显降低,而Bad、Bax无明显变化,Bcl-2或Bcl-xL/Bax明显减小,导致Bcl-2、Bcl-xL与Bax形成的异二聚体减少,从而使Bax更好地发挥其促凋亡功能。但是,其上游的具体分子机制还有待于进一步研究。
综上所述,shRNA干扰 FZD-7受体,靶向抑制Wnt/β-catenin信号通路可以引起HepG2肝癌细胞株增殖活性下降,凋亡增加。这一过程可能与下调IAPs,导致caspase-3的活化增加有关。凋亡相关蛋白Bcl-2家族在此过程中也扮演了重要角色。
[1]Eskens FA, Van Erpecum KJ, De Jong KP, et al. Hepatocellular carcinoma: Dutch guideline for surveillance, diagnosis and therapy [J]. Neth J Med, 2014, 72(6): 299-304.
[2]Liu F, Millar SE. Wnt/beta-catenin signaling in oral tissue development and disease [J]. J Dent Res, 2010, 89(4): 318-330.
[3]King TD, Zhang W, Suto MJ, et al. Frizzled7 as an emerging target for cancer therapy [J]. Cell Signal, 2012, 24(4): 846-851.
[4]Lee HS, Park MH, Yang SJ, et al. Novel candidate targets of Wnt/beta-catenin signaling in hepatoma cells [J]. Life Sci, 2007, 80(7): 690-698.
[5]冷开明, 康鹏程, 崔云甫, 等. 卷曲蛋白7与β连环蛋白在肝癌组织中的表达及其临床意义[J].中华肝胆外科杂志, 2014, 20(2): 108-112.
Leng KM, Kang PC, Cui YF, et al. Expression and clinical significance of frizzled-7 and β-catenin in human hepatocellular carcinoma [J]. Chin J Hepatobiliary Surg, 2014, 20(2): 108-112.
[6]周志平, 邱成志, 余外市, 等. 结直肠癌组织中高尔基磷酸化蛋白3表达与Wnt信号通路的关系[J].中华实验外科杂志, 2013, 30(12): 2709-2710.
Zhou ZP, Qiu CZ, Yu WS, et al. Relationship between golgi phosphoprotein 3 expression and Wnt/β-catenin signaling in colorectal cancer tissue [J].Chin J Exp Surg, 2013, 30(12): 2709-2710. [7]马光涛, 张燕, 李晨龙, 等. 姜黄素通过Wnt/β-catenin信号通路调控胶质瘤细胞增殖和凋亡的实验研究[J]. 中华神经外科杂志, 2015, 31(6): 625-630.
Ma GT, Zhang Y, Li CL, et al. Curcumin regulation of glioma cell proliferation and apoptosis through Wnt/β-catenin signaling pathway: an experimental study [J].Chin J Neurosurg, 2015, 31(6): 625-630.
[8]Nambotin SB, Lefrancois L, Sainsily X, et al. Pharmacological inhibition of Frizzled-7 displays anti-tumor properties in hepatocellular carcinoma[J].J Hepatol, 2011, 54(2): 288-299.
[9]Wang K, Lin B. Inhibitor of apoptosis proteins (IAPs) as regulatory factors of hepatic apoptosis[J].Cell Signal, 2013, 25(10): 1970-1980.
[10]Czabotar PE, Lessene G, Strasser A, et al. Control of apoptosis by the BCL-2 protein family: implications for physiology and therapy [J]. Nat Rev Mol Cell Biol, 2014, 15(1): 49-63.
[11]Zheng JH, Viacava Follis A, Kriwacki RW, et al. Discoveries and controversies in BCL-2 protein-mediated apoptosis [J]. FEBS J, 2016, 283(14): 2690-2700.
[12]Salakou S, Kardamakis D, Tsamandas AC, et al. Increased Bax/Bcl-2 ratio up-regulates caspase-3 and increases apoptosis in the thymus of patients with myasthenia gravis [J]. In Vivo, 2007, 21(1): 123-132.
[13]王亚进, 余耀, 周俭, 等. bcl-2基因在肝癌中的研究进展[J]. 中华实验外科杂志, 2012, 29(1): 154-155.
Wang YJ, Yu Y, Zhou J, et al. Progress of bcl-2 in hepatic carcinoma [J]. Chin J Exp Surg, 2012, 29(1): 154-155.
(责任编辑:王全楚)
Effects of shRNA silencing Frizzled-7 on the proliferation and apoptosis of HepG2 hepatocellular carcinoma cells
LIU Hanyang, XUE Yuyang, GAO Kai, YIN Zhusheng, NIU Linjun, GU Yuming
Department of Interventional Radiology, the Affiliated Hospital of Xuzhou Medical College, Xuzhou 221003, China
Objective To study the effects of blocking of Frizzled-7 (FZD-7) gene on the proliferation and apoptosis as well as its potential molecular mechanism in hepatocellular carcinoma cells.Methods The experiment was divided into three groups: blank group, shNC group and shFZD-7 group. The small hairpin RNA (shRNA) eukaryotic expression vectors specific to FZD-7 were transfected into HepG2 hepatoceuular carcinoma cells. The proliferation abilities were measured by cell counting kit-8 (CCK-8) assay. The rate of apoptosis was measured by Annexin V-FITC/PI double-staining method. Western blotting was used to detect the expressions of FZD-7, β-catenin, Pro-caspase-3, cleaved caspase-3, XIAP, cIAP-1, cIAP-2, Bcl-2, Bcl-xL, Bax, Bad and β-actin to illustrate the probable mechanisms.Results After transfected by 96 h, the A values of shFZD-7 group (0.97±0.10) was significantly decreased compared with the blank group (1.49±0.06) and shNC group (1.42±0.05) (P<0.01).Flow cytometer showed that the rate of apoptosis in shFZD-7 group (43.90±2.61)% was significantly increased compared with the blank group (14.12±1.39)% and shNC group (16.82±1.26)% (P<0.01). The analysis of values showed the protein level of cleaved caspase-3 was significantly increased in the shFZD-7 group (P<0.01). The β-catenin, XIAP, cIAP-1, cIAP-2, Bcl-2, Bcl-xL were decreased in shFZD-7 group compared with the blank group and shNC group (P<0.01). The Bcl-2/Bax or Bcl-xL/Bax was decreased in the shFZD-7 group compared with the blank group and shNC group (P<0.05).Conclusion The results demonstrate that blocking of FZD-7 can inhibit the cell proliferation and increase the rate of apoptosis in HepG2 and it is probably by downregulating the expression of IAPs and increasing the activation of caspase-3. The Bcl-2 family also play an important role in this procedure.
Hepatocellular carcinoma; Apoptosis; Proliferation; Frizzled-7
江苏省卫生厅重大项目(H201322)
顾玉明,主任医师,硕士,研究方向:肿瘤介入治疗。E-mail: guyuming_2006@163.com
10.3969/j.issn.1006-5709.2016.08.008
R735.7
A
1006-5709(2016)08-0868-05
2016-01-12

