盐酸青藤碱诱导人肝癌细胞SMMC-7721凋亡及其死亡受体DR4、DR5表达的变化
张 俊,卢桂芳,任牡丹,卢新兰,曹瑞琪,闫红林,王 新,和水祥
1. 西安交通大学第一附属医院消化内科,陕西 西安 710061; 2. 西安医学院第一附属医院消化内科
盐酸青藤碱诱导人肝癌细胞SMMC-7721凋亡及其死亡受体DR4、DR5表达的变化
张 俊1,卢桂芳1,任牡丹1,卢新兰1,曹瑞琪2,闫红林2,王 新1,和水祥1
1. 西安交通大学第一附属医院消化内科,陕西 西安 710061; 2. 西安医学院第一附属医院消化内科
目的 观察人肝癌细胞SMMC-7721凋亡过程中死亡受体DR4、DR5的表达,探讨盐酸青藤碱诱导人肝癌细胞凋亡的作用机制。方法 体外培养人肝癌细胞SMMC-7721,经不同浓度盐酸青藤碱作用后,采用MTT法检测细胞增殖情况;Hoechst染色荧光显微镜观察细胞凋亡;用Western blotting方法检测人肝癌细胞DR4、DR5的表达。结果 盐酸青藤碱对人肝癌细胞的生长有明显的抑制作用,并呈剂量、时间依赖性,不同浓度组之间差异均有统计学意义(P<0.05);Hoechst33258染色可见凋亡细胞皱缩,核碎裂,也可见典型凋亡小体;在蛋白水平,盐酸青藤碱处理后SMMC-7721细胞死亡受体DR4、DR5的表达水平较未处理组显著增加(P<0.05)。结论 盐酸青藤碱可抑制人肝癌细胞SMMC-7721的细胞增殖,促进其凋亡,此作用可能与细胞内死亡受体DR4和DR5表达上调有关。
肝细胞癌;SMMC-7721;死亡受体DR4/DR5;盐酸青藤碱;凋亡
肝细胞癌(hepatocellular carcinoma,HCC)是导致人类死亡的第二大全身性肿瘤,且发病率逐年上升,但传统治疗方法对HCC的治疗效果均不理想,患者5年生存率低于26%。因此,进一步研究HCC的发病机制,寻找新的治疗途径和方法对HCC的治疗至关重要。青藤碱是从中药青风藤中提取的单体生物碱,具有明显抗炎、抗免疫、镇痛、镇静、镇咳、降血压、促组胺释放、抗心律失常等药理作用。目前研究[1]发现,其在几种肿瘤细胞中,包括白血病、滑膜肉瘤、前列腺癌、肺癌、宫颈癌和HCC,均显示出体外抗肿瘤的药理活性。本研究中,我们观察了盐酸青藤碱在诱导人肝癌细胞凋亡过程中死亡受体DR4、DR5表达的变化,进一步探讨其在诱导人肝癌细胞凋亡中的作用机制。
1 材料与方法
1.1 实验材料与试剂 人肝癌细胞株SMMC-7721由西安交通大学第一附属医院临床分子实验中心陈威主任惠赠。盐酸青藤碱购自中国湖南正清药业公司,溶解于DMEM新鲜培养液中(含10%胎牛血清,终质量浓度为100 mmol/L)4 ℃冷藏备用。DMEM培养基购自GIBCO公司;胎牛血清购自中国浙江杭州四季青公司;胰蛋白酶及SMSO均购自Sigma公司;兔抗人DR4多抗购自Proteintech公司,兔抗人DR5多抗,鼠抗人β-actin单抗、山羊抗兔DR4、DR5二抗、山羊抗鼠β-actin二抗购自Abcam公司。
1.2 实验方法
1.2.1 人肝癌SMMC-7721细胞的培养:人肝癌SMMC-7721细胞在含10%胎牛血清、50 U/L青霉素和50 mg/L链霉素的DMEM培养液中,37 ℃恒温,5% CO2密闭传代培养。
1.2.2 药物处理及分组:盐酸青藤碱以含10%胎牛血清的DMEM溶解,使用时以含10%胎牛血清的DMEM培养液稀释成工作浓度,在前期工作基础上,并结合预实验结果设5个试验组,各组浓度分别为0.25、0.5、1.0、2.0、4.0 mmol/L,另设0 mmol/L为阴性对照组,根据MTT结果选取合适梯度浓度的盐酸青藤碱处理肝癌细胞。
1.2.3 MTT比色法检测SMMC-7721的增殖:取对数生长期细胞,0.25%胰蛋白酶消化,用含10%胎牛血清的DMEM制备细胞悬液3×104个/ml,接种于96孔板,每孔200 μl,生长24 h后,随机分6组,每组5个复孔,加入盐酸青藤碱终浓度分别为0 mmol/L(阴性对照组)、0.25、0.5、1.0、2.0、4.0 mmol/L的培养液,分别作用24 h、48 h、72 h后,每孔加新配置的5 mg/ml的MTT贮存液20 μl,继续孵育4 h后,弃上清,每孔加150 μl DMSO溶解细胞内结晶,酶标490 nm波长测定吸光度(A)值。抑制率(%)=(对照孔A490-实验孔A490)/对照孔A490×100%。
1.2.4 Hoechst33258染色荧光显微镜观察细胞凋亡:以0.25%胰蛋白酶消化对数生长期SMMC-7721细胞,制成单细胞悬液,接种在预先放置盖玻片的6孔板上,随机设阴性对照组(0 mmol/L)和盐酸青藤碱组(2.0 mmol/L),置于37 ℃培养箱中,48 h后收集各作用组的肝癌细胞,每孔加入500 μl多聚甲醛固定液固定15 min后,用PBS清洗,每孔加入500 μl荧光染液Hochest33258室温摇床上孵育5 min,PBS清洗,完全干燥后用甘油封片,倒置载玻片于荧光显微镜下观察并拍照。结果评判:在正常对照的细胞中,细胞核的形态饱满且规则,颜色为较深的蓝色,而凋亡阳性细胞是指细胞核出现了碎块状的致密浓染,且颜色发白。
1.2.5 Western blotting法检测DR4、DR5蛋白的表达:给药48 h后,3 ml PBS洗2遍,加入500 μl蛋白酶抑制剂和磷酸酶抑制剂的蛋白提取液,冰上裂解5 min,用细胞刮刮下培养皿中细胞斜放于冰上裂解20 min,刮取细胞后加到1.5 ml离心管中,4 ℃、12 000×g离心20 min,收集上清液。用BCA法测定蛋白浓度,取40 μg蛋白用12%的分离胶和5%的浓缩胶进行SDS-PAGE聚丙烯酰胺凝胶电泳220 V,1 h。电泳完毕后,剥离下完整胶,用半干转膜仪250 mA电转40 min将蛋白转移到PVDF膜上。根据目的蛋白分子量的大小裁剪适当大小的条带膜,将膜用封闭液封闭1 h,取出膜,加入适当体积的一抗稀释液(用PBST溶液以适当比例稀释,其中anti-DR4单抗1∶1 000,anti-DR5单抗1∶3 000,anti-β-actin单抗1∶1 000)杂交过夜,后用TBST洗膜3次,每次10 min,然后加入适当体积的、合适种属的二抗稀释液,1 h后取出膜,PBST洗3次,每次5 min。加入显色剂闭光显色,显色后凝胶成像系统照相并用密度分析软件对蛋白量进行定量。
1.3 统计学分析 采用SPSS 11.5统计软件进行处理,多组间比较采用单因素方差分析,两两比较采用SNK-q检验,P<0.05为差异有统计学意义。
2 结果
2.1 盐酸青藤碱对细胞生长的影响 盐酸青藤碱对肝癌细胞的增殖有明显的抑制作用,与阴性对照组相比,0.5、1.0、2.0、4.0 mmol/L组的盐酸青藤碱均可抑制人肝癌细胞SMMC-7721细胞的生长,且该抑制作用具有典型的浓度-时间依赖性,其中以4.0 mmol/L组作用48 h的抑制率最高,可达87%(见图1)。
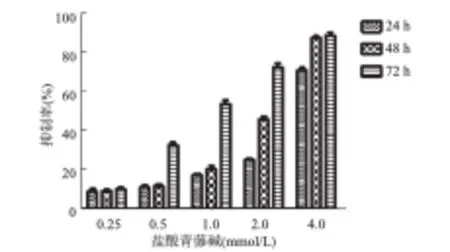
图1 盐酸青藤碱对人肝癌SMMC-7721细胞生长增殖的抑制作用
2.2 荧光显微镜观察SMMC-27721细胞凋亡变化 2.0 mmol/L盐酸青藤碱处理细胞48 h后,用Hoechst33258染色可见凋亡细胞皱缩,核染色质浓缩、核碎裂,也可见典型的凋亡小体,而阴性对照组细胞膜完整,胞质丰富而饱满(见图2)。
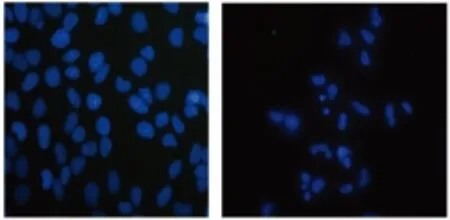
图 2 荧光显微镜观察SMMC-7721细胞凋亡(200×) A:阴性对照组;B:2.0 mmol/L盐酸青藤碱组
Fig 2 The apoptosis of SMMC-7721 cells observed by fluorescence microscopy (200×) A: negative control group; B: 2.0 mmol/L Sinomenine hydrochloride group
2.3 Western blotting检测各组SMMC-7721细胞中DR4、DR5的蛋白表达 DR4、DR5蛋白在阴性对照组中就有表达,经盐酸青藤碱作用后,DR4、DR5的蛋白表达较阴性对照组明显增加(P<0.05),表现为盐酸青藤碱呈剂量依赖性增加DR4、DR5的蛋白表达(见图3)。

注:与阴性对照组比较,*P<0.05,**P<0.01。
3 讨论
细胞凋亡又叫程序性细胞死亡(programmed cell death),是细胞在多种因子调控下发生的一种主动结束自身生命的一种死亡方式。Caspase 级联反应介导的细胞凋亡主要通过3种信号通路实现,分别是死亡受体(death receptor,DR)介导(外源性)的凋亡、线粒体(mitochondria)介导(内源性)的凋亡及内质网(endoplasmic reticulum)介导的凋亡。3条通路之间有交叉对话,共同介导细胞凋亡。死亡受体(death receptor,DR)介导的细胞凋亡又称外源性凋亡(extrinsic apoptosis)。由细胞外的相关配体与死亡受体结合而触发细胞凋亡。已知的死亡受体有5类:TNFR-1(CD120a、p55)、FAS(CD95、Apo1)、DR3(Apo3、WSL21、TRAMP、LARD)、DR4和DR5(Apo2、TRAIL-R2、TRICK2、KILLER),其中前3种受体相应的配体分别为TNF、FasL(又称CD95L)和APO23L,后2种的配体均为APO22L(TRAIL)。死亡配体与死亡受体的结合可导致受体胞质区的死亡结构域聚集并形成能与衔接蛋白结合的位点,募集相应的衔接蛋白与之结合,形成配体-受体-衔接蛋白复合物,即死亡诱导信号复合物(death-inducing signalling complex,DISC),DISC募集并激活procaspase-8,活化的caspase-8能够剪切活化下游的caspase而启动细胞凋亡。多数情况下,大剂量的化疗药物可以通过不同途径有效地杀死肿瘤细胞,但是治疗过程中往往出现一些毒副反应(如骨髓抑制、心脏毒性、恶习呕吐等),因而学者们一直致力于研发低毒性、低剂量的有效药物。
盐酸青藤碱(Sinomenine hydrochloride)是青藤碱的水溶性盐酸盐,临床用于治疗类风湿关节炎,疗效肯定,无明显毒副作用。研究[1]发现,青藤碱不仅有抗炎等活性,还具有抗肿瘤活性。在肝癌中,国内有研究初步报道了青藤碱在体外诱导人HCC HepG2细胞凋亡的作用[2-3]。相关文献也报道了死亡受体不仅可在肺癌[4]、星状细胞癌[5]、白血病[6]、卵巢癌[7]等中表达,还在多种人肝癌细胞中表达[8],而且多种药物如化疗药物可以抑制人肝癌细胞死亡受体DR4、DR5的表达水平[9-10]。本课题组前期研究证明了盐酸青藤碱可抑制人肝癌细胞的体外生长,可抑制裸鼠皮下人肝癌细胞移植瘤生长;盐酸青藤碱体外诱导的人HCC细胞凋亡呈caspase依赖性,线粒体介导的凋亡信号通路参与其中[11];据此推理,死亡受体介导的凋亡信号通路是否也参与其中是本课题欲解决的关键问题。为此,我们进一步研究了盐酸青藤碱诱导人肝癌细胞SMMC-7721凋亡过程中死亡受体DR4、DR5表达的变化,MTT结果显示盐酸青藤碱以时间和浓度依赖的方式抑制人HCC SMMC-7721细胞的增殖;Hoechst33258染色结合荧光显微镜观察SMMC-7721细胞凋亡的形态学变化,可见凋亡细胞皱缩,核染色质浓缩、核碎裂,随着药物作用时间延长,死亡细胞增多,有典型的凋亡小体形成,证实了青藤碱对人肝癌细胞不仅有增殖抑制作用,还有凋亡诱导作用;同时研究发现,随着青藤碱剂量的增加,DR4、DR5的蛋白表达水平有升高的趋势,各组表达均高于阴性对照组,其中1.0、2.0 mmol/L盐酸青藤碱作用组与阴性对照组比较,差异有统计学意义。即盐酸青藤碱能够浓度依赖性地上调死亡受体DR4、DR5蛋白表达水平,提示,死亡受体DR4、DR5表达上调可能是盐酸青藤碱抗癌作用的机制之一,这也为开发应用盐酸青藤碱防治肝癌等消化系统肿瘤提供了实验依据。
据相关文献报道,多种信号通路如MAPK等在盐酸青藤碱诱导乳腺癌等其他肿瘤中发挥作用[12],而MAPK等其他上下游相关信号通路在盐酸青藤碱诱导人HCC凋亡过程中是否也发挥作用?此外也有学者报道青藤碱可以通过诱导血管正常化来抑制乳腺癌等肿瘤的生长和侵袭转移等[13],因此,这为我们探讨青藤碱抗肿瘤作用的机制提供了又一新的思路,值得我们进一步研究。
[1]陈伟毅, 秦春宏, 银晓刚. 青藤碱抗肿瘤作用研究进展[J]. 中国药师, 2013, 16(12): 1902-1904. Chen WY, Qin CH, Yin XG. Advances in anti-tumor effect of sinomenine [J]. China Pharmacist, 2013, 16(12): 1902-1904.
[2]龚立, 高永翔. 青藤碱诱导肝癌细胞凋亡的实验研究[J]. 成都中医药大学学报, 2007, 30(3): 38-39, 47. Gong L, Gao YX. Experimental study of apoptosis of hepatocellular carcinoma cells induced by sinomenine [J]. Journal of Chengdu University of TCM, 2007, 30(3): 38-39, 47.
[3]史海龙, 崔亚亚. 青藤碱对人肝癌细胞HepG2增殖的抑制作用[J]. 中医临床研究, 2012, 4(19): 18-19. Shi HL, Cui YY. Inhibition function of sinomenine against HepG2 cells proliferation [J]. Clinical Journal of Chinese Medicine, 2012, 4(19): 18-19.
[4]Zhou Y, Peng Y, Mao QQ, et al. Casticin induces caspase-mediated apoptosis via activation of mitochondrial pathway and upregulation of DR5 in human lung cancer cells [J]. Asian Pac J Trop Med,2013,6(5): 372-378.
[5]Riddick E, Evans S, Rousch J, et al. Identification of death receptors DR4 and DR5 in HTB-12 astrocytoma cell lines and determination of TRAIL sensitivity [J]. J Solid Tumors, 2013, 3(6): 20-26.
[6]Hu R, Yang Y, Liu Z, et al. The XIAP inhibitor Embelin enhances TRAIL-induced apoptosis in human leukemia cells by DR4 and DR5 upregulation [J]. Tumour Biol, 2015, 36(2): 769-777.
[7]Chang CC, Kuan CP, Lin JY, et al. Tanshinone IIA facilitates TRAIL sensitization by up-regulating DR5 through the ROS-JNK-CHOP signaling axis in human ovarian carcinoma cell lines [J]. Chem Res Toxicol, 2015, 28(8): 1574-1583.
[8]李领明, 孙国华, 付玉东, 等. 人肝癌组织中DR4和DR5的表达及其临床意义[J]. 中国实验诊断学, 2011, 15(3): 525-526. Li LM, Sun GH, Fu YD, et al. The expression and clinical significance of DR4 and DR5 in human liver cancer tissues [J]. Chin J Lab Diagn, 2011, 15(3): 525-526.
[9]宋改环, 张弘, 甄学慧, 等. 顺铂对TRAIL死亡受体DR4、DR5的影响[J]. 中国妇幼保健, 2010, 25(10): 1415-1417.
Song GH, Zhang H, Zhen XH, et al. Effect of cisplatin on TRAIL death receptors-DR4 and DR5 [J]. Maternal and Child Health Care of China, 2010, 25(10): 1415-1417.
[10]邓立力, 吕慧芳, 王文秀, 等. 阿霉素对肝癌细胞增殖及TRAIL受体表达影响的实验研究[J]. 中国肿瘤, 2011, 20(7): 515-520. Deng LL, Lv HF, Wang WX, et al. Effect of adriamycin on cell proliferation and expression of TRAIL receptors in human hepatoma carcinoma cells HepG2 [J]. China Cancer, 2011, 20(7): 515-520.
[11]Lu XL, Zeng J, Chen YL, et al. Sinomenine hydrochloride inhibits human hepatocellular carcinoma cell growth in vitro and in vivo: involvement of cell cycle arrest and apoptosis induction [J]. Int J Oncol, 2013, 42(1): 229-238.
[12]Li X, Wang K, Ren Y, et al. MAPK signaling mediates sinomenine hydrochloride-induced human breast cancer cell death via both reactive oxygen species-dependent and -independent pathways: an in vitro and in vivo study [J]. Cell Death Dis, 2014, 5: e1356.
[13]Zhang H, Ren Y, Tang X, et al. Vascular normalization induced by sinomenine hydrochloride results in suppressed mammary tumor growth and metastasis [J]. Sci Rep, 2015, 5: 8888.
(责任编辑:王全楚)
Sinomenine hydrochloride inducing apoptosis of hepatocellular carcinoma SMMC-7721 cells and its effect on expressions of DR4 and DR5
ZHANG Jun1, LU Guifang1, REN Mudan1, LU Xinlan1, CAO Ruiqi2, YAN Honglin2, WANG Xin1, HE Shuixiang1
1. Department of Gastroenterology, the First Affiliated Hospital of Xi’an Jiaotong University, Xi’an 710061; 2. Department of Gastroenterology, the First Affiliated Hospital of Xi’an Medical University, China
Objective To investigate the expression levels of DR4 and DR5 on the process of apoptosis induced by Sinomenine hydrochloride in hepatocellular carcinoma (HCC) SMMC-7721 cells.Methods MTT assay was used to determine the effect of Sinomenine hydrochloride on the growth of hepatocellular carcinoma SMMC-7721 cells. In vitro cultured human HCC SMMC-7721 cells: the effect of Sinomenine hydrochloride on the morphologic change induced by sinomenine hydrochloride were assessed by fluorescence microscope after Hoechst staining. SMMC-7721 cells were cultured for 48 hours with Sinomenine hydrochloride 2 mmol/L, then the effect of Sinomenine hydrochloride on death receptors (DR4 and DR5) were detected by Western blotting.Results Sinomenine hydrochloride inhibited the growth of human HCC SMMC-7721 cells in a concentration-and time-dependent manner as determined by MTT assay. In vitro cultured human HCC SMMC-7721 cells, Sinomenine hydrochloride induced apoptosis by Hoechst staining; Sinomenine hydrochloride significantly increased death receptors (DR4 and DR5) protein expression in a concentration-dependent manner in human HCC SMMC-7721 cells.Conclusion Sinomenine hydrochloride can inhibit growth of human HCC SMMC-7721 cells through apoptotic induction; Sinomenine hydrochloride can increase the expression levels of death receptors (DR4 and DR5) on the process of apoptosis induced by Sinomenine hydrochloride in HCC SMMC-7721 cells.
Hepatocellular carcinoma; SMMC-7721; DR4/DR5; Sinomenine hydrochloride; Apoptosis
陕西省社会发展科技攻关项目(2015SF55);陕西省教育厅专项科研计划项目(2013JK0786)
张俊,硕士,研究方向:慢性肝病和肝癌的发病机制与防治。E-mail:zhang08doctor@163.com
任牡丹,在职博士,主治医师,研究方向:慢性肝病和肝癌的发病机制与防治。E-mail:rmd206@sohu.com
10.3969/j.issn.1006-5709.2016.08.009
R735.7
A
1006-5709(2016)08-0873-04
2015-11-17

