杠柳新苷P在水和土壤中的降解与移动特性
何振宇,宋梁栋,贺保国,胡兆农,吴文君
(1. 西北农林科技大学 植物保护学院 农药研究所,陕西杨凌 712100;2.陕西省植物源农药研究与开发重点实验室,陕西杨凌 712100;3.兴平市植保植检站,陕西兴平 713100)
杠柳新苷P在水和土壤中的降解与移动特性
何振宇1,2,宋梁栋3,贺保国1,2,胡兆农1,2,吴文君1,2
(1. 西北农林科技大学 植物保护学院 农药研究所,陕西杨凌712100;2.陕西省植物源农药研究与开发重点实验室,陕西杨凌712100;3.兴平市植保植检站,陕西兴平713100)
摘要采用室内模拟试验,研究植物杀虫活性成分杠柳新苷P在不同水体和不同类型土壤中的降解与移动特性,分析其对不同水体与不同类型土壤的污染风险性。结果表明:温度和pH对杠柳新苷P在水中的降解均有一定程度的影响。温度为50 ℃、pH=9时,降解速率最快,其水解半衰期为2.36 d。土壤降解与土壤淋溶试验表明,杠柳新苷P在麦田土、果园土和菜园土中的降解半衰期分别为4.33、4.25和3.85 d,降解速率依次为菜园土>果园土>麦田土;对比试验研究表明,在未灭菌的土壤中,杠柳新苷P的降解速率比灭菌的土壤中显著加快。
关键词植物源农药;杠柳新苷P;水体降解;土壤降解;土壤淋溶
植物源农药作为一种新兴农药,具有传统化学农药无法比拟的优势,目前,国内外的研究普遍认为,其大多数具有低毒、低污染、低残留、不易产生抗药性等良好的环境安全性[1]。然而,植物源农药绝不意味着无毒,部分植物源农药品种仍可对环境和人体健康带来一定的不利影响[2]。并非所有的植物源农药在水体与土壤中均容易降解、无残留[3]。如天然除虫菊对鱼毒性大,且易光降[4],烟草、狼毒等对高等动物具有较高的毒性[5]。由于植物源农药的成分复杂,化学结构新颖,作用机理特殊,其环境行为和生态毒性可能与传统的化学农药存在较大的不同[6]。因此,对植物源农药进行系统的环境行为安全性评价具有重要的理论意义和应用价值。
杠柳(PeriplocasepiumBunge)是萝藦科(Asclepiadaceae)杠柳属的一种蔓生性灌木,又名北五加、香加皮[7]。20世纪80年代,日本学者Itokawa等[8-9]从杠柳根皮中分离得到的化学成分主要有杠柳毒甙、北五加皮甙等。近年来,西北农林科技大学农药研究所对杠柳根皮的杀虫活性成分进行全面的研究,从杠柳根皮中分离得到一种新型糖苷类活性化合物杠柳新苷P(periplocoside P),其结构式见图1[10-11]。同时,该研究所以杠柳新苷类活性化合物为主要成分,开发了杠柳根皮提取物的10%微乳剂和15%水乳剂,但其环境安全性研究,目前国内外尚无相关报道。
本研究根据《化学农药环境安全评价试验准则》[12],以杠柳新苷P作为杠柳新苷类活性化合物的代表,研究其在水体和土壤中的降解与移动特性,并对其影响因素进行探讨,旨在为杠柳杀虫制剂的登记和科学合理使用提供依据。
1材料与方法
1.1材 料
杠柳新苷P(Periplocosides P):从杠柳根皮中分离,纯度95%以上,由西北农林科技大学农药研究所自行制备。
土壤:选择河南二合土、东北黑土和江西红土进行土壤淋溶试验,选择麦田土、菜园土和果园土进行土壤降解试验。6种土壤在去除杂物后风干处理,研碎,过0.15 mm孔径筛,备用。其相关理化性质见表1。
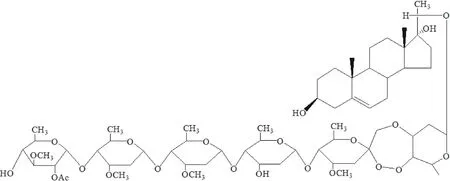
图1 杠柳新苷P的化学结构式
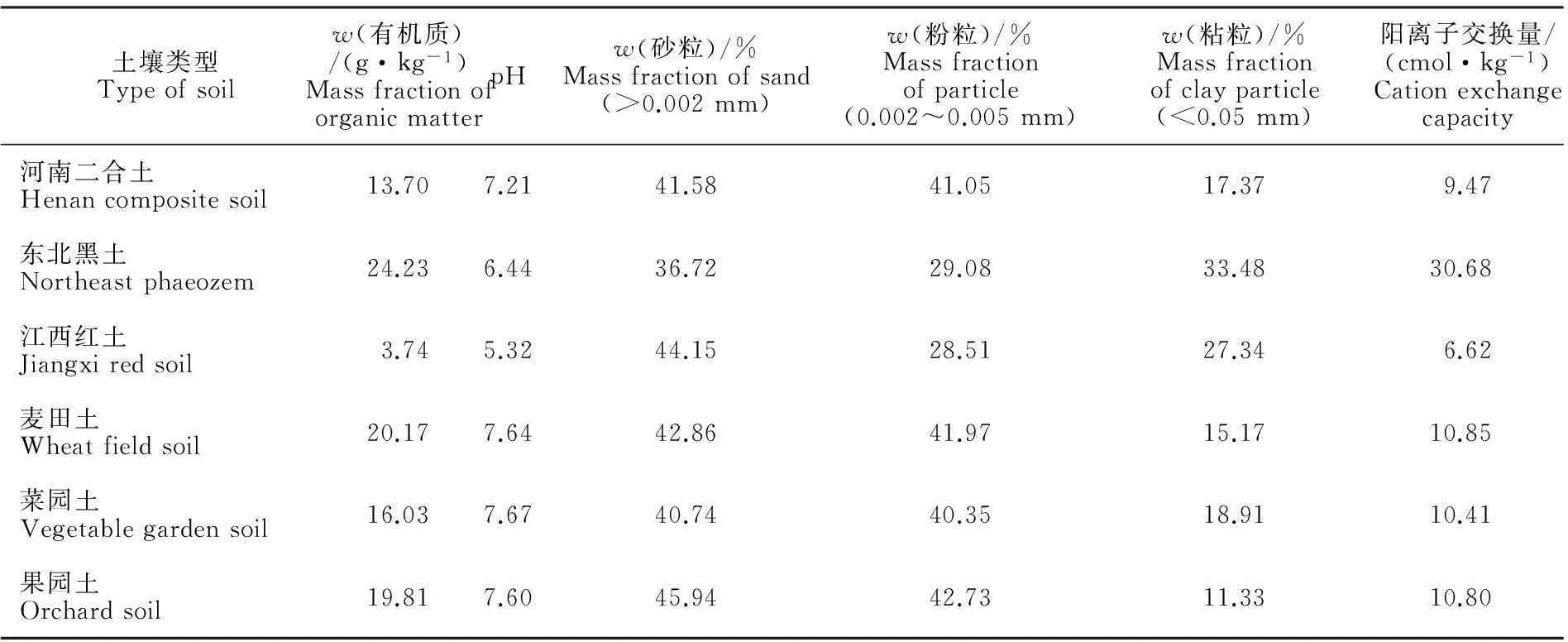
土壤类型Typeofsoilw(有机质)/(g·kg-1)MassfractionoforganicmatterpHw(砂粒)/%Massfractionofsand(>0.002mm)w(粉粒)/%Massfractionofparticle(0.002~0.005mm)w(粘粒)/%Massfractionofclayparticle(<0.05mm)阳离子交换量/(cmol·kg-1)Cationexchangecapacity河南二合土Henancompositesoil13.707.2141.5841.0517.379.47东北黑土Northeastphaeozem24.236.4436.7229.0833.4830.68江西红土Jiangxiredsoil3.745.3244.1528.5127.346.62麦田土Wheatfieldsoil20.177.6442.8641.9715.1710.85菜园土Vegetablegardensoil16.037.6740.7440.3518.9110.41果园土Orchardsoil19.817.6045.9442.7311.3310.80
1.2水体降解试验
按照Clark-Lubs缓冲体系设置5、7、9共3个pH,每个pH下设置25 ℃和50 ℃ 2个温度条件,配置后重新调节pH。无菌条件下添加杠柳新苷P,使初始质量浓度达200 mg·L-1,后置于恒温培养箱中避光培养。定期采集水样,利用HPLC检测水样中杠柳新苷P的质量分数,并计算其水解半衰期。
1.3土壤降解试验
将麦田土、蔬菜田土、果园土烘干后研碎并过0.12 mm筛,无菌组土壤进行高温高压蒸汽灭菌30 min。取25 g土与3.6 g杠柳浸膏拌匀后置于100 mL具塞三角瓶中,加8 mL水使土壤含水率为田间持水量的60%,置于25 ℃培养箱下恒温避光培养,于第0、1、4、7、14和28天分别取样3.0 g。经40 ℃鼓风干燥后,以20 mL甲醇超声提取3次,过滤后合并提取液,旋转蒸发后用色谱级甲醇溶解定容至5 mL,经HPLC检测样品中杠柳新苷P的质量分数,计算其降解半衰期。
1.4土壤淋溶试验
采用土壤薄层层析法,称取烘干后过0.12 mm筛的河南二合土、江西红土、东北黑土各10 g,置于研钵中,加适量蒸馏水研磨后,将搅拌均匀的土样涂布于10 cm×20 cm层析玻璃板上,土层厚度为0.5~1.0 mm,并将涂布好的土壤薄板在室内晾干。于距薄板底部2.0 cm处,用毛细管点药约10 μL。用纯水作为展开剂,展开剂前沿距原点4 cm处停止。晾干后将薄板上的土壤等距分为0~2、2~4、4~6、6~8、8~10和10~12 cm 6段,超声提取后用HPLC测定各段杠柳新苷P的质量分数,并计算其Rf值。
1.5检测条件
色谱条件:大连依利特EC2000色谱工作站;色谱柱为Hpersil BDS-C18柱,4.6 mm×250 mm,粒径5 μm;柱温25 ℃;流动相为V(CH3OH)∶V(H2O)=90∶10;检测波长205 nm;流速1 mL·min-1;进样量为5 μL。在上述色谱条件下,杠柳新苷P质量浓度在0.05~5.00 mg·L-1呈良好的线性,标准曲线方程为y=1.100 5x+7.767 9(R2=0.995 8)。式中y为质量浓度,x为峰面积。
1.6数据处理
试验数据、图表均采用Excel 2010软件进行处理。
2结果与分析
2.1杠柳新苷P在3种土壤中的移动特性
农药在土壤中的移动性是评价其对地下水污染风险的重要指标之一。通过薄层层析法测定杠柳新苷P在江西红土、东北黑土和河南二合土的迁移能力,其淋溶试验结果见表2。杠柳新苷P在3种土壤中均主要分布于0~2 cm土壤段,Rf值均在0~0.34。依据农药移动性能等级划分,杠柳新苷P在江西红土和河南二合土中的移动等级均为Ⅱ(弱),在东北黑土中的移动等级为Ⅰ(很弱)。表明杠柳新苷P具有较差的水溶性,对比试验结果进一步说明土壤的理化性质对杠柳新苷P在土壤中的移动能力影响较小。
2.2杠柳新苷P在3种土壤中的降解特性
土壤的降解作用是农药在环境中消失的一种最基本途径,在一定程度上决定农药的药效与其对环境的安全性。本试验在 25 ℃恒温条件下测定杠柳新苷P在麦田土、菜园土、果园土中的降解特性。杠柳新苷P在上述3种土壤中的降解动态均能较好地遵循一级动力学方程,结果见表3与表4。
随着采样时间的延长,杠柳新苷P在3种土样中的降解率逐渐变大。7 d后其残留量均小于50 μg·g-1,降解半衰期分别为4.33、3.85和4.25 d。第28 天采样时,杠柳新苷P的降解率均达95%以上(表3);而杠柳新苷P在灭菌土壤中的降解半衰期分别为5.73、6.03和6.48 d(表4),其降解半衰期均大于未经灭菌土壤。依据国家环保总局《化学农药环境安全评价试验准则》中农药土壤降解性划分等级,杠柳新苷P在上述3种土壤中均具易降解性。
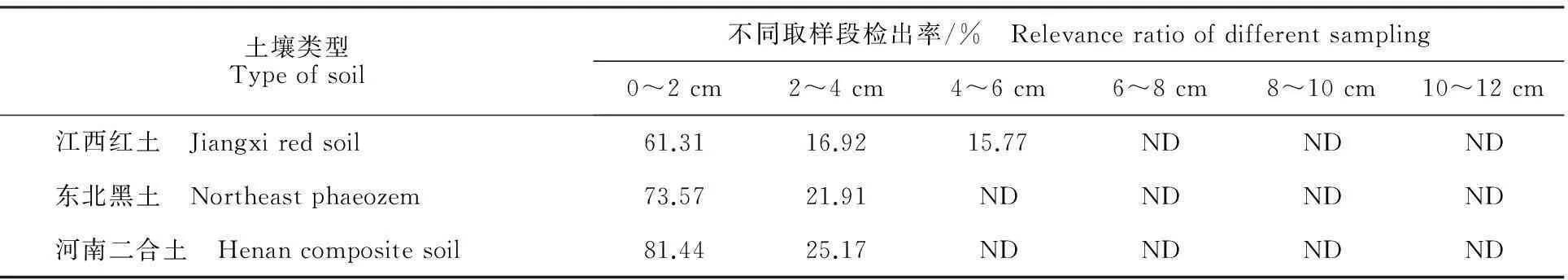
表2 土壤薄层层析试验结果
注:ND.未检出。
Note:ND meas non-detected.
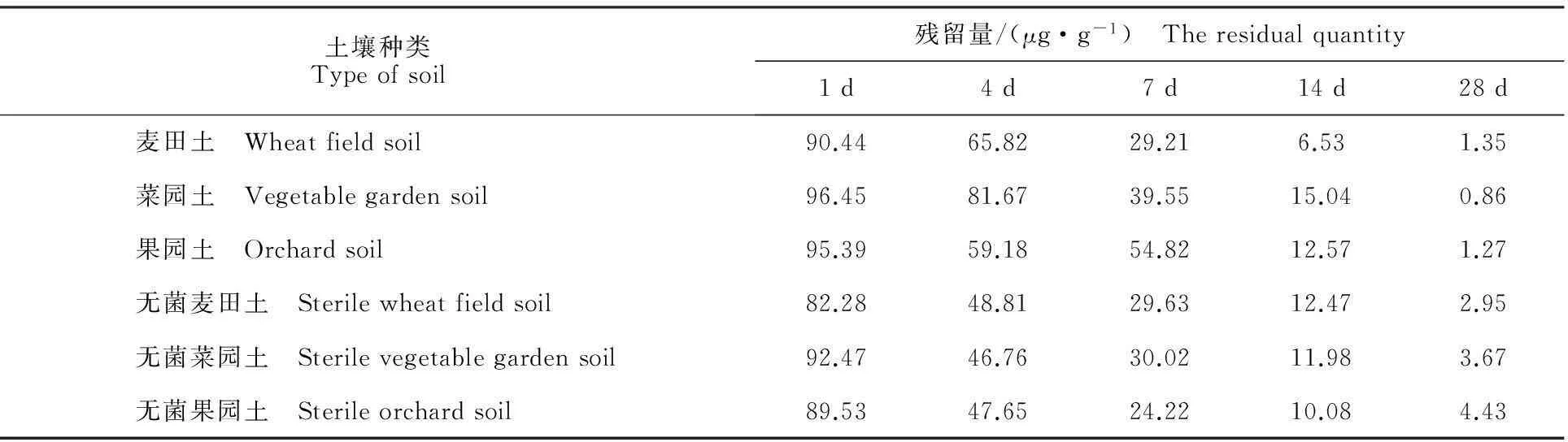
表3 不同时间土壤中杠柳新苷P的残留量
2.3杠柳新苷P的水体降解特性
在不同温度(25 ℃、50 ℃)和不同pH(5、7、9)条件下,杠柳新苷P的水解曲线如图2所示,水解动力方程及半衰期见表5。由图2可以看出,水相中杠柳新苷P质量分数随时间的推移逐渐减小,其降解速率在最初的5 d内最大,第5 天时其残留质量分数(除pH=7,25 ℃外)均小于50 μg·g-1,5 d后降解速率逐渐减小。结果表明,杠柳新苷P的水解规律均符合一级动力方程,且其在25 ℃和50 ℃条件下,pH=9的缓冲溶液中杠柳新苷P水解速度最快,其次是在pH=5缓冲溶液,而在pH=7缓冲溶液中的水解最慢;50 ℃的水解半衰期均小于25 ℃,依据农药水解特性等级划分杠柳新苷P属于易水解。
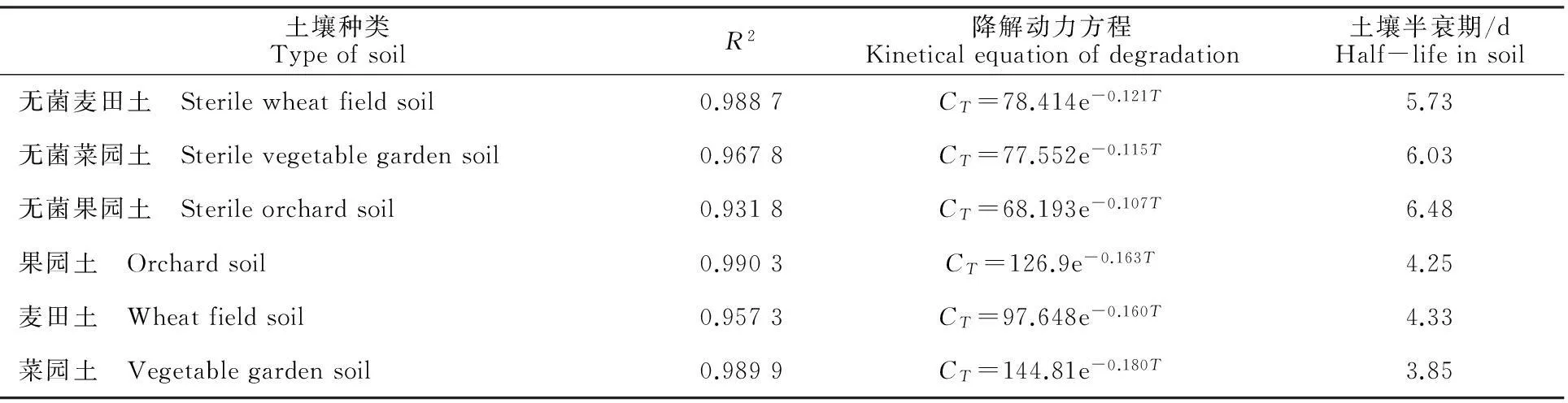
表4 杠柳新苷P的土壤降解半衰期和动力方程
注:农药降解动态可用方程CT=C0e-KT来具体表达;其中K为降解速率常数;C0为农药的初始质量浓度;CT为T时刻农药的质量浓度。表5同。
Note: Pesticide degradation dynamic level expressed in equation ofC=C0e-KT;K.disappearance rate constant;C0.initial mass concentration of pesticides;CT.mass concentration of pesticides atTtime.The same as table 5.
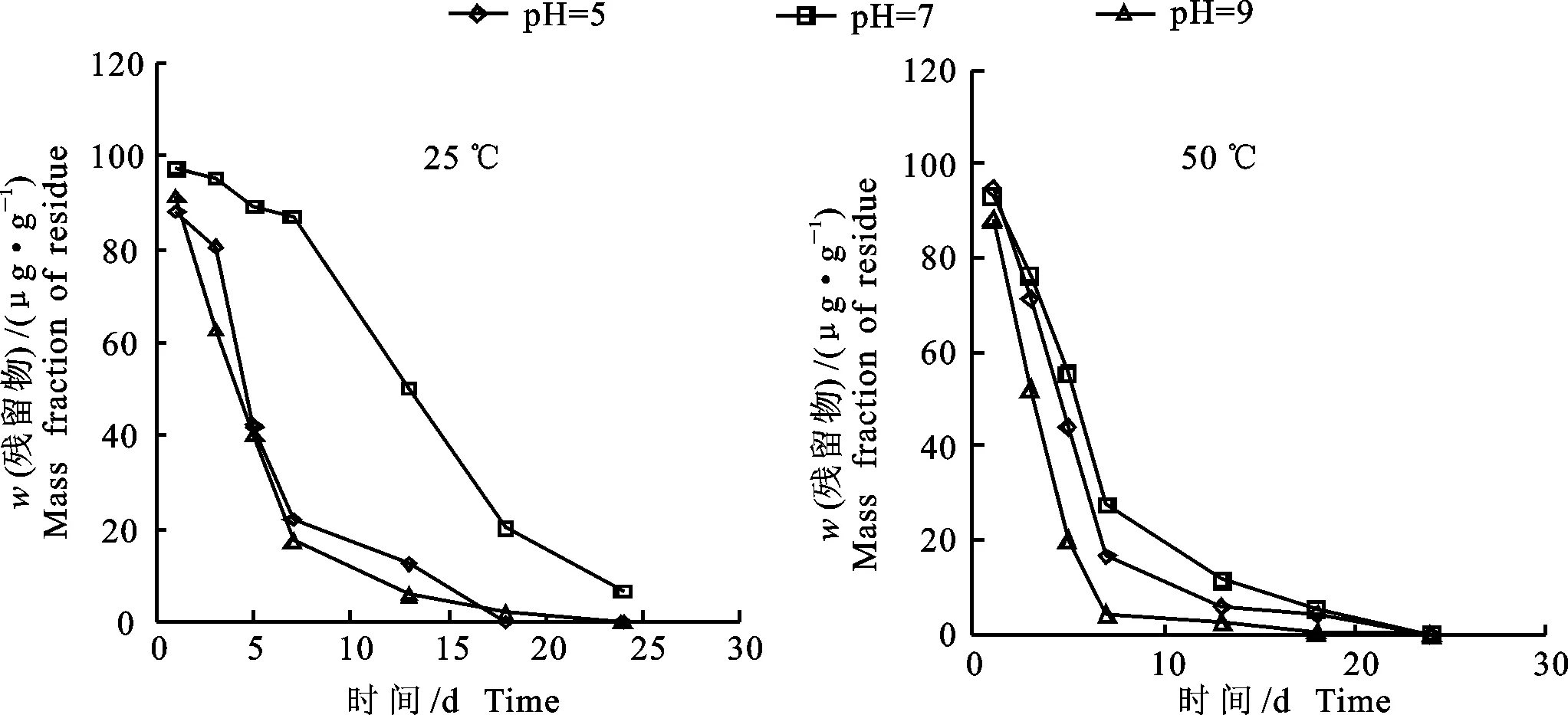
图2 不同温度下杠柳新苷P的水解曲线
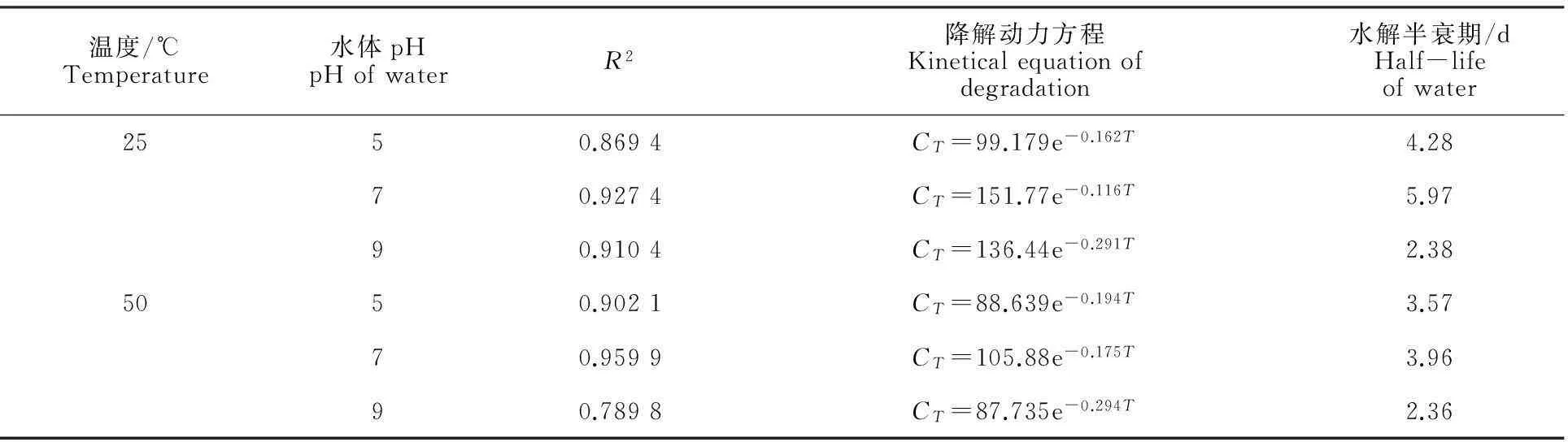
温度/℃Temperature水体pHpHofwaterR2降解动力方程Kineticalequationofdegradation水解半衰期/dHalf-lifeofwater2550.8694CT=99.179e-0.162T4.2870.9274CT=151.77e-0.116T5.9790.9104CT=136.44e-0.291T2.385050.9021CT=88.639e-0.194T3.5770.9599CT=105.88e-0.175T3.9690.7898CT=87.735e-0.294T2.36
3讨 论
土壤和水体是农药进入环境后的“储藏库”与“集散地”,施入农田的农药大部分残留于土壤环境介质中[13-15]。杨炜春等[16]认为,农药在土壤中的吸附、脱附是农药在土壤-水环境中归宿的主要支配因素。当农药被土壤强烈吸附以后,其生物活性和微生物对它的降解性能都会被减弱。吸附性强的农药,其移动性和扩散能力较弱,不易进一步造成对周围环境的污染[17]。因此,研究农药在水体中的水解和土壤中的吸附行为,不仅可为农药的使用技术提供指导,避免对后茬作物的影响,而且还可为新农药的优选、降低农药的使用量和减少对环境的污染提供理论依据和科学指导。
进入土壤和水体中的农药将发生一系列的物理化学过程,如被土壤胶粒及有机质吸附、向深层土壤移动、向大气中挥发扩散、被作物吸收、被土壤微生物降解等。农药在土壤中的物理行为在很大程度上取决于农药在土壤中的吸附和解吸能力[18]。本研究结果表明,杠柳新苷P在无菌土壤中的降解半衰期均显著大于未经灭菌的土壤,说明微生物的活动是其降解的一个重要因素。农药的微生物降解作用实际上表现为酶促反应,大多数农药的微生物降解途径已明确。综合来说,农药的微生物降解途径包括氧化、还原、水解、脱卤缩合、脱羧、异构化等,微生物降解是一些农药在土壤中的迁移转化的主要方式。如:滴滴涕(DDT)、对硫磷、艾氏剂等的主要消失途径均是通过微生物降解。影响微生物降解的主要条件是温度、微生物的菌属、土壤的含水量、有机物含量等[19]。杠柳新苷P(PSP)在50 ℃水解速率显著大于25 ℃,说明其在高温下更容易水解。温度影响微生物降解的速度主要是由于温度影响微生物的活性,从而影响降解速度[20]。例如,在微生物适宜温度0~35 ℃范围内,郑和辉等[21]研究甲草胺的微生物降解,发现甲草胺的微生物降解通常符合一级反应模型。此外,pH也是影响PSP在土壤中降解的一个重要因素。同一温度下,PSP在中性pH条件下水解最慢,碱性条件下水解速率大于酸性条件。朱忠林等[22]发现溴氟菊酯农药的水解速率随pH的增大而加快,在pH为5、7、9的溶液中其水解半衰期分别为15.6、8.3和4.2 d。同时,无论在何种温度和酸碱度条件下溴氯菊酯农药水解半衰期均小于1个月,属于易水解。但并非所有的农药都能很快水解,如丁草胺[23]在纯水中黑暗放置30 d,发现丁草胺的浓度并无变化,说明该农药在水体中的稳定性很高,对地下水有严重的污染性。
目前,对农药的研究只集中于其某一单一过程,如微生物降解、水解、光解等,并没有结合其他过程进行研究,而在农药的迁移转化过程中,这些过程会互相影响。研究农药在土壤中的迁移转化的对象主要是施入土壤中的农药,但农药迁移转化的中间产物可能与原来的农药有着截然不同的性质和结构(可能更具毒性或稳定性),且有的农药在酸性和碱性条件下的转化产物并不一样。在以后对农药的研究中,应把农药转化的中间产物作为农药迁移转化的一个重要参数来考虑。
本研究结果表明杠柳新苷P在土壤中移动性弱,易降解,其残留等级为低残留,可能是由多种因素共同影响所致。但是,目前杠柳新苷P在土壤中的具体降解反应还不清楚,尚需进一步的试验进行论证。
参考文献Reference:
[1]李凡海,王桂清.我国生物源农药应用现状及对策探讨[J].农业科技与装备,2014(8):58-60.
LI F H,WANG G Q.The present application situation and the countermeasures of biological pesticides in China [J].AgriculturalScience&Technology,2014 (8):58-60 (in Chinese with English abstract).
[2]DUBEY N K,SHUKLA R,KUMAR A,etal.Prospects of botanical pesticides in sustainable agriculture[J].CurrentScience,2010,98(4):479-480.
[3]BAKER B P,BENBROOK C M,GROTH E,etal.Pesticide residues in conventional,integrated pest management (IPM)-grown and organic foods:insights from three US data sets[J].FoodAdditives&Contaminants,2002,19(5):427-446.
[4]程暄生,赵平,于涌.天然除虫菊[J].农药,2005,44(9):391-394.
CHENG X SH,ZHAO P,YU Y.Natural insecticidal pyrethrum [J].Pesticides,2005,44(9):391-394 (in Chinese with English abstract).
[5]韩志华,朱忠林,单正军.几种植物源农药对环境生物的毒性[J].应用与环境生物学报,2005,11(3):346-348.
HAN ZH H,ZHU ZH L,SHAN ZH J.Toxicity of botanical pesticides to environment organisms [J].ChineseJournalofApplied&EnvironmentalBiology,2005,11(3):346-348 (in Chinese with English abstract).
[6]EL-WAKEIL N E.Botanical pesticides and their mode of action [J].GesundePflanzen,2013,65(4):125-149.
[7]师宝君,高履桐,姬志勤,等.杠柳杀虫活性成分的分离[J].农药学学报,2012,14(1):103-106.
SHI B J,GAO L T,JI ZH Q,etal.Isolation of the insecticidal ingredients fromPeriplocasepium[J].ChineseJournalofPesticideScience,2012,14(1):103-106 (in Chinese with English abstract).
[8]ITOKAWA H,XU J P,TAKEYA K,etal.Studies on chemical constituents of antitumor fraction fromPeriplocasepium.V.structures of new pregnane glycosides,periplocosides J,K,F and O[J].Chemical&PharmaceuticalBulletin,1988,36(11):982-987.
[9]ITOKAWA H,XU J P,TAKEYA K.Studies on chemical constituents of antitumor fraction fromPeriplocasepiumBGE.I.[J].Chemical&PharmaceuticalBulletin,1987,35(11):4524-4529.
[10]师宝君.杠柳和昆明山海棠根皮杀虫活性成分研究[D].陕西杨凌:西北农林科技大学,2009.
SHI B J.Studies on the insecticidal constituents of the roots bark ofPeriplocasepiumandTripterygiumhypoglaucum[D].Yangling Shannxi:Northwest A&F University,2009(in Chinese with English abstract).
[11]陈翠翠,高履桐,师宝君,等.杠柳新苷P和E对东方粘虫和小地老虎幼虫中肠蛋白酶活性的影响[J].昆虫学报,2012,55(4):412-419.
CHEN C C,GAO L T,SHI B J,etal.Effects of periplocosides P and E fromPeriplocasepiumon the proteinase activities in the midgut of larvae ofMythimnaseparataandAgrotisypsilon[J].ActaEntomologicaSinica,2012,55(4):412-419 (in Chinese with English abstract).
[12]MENSINK B,SCHEEPMAKER J.How to evaluate the environmental safety of microbial plant protection products:a proposal[J].BiocontrolScience&Technology,2007,17(1):3-20.
[13]SANKARARAMAKRISHNAN N,SHARMA A K,SANGHI R.Organochlorine and organophosphorous pesticide residues in ground water and surface waters of Kanpur,Uttar Pradesh,India[J].EnvironmentInternational,2005,31(1):113-120.
[14]ARIAS-ESTÉVEZ M,LPEZ-PERIAGO E,MARTN-EZCA RBALLO E,etal.The mobility and degradation of pesticides in soils and the pollution of groundwater resources[J].Agriculture,Ecosystems&Environment,2008,123(4):247-260.
[15]KJAER J,ERNSTSEN V,JACOBSEN O H,etal.Transport modes and pathways of the strongly sorbing pesticides glyphosate and pendimethalin through structured drained soils[J].Chemosphere,2011,84(4):471-479.
[16]杨炜春,刘维屏,马云,等.扑草净和扑灭通在土壤中吸附及其与色谱热力学函数的相关性[J].土壤学报,2004,39(5):693-698.
YANG W CH,LIU W P,MA Y,etal.Adsorption of herbicide prometryne and prometon on soils and correlation with their chromatographic thermodynamics[J].ActaPedologicaSinica,2004,39(5):693-698 (in Chinese with English abstract).
[17]李克斌,刘惠君,马云,等.不同类型表面活性剂在土壤上的吸附特征比较研究[J].应用生态学报,2004,15(11):2067-2071.
LI K B,LIU H J,MA Y,etal.Adsorption characteristics of three types of surfactants in soils[J].ChineseJournalofAppliedEcology,2004,15(11):2067-2071 (in Chinese with English abstract).
[18]郑立庆,方娜,周庆祥,等.农药在土壤中的吸附及其影响因素[J].安徽农业科学,2007,35(21):6573-6575.
ZHENG L Q,FANG N,ZHOU Q X,etal.Absorption of the pesticides in soils and its influencing factors[J].JournalofAnhuiAgriculturalSciences,2007,35(21):6573-6575 (in Chinese with English abstract).
[19]HARITASH A K,KAUSHIK C P.Biodegradation aspects of polycyclic aromatic hydrocarbons (PAHs):a review[J].JournalofHazardousMaterials,2009,169(1):1-15.
[20]MARIA D P C,LENNART T.Effect of biobed composition,moisture,and temperature on the degradation of pesticides[J].JournalofAgricultural&FoodChemistry,2007,55(14):5725-5733.
[21]郑和辉,叶常明.甲草胺和丁草胺等除草剂在多介质环境中环境行为综述[J].环境科学进展,1999,7(3):1-10.
ZHENG H H,YE CH M.The behavior summary of alachlor and butachlor in the multi-medium environment[J].AdvancesinEnvironmentalScience,1999,7(3):1-10 (in Chinese with English abstract).
[22]朱忠林,单正军,蔡道基.溴氟菊酯的光解、水解与土壤降解[J].生态与农村环境学报,1996,12(4):5-7.
ZHU ZH L,SHAN ZH J,CAI D J.Photnlysis,hydrolysis of bronuthrinate and its degradation in soil[J].RuralEco-Environment,1996,12(4):5-7 (in Chinese with English abstract).
[23]郑和辉,叶常明.乙草胺和丁草胺的水解及其动力学[J].环境化学,2001,20(2):168-171.
ZHENG H H,YE CH M.Hydrolysis of chloracetanilide herbicidesacetohlor and butachlor[J].EnvironmentalChemistry,2001,20(2):168-171 (in Chinese with English abstract).
Received 2015-03-04Returned2015-06-02
Foundation itemSpecial Fund for Agro-scientific Research in the Public Interest (No.200903052); Agricultural Science and Technology Key Project of Shaanxi Province(No.2015NY033).
First authorHE Zhenyu,male,master student.Research area:pesticide toxicology. E-mail: 274945399@qq.com
(责任编辑:史亚歌Responsible editor:SHI Yage)
Degradation and Moving Characteristics of Periplocosides P in Water and Soil
HE Zhenyu1,2,SONG Liangdong3,HE Baoguo1,2,HU Zhaonong1,2and WU Wenjun1,2
(1. Institution of Pesticide Science,College of Plant Protection,Northwest A&F University,Yangling Shaanxi 712100,China; 2. Key Laboratory of Botanical Pesticide R&D in Shaanxi Province,Yangling Shaanxi712100,China;3. Plant Protection and Quarantine Station of Xingping,Xingping Shaanxi713100,China)
AbstractIn this study,the degradation characteristics,moving characteristics and pollution risk of periplocosides P in different water and different types of soil were analyzed using the indoor simulation test method. The results showed that the temperature and pH influenced the degradation of periplocosides P in water to a certain degree. The half-life of fastest hydrolysis was 2.36 d under the condition of 50 ℃ and pH=9. The soil degradation and soil leaching test showed that the half-life of periplocosides P degradation in vegetable garden soil,orchard soil and wheat field soil soil was 4.33 d,4.25 d and 3.85 d,respectively. Meanwhile,the degradation rate of periplocosides P in vegetable garden soil,orchard soil and wheat field soil were sequenced in descending order. The degradation rate of periplocosides P in non-sterile soil was faster than in sterile soil. In conclusion,periplocosides P is an easily degradable compound in environment.
Key wordsBotanical insecticide;Periplocosides P;Hydrolysis;Soil degradation;Soil leaching
收稿日期:2015-03-04修回日期:2015-06-02
基金项目:国家公益性行业(农业)科研专项(200903052); 陕西省农业科技创新与攻关项目(2015NY033)。
通信作者:胡兆农,男,教授,博士,博士生导师,主要从事农药毒理学研究。E-mail:huzhaonong@nwsuaf.edu.cn
中图分类号S481+.8
文献标志码A
文章编号1004-1389(2016)04-0619-07
Corresponding authorHU Zhaonong,male,Ph.D,professor,doctoral supervisor.Research area:pesticide toxicology.E-mail: huzhaonong@nwsuaf.edu.cn
网络出版日期:2016-04-02
网络出版地址:http://www.cnki.net/kcms/detail/61.1220.S.20160402.1118.038.html
第一作者:何振宇,男,硕士生,从事农药毒理学研究。E-mail:274945399@qq.com

