影响甘蓝小孢子DH植株生长的几个因素
刘 争,张恩慧,程永安,许忠民,王改改
(西北农林科技大学 园艺学院,陕西杨凌 712100)
影响甘蓝小孢子DH植株生长的几个因素
刘争,张恩慧,程永安,许忠民,王改改
(西北农林科技大学 园艺学院,陕西杨凌712100)
摘要旨在筛选甘蓝小孢子DH植株健壮生长的最适培养基和光照强度。为缩短小孢子DH植株培养时间并为获得健壮植株创造条件,从而加快甘蓝DH系育种进程。以甘蓝‘秦甘50’为材料进行游离小孢子培养至诱导分化出不定芽,转接到NAA质量浓度不同的2种培养基上(1/2MS+0、0.1、0.2、0.3 mg/L NAA和MS+0.1 mg/L NAA),不同光照强度[40、60、80、100 μmol/(m2·s)]及添加不同质量浓度NH4NO3(0、0.4、0.8、1.2 g/L)培养,研究DH植株的生长势,获得甘蓝小孢子DH植株最适培养基和培养条件。结果表明,在NAA质量浓度不同的培养基中,1/2MS +0.1 mg/L NAA培养基中小孢子DH植株生长速度最显著,生根快、植株长势强;在80 μmol/(m2·s)光照强度下培养小孢子DH植株净生长高度显著,10.3 d再生出根系,根质量较好,叶片大而厚;MS培养基中添加质量浓度为0.4 g/L的NH4NO3,小孢子DH植株生长健壮,35 d内植株净生长高度最大为56.25 mm。以上结果说明,甘蓝小孢子DH植株快速健壮生长的适宜培养基为1/2MS+0.1 mg/L NAA+8 g/L琼脂+30 g/L蔗糖;在80 μmol/(m2·s)光照强度下或MS培养基中添加质量浓度为0.4 g/L的NH4NO3均能够促进甘蓝小孢子DH植株根茎叶生长旺盛。
关键词甘蓝;DH植株;小孢子再生;培养基;光照强度;NH4NO3
结球甘蓝(BrassicaoleraceaL.var.capitataL.)为十字花科芸薹属蔬菜,原产于地中海沿岸,是世界各国特别是欧美国家喜食的重要蔬菜作物,现在世界各地广泛栽培[1]。甘蓝具有显著的杂种优势,杂种一代是由性状纯合的2个亲本杂交而成。纯合亲本的获得除多代自交外,游离小孢子培养也是创制纯合自交系的快速途径[2-3]。甘蓝游离小孢子培养(Isolated microspore culture)是指从甘蓝的花蕾中直接分离获得游离态、新鲜、发育时期合适的小孢子群体,通过培养使其脱分化,经由胚状体或愈伤组织诱导,再生获得单倍体(Haploid)植株,而后经过自发或诱发的染色体加倍成为正常可育、高度纯合的双单倍体(Double Haploid,简称DH)植株的过程,这种双单倍体植株的自交后代则是DH系。DH系遗传基因纯合、性状稳定,可以直接作为亲本材料应用于杂种一代品种的选配[4-6]。近年来,甘蓝游离小孢子培养技术体系已初步建立,研究取得一定进展[7-11],但这项技术在甘蓝上的应用还不够理想,主要表现在小孢子诱导的胚状体成苗率低、质量差、耗时长,苗体生长发育速度缓慢等问题,直接影响小孢子DH植株健壮生长,导致当年培养的DH株田间移栽过晚,或越冬前DH株的营养体过小,最终导致小孢子DH植株春化不彻底,翌年DH株不能正常抽薹开花,延长利用DH系育种的年限。因而,探究甘蓝游离小孢子培养中影响小孢子DH植株健壮生长的栽培因素就显得尤为重要,寻找最适的胚状体再生植株培养基和适宜植株生长的光照强度,旨在为缩短小孢子再生植株培养时间和获得健壮植株苗创造条件,从而加快甘蓝DH系育种进程。
1材料与方法
1.1试验材料
甘蓝‘秦甘50’供试材料由西北农林科技大学园艺学院甘蓝育种室提供。甘蓝‘秦甘50’为杂种一代,2013-07-25露地播种育苗,6~7片真叶定植,2013-11-28假植窖藏越冬,2014-03-08定植纱网棚,正常管理;当植株抽薹时,选取合适花蕾进行游离小孢子培养,出胚后将发育正常、生长健壮的子叶型胚状体转接到B5+6-BA 1.0 mg/L+NAA 0.1 mg/L + Suc 30 g/L + Agar 9 g/L培养基上,在温度为23~25 ℃,光照强度为25~30 μmol/(m2·s)、光照时间14 h/d的条件下培养,直至分化出不定芽。
1.2试验方法
1.2.1培养基与NAA质量浓度对小孢子DH植株长势的影响选取高度相同的不定芽自基部切下,转接到含0、0.1、0.2、0.3 mg/L NAA+8 g/L琼脂+30 g/L蔗糖的1/2MS(有机物质质量浓度不变,其余物质质量浓度减半)培养基和0.1 mg/L NAA+8 g/L琼脂+30 g/L蔗糖的MS培养基,在25 ℃、光照强度为60 μmol/(m2·s)、光照时间为14 h/d条件下培养,比较含有不同质量浓度NAA的1/2MS和MS培养基对小孢子DH植株生长势的影响。
1.2.2光照强度对小孢子DH植株长势的影响选取高度相同的不定芽自基部切下,转接到MS+0.1 mg/L NAA+8 g/L 琼脂+30 g/L蔗糖的培养基上,在25 ℃、光照时间为14 h/d、光照强度分别为40、60、80、100 μmol/(m2·s)条件下培养,比较不同光照强度对小孢子DH植株生长势的影响。
1.2.3MS培养基添加NH4NO3对小孢子DH植株长势的影响选取高度相同的不定芽自基部切下,转接到质量浓度为0、0.4、0.8、1.2 g/L NH4NO3的MS+0.1 mg/L NAA+8 g/L 琼脂+30 g/L蔗糖的培养基上,在25 ℃、光照强度为60 μmol/(m2·s)、光照时间为14 h/d条件下培养,比较NH4NO3对小孢子DH植株生长势的影响。
以上处理中,口径3 cm的指形培养试管中转接1个不定芽,每个处理转接15个不定芽,重复3次;处理后定期观察统计植株高度、叶片和根系的生长发育,田间移栽时测植株质量。
1.3数据分析
采用DPS7.05 Duncan’s新复极差法分析,Excel作图。
2结果与分析
2.1培养基与NAA质量浓度对小孢子DH植株生长势的影响
从表1和图1看出,MS培养基中不同营养成分和NAA质量浓度对小孢子DH植株生长具有较大的影响, A2和A3处理有利于小孢子DH植株健壮生长,其胚状体不定芽转接培养小孢子再生植株后,间隔7 d植株净生长高度[12]值统计分析,A2和A3的小孢子DH植株净生长高度始终高于其他处理,35 d时观察小孢子DH植株长势,A2和A3植株生长健壮,叶片鲜绿、面积大,根系数量多、粗壮,移栽时苗质量分别达2.56、2.20 g(图2),与其他处理比较,小孢子DH植株生长势存在显著性差异,差异值主要表现在不定芽转接后培养的28 d内。A4和A5处理小孢子DH植株生长势次之,A1处理小孢子DH植株生长势最弱。处理A2、A3和A4在28 d内植株高度持续增长,但28 ~35 d的植株高度变化不大,而处理A1和A5在35 d内植株高度持续增长。由此得出,1/2MS+0.1 mg/L或0.2 mg/L NAA+8 g/L琼脂+30 g/L蔗糖培养基适宜甘蓝小孢子DH植株健壮生长。
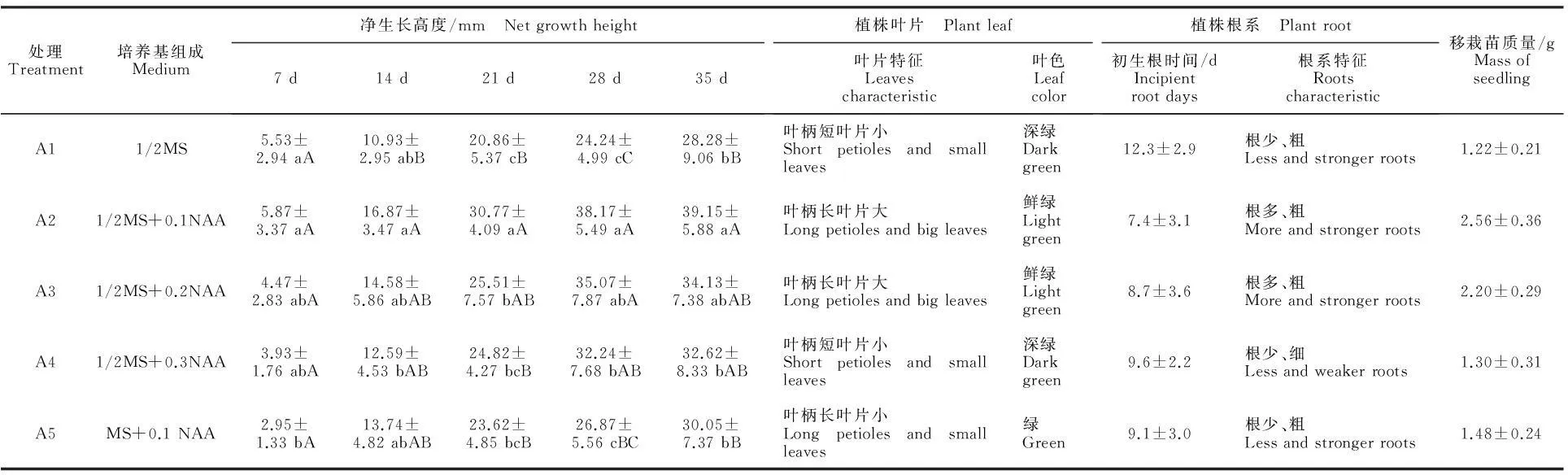
表1 不同培养基与NAA质量浓度下小孢子DH植株生长结果
注:同列数据后不同小写字母表示差异显著(P<0.05),同列数据后不同大写字母表示差异极显著(P<0.01),数据以“平均数±标准差”表示。下同。
Note:Different lowercase in each column indicate significant difference atP<0.05 and different uppercase letters indicate extremely significant difference atP<0.01, the data expressed in “Average±Standard Deviation”.The same below.
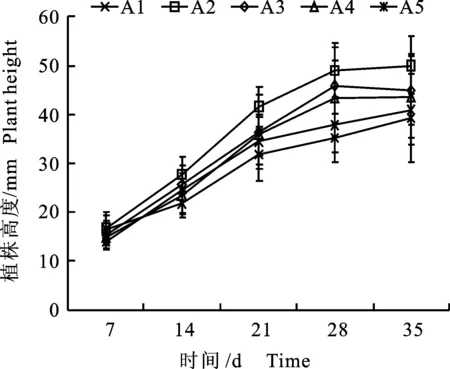
图1 不同培养基与NAA质量浓度下植株的生长高度
2.2光照强度对小孢子DH植株生长势的影响

A.1/2MS+0.1 mg/L NAA培养基中植株形态Plant morphology in 1/2MS+0.1 mg/L NAA culture medium;B. 1/2MS+0.2 mg/L NAA培养基植株形态Plant morphology in 1/2MS+0.2 mg/L NAA culture medium
图21/2MS+0.1 mg/L和0.2 mg/L NAA培养基中培养35d后甘蓝小孢子再生植株形态
从表2和图3看出,适宜的光照强度能够促进小孢子DH植株健壮生长,不同光照强度处理中,80 μmol/(m2·s)的小孢子DH植株生长旺盛,叶片大而厚,间隔7 d植株净生长高度与其他处理存在显著性差异,其植株净生长高度最大,60 μmol/(m2·s)下的次之,40和100 μmol/(m2·s)下的较小。小孢子DH植株初生根时间随着光照强度的增加而减短,植株根系健壮程度在一定光照强度范围内随着光照强度的增加而增强;在80 μmol/(m2·s)下植株根系生长最健壮,表现根多且粗(图4-C);60 μmol/(m2·s)下植株根系生长健壮程度次之(图4-B),表现根多较细;40 μmol/(m2·s)和100 μmol/(m2·s)下植株根系数量较少且粗细不一致(图4-A、D)。光照4个处理在35 d内小孢子DH植株高度值持续增加。由此得出,将甘蓝胚状体不定芽转接后,放置在80 μmol/(m2·s)的光照强度下培养有利于小孢子DH植株快速健壮生长。
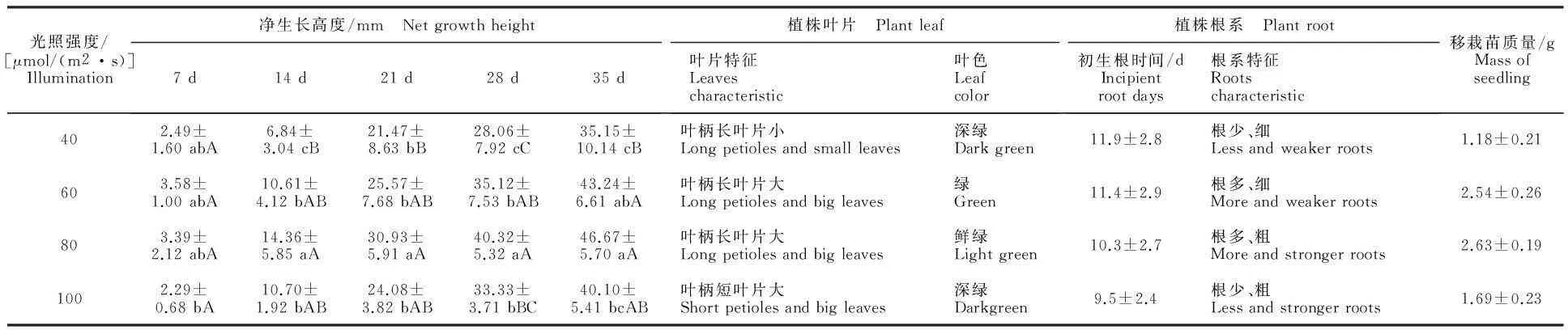
Fig.2 Plant morphology in 1/2MS+ 0.1 mg/L and 0.2 mg/L NAA medium cultured for 35 d
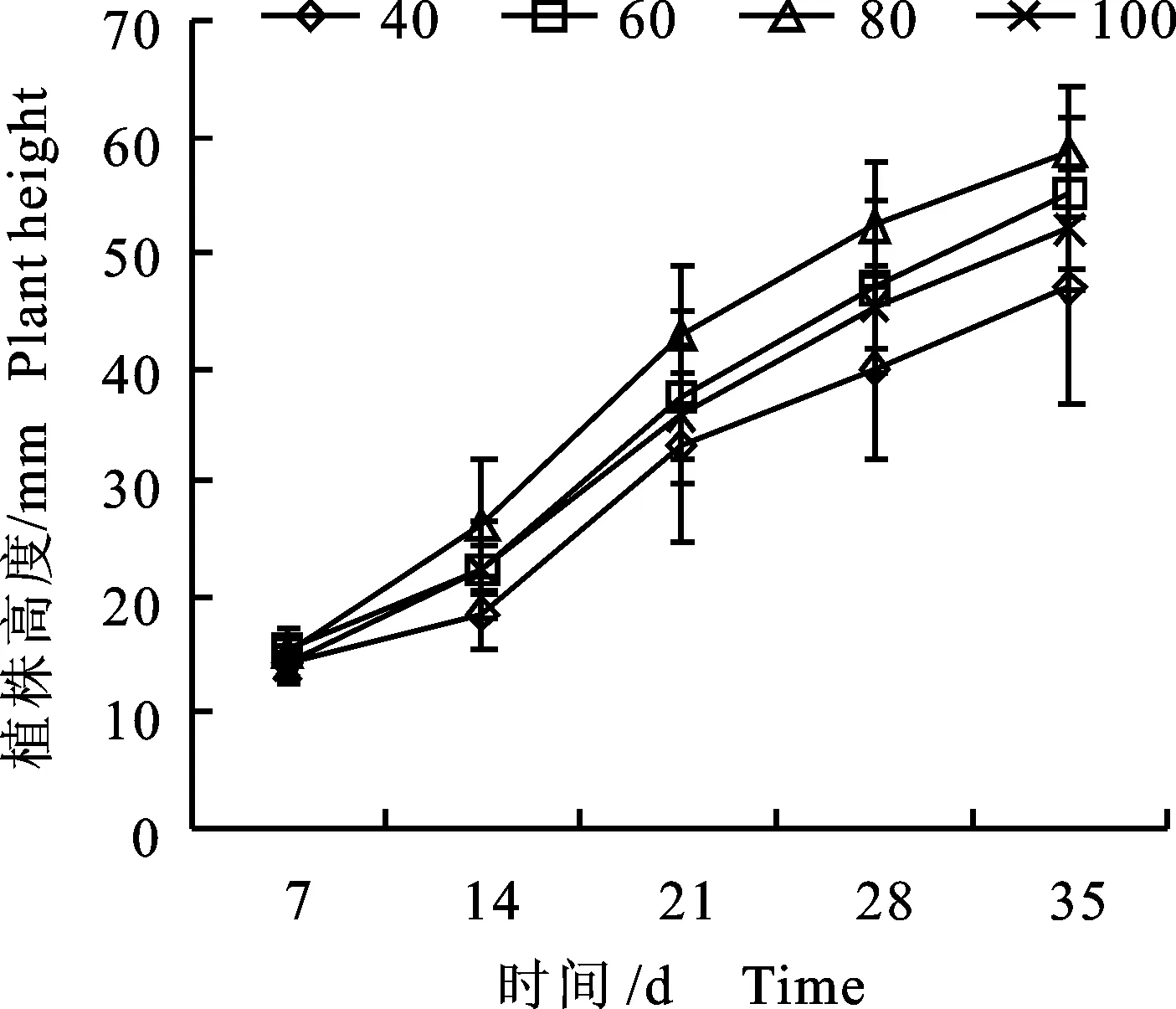
图3 不同光照强度下植株的生长高度
2.3MS培养基添加附加物NH4NO3对小孢子DH植株长势的影响
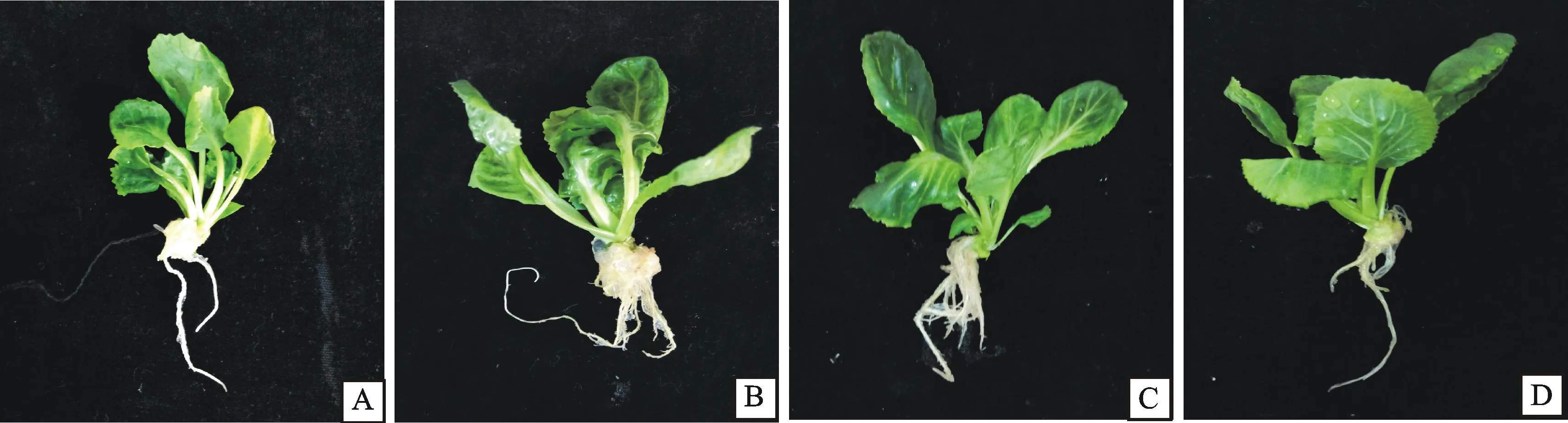
从表3和图5可看出,MS培养基中添加适量的NH4NO3能够促进小孢子DH植株快速、健壮生长,在添加不同质量浓度NH4NO3处理中,转接后7、14 d各处理间植株净生长高度差异不显著,14 d后N1 处理的小孢子DH植株净生长高度间隔7 d分别增加37.40、47.93和56.25 mm,与其他处理存在显著性差异;由小孢子DH植株长势相比较, N1处理的植株生长健壮,叶片大、叶柄长,初生根系时间为7.5 d,根系粗壮,移栽苗质量达到2.80 g;N2处理和 N0处理植株生A.光照强度40 μmol/(m2·s) The illumination is 40 μmol/(m2·s); B.光照强度60 μmol/(m2·s)The illumination is 60 μmol/(m2·s); C.光照强度80 μmol/(m2·s)The illumination is 80 μmol/(m2·s); D.光照强度100 μmol/(m2·s) The illumination is 100 μmol/(m2·s)
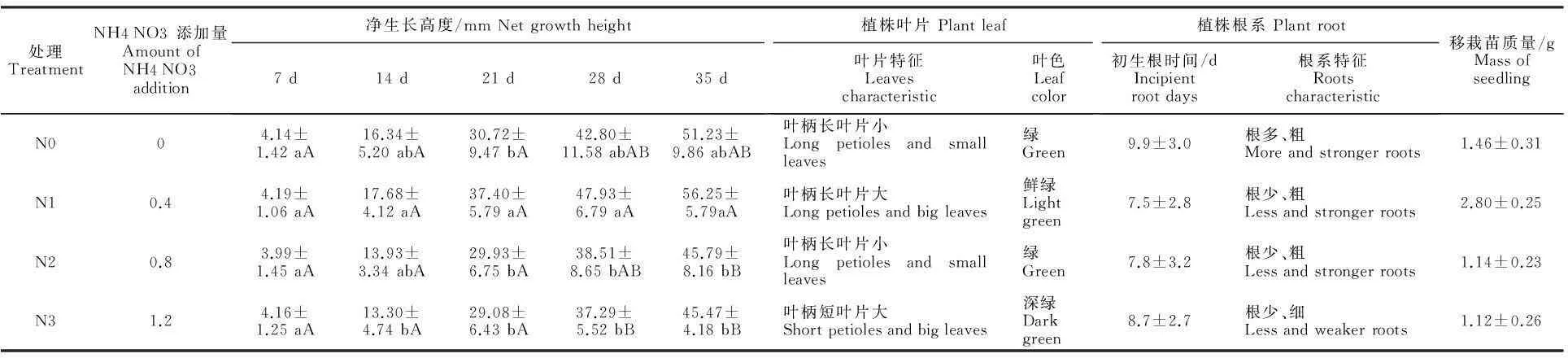
图4 不同光照强度下培养35 d 后植株形态

图5 MS培养基中添加NH4NO3甘蓝小孢子DH植株生长的结果
长势次之,表现出茎叶或根系单一生长健壮; N3处理生长势最差。由此得出,利用MS培养基再生甘蓝小孢子植株时添加0.4 g/L NH4NO3能够促进植株快速健壮生长。
3讨 论
植物地上部分生长与地下部分生长具有相关性,地下部分生长促进地上部分生长,地上部分发育有利于地下部分发育;大量有机物质和矿物质供给才能保障植株地上部分茎叶和地下部分根系快速健壮生长,但不同种类植物的生长对营养物质的种类和需求量是有选择的,尤其在植物组织培养中,培养基的成分对再生植株生长影响较大。本研究结果表明,有机物含量不变、其余物质含量减半的1/2MS培养基比MS培养基在28 d苗龄段内更显著的促进甘蓝小孢子DH植株快速健壮生长,表明,甘蓝小孢子组织培养苗生长对有机物质需要量相对较大,而对矿物质需求量相对较少;但苗龄超过28 d的继续培养会因1/2MS培养基中营养物质含量过少而生长减缓,需要及时继代或炼苗移栽。植物激素α-萘乙酸(NAA)具有促进根系再生的功能,但在培养基中额外添加过多NAA反而不利或抑制根系生长,对根系再生能力较强的甘蓝而言,其生长过程中能分泌出一定量刺激生根的内源激素,因而在组培时未添加NAA时外植体也可缓慢生根。本研究结果也验证这一结论,结果表明,在1/2MS培养基中添加0.1和0.2 mg/L NAA能够促进甘蓝小孢子植株健壮生长,但超过0.2 mg/L NAA易导致小孢子DH植株根系长势弱,植株生长缓慢。
光照强度是影响组培苗光合作用和生长的外在因素,适度提高光照强度可使甘蓝小孢子DH植株更好地生长发育。尹明华等[13]研究认为,高光照强度对红芽芋试管苗的生长发育影响较大,高光照度4 500 lx处理的试管苗新生芽数、新生根数、新生根长和株高均显著高于低光照度处理。王政等[14]研究得出,光照强度变幅为45~81 μmol/(m2·s)时,随着光照强度增加对彩色马蹄莲试管苗的生长有明显的促进作用。本研究中光照强度为80 μmol/(m2·s)时,小孢子DH植株净生长高度较其他光照强度处理显著提高,小孢子DH植株的生根速度较快,根的质量较好,植株生长发育良好;过低的光照强度使小孢子DH植株得不到足够的光照,或过高的光照强度可能抑制光合作用,两者均引起光合产物降低。本试验中光照强度为40或100 μmol/(m2·s)时,可能因光照强度较弱或过强均不利于小孢子DH植株光合作用,从而导致植株长势较弱。

参考文献Reference:
[1]李晓明,李晓红,冯辉.结球甘蓝的杂种优势利用进展[J].辽宁农业科学,2004(5):31-34.
LI X M,LI X H,FENG H.Development on heterosis utilization of the cabbage[J].LiaoningAgriculturalSciences,2004(5):31-34(in Chinese).
[2]严准,田志宏,孟金陵.甘蓝游离小孢子培养的初步研究[J].华中农业大学学报,1999,18(1):10-12.
YAN ZH,TIAN ZH H,MENG J L.Primary study on isolated microspore culture of cabbage(BrassicaoleraceaL.)[J].JournalofHuazhongAgriculturalUniversity,1999,18(1):10-12(in Chinese).
[3]袁素霞,刘玉梅,方智远,等.结球甘蓝和青花菜小孢子胚植株再生[J].植物学报,2010,45(2):226-232.
YUAN S X,LIU Y M,FANG ZH Y,etal.Plant regeneration from microspore-derived embryos in cabbage (BrassicaoleraceaL.var.capitataL.) and broccoli (BrassicaoleraceaL.var.italicPlanch.) [J].ChineseBulletinofBotany,2010,45(2):226-232(in Chinese with English abstract).
[4]LICHTER R.Induction of haploid plants from isolated pollen ofBrassicanapus[J].ZeitischriftFürPflanzenphysiologic,1982,105(5):427-434.
[5]TAKAHATA Y,KELLER W A.High frequency embryogenesis from microspore culture ofBrassicaoleracea[J].PlantBreeding,1990,40(1):134-135.
[6]杨丽梅,方智远,刘玉梅,等.利用小孢子培养选育甘蓝自交系[J].中国蔬菜,2003(6):36-37.
YANG L M,FANG ZH Y,LIU Y M,etal.Breeding inbred lines of cabbage with isolated microspore culture [J].ChinaVegetables,2003(6):36-37(in Chinese).
[7]张恩慧,程芳芳,杨安平,等.株龄、栽培环境及温度对甘蓝小孢子诱导出胚的影响[J].西北农林科技大学学报(自然科学版),2014,42(1):120-124.
ZHANG E H,CHENG F F,YANG A P,etal.Influence of plant age,cultivation environment and temperature on cabbage embryo induction by isolated microspore culture[J].JournalofNorthwestA&FUniversity(NaturalScienceEdition),2014,42(1):120-124(in Chinese with English abstract).
[8]方淑桂,陈文辉,曾小玲,等.结球甘蓝游离小孢子培养及植株再生[J].园艺学报,2006,33(1):158-160.
FANG SH G,CHEN W H,ZENG X L,etal.Isolated microspore culture and plantlet regeneration in cabbage(BrassicaoleraceaL.var.capitataL.) [J].ActaHorticulturaeSinica,2006,33(1):158-160(in Chinese with English abstract).
[9]姜凤英,冯辉,李娜,等.甘蓝类植物游离小孢子培养研究进展[J].辽宁农业科学,2006(5):28-30.
JIANG F Y,FENG H,LI N,etal.Research advance on isolated microspore culture in cabbage vegetable[J].LiaoningagriculturalSciences,2006(5):28-30(in Chinese).
[10]曾爱松,冯翠,高兵,等.结球甘蓝小孢子培养技术体系的优化研究[J].华北农学报,2010,25(增刊):40-44.
ZENG A S,FENG C,GAO B,etal.The optimization study of isolated microspore culture system in cabbage(BrassicaoleraceaL.var.capitataL.) [J].ActaAgriculturaeBoreali-Sinica,2010,25(supplement):40-44(in Chinese with English abstract).
[11]杨安平,张恩慧,王莎莎,等.甘蓝类蔬菜小孢子培养研究进展[J].中国农学通报,2008,24(7):332-335.
YANG A P,ZHANG E H,WANG SH SH,etal.The advances of studies on microspore culture in cabbage vegetables [J].ChineseAgriculturalScienceBulletin,2008,24(7):332-335(in Chinese with English abstract).
[12]刘莹莹,张恩慧,许忠民,等.甘蓝小孢子胚状体分化不定芽再生植株的研究[J].西北农林科技大学学报(自然科学版),2013,41(8):149-154.
LIU Y Y,ZHANG E H,XU ZH M,etal.Adventitious bud regeneration plant differentiation from cabbage microspore embryoid[J].JournalofNorthwestA&FUniversity(NaturalScienceEdition),2013,41(8):149-154(in Chinese with English abstract).
[13]尹明华,王艾平.光照时间和光照强度对红芽芋试管苗生长发育的影响[J].贵州农业科学,2013,41(9):63-65.
YIN M H,WANG A P.Effects of light duration and intensity on the growth of red bud taro plantlets[J].GuizhouAgriculturalSciences,2013,41(9):63-65(in Chinese with English abstract).
[14]王政,郭玉珍,何松林.不同光照强度对彩色马蹄莲试管苗生长的影响[J].西北林学院学报,2011,26(3):84-87.
WANG ZH,GUO Y ZH,HE S L.Effects of illumination on the growth of coloredZantedeschiashoots in virto[J].JournalofNorthwestForestryUniversity,2011,26(3):84-87 (in Chinese with English abstract).
[15]买凯乐,韩富亮,董丽芬,等.N、P、K元素对油松试管苗生长及生根诱导的影响[J].西北林学院学报,2007,22(5):69-71,139.
MAI K L,HAN F L,DONG L F,etal.The effect of nitrogen phosphorus and potassium elements on growth and root induction of test tube seedlings of Chinese pine[J].JournalofNorthwestForestryUniversity,2007,22(5):69-71,139(in Chinese with English abstract).
[16]万学锋,赖钟雄,陈菁瑛.不同培养基质对麦冬离体培养的影响[J].福建农业学报,2013,28(7):670-674.
WAN X F,LAI ZH X,CHEN J Y.Effects of different culture medium onOphiopogonjaponicus(L.F) Kew-Gawl.in vitro culture[J].FujianJournalofAgriculturalSciences,2013,28(7):670-674(in Chinese with English abstract).
[17]张春华,朴炫春,廉美兰,等.培养基组成对满天星试管苗增殖的影响[J].延边大学农学学报,2005,27(1):35-39.
ZHANG CH H,PIAO X CH,LIAN M L,etal.Effect of medium composition on the proliferation ofGypsophilapaniculataL.in vitro[J].JournalofAgriculturalScienceYanbianUniversity,2005,27(1):35-39(in Chinese with English abstract).
[18]牛振明,张国斌,刘赵帆,等.氮素形态及配比对甘蓝养分吸收、产量以及品质的影响[J].草业学报,2013,22(6):68-76.
NIU ZH M,ZHANG G B,LIU ZH F,etal.Effects of different nitrogen forms on nutrient uptake,yield formation and quality of cabbage[J].ActaPrataculturaeSinica,2013,22(6):68-76(in Chinese with English abstract).
Received 2015-10-08Returned2015-11-19
Foundation itemThe National Key Technology Support Program(No.2012BAD02B01); Technical System Project of National Bulk Vegetable Industry(No.CARS-25); Science and Technology Innovation Project of Shaanxi Province(No.2012NKC02-05).
First authorLIU Zheng, male, master student.Research area: cabbage breeding and biotechnology.E-mail:liuzhenglxy@163.com
(责任编辑:顾玉兰Responsible editor:GU Yulan)
Influence of Several Factors on Growth of DH Plants Regenerated from Microspores in Cabbage
LIU Zheng, ZHANG Enhui, CHENG Yong’an, XU Zhongmin and WANG Gaigai
(College of Horticulture, Northwest A&F University, Yangling Shaanxi 712100, China)
AbstractAims to screen the most appropriate medium and illumination for DH plants regenerated from microspore in cabbage and to shorten culture time of obtaining robust plants, which will accelerate the breeding process of cabbage double haploid. Microspores of ‘Qin-gan 50’ cabbage was cultured until emergence of adventitious buds which then transferred to two kinds of mediums (1/2MS+0,0.1,0.2,0.3 mg/L NAA and MS+0.1 mg/L NAA), adding different amount of NH4NO3(0,0.4,0.8,1.2 g/L) in MS medium and cultured at different illumination [40,60,80,100 μmol/(m2·s)] . Then the growth vigor of the DH plants were studied and the most appropriate medium and culture conditions could be gotten. The DH plants grown in 1/2MS +0.1 mg/L NAA medium had the fastest growth rate and strong growth vigor, rooting fast;cultured in the illumination of 80 μmol/(m2·s),the DH plants had the most remarkable growth speed, better roots and leaves, which rooted in 10.3 days;the DH plants in MS medium with added 0.4 g/L NH4NO3 had the maximum value 56.25 mm of net growth height in 35 days. In conclusion, the appropriate medium for the DH plants regenerated from microspore in cabbage is 1/2MS+0.1 mg/L NAA+8 g/L Agar+30 g/L Sugar;cultured in the illumination of 80 μmol/(m2·s) or transferred into the MS medium with added 0.4 g/L NH4NO3, the DH plants grown well with robust roots, stems and leaves.
Key wordsCabbage; DH plants; Regeneration from microspores; Medium; Illumination; NH4NO3
收稿日期:2015-10-08修回日期:2015-11-19
基金项目:国家科技支撑计划(2012BAD02B01);国家大宗蔬菜产业技术体系(CARS-25);陕西省科技创新(2012NKC02-05)。
通信作者:张恩慧,男,教授,硕士生导师,研究方向为甘蓝育种与生物技术。E-mail:ganlan606@126.com
中图分类号S635.1
文献标志码A
文章编号1004-1389(2016)04-0605-07
Corresponding authorZHANG Enhui,male,professor,master supervisor.Research area:cabbage breeding and biotechnology.E-mail:ganlan606@126.com
网络出版日期:2016-04-02
网络出版地址:http://www.cnki.net/kcms/detail/61.1220.S.20160402.1118.034.html
第一作者:刘争,男,硕士研究生,研究方向为甘蓝育种与生物技术。E-mail:liuzhenglxy@163.com

