氧化苦参碱对宫颈癌HeLa细胞侵袭转移的抑制作用
高 庆,高 美,屈 萍,李岐佩,陈 茜
(1. 西安交通大学第二附属医院妇产科,陕西西安 710004;2.西安高新医院妇产科,陕西西安 710075)
◇中医药研究◇
氧化苦参碱对宫颈癌HeLa细胞侵袭转移的抑制作用
高庆1,高美1,屈萍2,李岐佩1,陈茜1
(1. 西安交通大学第二附属医院妇产科,陕西西安710004;2.西安高新医院妇产科,陕西西安710075)
摘要:目的观察氧化苦参碱对宫颈癌HeLa细胞侵袭转移的作用及其相关分子机制。方法MTT法检测氧化苦参碱的抗增殖活性;Transwell小室法检测氧化苦参碱对HeLa细胞增殖的影响;Real-time PCR法检测氧化苦参碱对宫颈癌HeLa细胞侵袭转移能力的影响;Western blot法检测氧化苦参碱对MMP-2、MMP-9、AKT及p-AKT表达水平的影响。结果氧化苦参碱能够有效抑制HeLa细胞的增殖,与对照组(0 mg/mL)相比,氧化苦参碱高于0.8 mg/mL时出现明显差异。低于细胞毒性浓度(0.8 mg/mL)的氧化苦参碱能够明显抑制HeLa细胞的侵袭能力,随着氧化苦参碱浓度的升高穿过基质胶到达小室底端的细胞数目明显减少,0.1、0.2和0.4 mg/mL组分别为对照组的(77.07±20.43)%、(53.95±18.17)%、(20.35±11.20)%;0.1、0.2、0.4 mg/mL组MMP-2的RNA水平分别为对照组的(82.76±8.71)%、(39.51±12.79)%、(21.53±5.38)%,0.4 mg/mL组MMP-2的蛋白水平为对照组的(64.69±16.52)%;0.4 mg/mL组AKT的磷酸化水平为对照组的(41.27±7.13)%。结论氧化苦参碱能够明显抑制宫颈癌HeLa细胞的侵袭转移,这种作用可能是通过调节AKT信号通路的活性进而调节MMP-2的表达来实现的。本研究为氧化苦参碱的抗肿瘤机制增添了新的内容。
关键词:氧化苦参碱;宫颈癌;侵袭;基质金属蛋白酶
全球范围内,宫颈癌是导致女性癌症相关死亡的第二大病因[1]。近年来针对人乳头状瘤病毒(human papilloma virus, HPV)等早期诊断方法的发现与应用,有效地降低了宫颈癌的发病率和死亡率,并改善了宫颈癌患者的长期生存率[2-4]。但是,很多患者在诊断时已经发生侵袭转移,必须接受相应的化学治疗,而这些化疗药物毒性较大且存在耐受性差的问题,很多患者在接受化疗之后出现化疗耐药,并最终导致患者死亡[5]。
越来越多的证据显示,从植物中提取的一些天然药物在抗肿瘤领域正在被越来越多的专家认可,其中最具代表性的是长春新碱和紫杉醇。苦参是中药苦参根的干燥制剂,而氧化苦参碱是苦参中一种重要的碱性成分,具有抗炎、抗过敏、抗纤维化和免疫调节等多种功能[6-9]。最近研究发现,氧化苦参碱具有明确的抗肿瘤作用[10]。基于以上,本研究的目的在于明确氧化苦参碱在宫颈癌细胞侵袭转移过程中的作用及其可能机制。
1材料与方法
1.1主要试剂氧化苦参碱分子式为C15H24N2O2,相对分子质量为264.36,纯度大于98%。实验之前先利用DMSO将氧化苦参碱溶解制成母液、储存于-20 ℃冰箱内,然后在干预之前对母液进行稀释。
1.2细胞培养人宫颈癌HeLa细胞系为本实验室保有,培养于含有100 mL/L血清的高糖培养基中,培养环境为37 ℃、50 mL/L CO2。细胞2~3 d换液1次,当细胞融合率达到70%~80%时进行传代。
1.3细胞活性的检测MTT法检测氧化苦参碱作用后HeLa细胞的活性。首先取对数生长期细胞接种于96孔板中(Corning, USA)(1×103细胞/孔),4 h 后待细胞完全贴壁后加入不同质量浓度的氧化苦参碱(0、0.2、0.4、0.8、1.0、1.5 mg/mL)。细胞培养24 h后,每孔加入MTT(5 mg/mL, Sigma-Aldrich)20 μL 37 ℃继续培养4 h,然后每孔加入DMSO(Sigma-Aldrich)150 μL,最后将96孔板在酶标仪中(Model 3550,Bio-Rad)进行吸光度测量,波长为490 nm。计算公式为:(1-实验组吸收光度值/对照组吸收光度值)×100%,所有实验均重复3次。
1.4细胞侵袭实验取对数生长期HeLa细胞,胰酶常规消化后利用血清浓度为20 mL/L的培养基制成5×105/mL细胞悬液,在Tranwell小室上室中,加入含有不同浓度氧化苦参碱的细胞悬液0.4 mL,下室中加入血清浓度为100 mL/L的常规培养基。24 h后取出小室对细胞进行固定,去除上室中残留细胞,对下室中细胞进行固定、染色,其后随机选取5个视野进行拍照和计数。
1.5Real-time PCR检测氧化苦参碱对MMP-2、MMP-9转录水平的影响Trizol法提取各组细胞中总RNA,根据TaKaRa公司PrimeScript RT-PCR Kit试剂说明书进行反转录cDNA。以cDNA为模板进行Real-time PCR反应并对结果进行分析,引物设计见表1,实验重复3次。
表1Real-time PCR引物序列
Tab.1Gene-specific primer pairs used for real-time PCR
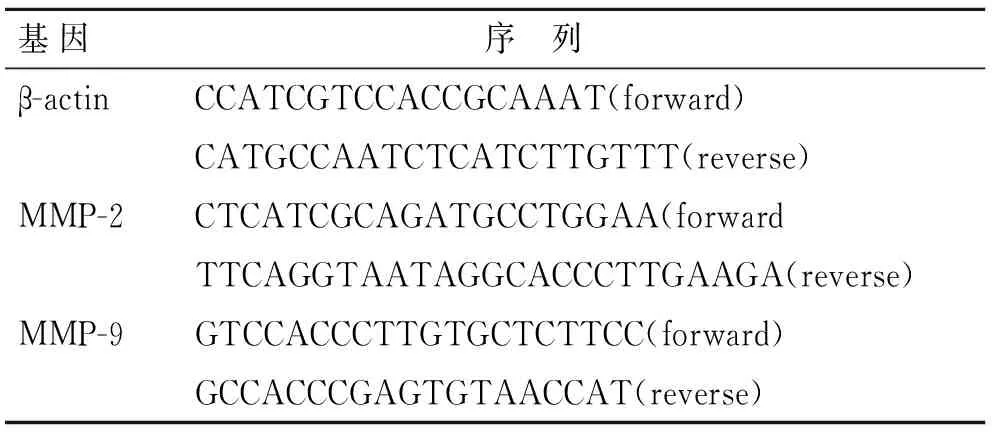
基因序 列 β-actinCCATCGTCCACCGCAAAT(forward)CATGCCAATCTCATCTTGTTT(reverse)MMP-2CTCATCGCAGATGCCTGGAA(forwardTTCAGGTAATAGGCACCCTTGAAGA(reverse)MMP-9GTCCACCCTTGTGCTCTTCC(forward)GCCACCCGAGTGTAACCAT(reverse)
1.6免疫印迹实验氧化苦参碱(0.4 mg/mL)作用24 h后,收集细胞并进行裂解,采用BCA(Bio-Rad)法检测蛋白浓度,100 g/L SDS-PAGE对样品进行电泳。电泳完成后利用PVDF膜(Millipore, Billerica, MA)进行转膜,首先在50 g/L脱脂牛奶中将转膜后的PVDF膜常温封闭1 h,一抗4 ℃过夜,次日取出PVDF膜TBST洗膜3次,每次15 min,将PVDF膜放入装有相应二抗的孵育盒中,常温孵育1 h。将PVDF膜再次用TBST溶液洗涤3次,然后加入发光液进行发光,最后进行图像采集与分析,实验重复3次。
2结果
2.1氧化苦参碱对HeLa细胞增殖的影响氧化苦参碱对HeLa细胞的增殖具有明显的抑制作用,随着氧化苦参碱质量浓度的升高,其对HeLa细胞增殖的抑制作用逐渐增强,与对照组相比,当质量浓度达到0.8 mg/mL时差异具有统计学意义(图1)。
2.2氧化苦参碱对HeLa细胞侵袭能力的影响本研究前期实验结果显示,氧化苦参碱能够明显抑制HeLa细胞的增殖,这种作用在低于0.6 mg/mL时无统计学差异。为此,我们选择低于0.6 mg/mL质量浓度的氧化苦参碱作为检测其抗侵袭能力的实验浓度。结果发现,在低于细胞毒性浓度的情况下,氧化苦参碱能够明确抑制HeLa细胞的侵袭能力,这种抑制作用随着药物浓度的升高而增强,差异具有统计学意义(图2)。
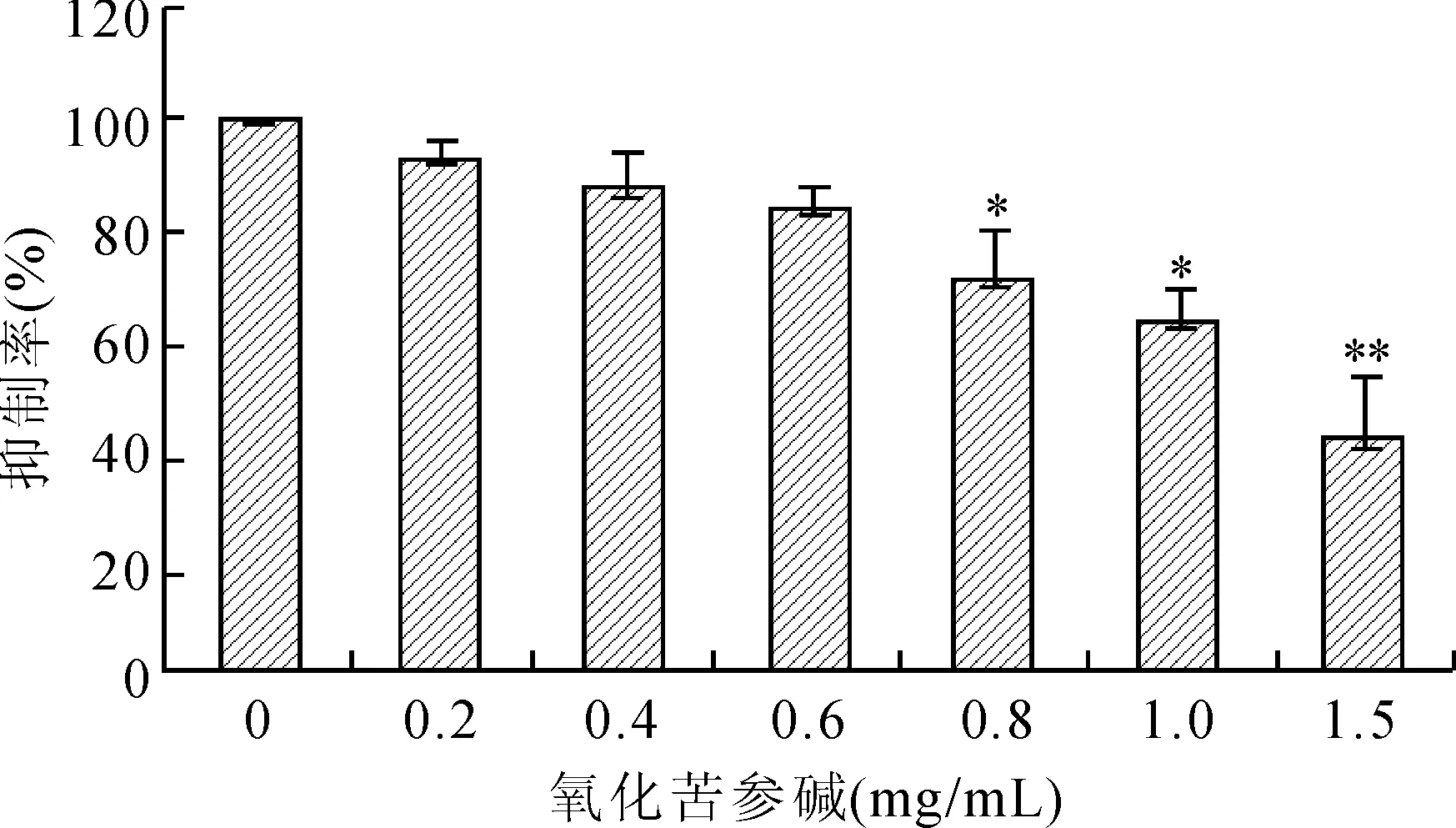
图1氧化苦参碱对HeLa细胞增殖的抑制作用
Fig.1 The inhibitory effect of oxymatrine on the proliferation of HeLa cells
与对照组(0 mg/mL)比较,*P<0.05,**P<0.01。
2.3氧化苦参碱对MMP-2、MMP-9 mRNA转录的影响为了进一步检测氧化苦参碱抑制HeLa细胞侵袭转移的机制,我们利用Real-time PCR技术检测了氧化苦参碱对MMP-2、MMP-9 mRNA转录的影响。结果发现,氧化苦参碱能够在mRNA水平明显抑制MMP-2的转录,差异具有统计学意义(图3)。但是氧化苦参碱对MMP-9的转录没有明显的抑制作用。
2.4氧化苦参碱对MMP-2和MMP-9蛋白表达的影响进一步检测了氧化苦参碱对HeLa细胞中MMP-2的蛋白表达的影响,结果发现,氧化苦参碱能够明显抑制MMP-2的蛋白表达水平,这种作用随着氧化苦参碱浓度的升高而增强,差异具有统计学意义(图4)。与Real-time PCR中结果一样,氧化苦参碱对MMP-9的表达没有明显的抑制作用。


图2 氧化苦参碱对HeLa细胞侵袭转移能力的影响Fig.2TheeffectofoxymatrineontheinvasionofHeLacellsA:氧化苦参碱0mg/mL;B:氧化苦参碱0.1mg/mL;C:氧化苦参碱0.2mg/mL;D:氧化苦参碱0.4mg/mL;E:Tranwell小室下室中细胞计数比较。与对照组(0mg/mL)比较,*P<0.05,**P<0.01。

图3氧化苦参碱对HeLa细胞中MMP-2和MMP-9转录水平的影响
Fig.3 The effect of oxymatrine on the expressions of MMP-2 and MMP-9 in HeLa cells
与对照组(0 mg/mL)比较,**P<0.01。
2.5氧化苦参碱对AKT磷酸化水平的影响为了进一步探讨氧化苦参碱抑制HeLa细胞侵袭、转移的可能调控机制,本研究检测了氧化苦参碱对AKT信号通路活性的影响。结果发现,氧化苦参碱能够明显抑制AKT的磷酸化水平(图5),提示氧化苦参碱能够抑制HeLa细胞的信号通路的活性。

图4氧化苦参碱对MMP-2和MMP-9蛋白表达的影响
Fig.4 The effect of oxymatrine on the expressions of MMP-2 and MMP-9 at the protein level in HeLa cells
与对照组(0 mg/mL)比较,*P<0.05。

图5氧化苦参碱对AKT信号通路活性的影响
Fig.5 The effect of oxymatrine on the activity of AKT signaling pathway
与对照组(0 mg/mL)比较,**P<0.01。
3讨论
苦参在中医药中的应用已经有上千年的历史,具有明确的抗炎、抗纤维化和免疫调节等功能。氧化苦参碱是苦参中重要的活性成分之一。近年研究发现,氧化苦参碱能够有效抑制胃癌、胰腺癌和结肠癌细胞的增殖[11-14]。也有研究发现氧化苦参碱可有效抑制宫颈癌HeLa细胞的体外增殖能力及裸鼠体内的成瘤能力[15]。但至今为止还未见氧化苦参碱对宫颈癌细胞侵袭转移作用的文献报道。本研究发现,氧化苦参碱能够在体外有效抑制宫颈癌HeLa细胞的增殖,且具有明显的剂量效应关系。低于细胞毒性剂量的氧化苦参碱干预后,HeLa细胞侵袭能力明显降低,随着氧化苦参碱浓度的增高,穿过基底膜到达小室下端的细胞逐渐减少,呈现明显剂量效应关系。
肿瘤的侵袭转移是导致患者预后不良和死亡的重要原因。侵袭转移的发生提示宫颈癌患者的治疗效果不佳并最终影响患者的预后。研究表明复发和转移是影响宫颈癌患者预后的最为重要的因素[16]。在肿瘤的侵袭转移过程中,很多分子与信号通路参与其中,这些分子和信号通路通过在肿瘤侵袭转移过程中的各个环节发挥作用,最终影响肿瘤的侵袭转移过程,MMP就是这些分子中的重要组成部分。研究发现,MMP-2和MMP-9在宫颈癌的侵袭转移过程中发挥重要作用,且为多种药物和分子调节宫颈癌细胞侵袭转移的关键分子[17-18]。有研究认为MMP-2和MMP-9与宫颈癌患者的预后密切相关,可作为判断患者预后的标志性分子[19-20]。在本研究中我们发现,氧化苦参碱能够有效抑制HeLa细胞中MMP-2的mRNA和蛋白水平的表达,提示氧化苦参碱对HeLa细胞侵袭转移的抑制作用,与其对MMP-2表达的调节作用相关。
AKT信号通路在多种肿瘤的发生和进展过程中发挥重要作用,其中就包括宫颈癌[21]。此外,研究发现抑制AKT信号通路的活性,能够降低胃癌细胞中MMP-2和MMP-9蛋白的表达水平,从而抑制胃癌细胞的侵袭[22]。在宫颈癌细胞中,AKT信号通路能够通过有效调节MMP-2的表达与活性,进一步影响宫颈癌细胞增殖、侵袭与转移[23]。在宫颈癌HeLa细胞中,Toll样受体能够通过对AKT信号通路活性的调节,对多种基因的表达产生影响[24]。在本研究中我们发现,氧化苦参碱能够有效抑制HeLa细胞中AKT的磷酸化水平,说明其能够有效抑制AKT信号通路的活性,提示其对宫颈癌HeLa细胞侵袭转移的调节作用与其对AKT信号通路的活性抑制相关。
综上,本研究发现氧化苦参碱能够有效抑制宫颈癌HeLa细胞的增殖与侵袭转移,而这种作用可能是通过降低AKT信号通路的活性进而抑制MMP-2的表达来实现的,提示氧化苦参碱是一种潜在的抗宫颈癌药物。
参考文献:
[1] HAUSEN HZ. Papillomaviruses and cancer: from basic studies to clinical application[J]. Nat Rev Cancer, 2002, 2(5):342-350.
[2] KARNON J, PETERS J, PLATT J, et al. Liquid-based cytology in cervical screening: an updated rapid and systematic review and economic analysis[J]. Health Technol Assess, 2004, 8(20):iii, 1-78.
[3] U.S. PREVENTIVE SERVICES TASK FORCE. Screening for cervical cancer: recommendations and rationale[J]. Am J Nurs, 2003, 103(11):101-102, 105-106, 108-109.
[4] KLAES R, BENNER A, FRIEDRICH T, et al. p16INK4a immunohistochemistry improves interobserver agreement in the diagnosis of cervical intraepithelial neoplasia[J]. Am J Surg Pathol, 2002, 26(11):1389-1399.
[5] SIVANESARATNAM V. The role of chemotherapy in cervical cancer—a review[J]. Singapore Med J, 1988, 29(4):397-401.
[6] CAO YG, JING S, LI L, et al. Antiarrhythmic effects and ionic mechanisms of oxymatrine from Sophora flavescens[J]. Phytother Res, 2010, 24(12):1844-1849.
[7] CUI X, WANG Y, KOKUDO N, et al. Traditional Chinese medicine and related active compounds against hepatitis B virus infection[J]. Biosci Trends, 2010, 4(2):39-47.
[8] DENG ZY, LI J, JIN Y, et al. Effect of oxymatrine on the p38 mitogen-activated protein kinases signalling pathway in rats with CCl4 induced hepatic fibrosis[J]. Chin Med J (Engl), 2009, 122(12):1449-1454.
[9] FAN H, LI L, ZHANG X, et al. Oxymatrine downregulates TLR4, TLR2, MyD88, and NF-kappaB and protects rat brains against focal ischemia[J]. Mediators Inflamm, 2009(2):271-287.
[10] GUO B, ZHANG T, SU J, et al. Oxymatrine targets EGFR(p-Tyr845) and inhibits EGFR-related signaling pathways to suppress the proliferation and invasion of gastric cancer cells[J]. Cancer Chemother Pharmacol, 2015, 75(2):353-363.
[11] SONG MQ, ZHU JS, CHEN JL, et al. Synergistic effect of oxymatrine and angiogenesis inhibitor NM-3 on modulating apoptosis in human gastric cancer cells[J]. World J Gastroenterol, 2007, 13(12):1788-1793.
[12] LING Q, XU X, WEI X, et al. Oxymatrine induces human pancreatic cancer PANC-1 cells apoptosis via regulating expression of Bcl-2 and IAP families, and releasing of cytochrome c[J]. J Exp Clin Cancer Res, 2011, 30(1):66-66.
[13] ZHANG Y, PIAO B, HUA B, et al. Oxymatrine diminishes the side population and inhibits the expression of beta-catenin in MCF-7 breast cancer cells[J]. Med Oncol, 2011, 28 (Suppl 1):S99-107.
[14] ZOU J, RAN ZH, XU Q, et al. Experimental study of the killing effects of oxymatrine on human colon cancer cell line SW1116[J]. Chin J Dig Dis, 2005, 6(1):15-20.
[15] LI M, SU BS, CHANG LH, et al. Oxymatrine induces apoptosis in human cervical cancer cells through guanine nucleotide depletion[J]. Anticancer Drugs, 2014, 25(2):161-173.
[16] MORIMOTO K, KIM SJ, TANEI T, et al. Stem cell marker aldehyde dehydrogenase 1-positive breast cancers are characterized by negative estrogen receptor, positive human epidermal growth factor receptor type 2, and high Ki67 expression[J]. Cancer Sci, 2009, 100(6):1062-1068.
[17] ROOMI MW, KALINOVSKY T, CHA J, et al. Effects of a nutrient mixture on immunohistochemical localization of cancer markers in human cervical cancer HeLa cell tumor xenografts in female nude mice[J]. Exp Ther Med, 2015, 9(2):294-302.
[18] CHU SC, YU CC, HSU LS, et al. Berberine reverses epithelial-to-mesenchymal transition and inhibits metastasis and tumor-induced angiogenesis in human cervical cancer cells[J]. Mol Pharmacol, 2014, 86(6):609-623.
[19] OTA S, MIYAJIMA Y, NAKASHIMA A, et al. Expression of matrix metalloproteinase-2 (mmp-2) in cervical neoplasia-immunohistochemical and in-situ hybridization studies[J]. Int J Oncol, 1994, 5(6):1301-1304.
[20] GHOSH A, MOIRANGTHEM A, DALUI R, et al. Expression of matrix metalloproteinase-2 and 9 in cervical intraepithelial neoplasia and cervical carcinoma among different age groups of premenopausal and postmenopausal women[J]. J Cancer Res Clin Oncol, 2014, 140(9):1585-1593.
[21] BAI X, MA Y, ZHANG G. Butein suppresses cervical cancer growth through the PI3K/AKT/mTOR pathway[J]. Oncol Rep, 2015, 33(6):3085-3092.
[22] ZHANG J, ZHANG QY, FU YC, et al. Expression of p-Akt and COX-2 in gastric adenocarcinomas and adenovirus mediated Akt1 and COX-2 ShRNA suppresses SGC-7901 gastric adenocarcinoma and U251 glioma cell growth in vitro and in vivo[J]. Technol Cancer Res Treat, 2009, 8(6):467-478.
[23] RAH B, AMIN H, YOUSUF K, et al. A novel MMP-2 inhibitor 3-azidowithaferin A (3-azidoWA) abrogates cancer cell invasion and angiogenesis by modulating extracellular Par-4[J]. PLoS One, 2012, 7(9):e44039.
[24] LI L, CHENG FW, WANG F, et al. The activation of TLR7 regulates the expression of VEGF, TIMP1, MMP2, IL-6, and IL-15 in Hela cells[J]. Mol Cell Biochem, 2014, 389(1-2):43-49.
(编辑卓选鹏)
Effect of oxymatrine treatment on the invasion of human cervical cancer cells
GAO Qing1, GAO Mei1, QU Ping2, LI Qi-pei1, CHEN Qian1
(1. Department of Obstetricsand Gynecology, the Second Affiliated Hospital of Xi’an Jiaotong University, Xi’an 710004; 2. Department of Obstetrics and Gynecology, Xi’an High-tech Hospital, Xi’an 710075, China)
ABSTRACT:ObjectiveTo investigate the anticancer effect of oxymatrine on cervical cancer cell line (HeLa). MethodsMTT assay was used to detect the anti-proliferative effect of oxymatrine. Transwell chamber was used to detect the anti-metastatic effect of oxymatrine. Real-time PCR was used to detect the mRNA levels of MMP-2 and MMP-9. Western blot was used to detect the protein levels of MMP-2, MMP-9, AKT, p-AKT and GADPH. ResultsWe found that application of oxymatrine significantly inhibited the growth of HeLa cells at the concentration above 0.8 mg/mL. We also found that oxymatrine (0.1, 0.2 and 0.4 mg/mL) inhibited the invasion of HeLa cells under cytotoxic dose, which was (77.07±20.43)%, (53.95±18.17)% and (20.35±11.20)% of cells that migrated through the matrigel when compared with those of non-oxymatrine treatment group (P<0.05). Further research found that oxymatrine (0.1, 0.2 and 0.4 mg/mL) could reduce the expression of MMP-2 at the mRNA level, i.e. (82.76±8.71)%, (39.51±12.79)% and (21.53±5.38)% of the expression level when compared with that of non-oxymatrine treatment group (P<0.05). The protein expression level of MMP-2 in 0.4 mg/mL group was (64.69 ±16.52)% of non-oxymatrine treatment group (P<0.05). The phosphorylation level of AKT in 0.4 mg/mL group was (41.27±7.13)% of non-oxymatrine treatment group (P<0.05). ConclusionOxymatrine can inhibit the invasion of HeLa cells by reducing the expression of MMP-2 via inhibiting the activity of AKT signal pathway. All together, our findings bring new insights into the mechanism of the anticancer effects induced by oxymatrine treatment.
KEY WORDS:oxymatrine; cervical cancer; invasion; matrix metalloproteinase (MMP)
收稿日期:2015-06-21修回日期:2015-12-15
基金项目:陕西省自然科学基金研究计划资助项目(No.2014JM4143)
通讯作者:陈茜. E-mail: chenqian@mail.xjtu.edu.cn
中图分类号:R737.33
文献标志码:A
DOI:10.7652/jdyxb201603030
Supported by the Natural Science Foundation of Shaanxi Provice (No.2014JM4143)
优先出版:http://www.cnki.net/kcms/detail/61.1399.R.20160411.1029.012.html(2016-04-11)

