抑制辣椒炭疽菌的生防芽孢杆菌菌株筛选和鉴定*
喇文军,贾书娟,吴小丽,曾大兴(深圳职业技术学院 应用化学与生物技术学院,广东 深圳 518055)
抑制辣椒炭疽菌的生防芽孢杆菌菌株筛选和鉴定*
喇文军,贾书娟,吴小丽,曾大兴*
(深圳职业技术学院 应用化学与生物技术学院,广东 深圳 518055)
摘 要:从植物根际土壤分离筛选获得的芽孢杆菌C-D6菌株对辣椒炭疽菌(Colletotrichum capsici)显示明显的抑制作用.通过形态观察、16S rDNA序列同源性分析以及tetB-tetL基因特异序列扩增,鉴定该菌为枯草芽孢杆菌(Bacillus subtilis).实验结果表明:C-D6菌株在PDA平板上对辣椒炭疽菌、尖孢镰刀菌、苞叶芋柱帚霉和烟草疫霉等多种重要植物病原真菌具有明显的拮抗作用.显微观察发现:C-D6菌株的细菌培养液对辣椒炭疽菌的附着胞形成具有强烈的抑制作用.表明该菌株对辣椒炭疽菌引起的炭疽病的生物防治具有潜在的应用价值.
关键词:枯草粉芽孢杆菌;辣椒炭疽菌;附着胞形成
辣椒炭疽菌(Colletotrichum capsici)引起辣椒黑点炭疽病,是辣椒果实的主要病害之一,可造成辣椒减产甚至绝收,并严重影响辣椒品质[1].此外,该菌分布广泛,在华南地区可危害多种蔬菜、花卉、药用植物和大田作物,引起烂果、枯枝和叶斑等症状,对农林生产造成严重危害[2-3].化学防治和选用抗病品种是作物真菌病害的主要防治途径,在各种炭疽病的防治上也广泛采用.然而,由于化学防治易使病原菌产生抗药性,污染环境和农产品,导致抗病品种易退化等原因,使多种炭疽病处于较难防治的困境.
生物防治因其具有无毒无害、无污染、不产生抗药性和持续高效等优点,符合农业可持续发展的要求,是当前和未来植物病害综合防治的发展方向.植物病害生物防治的研究策略是从自然界筛选拮抗微生物,利用其营养竞争、重寄生、诱导抗性及产生抗生素、水解酶等多种方式作用于病原菌,杀死病原菌或抑制其菌丝生长,从而实现病害防治目的[4].应用拮抗细菌及其产生的抗菌物质开展炭疽病的生物防治研究取得了一些进展[5-6].然而,以抑制病原菌生长或直接杀死病原菌的传统生防策略对于炭疽病的防治存在明显的局限,原因是炭疽病为潜伏侵染病害,其潜伏侵染的菌丝会受到植物的保护而使生防因子不能作用[7].
为探索炭疽病新的生物防治途径,我们以辣椒炭疽菌侵入循环中的附着胞形成为靶点,建立了快速筛选抑制附着胞形成的细菌菌株的实验方法[8].通过大量筛选工作,从一份土壤样品中获得了一株能明显抑制该菌附着胞形成,并具有广谱抗菌性的芽孢杆菌菌株.本文给出该菌株的筛选、鉴定及对辣椒炭疽菌的抑菌特征.
1 材料与方法
1.1菌株
芽孢杆菌C-D6菌株从安徽省旌德县采集的农田土壤分离筛选获得.供试病原菌:辣椒炭疽菌(Colletotrichum capsici)501、希金斯炭疽菌(C.higginsianum)CGZ-1、胶孢炭疽菌(C.gloeosporioides)Mg1、尖孢镰刀菌(Fusarium oxysporum)F2,FDC-4、稻瘟病菌(Magnaporthe grisea)SD-3、烟草疫霉(Phytophthora nicotianae)DBL-1、苞叶芋柱帚霉(Cylindrocladium spathiphylli)Zh-20和立枯丝核菌(Rhizoctonia solani)RH-5.胶孢炭疽菌、希金斯炭疽菌和烟草疫霉菌株由深圳职业技术学院微生物室分离保存;辣椒炭疽菌、尖孢镰刀菌和稻瘟病菌等菌株由华南农业大学植病系真菌研究室赠送.
1.2培养基
PDA培养基:马铃薯 200 g/L,葡萄糖20 g/L,琼脂 20 g/L.酵母膏蛋白胨培养基(YPD):酵母膏10 g/L,蛋白胨10 g/L,葡萄糖10 g/L.牛肉膏蛋白胨培养基:牛肉膏 3 g/L,蛋白胨 10 g/L,NaCl 5 g/L.PDA培养基为天然pH,其余培养基pH为7.0~7.2.
1.3菌株的筛选
菌株筛选参照文献[8]的方法进行,即采用稀释平板分离法分离土壤细菌,分离培养基为牛肉膏蛋白胨培养基,分离平板37℃恒温培养24 h后,挑起单菌落转接到的96孔板中(每孔含200µL YPD培养基),37℃培养18~24h后,取20µL培养液与含300U/mL青霉素和300µg/mL硫酸链霉素的等量炭疽菌孢子悬液(1×106/mL)混合后,滴加到载片中央,25℃保湿培养,10~12h后进行显微观察,选取抑制附着胞形成的菌株为初筛菌株.初筛菌株接种到YPD培养基中,37℃,250r/min摇床培养24h后,离心收集培养液,过滤除菌后,用上述载片培养方法进行3轮复筛.选取抑制率高和作用效果稳定的菌株为目标菌株.
1.4细菌的形态特征观察
将C-D6菌株划线接种到牛肉膏蛋白胨培养基上,37℃培养18h后,观察菌落形态;取样涂布制片,进行革兰氏染色,观察菌体形态,测量其大小.
1.5菌株C-D6的16SrDNA序列分析
采用AxyPrep基因组DNA小量试剂盒(Axygen 公司)提取菌株C-D6的基因组DNA.以基因组DNA为模板,细菌通用引物8F (5′-GAGAGTTTGATCCTGGCTCAG-3′)和1492R (5′-GGYTACCTTGTTACGACTT-3′)为扩增引物,PCR扩增16S rDNA片段.PCR 反应体系选用25µL反应体系,扩增条件为:95℃ 5 min;95℃ 1 min,55℃ 1 min,72℃ 2 min,40循环;72℃ 10 min.扩增产物经1%琼脂糖凝胶电泳检测后,委托上海生工生物技术有限公司进行测序,将测序结果提交GenBank 核酸序列数据库,通过BLAST搜索比对进行序列同源性比较.采用MEGA3.1软件构建系统发育树.
1.6菌株C-D6的特异性基因序列扩增
选用Reva设计的两对芽孢杆菌特异引物(YyaO-F/TetB-R 和 YyaR-F/TetB-R)对菌株C-D6进行特异片段扩增[10].引物序列为:
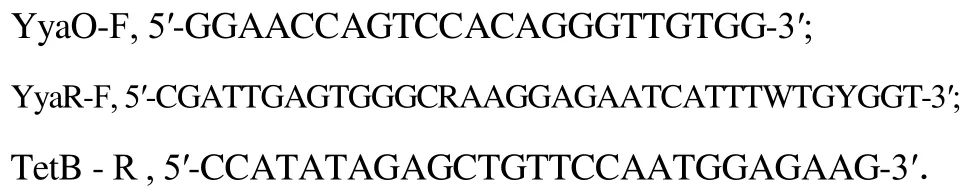
引物由上海生工合成,PCR反应体系及条件参照文献[9]的方法进行.采用1%琼脂糖凝胶电泳检测扩增结果.
1.7菌株C-D6的抗菌谱测定
菌株C-D6的抗菌谱测定参照文献[9]的方法进行,即从25℃培养约7d的病原菌,菌落边缘切取直径为6.5 mm的圆形小菌,块置于PDA平板中央,在其2边2.5 cm处对称接入C-D6,25℃培养7d后,测定其抑菌带宽度.每处理3次重复.
2 结果与分析
2.1菌株C-D6的分离筛选
以抑制辣椒炭疽菌附着胞形成为筛选目标,从广东、海南、湖南、安徽和江西等省部分地区采集的69份土样筛选有效菌株.通过载片混合培养筛选,从1152个细菌分离菌株中,共获得126个抑制辣椒炭疽菌附着胞形成或影响附着胞形态的初筛菌株,有效菌株占10.94%.初筛菌株经3轮复筛,共获得25个对辣椒炭疽菌附着胞形成有明显影响的细菌菌株,其中包括抑制附着胞形成的菌株16个,影响附着胞形态的菌株9个,前者的YPD培养液能明显抑制附着胞形成,后者的YPD培养液使辣椒炭疽菌形成膨大、中空、色浅的无效附着胞.进一步的实验测定发现分离自安徽省旌德县农田土壤的C-D6菌株,在相同稀释条件下对抑制炭疽菌附着胞形成的作用效果优于其它菌株,且作用效果稳定(见图1),选定为本研究的目标菌株.
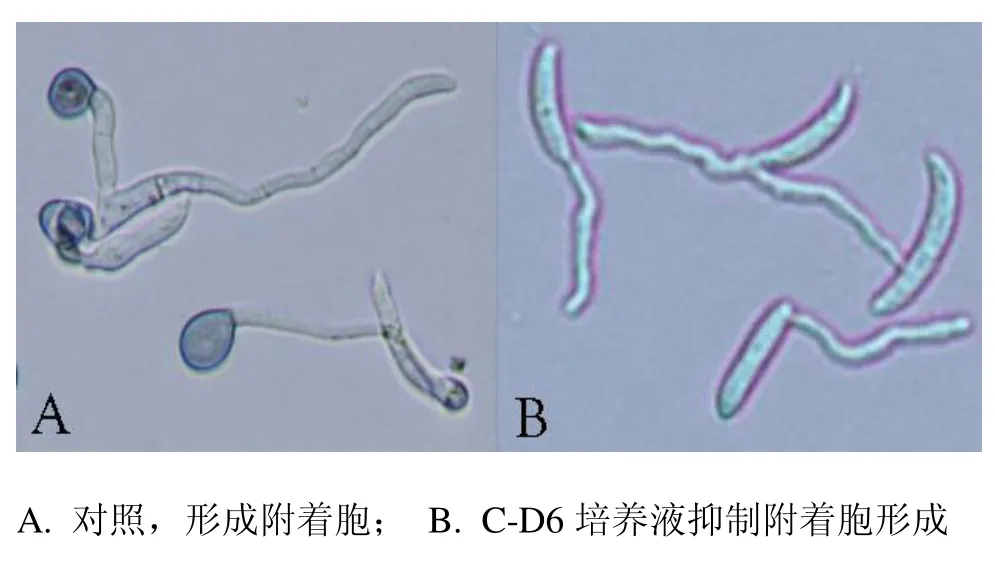
图1 菌株C-D6培养液对辣椒炭疽菌附着胞形成的抑制作用
2.2菌株C-D6的鉴定
2.2.1菌株C-D6的形态特征
菌株C-D6在牛肉膏蛋白胨培养基上37℃培养18h,形成乳白、表面粗糙有皱褶、边缘整齐的圆形突起菌落;菌体杆状,大小为0.89µm×2.74µm.经革兰氏染色后观察:芽孢中生,椭圆,孢囊不膨大.革兰氏染色阳性.
2.2.2菌株C-D6的16S rDNA序列特征
采用优化的扩增条件,从C-D6的基因组DNA扩增获得一条16S rDNA片段,测得该片段序列长度为1691bp.将测定序列提交Genbank进行搜索比对,结果显示:该序列与Genbank中的2个枯草芽孢杆菌参考菌株L4和WD23 (登陆号分别为:GQ421472和EU780682)的序列同源性大于99%.从Genbank中选择了8个芽孢杆菌菌株的16SrDNA基因序列,应用MEGA3.1进行多重比较后构建的系统发育树见图2.结果表明:菌株C-D6与枯草芽胞杆菌的亲缘关系最近.
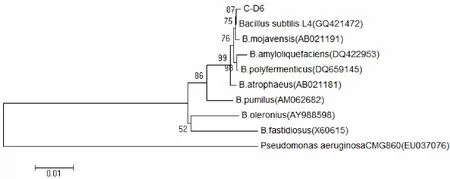
图2 C-D6基于16SrDNA序列的系统发育树
2.2.3菌株C-D6的特异性基因序列分析
分别用两对芽孢杆菌特异引物YyaO-F/TetB-R和YyaO-F/TetB-R对C-D6菌株的基因组DNA进行PCR扩增.结果显示:当以YyaO-F/TetB-R为引物时,C-D6能扩增获得一条大约600bp的DNA片段,以YyaR-F/TetB-R为引物时,C-D6不产生扩增产物(见图3).
YyaO-F/TetB-R和YyaR-F/TetB-R是Reva基于编码转运蛋白基因(tetB-tetL)的序列差异而设计的用于鉴别枯草芽胞杆菌和解淀粉芽孢杆菌的特异引物[10].YyaO-F/TetB-R扩增阳性,YyaR-F/TetB-R扩增阴性为枯草芽胞杆菌,反之为解淀粉芽孢杆菌.因此,上述实验结果支持将C-D6鉴定为枯草芽胞杆菌.结合形态特征和16SrDNA序列分析,将菌株C-D6鉴定为枯草芽孢杆菌.
2.3菌株C-D6的抗菌谱测定
用对峙培养法测定了菌株C-D6对辣椒炭疽菌、尖孢镰刀菌和稻瘟病菌等重要植物病原真菌的抑制作用,结果见表1.结果显示:拮抗菌株C-D6对尖孢镰刀菌、胶孢炭疽菌、辣椒炭疽菌、苞叶芋柱帚霉、烟草疫霉和稻瘟病菌都有明显的抑制作用,其抑菌带宽度在17.54~27.66mm之间,其中对尖孢镰刀菌抑菌效果最好,抑菌带宽度高达27.66mm,仅对立枯丝核菌没有作用.由此可见,拮抗菌株C-D6抗菌谱较宽,对多种病害的生物防治具有应用潜力.
图3 C-D6菌株的特异性基因序列PCR扩增图谱
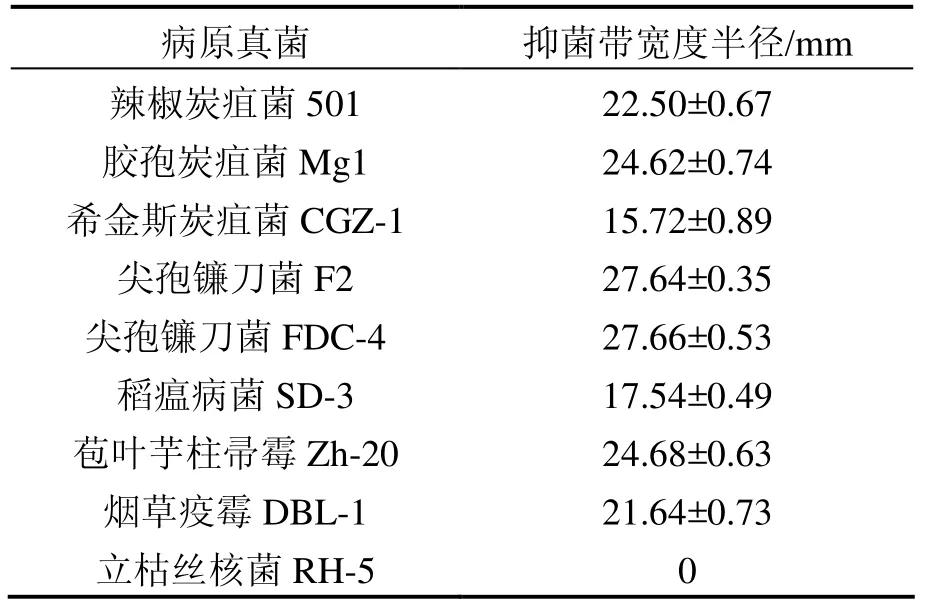
表1 枯草芽孢杆菌C-D6菌株的抗菌谱测定
3 讨 论
炭疽菌侵入寄主植物的过程极其复杂,包含分生孢子黏附在寄主表面、孢子萌发、附着胞形成、附着胞黑色素化及产生侵入钉直接侵入寄主组织等一系列重要步骤.其中附着胞的形成是侵染过程中的关键环节,对病害的发生非常重要[11].Kim等的研究证实在大肠杆菌内表达的辣椒酯酶能抑制胶孢炭疽菌附着胞的形成,从而可控制病害的发生[12].为探索炭疽病生物防治的新途径,我们以辣椒炭疽菌侵入循环中的附着胞形成为靶点,开展抑制附着胞形成的生防细菌筛选,通过大量筛选工作,获得了一株能明显抑制辣椒炭疽菌附着胞形成,并具有广谱抑菌作用的新型芽孢杆菌生防菌株C-D6.芽孢杆菌具有生长快、耐热及抗逆性强等突出特点,有利于生防菌剂生产及生防菌在环境中的存活、定殖与繁殖,是一种理想的生防微生物[13],已广泛应用于植物病害的生物防治[5,6,14].
基于形态观察和生理生化试验的传统细菌鉴定方法不仅繁琐耗时,而且不能有效区分多种细菌的近缘种.因此,细菌的分类鉴定越来越依赖于分子生物学方法.16S rDNA序列分析是一种广泛应用于细菌鉴定的分子方法,通过序列比对和同源性分析可将菌株快速鉴定到属,甚至种[15].然而,有研究表明芽孢杆菌的一些种具有极高的16S rDNA序列相似值,这一方法不适用于这些芽孢杆菌种的鉴定.为此,其它一些基因,如gyrA、gyrB、polC和tetB(L)等被引入芽孢杆菌种的分类鉴定,并证明完全有效[16].这些序列的种间差异还为种特异引物的设计提供丰富的序列信息.Reva等研究发现:枯草芽孢杆菌和解淀粉芽孢杆菌的tetB(L)基因存在序列结构差异,并据此设计两对特异引物YyaO-F/TetB-R和YyaR-F/TetB-R,分别用于枯草芽孢杆菌和解淀粉芽孢杆菌的快速鉴定[10].在本研究中,菌株C-D6的16S rDNA序列与GenBank数据库中的枯草芽孢杆菌和解淀粉芽孢杆菌等多个种的序列相似性均大于99%,据此不能准确确定该菌株的分类地位.进一步采用种特异引物YyaO-F/TetB-R和YyaR-F/TetB-R对菌株C-D6进行扩增,实验结果支持将该菌株鉴定为枯草芽孢杆菌,结合形态特征和16S rDNA序列分析结果,最终将菌株C-D6鉴定为枯草芽孢杆菌.菌株C-D6的筛选获得、鉴定和抑菌特征研究,为进一步研究其生防机理和开发新型生防制剂奠定了基础.
参考文献:
[1] 杨青,易图永.辣椒炭疽病及其防治研究进展[J].江西农业学报,2009,21(7):107-109.
[2] Sutton B C. The genus Glomerella and its anamorph Colletotrichum[A]//In Colletotrichum-Biology, Pathology and Control Bailey J A & Jeger M J ed. CAB International:Wallingford, 1992:1-26.
[3] 曾大兴,戚佩坤,姜子德.应用RAPD技术快速鉴定蔬菜上的弯孢类炭疽菌[J].植物病理学报,2002,32 (2):170-175.
[4] Whipps J M.Developments in the biological control of soil-borne plant pathogens[J]. Advances in BotanicalResearch, 1997,26:1-134.
[5] Kim P I, Ryu J, Kim Y H, et al. Production of biosurfactant lipopeptides iturin A, fengycin and surfactin A from Bacillus subtilis CMB32 for control of Colletotrichum gloeosporioides[J]. Journal of Microbiology and Biotechnology, 2010,20:138-145.
[6] Ryu H, Park H, Suh D S, et al. Biological control of Colletotrichum panacicola on Panax ginseng by Bacillus subtilis HK-CSM-1[J].Journal of Ginseng Research, 2014,38:215-219.
[7] Yakoby N, Zhou R, Kobiler I, et al. Development of Colltotrichum gloeosporioides restriction enzymemediated integration mutants as biocontrol agents against anthracnose disease in Avocado fruits[J]. Phytopathology, 2001,91(2):143-148.
[8] 曾大兴,吴小丽,涂国全.抑制辣椒炭疽菌附着胞形成的细菌菌株的快速筛选方法[C].中国植物病理学会2007年学术年会论文集.西安:西北农林科技大学出版社,2007:448-450.
[9] 况福元,吴小丽,吕风青,等.菜心炭疽病菌拮抗细菌的筛选及鉴定[J].微生物学通报,2009,36 (9):1350-1355.
[10] Reva O N, Dixelius C, Meijer J, et al. Taxonomic characterization and plant colonizing abilities of some bacteria related to Bacillus amyloliquefaciens and Bacillus subtilis[J]. FEMS Microbiology Ecology, 2004,48:249-259.
[11] Deising H B, Wnener S. The role of fungal appressoria in plant infection[J].Microbes and Infection, 2000,2(13):1631-1641.
[12] Kim Y S, Lee H H, Ko M K, et al. Inhibition of fungal appressorium formation by pepper (Capsicum annuum) esterase[J]. Molecular Plant-Microbe Interactions, 2001,14(1):80-85.
[13] Monica LE, Elizabeth ADJ, William EBJ, et al. Viability and stability of biological control agents on cotton and snap bean seeds[J]. Pest Management Science, 2001,57(8):695-706.
[14] Leelasuphakul W, Sivanunsakul P, Phongpaichit S. Purification, characterization and synergistic activity of β-1,3-glucanase and antibiotic extract from an antagonistic Bacillus subtilis NSRS 89-24 against rice blast and sheath blight[J]. Enzyme and Microbial Technology, 2006,38(7):990-997.
[15] Drancourt M, Bollet C, Carlioz R, et al. 16S ribosomal DNA sequence analysis of a large collection of environmental and clinical unidentifiable bacterial isolates[J]. Clin Microbiol, 2000,38:3623-3630.
[16] Li L H, Ma J C, Li Y, et al. Screening and partial characterization of Bacillus with potential applications in biocontrol of cucumber Fusarium wilt[J]. Crop Protection, 2012,35:29-35.
*项目来源:深圳市基础研究计划资助项目(No. JC201105201186A)
Screening and Identification of an Antagonistic Bacillus sp. Against Colletotrichum Capsici
LA Wenjun, JIA Shujuan, WU Xiaoli, ZENG Daxing
(School of Applied Chemistry and Biological Technology, Shenzhen Polytechnic, Shenzhen, Guangdong 518055, China)
Abstract:The bacterial strain C-D6 which showed strong antifungal activity against Colletotrichum capsici was isolated from a rhizosphere soil sample. Based on morphological characteristics and analysis of 16s rDNA sequences and tetB-tetL gene specific sequences, strain C-D6 was identified as Bacillus subtilis. Strain C-D6 showed strong antagonistic activity against several pathogenic fungi, including C. capsici, Fusarium oxysporum, Cylindrocladium spathiphylli and Phytophthora nicotianae, on potato dextrose agar plate. Light microscopic observation showed that culture filtrate of strain C-D6 had a significant inhibitory effect on appressorium formation of C. capsici. These results suggest that B. subtilis C-D6 could be a potential bio agent for control of anthracnose caused by C. capsici.
Key words:bacillus subtilis; colletotrichum capsici; appressorium formation
*通讯作者:曾大兴(1963-),男,教授,主要研究领域为真菌病害生物防治.E-mail:zengdx@szpt.edu.cn.
作者简介:喇文军(1977-),男,陕西人,实验师,主要从事生物技术应用的教学与科研工作.
收稿日期:2015-11-16
DOI:10.13899/j.cnki.szptxb.2016.03.010
中图分类号:S436.418
文献标志码:A
文章编号:1672-0318(2016)03-0048-05

