双活性磺酸基蔗渣木聚糖邻苯二甲酸酯的合成与表征
李和平,武冠亚,杨 旭,袁金伟,孙 彦,邹英东
桂林理工大学化学与生物工程学院,广西 桂林 541004
双活性磺酸基蔗渣木聚糖邻苯二甲酸酯的合成与表征
李和平,武冠亚,杨 旭,袁金伟,孙 彦,邹英东
桂林理工大学化学与生物工程学院,广西 桂林 541004
摘要:以蔗渣木聚糖为主要原料,经两步酯化反应合成磺酸基蔗渣木聚糖邻苯二甲酸酯,考察反应条件对合成反应的影响,并通过红外光谱(FT-IR)、X射线衍射(XRD)、热重分析(TG-DTG)和扫描电镜(SEM)对蔗渣木聚糖经双酯化改性前后的样品进行表征。结果表明,较优的反应条件为:第一步以邻苯二甲酸酐为羧酸酯化剂,三乙胺为催化剂,在三乙胺与N,N-二甲基甲酰胺体积比为1:16,蔗渣木聚糖单元和邻苯二甲酸酐物质的量之比为1:2时,于80 ℃下反应4 h,经催化羧酸酯化合成单活性蔗渣木聚糖邻苯二甲酸酯;第二步以氨基三磺酸钠为酯化剂,在碱性条件下,蔗渣木聚糖邻苯二甲酸酯与NaNO2的质量比为1:2时,于50 ℃下反应4 h,合成了双活性磺酸基蔗渣木聚糖邻苯二甲酸酯。双酯化后的磺酸基蔗渣木聚糖邻苯二甲酸酯的热稳定性增强,其分子表面形貌更加紧密。
关键词:磺酸基蔗渣木聚糖邻苯二甲酸酯 合成 双活性衍生物 蔗渣木聚糖
木聚糖属于植物细胞中半纤维素的一部分,主要是由β-D-1,4-木糖苷键连接的多聚五碳糖结构,其来源广泛、绿色环保。在初期的研究中发现木聚糖具有稳定、无毒、促进有益菌的繁殖和刺激细胞免疫调节等特点,其独特的生物活性和生理功能引起了一些学者的关注[1]。为进一步提高木聚糖的功能性及应用价值,可对木聚糖分子上的羟基进行化学修饰,如采用酯化、磺化、醚化和羧甲基化等方法引入功能性官能团[2-7],提高木聚糖的免疫调节活性、抗病毒活性和抑制有害菌增长的能力等[8,9]。随着研究的深入,木聚糖一些单变性衍生物在抗癌和抗凝血方面的应用也有了相关报道[10-12]。
木聚糖酯化方面的研究主要包括羧酸酯化、硫酸酯化和磷酸酯化等[13,14],经酯化后改善和提高了木聚糖的理化性质,拓展了其在医药、精细化工、食品、材料和环境等领域的应用[1,15,16]。继国外学者发现经过硫酸酯化后的木聚糖单酯化衍生物具有抑制艾滋病病毒活性以后,木聚糖的硫酸酯化研究得到较多的关注。据报道,酯化改性后的木聚糖在抗血栓[17]和抗HIV活性[18]等方面具有显著作用,但由于硫酸酯化后的木聚糖单变性衍生物抗HIV活性低和选择性弱等问题限制了其在抗HIV方面的深入探索。如何提高木聚糖酯化衍生物的抗HIV活性和选择性成为突出问题。
目前国内外对木聚糖酯化改性仍然集中在对其单酯化修饰及其性质的研究,李和平等[7,14,19,20]也相继对蔗渣木聚糖的羧甲基化、醋酸酯化、磷酸酯化和硫酸酯化等改性及应用进行了研究报道,并取得了一些研究成果。针对蔗渣木聚糖分子的单元结构,在单酯化改性的基础上,李和平等率先提出对蔗渣木聚糖进行双酯化分子构建,设计合成具有双活性基团的蔗渣木聚糖酯化衍生物,强化提高木聚糖酯化衍生物的生物活性与医药价值。本工作以从甘蔗渣中提取的木聚糖为主要原料,以多靶向药物理论为基础,以增加活性基团从而进一步提高产物的抗HIV活性为目标,选择具有生物活性基团的酯化剂邻苯二甲酸酐,经过羧酸酯化和硫酸酯化两步修饰得到具有双活性的蔗渣木聚糖双酯化衍生物磺酸基蔗渣木聚糖邻苯二甲酸酯,提高蔗渣木聚糖衍生物的医药与生物应用价值。
1 实验部分
1.1 合成方法
1.1.1 蔗渣木聚糖邻苯二甲酸酯的合成
取一定量蔗渣木聚糖和N,N-二甲基甲酰胺(DMF)置于250 mL四口烧瓶中,置水浴中搅拌,向四口烧瓶中滴加适量催化剂三乙胺。将邻苯二甲酸酐溶于一定量的DMF中,用恒压漏斗缓慢滴加入四口烧瓶中,控制在2~3 h内滴加完毕,反应结束后,将混合溶液抽滤,溶剂DMF精馏回收,所得棕黄色滤饼,分别用无水乙醇和蒸馏水洗涤多次除去未反应的邻苯二甲酸酐和木聚糖等浅黄色粉末状固体,置真空干燥箱中干燥至恒重,即得蔗渣木聚糖邻苯二甲酸酯。主要反应式如下:

1.1.2 磺酸基蔗渣木聚糖邻苯二甲酸酯的合成
取一定量的NaHSO3置于250 mL四口烧瓶中,加蒸馏水溶解,置水浴中搅拌,将水浴温度升至90 ℃。按NaHSO3和NaNO2物质的量之比为9:2,取NaHSO3用蒸馏水溶解,用恒压漏斗缓慢滴加入四口烧瓶中,控制在1 h内滴加完毕,继续反应1.5 h,得硫酸酯化试剂氨基三磺酸钠。继续调节反应体系pH值至9.0,降温至所需反应温度,加入一定量的蔗渣木聚糖邻苯二甲酸酯,恒温反应一定时间,调节体系pH值至7.0,继续反应10 min。反应结束后,加入无水乙醇析出最终产物,抽滤得浅黄色滤饼,用无水乙醇和水洗涤除去体系中的NaHSO3,NaNO2和氨基三磺酸钠等未反应的原料或副产物,再将洗涤后的滤饼置真空干燥箱中干燥24 h,得乳白色粉末磺酸基蔗渣木聚糖邻苯二甲酸酯产物。主要反应式为:

1.2 分析与表征
酯化取代度(DS)是衡量酯化反应所进行的程度,当酯化反应进行的程度越高,酯化取代度越高。蔗渣木聚糖双酯化衍生物的羧酸酯化取代度(DSC)采用酸碱滴定的方法进行测定[21];蔗渣木聚糖双酯化衍生物的硫酸酯化取代度(DSS)采用硫酸钡-明胶分光光度法进行测定[22],在日本岛津公司UV-2450型紫外可见分光光度计上进行。
产物的红外光谱(FT-IR)分析采用美国TA仪器有限公司NicoLet-iSL0型傅立叶转换红外光谱仪,扫描范围为4 000~500 cm-1;X射线衍射(XRD)采用荷兰帕纳科公司X’Pert PRO型XRD粉末衍射仪,扫描范围为10~80°;热重分析(TG-DTG)采用美国TA仪器有限公司SDT-Q600型同步TGA/DSC分析仪,在N2氛围下,以10 ℃/min的升温速率由30 ℃升至800 ℃;扫描电镜(SEM)分析采用日本JEOL公司JSM-6380LV型扫描电子显微镜。
2 结果与讨论
2.1 蔗渣木聚糖邻苯二甲酸酯的合成工艺研究
2.1.1 催化剂用量的影响
以三乙胺为催化剂,取5.0 g蔗渣木聚糖,5.7 g邻苯二甲酸酐,DMF 32.0 mL,反应温度60 ℃,反应时间5 h,考察催化剂用量对蔗渣木聚糖邻苯二甲酸酯DSC的影响,结果见图1。由图可知,随着催化剂用量的增加,目标产物DSC也逐渐增大,当催化剂用量为2.0 mL时,目标产物DSC最大,这是因为催化剂的用量较少达不到催化的效果,但催化剂过量会使副反应增多和引起催化剂中毒现象,导致目标产物DSC下降。因此,催化剂用量为2.0 mL较合适。
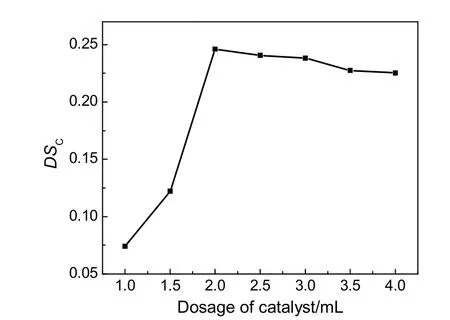
图1 催化剂用量对羧酸酯化取代度的影响Fig.1 Effect of the dosage of catalyst on DSC
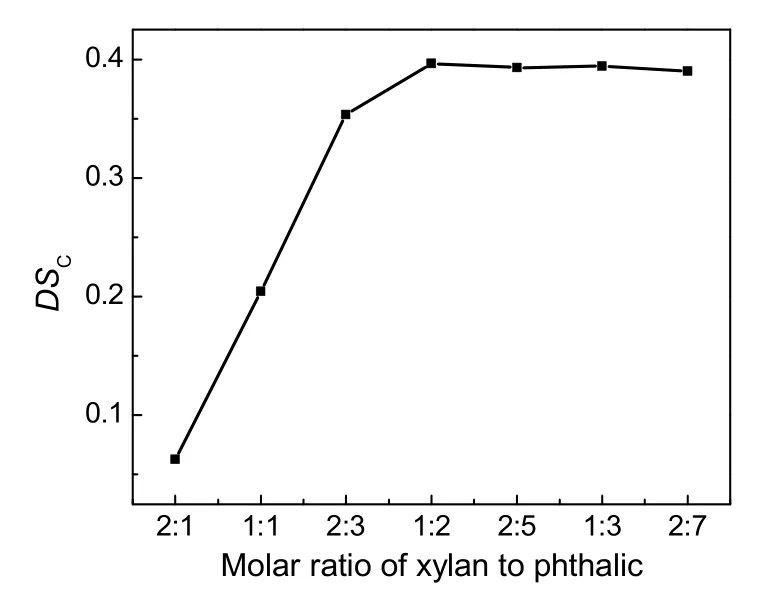
图2 蔗渣木聚糖与邻苯二甲酸酐物质的量之比对羧酸酯化取代度的影响Fig.2 Effect of molar ratio of xylan to phthalic anhydride on DSC
2.1.2 物料配比的影响
三乙胺和DMF的体积比为1:16,反应温度60 ℃,反应时间5 h,考察不同蔗渣木聚糖与邻苯二甲酸酐的物料比对蔗渣木聚糖邻苯二甲酸酯DSC的影响,结果见图2。由图可知,随着蔗渣木聚糖与邻苯二甲酸酐物质的量之比的减小,目标产物DSC增加较快,在蔗渣木聚糖与邻苯二甲酸酐物质的量之比为1:2时,目标产物DSC为一个较大的值,继续增大邻苯二甲酸酐的用量,目标产物DSC有轻微降低。这是因为随着邻苯二甲酸酐用量的增加,蔗渣木聚糖逐渐得到一定程度的酯化,邻苯二甲酸酐的过量加入会带来一定的副反应,影响到主反应的进行,使得目标产物DSC略降低。因此,木聚糖单元与邻苯二甲酸酐物质的量之比为1:2较合适。
2.1.3 羧酸酯化温度的影响
按蔗渣木聚糖与邻苯二甲酸酐物质的量之比为1:2投料,三乙胺与DMF体积比为1:16,反应时间5 h,考察反应温度对蔗渣木聚糖邻苯二甲酸酯DSC的影响,结果见图3。由图可知,随着反应温度的升高,目标产物DSC先增大后减小,在反应温度为80 ℃时,目标产物DSC达到最大值。这是因为升高温度会加快羧酸酯化反应的速率,当温度维持在80 ℃以上时,反应较快,但副反应较多,较高的温度也会使部分羧酸酯化反应产物产生分解,使得目标产物DSC降低。因此,在此反应条件下,羧酸酯化温度为80 ℃较合适。
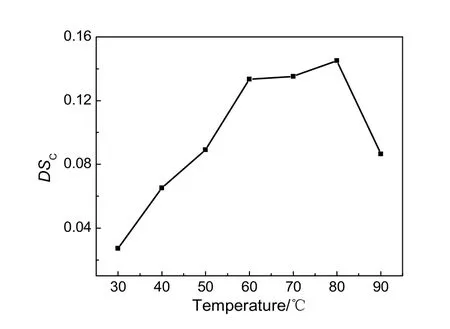
图3 反应温度对羧酸酯化取代度的影响Fig.3 Effect of the reaction temperature on DSC
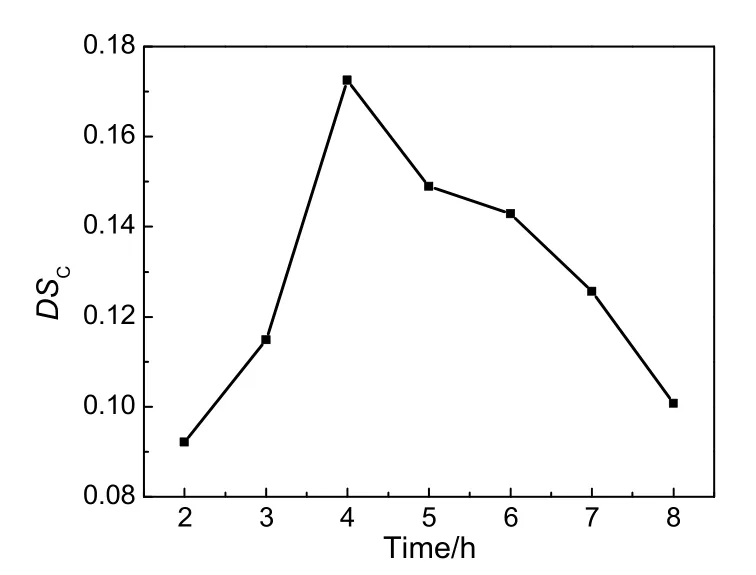
图4 羧酸酯化取代度随反应时间的变化情况Fig.4 Changes of DSCwith the reaction time
2.1.4 羧酸酯化时间的影响
按蔗渣木聚糖与邻苯二甲酸酐物质的量之比为1:2投料,三乙胺与DMF体积比为1:16,反应温度80 ℃下,考察蔗渣木聚糖邻苯二甲酸酯DSC随反应时间的变化情况,结果见图4。由图可知,随着反应时长的增大,目标产物DSC迅速增大后减小,在4 h时达到最大值。这是因为经过一段时间反应物充分得到反应,并使反应达到平衡状态,继续反应会使副反应增多和目标产物的分解,目标产物DSC降低。因此,反应时间为4 h较合适。
2.2 磺酸基蔗渣木聚糖邻苯二甲酸酯的合成工艺研究
2.2.1 蔗渣木聚糖邻苯二甲酸酯与NaNO2质量比的影响

图5 蔗渣木聚糖邻苯二甲酸酯与NaNO2的质量比对硫酸酯化取代度的影响Fig.5 Effect of the mass ratio of bagasse xylan phthalate to NaNO2on DSS
在反应体系pH值为9,反应温度为60 ℃,反应时间为5 h的条件下,蔗渣木聚糖邻苯二甲酸酯进行硫酸酯化反应,考察不同蔗渣木聚糖邻苯二甲酸酯与NaNO的质量比对目标产物DS的影响,结2S果见图5。由图可看出,随着蔗渣木聚糖邻苯二甲酸酯与NaNO2质量比的减小,磺酸基蔗渣木聚糖邻苯二甲酸酯DSS先增大后减小,增加NaNO2的用量,会使氨基三磺酸钠的生成量增加,更有利于蔗渣木聚糖邻苯二甲酸酯的硫酸酯化反应,目标产物DSS增大,在质量比为1:2时,目标产物DSS达到最大值,继续增大亚硝酸钠用量,体系中副产物较多,影响主反应的进行,使目标产物DSS降低。因此,蔗渣木聚糖邻苯二甲酸酯与NaNO2的质量比为1:2较合适。
2.2.2 反应温度的影响
按蔗渣木聚糖邻苯二甲酸酯和NaNO2的质量比为1:2,反应体系pH值为9,反应时间为5 h时,对蔗渣木聚糖邻苯二甲酸酯进行硫酸酯化反应,考察硫酸酯化反应温度对目标产物DSS的影响,结果见图6。由图可知,随着反应温度的升高,目标产物DSS先增大后减小。温度的升高使反应分子活性增高,增大正方向反应程度,反应温度为50 ℃时,目标产物DSS达到最大值,继续升高温度会使副反应增多和酯化反应产物分解从而降低目标产物DSS。因此,硫酸酯化的反应温度为50 ℃较合适。

图6 硫酸酯化反应的反应温度对硫酸酯化取代度的影响Fig.6 Effect of the reaction temperature of the sulfation reaction on DSS

图7 硫酸酯化取代度随硫酸酯化反应时间的变化Fig.7 Changes of DSSwith time of the sulfation reaction
2.2.3 硫酸酯化反应时间的影响
按蔗渣木聚糖邻苯二甲酸酯和NaNO2的质量比为1:2,反应体系pH值为9,反应温度为50 ℃的条件下,进行蔗渣木聚糖邻苯二甲酸酯的硫酸酯化反应,考察目标产物DSS随硫酸酯化反应时间的变化情况,结果见图7。由图可知,随着反应时间的延长,目标产物DSS先增大后减小,反应时间为4 h时,反应达到平衡状态,目标产物DSS最大,继续反应,目标产物DSS缓慢降低。这是由于反应时间的增加会使副反应增多,部分产物分解等。因此,硫酸酯化反应时间为4 h较合适。
2.3 磺酸基蔗渣木聚糖邻苯二甲酸酯的结构表征
2.3.1 FT-IR表征
图8为蔗渣木聚糖和磺酸基蔗渣木聚糖邻苯二甲酸酯红外光谱图。

图8 原蔗渣木聚糖和磺酸基蔗渣木聚糖邻苯二甲酸酯红外光谱Fig.8 FT-IR spectra of raw bagasse xylan and sulfonic groups bagasse xylan phthalate

图9 原蔗渣木聚糖和磺酸基蔗渣木聚糖邻苯二甲酸酯的XRD图谱Fig.9 XRD patterns of raw bagasse xylan and sulfonic groups bagasse xylan phthalate
由图8可知,蔗渣木聚糖通过双酯化改性后,红外光谱出现较大变化,原蔗渣木聚糖在3 431.60 cm-1处的宽峰为-O-H的伸缩振动吸收峰,双酯化改性后,峰值向低波数(3 427.40 cm-1)偏移;原蔗渣木聚糖在2 925.94 cm-1处的吸收峰为-C-H的伸缩振动吸收峰,双酯化改性后,向低波数(2 921.03 cm-1)偏移;酯类物质的特征吸收包括羰基的伸缩振动与O-C-O结构的非对称伸缩振动,双酯化改性后,由于C=O与苯环形成共轭结构致使酯的伸缩振动吸收峰向低波数偏移,出现在1 721.50 cm-1处;另外,1 114.83 cm-1处为硫酸酯的S=O的伸缩振动吸收峰,895.91 cm-1处为S-O的伸缩振动吸收峰。红外光谱结果表明已经成功合成目标产物磺酸基蔗渣木聚糖邻苯二甲酸酯。
2.3.2 XRD表征
图9为原蔗渣木聚糖和磺酸基蔗渣木聚糖邻苯二甲酸酯的XRD图谱。由图可知,蔗渣木聚糖在14.12,22.37,31.97,42.47和72.56°等处出现较强的衍射峰,通过双酯化改性后,原蔗渣木聚糖部分XRD衍射峰强度减弱甚至消失,这是由于蔗渣木聚糖改性后支链增多,阻止了磺酸基蔗渣木聚糖邻苯二甲酸酯的主链相互接近并进一步形成结晶,最终导致结晶数量减少,结晶度下降。另外在18.97,25.46,27.96和28.93°等位置出现新的强衍射峰,说明可能有新的物质生成。
2.3.3 热重分析
图10为原蔗渣木聚糖和磺酸基蔗渣木聚糖邻苯二甲酸酯的TG-DTG曲线。由图可知,原蔗渣木聚糖在低于100 ℃区间为脱去物理吸附水和部分结晶水的过程,失重约14.5%;在100~350 ℃,蔗渣木聚糖的失重约占整个样品质量的53.7%,这是由于木聚糖主链β-1,4糖苷键等羟基键的断裂造成;在350~800 ℃,样品失重约占25.3%,失重速率较小,温程较长,主要是由残基的断裂造成的。双酯化改性蔗渣木聚糖在低于100 ℃区间失重约为10.0%,与双酯化改性前相比变化较小;在100~350 ℃,改性蔗渣木聚糖的失重约占整个样品质量的46.4%,在350~750 ℃总失重约21.46%,此温度区间为改性后羧酸酯键、硫酸酯键等的断裂所引起的;在750~800 ℃的失重是一些残基的断裂所引起的,失重约2.8%,经过改性后的磺酸基蔗渣木聚糖邻苯二甲酸酯在800 ℃后剩余残渣较多。这是因为改性并没有改变蔗渣木聚糖的主体结构,只是利用了蔗渣木聚糖的活性位点,增加了新的功能性活性基团,通过热重分析表明双酯化后的产物热稳定性得到提高。

图10 原蔗渣木聚糖和磺酸基蔗渣木聚糖邻苯二甲酸酯的TG-DTG曲线Fig.10 TG-DTG curves of raw bagasse xylan and sulfonic groups bagasse xylan phthalate
2.3.4 SEM表征
图11为原蔗渣木聚糖和磺酸基蔗渣木聚糖邻苯二甲酸酯的SEM图。由图可知,原蔗渣木聚糖颗粒之间存在较大空隙,表面光滑柔和,呈现无规则堆积状,是非晶体外观性状,呈无定型形态,而蔗渣木聚糖经双酯化改性后,颗粒之间的空隙明显缩小,呈团状,同时表面变粗糙,而且在蔗渣木聚糖表面出现白色的附着物。说明双酯化改性后的蔗渣木聚糖仍属于非晶体,并且处于无定型形态,但表面形貌及紧密性发生了明显变化。

图11 原蔗渣木聚糖(a)和磺酸基蔗渣木聚糖邻苯二甲酸(b)酯的SEM照片Fig.11 SEM images of bagasse xylan(a) and sulfonic groups bagasse xylan phthalate(b)
3 结 论
以蔗渣木聚糖为原料,分别以邻苯二甲酸酐和氨基三磺酸钠为羧酸酯化剂和硫酸酯化剂,分两步进行羧酸酯化和硫酸酯化改性,得到了具有双活性的蔗渣木聚糖双酯化衍生物磺酸基蔗渣木聚糖邻苯二甲酸酯。双酯化后的磺酸基蔗渣木聚糖邻苯二甲酸酯的热稳定性增强,其分子表面形貌更加紧密。
参考文献:
[1] 李和平, 何丽霞. 木聚糖的化学修饰及其衍生物的应用研究进展[J]. 化工进展, 2009, 28(11): 1955-1964, 1981. Li Heping, He Lixia. Advances in chemical modification of xylan and application of their derivatives[J]. Chemical Industry and Engineering Progess, 2009, 28(11): 1955-1964, 1981.
[2] Peng X W, Ren J L, Sun R C. Homogeneous esterification of xylan-rich hemicelluloses with maleic anhydride in ionic liquid[J]. Biomacromolecules, 2010, 11(12): 3519-3524.
[3] Marina A, Kirsi S M, Raimo A, et al. Carboxymethylation of alkali extracted xylan for preparation of bio-based packaging films[J]. Carbohydrate Polymers, 2014, 100(2): 89-96.
[4] Maria S P, Kari K, Harri S, et al. Structural features and water interactions of etherified xylan thin films[J]. Journal of Polymers Environment, 2012, 20(4): 895-904.
[5] Michael J B, Bruce S D, Patricia J O, et al. Selective chemical oxidation and depolymerization of switchgrass(Panicum virgatum L) xylan with oligosaccharide product analysis by mass spectrometry[J]. Rapid Communications in Mass Spectrometry, 2011, 25(7): 941-950.
[6] Cüneyt H Ü, N Simge Ö, Oya G A. Synthesis and thermal characterization of xylan-graft-polyacrylonitrile[J]. Carbohydrate Polymers,2012, 90(2): 1120-1126.
[7] 李和平, 何利霞, 牛春花. 羧甲基蔗渣木聚糖的合成与表征[J]. 精细化工, 2010, 27(3): 254-259. Li Heping, He Lixia, Niu Chunhua. Synthesis and characterization of carboxymethyl bagasse xylan[J]. Fine Chemicals, 2010, 27(3): 254-259. [8] Wu S P, Du Y M, Hu Y Z, et al. Antioxidant and antimicrobial activity of xylan-chitooligomer-zinc complex[J]. Food Chemistry, 2011,138(2/3): 1312-1319.
[9] Lei S, Qun D, Kan D. Structure elucidation and immunomodulatory activity in vitro of a xylan from roots of cudrania tricuspidata[J]. Food Chemistry, 2014, 152(2): 291-296.
[10] Melo-Silveira R F, Fidelis G P, Costa M S, et al. In vitro antioxidant, anticoagulant and antimicrobial activity and in inhibition of cancer cell proliferation by xylan extracted from corn cobs[J]. International Journal of Molecular Sciences, 2012, 13(1): 409-426.
[11] Sastry G, Mamdooh G. MGN-3/biobran, modified arabinoxylan from rice bran, sensitizes human breast cancer cells to chemotherapeutic agent, daunorubicin[J]. Cancer Detection and Prevention, 2008, 32(1): 1-6.
[12] 许泓瑜, 韩 亮, 许正宏. 玉米芯木聚糖硫酸酯抗凝血及抗血小板聚集的活性研究[J]. 纤维素科学与技术, 2008, 16(3): 28-33. Xu Hongyu, Han Liang, Xu Zhegnhong. Study on anticoagulant and antiplatelet aggregation activity of corn cob xylan sulfate[J]. Journal of Cellulose Science and Technology, 2008, 16(3): 28-33.
[13] 崔志敏, 罗儒显, 朱锦瞻, 等. 蔗渣纤维素磷酸酯的合成与应用研究[J]. 精细化工, 2001, 18(12): 609-702. Cui Zhimin, Luo Ruxian, Zhu Jinzhan, et al. Synthesis and application of bagasse cellulose phosphate ester[J]. Fine Chemicals, 2001,18(12): 609-702.
[14] 李和平, 李东旭, 鲁 勇. 蔗渣木聚糖磷酸酯的合成与表征[J]. 化学研究与应用, 2011, 23(10): 1353-1358. Li Heping, Li Dongxu, Lu Yong. Synthesis and characterization of bagasse xylan phosphate[J]. Chemical Research and Application, 2011,23(10): 1353-1358.
[15] Li X X, Shi X W, Wang M, et al. Xylan chitosan conjugate-a potential food preservative[J]. Food Chemistry, 2011, 126(2): 520-525.
[16] Sedlmeyer F B. Xylan as by-product of biorefineries: characteristics and potential use for food applications[J]. Food Hydrocolloids, 2011,25(8): 1891-1898.
[17] Stone A L, Melton D J, Lewis M S. Structure-function relations of heparin-mimetic sulfated xylan oligosaccharides inhibition of human immunodeficiency virus-1 infectivity in vitro[J]. Glycoconjugate Journal, 1998, 15(7): 697-712.
[18] Yoshida T, Kanga B W, Hattoria K. Anti-HIV activity of sulfonated arabinofuranan and xylofuranan[J]. Carbohydrate Polymers, 2001,44(2): 141-150.
[19] 李和平, 杨官威, 胡 杨, 等. 氨基三磺酸钠水相酯化法合成蔗渣木聚糖硫酸酯[J]. 化学反应工程与工艺, 2012, 28(5): 440-445.Li Heping, Yang Guanwei, Hu Yang, et al. Aqueous esterification of bagasse xylan with sodium nitrilotriacetic sulfonate as esterifying agent[J]. Chemical Reaction Engineering and Technology, 2012, 28(5): 440-445.
[20] 李和平, 李东旭, 鲁 勇. 蔗渣木聚糖醋酸酯的合成与表征[J]. 精细化工, 2011, 28(3): 227-231. Li Heping, Li Dongxu, Lu Yong. Synthesis and characterization of bagasse xylan acetates[J]. Fine Chemicals, 2011, 28(3): 227-231.
[21] Sun R C, Fanga J M, Tomkinson J, et al. Esterification of hemicelluloses from poplar chips in homogeneous solution of N,N-dimethylformamide/lithium chloride[J]. Journal of Wood Chemistry and Technology, 1999, 19(4): 287-306.
[22] 张惟杰. 糖复合物生化研究技术[M]. 杭州: 浙江大学出版社, 1999: 91.
Synthesis and Characterization of Dual Active Sulfonic Groups Bagasse Xylan Phthalate
Li Heping, Wu Guanya, Yang Xu, Yuan Jinwei, Sun Yan, Zou Yingdong
College of Chemistry and Bioengineering, Guilin University of Technology, Guilin 541004, China
Abstract:The sulfonic groups bagasse xylan phthalate was synthesized by two steps of esterification using bagasse xylan as the raw material. The effects of reaction conditions were investigated and the optimal conditions were obtained. The samples were characterized by infrared spectroscopy(FT-IR), X-ray diffraction (XRD), thermal gravimetric analysis (TG-DTG) and scanning electron microscopy (SEM) before and after double esterification of the bagasse xylan. The single active bagasse xylan phthalate was synthesized in the first step by catalytic esterification with phthalic anhydride as carboxylic acid esterification agent and triethylamine as the catalyst with the volume ratio of triethylamine to DMF 1:16, the molar ratio of bagasse xylan unit to phthalic anhydride 1:2, the reaction temperature 80 ℃ and the reaction time 4 h. The dual active sulfonic groups bagasse xylan phthalate was synthesized in the second step under alkaline conditions using sodium nitrilotriacetic sulfonate as the sulfonation agent with the mass ratio of bagasse xylan to NaNO21:2, the reaction temperature 50 ℃ and reaction time 4 h. The characterization results showed that the thermal stability of sulfonic groups bagasse xylan phthalate was enhanced, and the molecular surface morphology of the dual esterified derivative showed more closely.
Key words:sulfonic groups bagasse xylan phthalate; synthesis; dual active derivatives; bagasse xylan
作者简介:李和平(1961—),男,工学博士,教授。E-mail: lhpp2008@163.com。基金项目:国家自然科学基金(21466010)。
收稿日期:2015-10-20;
修订日期:2015-11-24。
文章编号:1001—7631 ( 2016 ) 02—0144—08
中图分类号:O621.25
文献标识码:A

