小鼠跨区供血耳瓣choke区的组织学观察
温福利, 梁 成, 庄跃宏, 吴剑威, 郑和平
(1. 南京军区福州总医院比较医学科, 福州 350025; 2. 福建医科大学人体解剖与组织胚胎学系, 福州 350108)
小鼠跨区供血耳瓣choke区的组织学观察
温福利1, 梁 成1, 庄跃宏2, 吴剑威1, 郑和平1
(1. 南京军区福州总医院比较医学科, 福州 350025; 2. 福建医科大学人体解剖与组织胚胎学系, 福州 350108)
目的 观察小鼠跨区供血耳瓣模型血管组织学和形态学变化。方法 以小鼠右耳为实验组,用眼科剪从尾侧向头侧剪断小鼠耳基底部尾侧2/3,保留头侧1/3,建立耳前动静脉为蒂内含3个血管体和2个choke区的跨区供血耳瓣小鼠模型。左耳为对照组,仅作脱毛处理。在术后0 d、1 d、3 d、5 d、7 d分别切取鼠耳置于体积分数10%甲醛固定,用于观察耳瓣choke I区和choke II区的组织学变化。结果 不同时间点choke I区实验组血管管径均大于对照组(P<0.01); choke I区和choke II区静脉血管数量分别在3 d和5 d达到峰值,然后逐渐减少,这一趋势可能与耳瓣基底部静脉回流的建立有关。choke I区和choke II区动脉血管充盈度平均值分别为40.64%和38.85%,静脉血管充盈度平均值分别为57.02%和61.48%。结论 ①跨区耳瓣切取后,静脉扩张是被动扩张,而动脉扩张是主动增值; ②跨区耳瓣切取后choke II区扩张的choke血管数量及扩张度均小于chokeⅠ区; ③跨区耳瓣切取后,血管管径变化对皮瓣存活起积极作用。
小鼠; 耳瓣; 组织学观察; choke血管
创伤是当今威胁人类安全的“第一公害”[1],常出现较大面积软组织缺损,单个轴形皮瓣往往无法覆盖, 临床基于修复较大缺损的需要, 曾大胆地将皮瓣扩大切取, 有的甚至可达相邻供区全部, 皮瓣仍可成活[2]。这样的供区, 目前仅限于临床应用例证,而没有详尽、确切的形态学依据, 因而不易于推广。本项目拟在前期小鼠跨区供血耳瓣模型研究基础上, 从组织学角度对choke区血管作进一步探讨。
1 材料与方法
1.1 实验动物
15只清洁级雄性ICR小鼠,体质量25~30 g,由福建医科大学动物中心[SYXK(闽)2012-0001]提供,鼠耳完整无皮肤病变或外伤; 饲养于南京军区福州总医院比较医学科屏障环境[SYXK(闽)2013-0004],环境温度22±1 ℃,相对湿度40%~65%。
1.2 仪器设备
体视显微镜(XTZ-E),上海光学仪器一厂; 石蜡包埋机(Leica,EG1150H), 半自动轮转式切片机(Leica, RM2245), 多功能染色机(Leica,ST5020),全自动化玻片盖片机(Leica,CV5030); 生物显微镜(Leica,DM2000),德国徕卡公司; 隔水式恒温培养箱(GHP-9080),上海一恒科学仪器有限公司。
1.3 模型建立
用质量分数2%戊巴比妥钠(40 mg/kg)将小鼠麻醉成功后,使用人用脱毛膏对鼠耳脱毛,体视显微镜下(×25)观察鼠耳的血管分布情况。根据观察结果,用眼科剪从尾侧向头侧剪断小鼠耳基底部尾侧2/3,保留头侧1/3,形成以耳前动静脉为蒂内含3个血管体和2个choke区的跨区供血耳瓣。
1.4 组织学检测
小鼠右耳为实验组,按上述方法建立耳瓣模型。左耳为对照组,仅作脱毛处理。在0 d、1 d、3 d、5 d、7 d分别切取小鼠耳瓣,置于体积分数10%甲醛固定24 h,垂直于耳基部线切取chokeⅠ区和chokeⅡ区组织,进行常规脱水包埋,组织切片HE染色后,对不同时间点chokeⅠ区和chokeⅡ区动静脉血管数量、管径变化及血管内红细胞的充盈度进行观察。
1.5 数据测量及统计分析
用Photoshop CS5/photomerge功能自动合成每只鼠耳的全景图,用灰度分析、计数工具、标尺工具测量不同时间点chokeⅠ区和chokeⅡ区动静脉血管数量和管径变化以及血管内红细胞的充盈度。用SPSS 20.0软件进行统计分析,所有数据以表示,P<0.05为差异有统计学意义。
2 结果
2.1 耳瓣HE染色观察
鼠耳皮肤结构完好,组织切片及染色成功。毛囊内发根短小或没有,表皮细胞排列紧密,皮脂腺和汗腺未见异常,组织细胞核呈蓝黑色,细胞质呈粉红色。软骨组织呈空泡样整齐排列,靠近耳背,两侧均有血管分布。动脉血管呈圆形或椭圆形,管壁较厚,见静脉血管伴行。静脉血管管壁较薄,管径大小不一,相差较大。实验组血管平滑肌细胞较长,胶原纤维变厚。实验组后期血管周围可见肥大细胞浸润(图1)。
2.2 血管数量与管径变化
结果显示,实验组chokeⅠ区、chokeⅡ区内动静脉平均血管密度和平均血管外径与对照组均有显著差异(P<0.01)(表1)。
不同时间点chokeⅠ区实验组血管管径平均值均大于对照组,chokeⅠ区实验组血管管径和血管数量随着术后天数的增加而呈现上升趋势; chokeⅡ区实验组血管管径也呈现上升趋势,但管径均小于chokeⅠ区,血管数量差异不明显(P>0.05)(图2)。 chokeⅠ区和chokeⅡ区0 d时血管管径大于1 d。
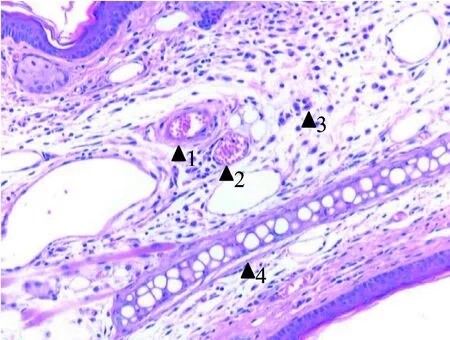
图1 耳瓣HE染色观察
2.3 血管内红细胞充盈程度
表2结果显示, chokeⅠ区动脉充盈度先上升,1 d时最大,随后保持稳定,但略高于对照组; 静脉与动脉相似,在术后血管充盈度上升,3 d时达到峰值,随后略微下降并维持该充盈度。chokeⅡ区术后即刻动静脉血管充盈度均有所下降,随后呈上升趋势,7 d时与对照组均值相近,静脉血管的充盈度在3 d时达到峰值,随后保持稳定。对照组在不同时间点血管充盈度无明显差异,chokeⅠ区和chokeⅡ区动脉血管充盈度总体平均值分别为40.64%和38.85%,静脉血管充盈度平均值分别为57.02%和61.48%。
3 讨论
3.1 血管数量与静脉回流通道的变化关系
吻合血管中真性吻合的建立是choke区血管数量增加的基础,由单一血管蒂供应的远端血管,血供欠佳,可使血管发生代偿性扩张。组织切片观察表明,术后0 d和1 d时chokeⅡ区血管周围组织中散在零星红细胞,这可能与制片过程或组织损伤有关。choke区血管的血流量一般很小,主要是因为choke区血管是相邻血管体压力的相对平衡点[3]。当某一皮瓣被破坏,邻接的血管体可通过choke血管扩张进行灌注,以弥补减少的血流。chokeⅠ区和chokeⅡ区静脉血管数量分别在3 d和 5 d达到峰值,然后逐渐减少,这一趋势与耳瓣基底部静脉回流的建立有关,基底部的静脉回流通道可减少choke区两端灌注压差,非真性吻合血管可能再次闭合。庄跃宏等[4]认为在跨区皮瓣切取的早期,静脉血以“迷宫”式回流为主;术后晚期,静脉回流以“瓣膜失效”为主,同时存在“迷宫式”回流。大部分扩张的交通小静脉管径减小,并最终消失。上述情况可能是choke区后期血管数量相对减少的主要原因。

表1 小鼠耳动静脉血管数量与管径测量

图2 不同时间点小鼠choke区血管的组织学变化
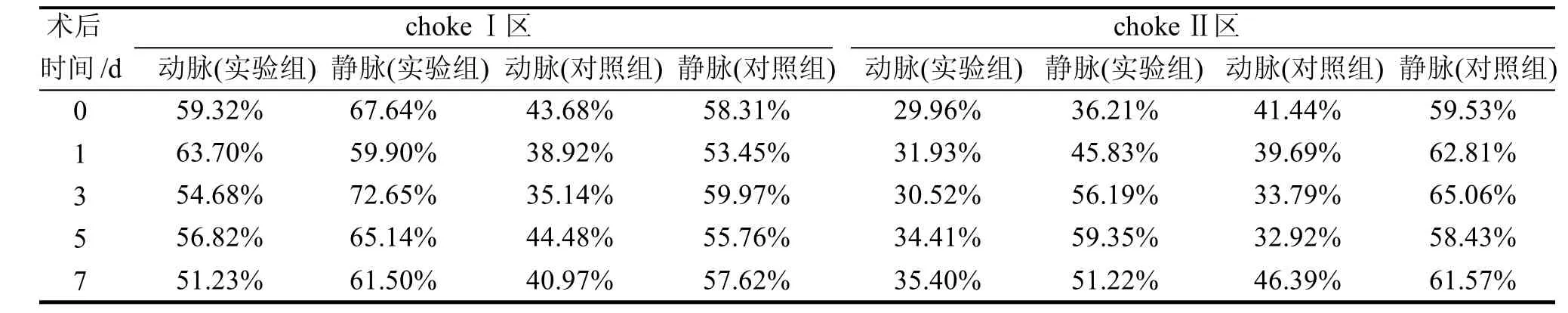
表2 小鼠耳血管内红细胞充盈程度测量结果
3.2 血管管径变化对皮瓣存活起积极作用
动脉血管的弹性较大,具有储存血液的功能,对急性缺血具有较强的调控能力,故耳瓣动脉血管数量与术前相比也仅有少量增加。通过对管径的测量表明,术后0 d时chokeⅠ区和chokeⅡ区血管的管径均大于1 d,然后逐渐扩大,这可能与耳瓣切取时的抓取及应激有关系。血管的生长是一个积极的过程,血流量可以增加剪切力,引起最初血管内膜的破裂,血管细胞的大小和数量增加,平滑肌细胞伸长[5]。实验组和对照组血管对比显示,choke区的动静脉的管径均有变大, chokeⅠ区扩张幅度大于chokeⅡ区。作者前期实验表明[6],耳瓣坏死也主要发生在chokeⅡ区,说明在术后chokeⅠ区血管大幅度扩张为耳瓣提供了充足血供。在术后初期,choke区血管发生代偿性扩张,之后变为积极主动的扩张,对提高皮瓣存活率具有重要的作用。
3.3 血管充盈度初步评价耳瓣血供情况
小鼠耳瓣较小,血管细小,动静脉伴行紧密,动脉血管常常被掩盖,对动脉血管血流量的观察较为不便,故考虑用血管充盈度的变化来进行监测。血管充盈度是通过组织切片观察静态情况下血液在血管中的瞬时充盈程度,该指标可为血管内瞬时血液流量提供参考,本实验主要通过术后即刻固定的组织切片进行血管充盈度的观察。
皮瓣是否发生坏死主要取决于血液循环量是否达到组织代谢所需的最低要求[7]。在耳瓣切取后,整个耳瓣的血液仅由头侧血管体供应,choke I区血管代偿性扩张。choke I区静脉血管充盈度峰值在术后1 d, 而动脉的峰值在3 d,这可能与动脉血管较大的弹性有关。在耳瓣切取后,chokeⅡ区的动静脉血管充盈度均有所下降,这可能是chokeⅡ区的血液部分流失,吻合血管来不及扩张,灌注压较choke I区低,血液不能及时补充所致。在正常生理状态下,跨区皮瓣choke区保持着压力的平衡,血液供给切断后,压力平衡打破,血流被迫快速流向管径更小的毛细血管[8]。随着蒂部血管扩张和跨区血管真性吻合的建立,chokeⅡ区的血管充盈度得以上升,但扩张仅限于满足基本的组织代谢需求来避免耳瓣坏死,充盈程度不如术前。通过对血管充盈度的观察可初步了解耳瓣的血供情况,从而减少耳瓣坏死率。
[1] Lozano R, Naghavi M, Foreman K, et al. Global and regional mortality from 235 causes of death for 20 age groups in 1990 and 2010: a systematic analysis for the Global Burden of Disease Study 2010[J]. Lancet, 2012, 380(9859):2095-2128.
[2] 王渭滨, 柳大烈, 孟庆延, 等. 跨区互蒂轴型皮瓣的研究进展[J]. 中国临床解剖学杂志, 2000, 18(4):385-388.
[3] McGregor IA, Morgan G. Axial and random pattern flaps[J]. Br J Plast Surg, 1973, 26(3):202-213.
[4] 庄跃宏. 穿支体形态学及跨区皮瓣存活机制的研究[D]. 广州: 南方医科大学, 2012:40-41.
[5] Dhar SC, Taylor GI.The delay phenomenon:the story unfolds [J]. Plast Reconstr Surg, 1999, 104(7):2079-2091.
[6] 梁成, 庄跃宏, 郑和平, 等. 新型小鼠跨区供血耳瓣模型的构建[J]. 中国比较医学杂志, 2014, 26(7):25-29.
[7] 冯瑞铮, 弓军胜, 董佳生. 穿支皮瓣微循环血流量的动态观察及组织学研究[J]. 山西医科大学学报, 2009, 40(11):985-988.
[8] Williams BA, Currie RW, Morris SF.Impact of arteriogenesis in plastic surgery: choke vessel growth proceeds via arteriogenic mechanisms in the rat dorsal island skin flap[J]. Microcirculation, 2009, 16(3):235-250.
Histopathological Observation on a Cross-territory Flap Choke Area of Ear in Mouse
WEN Fu-li1, LIANG Cheng1, ZHUANG Yue-hong2, WU Jian-wei1, ZHENG He-ping1
(1. Department of Comparative Medicine, Fujian Medical University Affiliated Fuzhou General Hospital of Nanjing Command, PLA, Fuzhou 350025, China; 2.Department of Human Anatomy and Histology and Embryo, Fujian Medical University, Fuzhou 350108, China)
ObjectiveTo observe the histological and morphological changes of mouse’s crossterritory ear flap model of vascular.MethodsThe right-ear of mice as experimental group, the caudal of the mouse ears were cut for 2/3 with eye scissors from caudal to cephalic direction, ear’s flap based on a vascular pedicle but crossed three vascular territories was created.The left-ear as the control group, just clearing the hair. The ear of mice were surgically cut in 0 d, 1 d, 3 d, 5 d, 7 d respectively postoperation, and fixed in 10% formaldehyde for histological observation of the changes of choke I area and choke II area in the ear’s flap.ResultsAt different time points, the average value of choke I area of blood vessels in the experimental group was larger than that of the other groups (P<0.01). The amount of venous blood vessels in choke I and choke II area respectively reached peak value at 3 d and 5 d, and then decreased gradually, and this trend may be related to the establishment of the venous reflux in the basal part of the ear flap.In choke I and choke II area, the mean values of arterial and venous blood vessel filling degree were 38.85%, 40.64% and 57.02%, 61.48%, respectively .Conclusions①After establishment of extended flap, the dilation of veins seemed to passive , whereas the dilation of arteries seemed to active; ② The number of the choke vessels between the dynamic and potential territories that are involved in dilation and extent of the dilation are much smaller than that of the choke vessels between the anatomic and dynamic territories; ③ The change of vascular diameter has positive effect on the survival of skin flap.
Mouse; Ear flap; Histopathological observation; Choke vessels
R-33 Q95-33
A
1674-5817(2016)05-0345-05
10.3969/j.issn.1674-5817.2016.05.004
福建省自然科学基金资助项目(2015J01412)和南京军区医学科技创新重大专项(ZX30)
温福利(1987-), 男, 技师, 研究方向: 比较医学。E-mail: wen_fuli@163.com
郑和平(1962-), 男, 主任医师, 研究方向: 比较医学。E-mail: zhpfz@163.com

