IgA型免疫管状肾小球病
梁少姗 曾彩虹
·肾活检·
IgA型免疫管状肾小球病
梁少姗 曾彩虹
老年男性患者,病程6年,肾脏损伤表现为肾病综合征、大量镜下血尿,肾功能不全及高血压,肾外表现为反复发作的双下肢紫癜样皮疹、补体C3偏低、贫血、血轻链κ/λ比值增高。肾活检组织学改变为肾小球膜增生样病变,免疫荧光以IgA沿肾小球毛细血管袢沉积为主,电镜下肾小球系膜区、内皮下、上皮侧见平行排列、直径均一的中空微管状物质。该患者最终诊断为IgA型免疫管状肾小球病。
IgA 免疫管状肾小球病 肾活检
病例摘要
现病史 65岁男性患者,因“反复皮疹6年,尿检异常3年,血清肌酐(SCr)升高1年”于2015-10-15入院。
2009年患者饮酒后出现双下肢皮肤出血点,大小不一,压之不褪,以左下肢明显,至当地医院检查考虑“过敏性紫癜”,未行尿检,具体治疗方案不详,皮疹缓解,此后饮酒或食用辛辣食物后反复出现双下肢皮疹,未重视。2012年尿检发现尿蛋白阳性(具体不详),肾功能不详,服泼尼松30 mg/d,后自行减至20 mg/d,尿蛋白持续阳性。2014年8月出现双下肢水肿,当地医院查血压偏高,最高达160/100 mmHg,尿蛋白+++,血清白蛋白(Alb)27.4 g/L,SCr 154 μmol/L,行肾穿刺活检术提示“假性膜增生性过敏紫癜性肾炎(ISKD Ⅳ型)”,予泼尼松、雷公藤多苷及硝苯地平缓释片治疗,血压控制不佳,未复查。2015年9月复查SCr升至408.5 μmol/L,血红蛋白78 g/L。2015年10月至我院门诊查尿蛋白定量5.75 g/24h,尿沉渣红细胞240万/ml,尿白细胞(WBC)10~15 个/HP,尿糖+++,Alb 34.4 g/L,SCr 385 μmol/L,空腹血糖7.35 mmol/l,补体C3偏低(0.6 g/L),C4正常,cANCA、pANCA阴性,双肾体积可、结构欠清。1月前曾有1次痰中带血丝,未经处理自行缓解,无肉眼血尿、关节痛,无咳嗽、咳痰,无胸闷、气喘,无头晕、头痛,无腹胀、腹泻、腹痛、黑便、脱发、频发口腔溃疡。患者目前常有恶心、呕吐感,精神、体力正常,食欲较差,睡眠可,近期体重明显变化,大便正常,尿量正常。
既往史 40年前曾行“阑尾切除术”,2014年曾行“痔疮切除术”。
个人史、婚育史、家族史 无特殊。
体格检查 血压113/73 mmHg,全身无明显皮疹,心肺腹体检未及明显无异常,双下肢无水肿。
实验室检查
尿液 尿蛋白定量5.75 g/24h,尿沉渣红细胞计数 240万/ml(80%多形型),尿WBC 0~1 个/HP;尿糖++;尿C3 10 mg/L;尿α2-MG 4 mg/L;尿NAG 50.4 U/(g·cr), RB蛋白58.2 mg/L,溶菌酶61.54 mg/L。
血生化 Alb 30.4 g/L,球蛋白14.1 g/L,SCr 302 μmol/L,BUN 8.6 mmol/L,UA 252 μmol/L,ALT 14 U/L,AST 16 U/L,总胆固醇4.44 mmol/L,三酰甘油0.92 mmol/L,钙2.18 mmol/L,其余电解质正常,空腹血糖4.9 mmol/L,餐后血糖8.0 mmol/L,HbA1c 5.4 %。eGFR 17.80 ml/(min·1.73m2)(采用EPI公式计算)。
免疫学 IgA 3.78 g/L(正常值0.7~4.0 g/L),IgG 1.43 g/L(正常值7~16 g/L),IgM 0.185 g/L(正常值0.4~2.3 g/L),类风湿因子及抗链“O”正常,ANA、A-dsDNA、pANCA、cANCA、抗GBM抗体阴性。血游离轻链κ 92.29 mg/L,λ 30.06 mg/L,κ/λ=3.07。血清免疫固定电泳未见单克隆免疫球蛋白条带。补体C3 0.60 g/L,C4 0.19 g/L,C3肾炎因子阴性,补体H因子正常、抗补体H因子抗体阴性。
其他 乙型肝炎病毒表面抗原、表面抗体、e抗原无异常, e抗体0.79,核心抗体8.41。丙型肝炎病毒IgG抗体、抗-HIV抗体、抗梅毒螺旋体抗体均阴性。
辅助检查
胸片 左上肺结节。
心电图 大致正常心电图。
腹部平片 (1)腹主动脉钙化总积分为0分;(2)腰椎退行性变。
初任期教师职业发展受外界因素诱发而被动改变。与初任期不同,此阶段教师职业发展具有积极主动的特点,发展动力源于内在的教师信念的变化。因为工作环境稳定、教学能力提高、职业焦虑降低,无需为“生存”而竞争,张老师的教学探索发自教育主体的主观能动。注重课堂组织、教课技巧和教学方法的教育信念和职业信念开始形成。听课记录、会议记录反映着她的职业信念的变化。描述课堂组织环节的“节奏”,关注“课堂气氛”,评价讲课方法和技巧,这说明她的教育信念由关注“他者”(语言)转向“求诸己”,关注自己的教学技巧和课堂组织方法。教师信念由关注“外在”转向关注“内心”,职业发展由“外层”改变转向“内层”的变化。
CT冠状动脉钙化分数测定 左冠状动脉前降支可见钙化,钙化总积分为32.6。
超声 心脏:(1)主动脉瓣钙化伴轻度反流。(2)轻-中度二尖瓣反流。双肾:左肾93 mm×41 mm×46 mm,右肾96 mm×46 mm×48 mm,肾皮质厚度不清,肾皮质回声稍增强,皮髓界限清楚,集合系统正常,右肾中极见一大小约9 mm× 9 mm类圆形无回声区,双肾轮廓规则,包膜连续完整,双肾内未见肾盂肾盏扩张。
骨髓穿刺细胞学检查 轻度血稀骨髓象,浆细胞占1.5%,为成熟浆细胞;骨髓活组织检查:右侧髂前上棘示骨髓增生活跃。
肾活检病理
光镜 皮质肾组织1条。35个肾小球中14个球性废弃(40%)。余肾小球系膜区中~重度增宽,毛细血管袢开放尚好,节段袢内皮细胞增殖,单个核细胞浸润致数处袢腔狭小,偶见PAS弱阳性的“栓子”(图1A),囊壁节段增厚。PASM-Masson:肾小球系膜区节段、内皮下较多、上皮侧偶见嗜复红物沉积(图1B),较多外周袢分层(图1C)。肾小管间质慢性病变中度,灶性肾小管萎缩、基膜增厚,未萎缩肾小管基膜亦增厚,急性病变中度,多灶性肾小管上皮细胞刷状缘脱落,管腔内见蛋白管型、红细胞管型及脱落的肾小管上皮细胞,间质弥漫单个核细胞浸润,散在泡沫细胞分布,灶性纤维化++。小叶间动脉内膜增厚,小动脉节段透明变性。
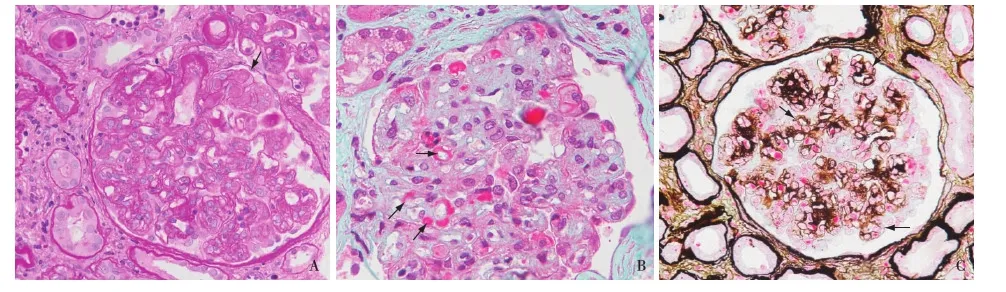
图1 A:肾小球系膜区中~重度增宽,毛细血管袢腔狭小,偶见“栓子”(↑)(PAS,×400);B:肾小球系膜区、内皮下、上皮侧嗜复红物沉积(↑)(Masson三色,×400);C:肾小球外周袢分层(↑)(PASM-Masson,×400)
免疫荧光 17个肾小球, IgA++(图2A)、IgM trace、C3++、κ轻链++(图2B)、λ轻链++(图2C),呈颗粒状弥漫分布于系膜区及血管袢,以血管袢沉积为主。IgG、C1q阴性。
电镜 3个肾小球。肾小球系膜区增宽,系膜细胞及系膜基质增多,系膜区见密度不均的电子致密物分布(图3A);肾小球毛细血管袢开放欠好,袢腔内充填肿胀、增生的内皮细胞及浸润细胞(单核细胞、淋巴细胞及中性粒细胞);多处系膜插入、新的基膜形成。低倍镜下毛细血管袢基膜内皮下节段、上皮侧偶见密度不均匀的电子致密物沉积(图3B),高倍镜下致密物为中空微管状结构,直径33~47 nm,平行排列(图3C)。肾小球毛细血管袢基膜厚度约250~410 nm。肾小球足细胞足突广泛融合(70%~80%),胞质少量微绒毛化,胞质内见吞噬性溶酶体。
综合临床病理,最终诊断为IgA型免疫管状肾小球病。
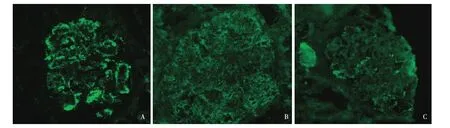
图2 IgA ++ (A),κ++(B),λ++(C),呈颗粒状沉积于肾小球系膜区及血管袢,并以血管袢沉积为主(IF,×400)

图3 A:肾小球系膜区、基膜内皮下及上皮侧见密度不均匀的电子致密物沉积;B,C:高倍镜下致密物为中空微管状结构,直径33~47 nm,平行排列(EM)
讨 论
患者为老年男性,慢性病程,临床表现肾病综合征,大量镜下血尿,肾功能不全及高血压;肾外表现为反复发作的双下肢紫癜样皮疹,补体C3偏低;血液系统表现为贫血,IgA水平正常但IgG、IgM明显下降,血轻链κ/λ比例增高,骨髓细胞学示成熟浆细胞1.5%。肾活检光镜改变为肾小球膜增生样病变(MPGN)伴袢腔内偶见“栓子”,免疫荧光以IgA、C3血管袢沉积为主,电镜下沉积物为微管状物质。
MPGN这一形态学表现根据免疫病理可分为免疫复合物相关肾小球疾病、单克隆免疫球蛋白相关的肾小球疾病和C3肾病[1]。该例患者免疫荧光除C3外,同时存在免疫球蛋白IgA沉积,IgA和C3染色强度相等,首先排除C3肾病的诊断。其次,患者自身抗体阴性、无丙肝病毒及活动性乙肝病毒感染、无患实体肿瘤证据,排除自身免疫、感染、实体肿瘤相关的免疫复合物介导的肾小球疾病。免疫球蛋白染色IgA++,IgM trace, IgG阴性,结合患者血液系统的表现,应积极排查单克隆免疫球蛋白相关的肾小球疾病。进一步行轻链染色示肾小球k、λ均阳性,但是,在IgM阳性的情况下,不能完全根据轻链染色双阳性而否定单克隆免疫球蛋白相关的肾小球疾病[2]。
免疫荧光肾小球以IgA沉积为主的疾病,常见有以下几类疾病。(1)IgA肾病:光镜下的表现呈多样性,从肾小球轻度系膜增生性病变至弥漫增生性病变,免疫荧光IgA系膜区沉积为主,电镜下电子致密物无特殊结构,肾外无皮肤紫癜的表现,因此本例患者不考虑IgA肾病。(2)过敏性紫癜性肾炎:与IgA肾病的光镜、免疫荧光及电镜相类似,国际肾脏病组织(ISKD)将其分为六型,其中Ⅵ型为“肾小球膜增生样病变”。肾外表现为皮肤紫癜,较常见于双下肢伸侧,补体C3水平正常。该例患者尽管存在紫癜样皮疹,但IgA沉积的部位以血管袢为主,且最为突出的表现为电镜下沉积物具有特殊结构,与过敏性紫癜性肾炎的免疫荧光及超微结构特点均不符。(3)IgA沉积为主的感染后肾小球肾炎:常见于中老年人,糖尿病为易患因素,多为葡萄球菌感染诱发,补体C3下降,光镜主要表现肾小球弥漫毛细血管内细胞增殖性病变伴显著的中性粒细胞浸润,免疫荧光以IgA、C3沉积为主,且C3染色多强于IgA,电镜见典型“驼峰”形成[3]。该例患者无糖尿病,起病前无感染诱因,电镜下亦未见“驼峰”形成,因此不符合。(4)IgA沉积为主的MPGN,本例患者属于此类,进一步行电镜及其他辅助检查有助于明确诊断。
本例患者电镜下观察发现超微结构极具特征性,表现为低倍镜下肾小球系膜区、毛细血管袢基膜内皮下较多、上皮侧偶见密度不均匀的电子致密物沉积,高倍镜下电子致密物呈中空微管状结构,直径均一,约33~47 nm,平行排列。根据该超微结构特点,结合光镜及免疫荧光,诊断考虑免疫管状肾小球病。
免疫管状肾小球病的光镜主要表现为MPGN,可伴内皮下大量沉积物,少数可见袢内栓塞形成,其次为肾小球膜性病变和肾小球毛细血管内增生性病变,沉积物PAS弱阳性、嗜伊红、不嗜银,一般不累及肾小管间质及血管。免疫荧光免疫球蛋白以IgG沉积多见,IgA、IgM少见,目前报道的病例中以单克隆性的单一重链及单一轻链常见。电镜下沉积物为平行或成束排列、无分枝、直径均一,约20~90 nm、多数30~60 nm的中空微管状物。目前它的诊断标准为[4]:(1)免疫荧光免疫球蛋白沉积,(2)电镜<30 000放大倍数下可见中空微管状结构,(3)局部或全部呈平行排列,(4)排除冷球蛋白相关肾小球肾炎及狼疮性肾炎。
IgA型免疫管状肾小球病极为罕见,目前仅见个案报道。Moriyama等[5]报道1例IgA2及单一κ轻链阳性的MPGN,电镜下肾小球系膜区、基膜膜内及内皮下可见平行排列、直径35~45 nm的微管状结构。Nasr等[4]报道了16例免疫管状肾小球病患者,其中1例患者光镜下表现为MPGN-Ⅲ型,免疫荧光IgA、IgM、k、λ沉积,电镜下平均直径31 nm的中空微管状物质沉积于系膜区及基膜内皮下,血和尿免疫固定电泳见IgA-κ条带。
免疫管状肾小球病需要鉴别其他免疫球蛋白沉积伴电镜下具有特殊超微结构的疾病,包括系统性淀粉样变性、冷球蛋白血症肾小球肾炎、单克隆免疫球蛋白沉积的增生性肾小球肾炎、纤维性肾小球肾炎等。免疫球蛋白通常为IgG,以IgA沉积为主病例尽管罕见,但不能忽视。(1)重链及轻-重链型淀粉样变性:肾组织刚果红染色阳性,肾小球、血管、间质、肾小管基膜均可沉积,淀粉样物质PAS及银染可呈阳性,免疫荧光单一重链IgA及单一的κ或λ沉积,电镜下为无分枝、排列紊乱、直径8~12 nm的纤维丝,无微管状结构。(2)冷球蛋白血症相关性肾小球肾炎:血冷球蛋白阳性,光镜下呈MPGN,袢腔内可见PAS强阳性的冷球蛋白栓子,超微结构可见弯曲微管状、杆状、纤维丝状、指纹状结构,但不是每例冷球蛋白血症的患者沉积物均具有超微结构,本例患者超微结构的微管状物与冷球蛋白的不同,呈平行排列,需待冷球蛋白结果进一步排除。Touchard等[6]曾报道IgA型冷球蛋白血症相关的肾小球肾炎,肾脏病理为肾小球弥漫毛细血管内渗出性病变,IgA沉积于肾小球系膜区、内皮下,以及袢腔内形成“栓子”,电镜下电子致密物为“网格状”晶体(纵切面为20 nm宽条纹,横切面为直径10 nm的微管)。(3)单克隆免疫球蛋白沉积的增生性肾小球肾炎:免疫病理肾小球单一的重链亚型和单一轻链沉积,肾小管、间质及血管壁阴性。Bhutani等[7]报道了60例单克隆免疫球蛋白沉积的增生性肾小球肾炎,其中1例患者仅IgA及k轻链沉积于肾小球,血清单克隆免疫球蛋白条带阳性、骨髓检查发现单克隆浆细胞。Soares等[8]报道1例IgA1及单一λ轻链阳性的MPGN,电镜下见矩形的块状物质沉积、内见平行排列条纹状超微结构,外周血浆细胞标记可见少量单克隆λ阳性的浆细胞。(4)纤维性肾小球肾炎:Nebuloni等[9]报道1例患者光镜为肾小球系膜增生性病变伴袢坏死及新月体,免疫荧光肾小球IgA及单一κ轻链沉积,电镜下可见系膜区、基膜膜内、内皮下及上皮侧无分枝的、短直的纤维丝,最长200 nm,直径10~23 nm,无微管状结构,排列紊乱或偶见成对平行排列。
自1980年首次提出免疫管状肾小球病以来,陆续有类似的报道[4,10-11],本中心曾报道两例免疫管状肾小球病[12-13]。患者以中老年男性为主,肾脏表现肾病范围蛋白尿,可伴肾功能不全。肾外表现为近1/2患者补体C3下降,多数患者血、尿免疫固定电泳可见单克隆免疫球蛋白条带,可伴血、尿轻链比值异常,约1/3患者诊断为多发性骨髓瘤、慢性淋巴细胞性白血病或淋巴浆细胞性淋巴瘤。治疗上采用激素及免疫抑制剂治疗,预后不佳。本例患者肾脏表现为肾病综合征及肾功能不全,同时存在补体C3下降,贫血,IgA水平正常但IgG、IgM水平明显下降,血轻链比值异常,骨髓细胞学成熟浆细胞占1.5%,考虑为浆细胞相关性疾病。患者随访9个月时,进入维持性血液透析。此外,本例患者极具迷惑性的临床表现为病程中反复出现皮肤紫癜,肾小球肾炎合并紫癜样皮疹的鉴别诊断中,最常见的疾病为过敏性紫癜,其皮肤活检可见IgA沿血管壁沉积,其次,冷球蛋白血症患者也可出现紫癜样皮疹。免疫管状肾小球病伴有紫癜样皮疹的病例报道仅有3例,皮肤活检均为白细胞破碎性血管炎,皮肤血管周围伴[14]或不伴[4,15]免疫球蛋白沉积。对于紫癜样皮疹,有条件应行皮肤活检行光镜和免疫荧光染色有助于鉴别诊断。
免疫管状肾小球病的发病机制尚未明确,激光微分离肾小球质谱分析提示微管状沉积物的成分为免疫球蛋白、补体,并含淀粉样P物质、载脂蛋白E等[4]。
总之,本例是极为罕见的IgA型免疫管状肾小球病,光镜表现为MPGN,免疫荧光IgA血管袢沉积为主,电镜下肾小球系膜区、内皮下、上皮侧见极具特征性的平行排列的中空微管状的超微结构。临床表现肾病综合征和大量镜下血尿,伴补体C3下降、贫血、IgA水平正常但IgG、IgM水平明显下降,血轻链比值异常,病程中反复发作紫癜样皮疹,需要长期随访排除浆细胞异常增生性疾病或其他特殊疾病。肾小球以IgA沉积为主的疾病病因多样,需结合临床考虑,电镜是诊断和鉴别诊断的重要手段。
1 Sethi S,Fervenza FC.Membranoproliferative glomerulonephritis--a new look at an old entity.N Engl J Med,2012,366(12):1119-1131.
2 Hemminger J,Nadasdy G,Satoskar A,et al.IgG Subclass Staining in Routine Renal Biopsy Material.Am J Surg Pathol,2016,40(5):617-626.
3 Nasr SH,D′Agati VD.IgA-dominant postinfectious glomerulonephritis: a new twist on an old disease.Nephron Clin Pract,2011,119(1):c18-25.
4 Nasr SH,Fidler ME,Cornell LD,et al.Immunotactoid glomerulopathy: clinicopathologic and proteomic study.Nephrol Dial Transplant,2012,27(11):4137-4146.
5 Moriyama T,Honda K,Tsukada M,et al.A case of immunotactoid glomerulopathy with IgA2,kappa deposition ameliorated by steroid therapy.Nihon Jinzo Gakkai Shi,2003,45(5):449-456.
6 Touchard G.Ultrastructural pattern and monoclonal classification of renal monoclonal immunoglobulin deposits∥Touchard AP,Hermine G,Ronco Q,et al.Monoclonal Gammopathies and the Kidney.Dordrecht,The Netherlands;Kluwer.2003:97-117.
7 Bhutani G,Nasr SH,Said SM,et al.Hematologic characteristics of proliferative glomerulonephritides with nonorganized monoclonal immunoglobulin deposits.Mayo Clin Proc,2015,90(5):587-596.
8 Soares SM,Lager DJ,Leung N,et al.A proliferative glomerulonephritis secondary to a monoclonal IgA.Am J Kidney Dis,2006,47(2):342-349.
9 Nebuloni M,Genderini A,Tosoni A,et al.Fibrillary glomerulonephritis with prevalent IgA deposition associated with undifferentiated connective tissue disease: A case report.NDT Plus,2010,3(1):57-9.
10 Schwartz MM,Korbet SM,Lewis EJ.Immunotactoid glomerulopathy.J Am Soc Nephrol,2002,13(5):1390-1397.
11 Rosenstock JL,Markowitz GS,Valeri AM,et al.Fibrillary and immunotactoid glomerulonephritis: Distinct entities with different clinical and pathologic features.Kidney Int,2003 Apr;63(4):1450-61.
12 曾彩虹,刘志红,郑春霞,等.免疫管状肾小球病.肾脏病与透析肾移植杂志,2008,17(5): 488-493.
13 陈浩,朱小东,曾彩虹.肾小球微管状免疫球蛋白沉积.肾脏病与透析肾移植杂志,2015,24(2): 190-194.
14 Schifferli JA,Merot Y,Cruchaud A,et al.Immunotactoid glomerulopathy with leucocytoclastic skin vasculitis and hypocomplementemia: a case report.Clin Nephrol,1987,27(3):151-155.
15 Orfila C,Meeus F,Bernadet P,et al.Immunotactoid glomerulopathy and cutaneous vasculitis.Am J Nephrol,1991,11(1):67-72.
(本文编辑 律 舟)
Immunotactoid glomerulopathy with prevalent IgA deposition
LIANGShaoshan,ZENGCaihong
NationalClinicalResearchCenterofKidneyDiseases,JinlingHospital,NanjingUniversitySchoolofMedicine,Nanjing210016,China
A 65-year-old man who had recurrent skin purpura rash developed nephrotic symdrome, hematuria, renal failure, hypertension, as well as extrarenal manifestations of anemia, decreased C3, and elevated κ∶ λ ratio. Renal biopsy showed membranoproliferative glomerulonephritis (MPGN). Immunoflurerscence indicated granular staining of capillary loop and mesangium in glomeruli for IgA, κ and λ light chain. Ultrastructral examination showed presence of electron-dense deposition of microtubules that had distinct hollow centers with 33-47 nm in diameter, arranged in parallel in the mesangium, subendothelial and rarely in the subepithelial area. The final diagnosis was immunotactoid glomerulopathy with prevalent IgA deposition.
lgA immunotactoid glomerulopathy renal biopsy
10.3969/cndt.j.issn.1006-298X.2016.05.019
南京军区南京总医院肾脏科 国家肾脏疾病临床医学研究中心 全军肾脏病研究所(南京,210016)
2016-09-08

