油松叶水提液对高羊茅的化感效应研究
王晓英
(唐山师范学院,河北 唐山 063000)
油松叶水提液对高羊茅的化感效应研究
王晓英
(唐山师范学院,河北 唐山063000)
摘要:采用室内生物测定法比较油松(Pinus tabulaeformis)生活叶、凋落叶以及凋落叶腐解物的水提液对高羊茅(Festuca arundinacea)种子萌发、幼苗生长及生理的影响。结果表明:油松生活叶、凋落叶、凋落叶腐解物水提液对高羊茅种子发芽率和发芽势的抑制率分别为6.14%~69.30%和3.23%~96.77%;对高羊茅幼苗根长和苗高的抑制率分别为-1.92%~45.90%和0.39%~29.83%。高羊茅对3种水提液化感效应敏感性依此为:生活叶水提液>凋落叶水提液>凋落叶腐解物水提液。3种水提液对高羊茅幼苗SOD,POD和CAT活性表现出不同程度的促进或抑制作用;MDA含量随处理浓度升高显著升高;除0.075 g/mL凋落叶水提液处理外,其余处理可溶性蛋白含量降低。试验表明,3种油松叶水提液对高羊茅均有一定的化感效应,以生活叶的作用最强,其次为凋落叶,凋落叶腐解物最弱。
关键词:油松叶;水提液;高羊茅;化感效应
园林绿化林草复合种植不仅可以充分利用林地资源,丰富园林绿化效果,而且还可以提高林下植被多样性,是人工林种植模式中兼顾生态效益、经济效益和社会效益的重要经营管理模式之一。但是不同种群间的化学生态关系明显影响该种植模式,如桉树下欧石楠和木麻黄生长受到抑制[1],木豆叶片浸提液影响黑麦草、高羊茅和非洲狗尾草等种子萌发和幼苗生长[2],巨桉对林下紫花苜蓿存在明显的化感作用[3],油松枯落叶混土分解后的浸提液抑制毛苕子和草木樨种子萌发[4]等。因此,科学配置园林植物需要明确园林植物间的化学生态关系。
油松(Pinustabulaeformis)是松科(Pinaceae)常绿植物。在城市园林绿化中,油松常散植于草坪中,可增加绿化层次。但种植多年后,油松周边高羊茅草坪生长不良,甚至死亡。前人研究表明,油松具有自毒作用,且主要器官为地上部枝叶[5]。试验测定了油松生活叶、凋落叶以及凋落叶腐解物水提液对高羊茅种子萌发、幼苗生长以及生理指标的影响,旨在探明油松叶对高羊茅的化感效应,为园林植物绿化的合理配置及园地的管理提供理论依据。
1材料和方法
1.1试验材料
油松生活叶于2014年12月采自唐山师范学院校园油松植株二年生枝条上,凋落叶取自校园油松树冠下表层黄色凋落叶,高羊茅种子购自克劳沃公司。
1.2试验方法
1.2.1材料采集和处理油松生活叶洗净,凋落叶剔除杂质、筛去土粒,风干,粉碎,过筛备用。
1.2.2油松凋落叶腐解物制备凋落叶粉末与漂洗过的园土以60∶300 g的比例混匀装入烧杯,加少许水,塑料薄膜封口(扎眼通气),置于人工气候箱内25℃恒温避光腐解40 d后,取出腐解物加入600 mL蒸馏水搅拌均匀,8层纱布过滤后4 000 r/min离心10 min,使上清液通过0.45 μm的微孔滤膜,得到质量浓度为0.100 g/mL的腐解液母液(即母液包含0.100 g/mL凋落叶粉末腐解后的化感物质)。稀释至0.075,0.050和0.025 g/mL,4℃保存备用。为了消除外界影响,腐解所用的土壤用清水反复漂洗,消除土壤中的养分物质后,风干,磨碎,过筛备用[6]。
1.2.3油松生活叶、凋落叶水提液制备分别取油松生活叶、凋落叶粉末于烧杯中,与蒸馏水以质量比1∶8比例混匀,置于人工气候箱25℃恒温避光浸提72 h,8层纱布过滤后4 000 r/min离心10 min,使上清液通过0.45 μm的微孔滤膜,得到质量浓度为0.125 g/mL的水提液母液(即母液包含0.125 g/mL凋落叶粉末水提后的化感物质)。稀释成0.100、0.075、0.050、0.025 g/mL的工作液,4℃保存备用。
1.2.4试验设计将高羊茅种子用0.3% KMnO4溶液消毒10 min,蒸馏水冲洗后,置于40~45℃的恒温水浴锅中水浴20 min,备用。每个培养皿铺2层滤纸,均匀播入50粒种子,向培养皿中分别加入3 mL的0.025、0.050、0.075、0.100 g/mL的凋落叶腐解液、生活叶水提液、凋落叶水提液,保持滤纸湿润,将培养皿置于室温下培养,对照组用蒸馏水。每个处理设3次重复。每天根据培养皿滤纸干燥程度适量补充处理液。
从种子露白开始,每隔24 h记录萌发的种子数(胚根或胚轴突破种皮1~2 mm为萌发)。连续记录7 d,计算发芽率、发芽势。
发芽率=7 d内正常发芽的种子数/供试种子总数×100%。
发芽势=3 d内正常发芽的种子数/供试种子总数×100%。
发芽后第 7 d取部分幼苗测定其生长和生理指标。从每个培养皿中挑选10株健壮幼苗,吸水纸吸干水分后,用直尺测定每株幼苗的根长和苗高;超氧化物歧化酶(SOD)、过氧化物酶(POD)、过氧化氢酶(CAT)活性测定参照文献[7]方法;丙二醛(MDA)含量测定参照文献[8]的方法;可溶性蛋白含量测定采用文献[9]方法。
考虑到各测定指标的量纲不同,所以油松叶对高羊茅化感效应的研究是通过各个指标的化感相对抑制率(IR)来体现。
相对抑制率IR=(处理值-对照值)/对照值×100%
IR>0表示促进,IR<0表示抑制,抑制率绝对值的大小与作用强度一致。
以化感效应平均敏感指数(M)[10-11]评价各测定指标以及高羊茅种子萌发和幼苗生长2个阶段对油松叶化感效应的敏感性:
式中:R为化感效应平均敏感指数(M)的级别,IR为数据项,n为该级别数据(IR)的总个数。M绝对值的大小与作用强度(敏感性)一致,M>0为促进,M<0为抑制。文中将受体植物R项分为1,2和3共3个级别,分别代表1、2、3级敏感指数。1级敏感指数评价种子发芽率、发芽势及幼苗根长、苗高4个测定指标对化感作用的敏感性;2级敏感指数评价受体植物在种子萌发阶段和幼苗生长阶段对化感作用的敏感性;3级敏感指数评价受体植物在物种水平的综合敏感性。
1.3数据处理
数据经Excel处理后,利用SPSS19.0进行显著性分析。数据均以“均值±标准误”表示。
2结果与分析
2.1油松叶水提液对高羊茅种子萌发的影响
不同浓度油松生活叶、凋落叶和凋落叶腐解物的水提液对高羊茅种子发芽率和发芽势均有抑制作用,且有浓度效应(表1)。0.025g/mL质量浓度处理下,生活叶、凋落叶和凋落叶腐解物的水提液对高羊茅种子萌发抑制率分别为21.93%,6.14%和10.09%,对种子发芽势抑制率分别为34.40%,3.23%和12.37%;随着质量浓度的升高,高羊茅种子发芽率、发芽势逐渐降低,在0.100g/mL质量浓度处理下,生活叶、凋落叶和凋落叶腐解物的水提液对高羊茅种子发芽率抑制率分别达到69.30%,57.01%和27.18%,对种子发芽势抑制率分别为96.77%,79.56%和38.18%。除0.025g/mL质量浓度处理下,凋落叶水提液对种子发芽率和发芽势的抑制率低于凋落叶腐解物水提液处理外,其余各浓度处理对高羊茅种子发芽率和发芽势的抑制率大小依次为生活叶水提液>凋落叶水提液>凋落叶腐解物水提液。
2.2油松叶水提液对高羊茅幼苗生长的影响
不同浓度油松生活叶和凋落叶水提液对高羊茅幼苗根长表现出抑制作用,凋落叶腐解物水提液对其表现出“低促高抑”的作用,且随水提液质量浓度升高抑制程度增大(表2)。在0.025g/mL质量浓度下,油松生活叶和凋落叶水提液对高羊茅幼苗根长的抑制率分别为2.09%和17.80%,凋落叶腐解物水提液则促进了根长生长,促进率为1.92%,均未达到显著水平。随着水提液质量浓度的升高,各水提液对根长生长均表现出抑制作用,在0.100 g/mL质量浓度下,3种水提液对根长的抑制率分别为42.93%,42.06%和45.90%,均与对照差异显著(P<0.05)。不同浓度油松生活叶、凋落叶和凋落叶腐解物的水提液对高羊茅幼苗苗高生长均有抑制作用,抑制程度随水提液质量浓度升高而增大。低浓度处理(≤0.050)的高羊茅幼苗苗高与对照差异不显著,高浓度(≥0.075)处理与对照差异显著。除0.025 g/mL质量浓度下,油松生活叶水提液对苗高生长的抑制作用很微弱,其余浓度下生活叶水提液对苗高的抑制率最大,其次为凋落叶水提液,凋落叶腐解物水提液对苗高抑制率最小。
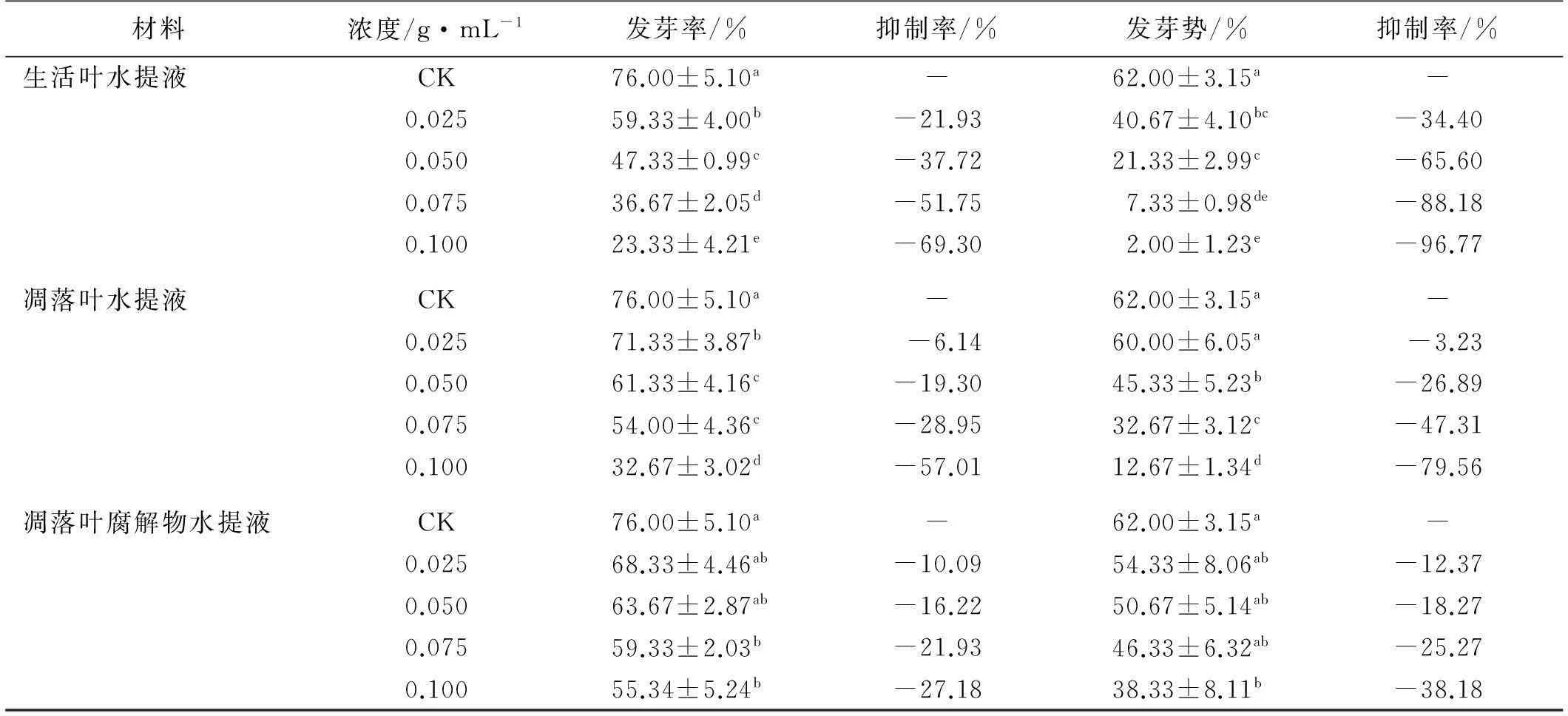
表1 不同浓度油松生活叶水提液、凋落叶水提液和凋落叶腐解物水提液处理下
注:表中同处理同列不同小写字母表示差异显著(P<0.05)
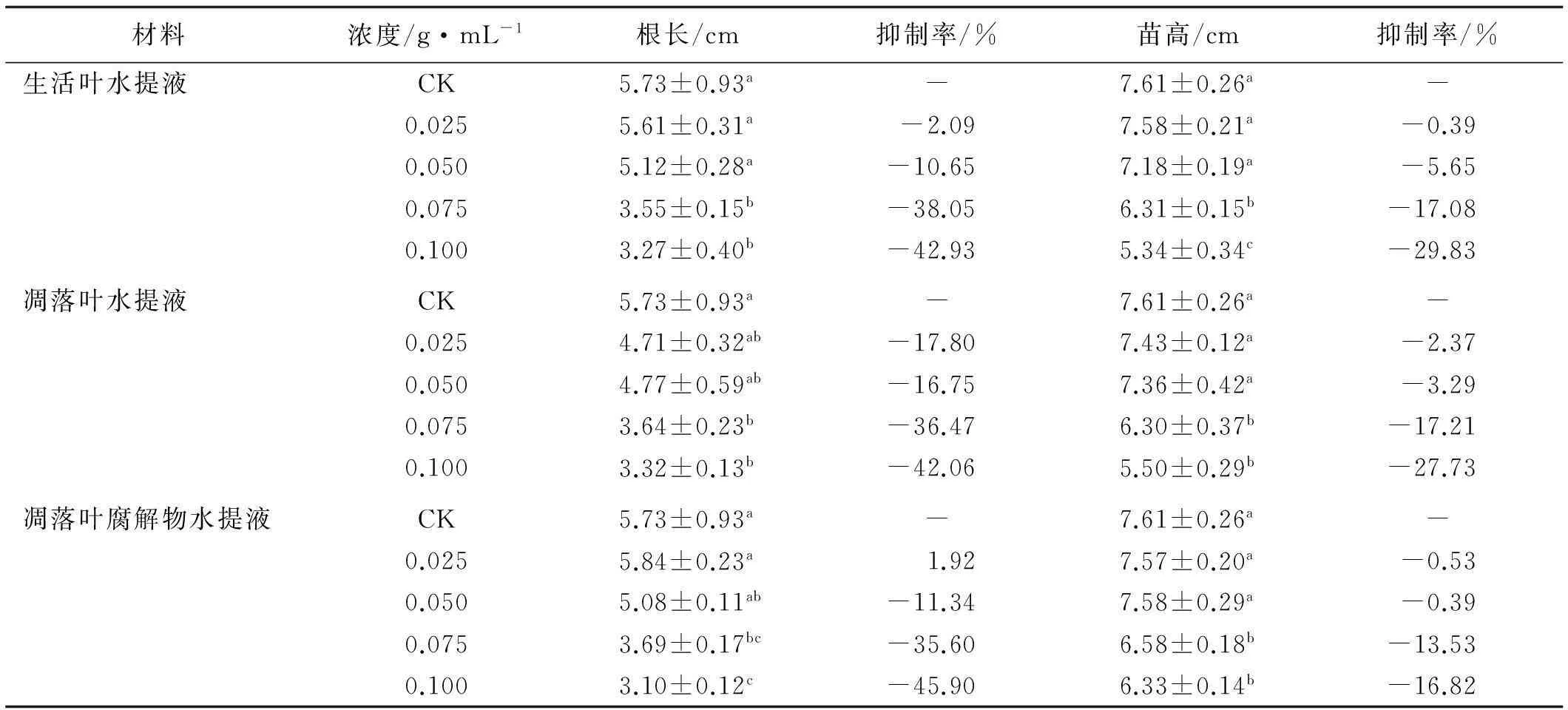
表2 不同浓度油松鲜叶水提液、落叶水提液和落叶腐解液处理下高羊茅幼苗生长的化感作用
2.3油松叶水提液对高羊茅不同受体指标化感效应综合比较
1、2、3级敏感指数均为负值,说明3种油松叶的水提液对高羊茅种子萌发和幼苗生长均有抑制作用,抑制程度有差异(表3)。由1级敏感指数(M1)可知,高羊茅种子发芽势对3种供体的敏感性强于发芽率,根长对其的敏感性强于苗高。由二级敏感指数(M2)可知,生活叶水提液对高羊茅种子萌发阶段的抑制作用最强;凋落叶水提液对高羊茅幼苗生长的抑制作用最大;凋落叶腐解物的水提液对二者的抑制作用均最弱。从受体植物(M3)来看,高羊茅对生活叶水提液的敏感性最强,其次是凋落叶水提液,对凋落叶腐解物水提液的敏感性最弱。
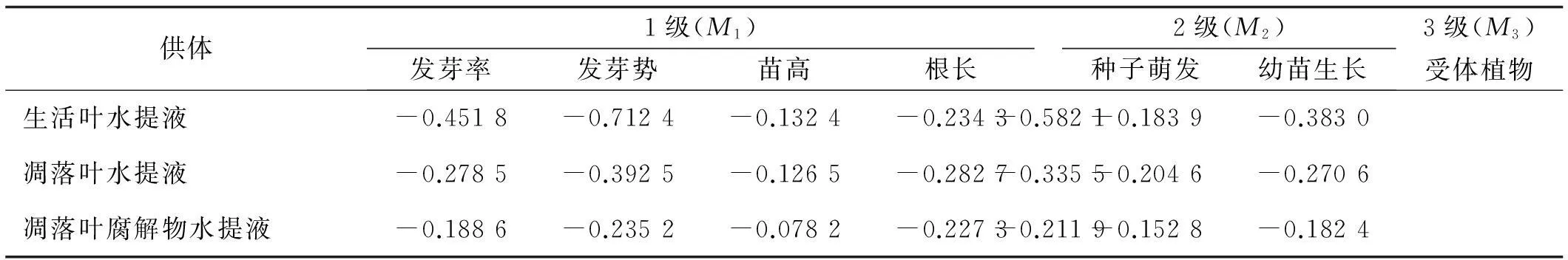
表3 高羊茅不同受体指标处理下油松叶化感效应的敏感性
2.4油松叶水提液对高羊茅幼苗生理指标的影响
不同类型油松叶水提液处理下,高羊茅幼苗的保护酶活性、丙二醛和可溶性蛋白含量均有变化(表4)。低浓度生活叶水提液处理(≤0.050 g/mL)明显促进了幼苗SOD活性(P<0.05),高浓度处理(≥0.075 g/mL)抑制了SOD活性,但与对照差异不显著。在0.050和0.075 g/mL凋落叶水提液处理下,高羊茅幼苗体内SOD活性表现出明显的降低(P<0.05),当浓度增加到0.100 g/mL时,高羊茅幼苗体内SOD活性有上升,但与对照相比,仍降低了5.78%。低浓度生活叶水提液处理(≤0.050 g/mL)促进了高羊茅幼苗体内POD活性和CAT活性,0.075 g/mL处理则抑制了其活性;当浓度升高至0.100 g/mL,幼苗体内POD活性和CAT活性升高,但与对照差异不显著。凋落叶水提液处理对幼苗POD活性和CAT活性均表现出低浓度促进高浓度抑制的作用,但与对照差异均不显著。凋落叶腐解物水提液处理对高羊茅幼苗体内SOD活性和CAT活性有不同程度的促进作用,促进率分别为11.92%~19.66%和11.04%~17.18%;对高羊茅幼苗POD活性基本表现出“低促高抑”的作用,
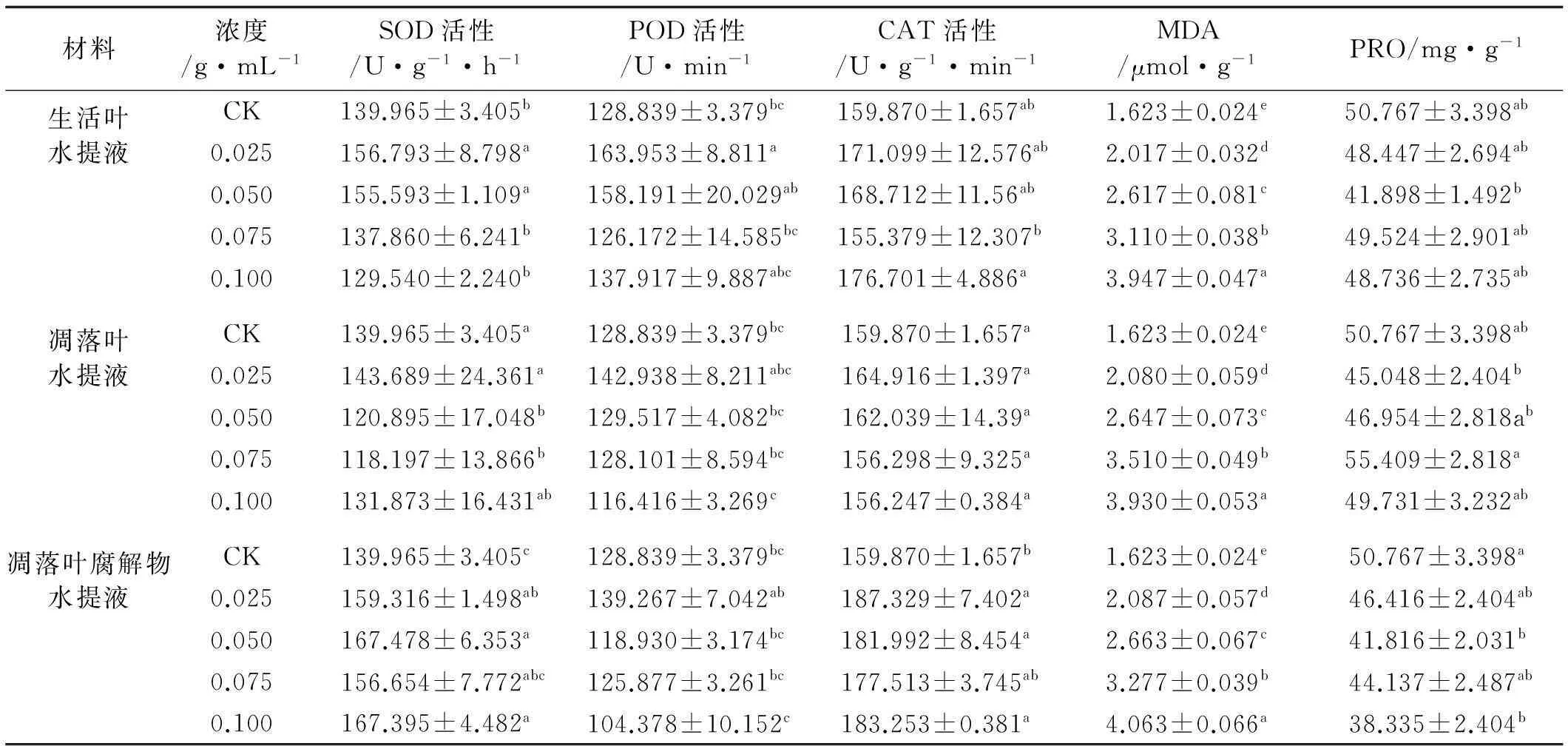
表4 油松叶对高羊茅幼苗生理指标的化感效应
在抑制的浓度范围内抑制率有波动。
丙二醛是膜脂过氧化的终产物之一。不同质量浓度的生活叶、凋落叶、凋落叶腐解物的水提液对高羊茅幼苗MDA含量均有显著促进作用(P<0.05),促进程度随质量浓度升高而增加。在质量浓度为0.100 g/mL时,幼苗体内MDA含量分别是对照的2.43,2.42和2.50倍。除0.075 g/mL凋落叶水提液处理外,其余处理的生活叶、凋落叶、凋落叶腐解物的水提液对高羊茅幼苗可溶性蛋白含量有不同程度的抑制作用。
3讨论
目前,园林树木的化感作用主要集中在园林树木与林下地被之间,前人对红叶李、白玉兰、刺桐、樟树、圆柏等园林树木对多种地被植物的化感作用进行了研究报道,供体材料主要是园林树木生活叶或凋落叶的水提液[12-15]。实际生活中,植物叶片还可经过腐烂分解逐步释放出化感物质,需要经过复杂的土壤转化过程[16]。所以,通过采集凋落叶经过混土分解培养后的腐解物的水提液进行化感试验,更能全面反映凋落叶所产生的化感效应。再将凋落叶腐解物水提液的化感效应与生活叶和凋落叶自身的水提液化感效应进行对比,还能反映植物叶在不同生命周期中化感效应的变化。
植物化感作用对受体的影响主要是通过影响受体的种子萌发和幼苗生长来表达[17]。试验结果表明:油松生活叶、凋落叶以及凋落叶腐解物水提液对高羊茅种子萌发和幼苗生长均有抑制作用,说明其化感效应的存在。高羊茅对油松生活叶水提液的敏感性最强,敏感指数为-0.383 0;其次,凋落叶水提液的-0.270 6,对凋落叶腐解物水提液的敏感性最弱,为-0.182 4。这可能是不同供体材料水提液包含的化合物不同和化感物质协同作用的结果[18]。生活叶是植物进行光合作用合成有机物的主要器官,各种次生代谢也在此进行,合成了包括化感物质在内的影响植物种子萌发和幼苗生长的各种次生代谢物质,故其化感抑制作用较强。油松叶在枯落前将部分化感物质转移到植株其它生活部位,导致落叶化感物质含量及种类减少,其水提液的化感作用减弱,这是植物在长期的种间竞争过程中进化而来的竞争机制。凋落叶腐解物水提液的化感作用最弱,其原因是落叶经土壤中微生物的分解后产生了两种物质,一种是促进植物生长的养分或者激素类物质,另一种是抑制植物生长的化感物质[16],这两种物质的综合效应使得凋落叶腐解物水提液的化感抑制作用弱于凋落叶水提液。
抗氧化能力的提高与渗透调节物质的积累,是植物在逆境下得以生存的两种重要机制[19]。试验结果表明:油松生活叶、凋落叶及凋落叶腐解物水提液处理对高羊茅幼苗体内的保护酶活性、丙二醛含量及可溶性蛋白含量均有不同程度的影响。3种水提液对高羊茅幼苗SOD,POD和CAT活性基本表现出促进或低浓度促进高浓度抑制的作用。说明低浓度水提液处理下,高羊茅受体SOD,POD和CAT活性增强,随着浓度的增加外界胁迫超过了受体SOD,POD和CAT酶的调节能力,故其活性受到抑制,导致膜脂过氧化作用加强,细胞膜受损,MDA含量升高,这与前人研究结果一致[20]。
在逆境中,为保持细胞的渗透调节能力和保护细胞内某些酶的活性,植物细胞自身会积累一些渗透调节物质。本试验中各水提液处理下,高羊茅幼苗可溶性蛋白含量均降低,这与前人研究结果一致[21]。陈洪等[22]研究表明,受土壤中巨桉凋落叶分解的影响,老芒麦体内可溶性糖与可溶性蛋白含量分别显著升高与降低,推测二者之间可能存在某种转化关系。油松叶水提液处理下高羊茅体内可溶性糖含量是否增加以及是否由可溶性蛋白转化而来需进一步研究。
在试验所设浓度范围内,油松生活叶、凋落叶和凋落叶腐解物的水提液对高羊茅种子萌发、幼苗生长均有一定的化感抑制作用,以生活叶的作用最强,其次为凋落叶,凋落叶腐解物最弱。目前,不同研究者对化感物质研究所设定的浓度范围差距较大。实践中油松生活叶、凋落叶和凋落叶腐解物水提液对高羊茅的化感效应还与其释放到环境中的浓度与量有关,需进一步研究。
参考文献:
[1]MORAL R D,WILLIS R T.Suppression of coastal heath vegetation by Eucalyptus baxteri[J].Australian Journal of Botany,1978,26(2):203-219.
[2]许岳飞,毕玉芬,金晶炜.木豆化感作用对6种灌草种子萌发和幼苗生长的影响[J].云南农业大学学报,2008,23(3):375-380.
[3]钟宇,张健,杨万勤,等.不同土壤水分条件下生长的巨桉对紫花苜蓿的化感作用[J].草业学报,2009,18(4):81-86.
[4]李俊,刘增文.4种针叶纯林枯落叶对3种豆科灌草的化感效应[J].草业科学,2013,30(7):1057-1065.
[5]李登武,王冬梅,姚文旭.油松的自毒作用及其生态学意义[J].林业科学,2010,46(11):174-178.
[6]李俊,刘增文,田楠,等.黄土高原人工林枯落叶对苜蓿的化感效应[J].草地学报,2013,21(1):92-99.
[7]张志良.植物生理学实验指导[M].北京:高等教育出版社,2003.
[8]赵世杰,许长成,邹琦,等.植物组织中丙二醛含量测定方法的改进[J].植物生理学通讯,1991,30(3):207-210.
[9]BRADFORD M M.A rapid and sensitive method for quantization of microgram quantities of protein utilizing the principle of protein dye binding[J].Analytical biochemistry,1976,72:248-254.
[10]马瑞君,王明理,赵坤,等.高寒草场优势杂草黄帚橐吾水浸液对牧草的化感作用[J].应用生态学报,2006,17(5):845-850.
[11]马瑞君,惠继瑞,朱慧,等.当归营养期的化感作用[J].中国生态农业学报,2008,16(6):1483-1488.
[12]沈洁,吉星星,袁堂如,等.樟树叶水浸提液对高羊茅种子萌发和幼苗生长的化感作用[J].湖北农业科学,2013,52(14):3349-3353.
[13]董沁,吕斌,鱼小军,等.圆柏叶片水提液对4种草坪草种子萌发和幼苗生长的影响[J].草原与草坪,2010,30(6):58-64.
[14]朱强,安黎,邹梦辉,等.红叶李水浸液对4种草坪植物的化感作用[J].浙江农林大学学报,2014,31(5):710-715.
[15]朱强,邹梦辉,安黎,等.琼花对4种草坪植物的化感作用[J].江苏农业科学,2014,42(10):172-174.
[16]田楠,刘增文,李俊,等.林(果)粮间作中树木枯落叶对小麦发芽期和苗期的化感效应[J].中国生态农业学报,2013,21(6):707-714.
[17]赵彦华,黄高宝.不同生育时期白三叶与黑麦草的化感作用研究[J].草原与草坪,2007(5):19-24.
[18]左艳春,杨春华.扁穗牛鞭草对白三叶的化感作用初探[J].草原与草坪,2005(3):24-26.
[19]王娟,李德全.逆境条件下植物体内渗透调节物质的积累与活性氧代谢[J].植物学通报,2001,18(4):459-465.
[20]王硕,慕小倩,杨超,等.黄花蒿浸提液对小麦幼苗的化感作用及其机理研究[J].西北农林科技大学学报,2006,34(6):106-110.
[21]王晓英,吴洪新.紫花地丁水浸提液对草地早熟禾和高羊茅的化感作用研究[J].中国草地学报,2015,37(1):97-103.
[22]陈洪,胡庭兴,杨万勤,等.巨桉凋落叶分解初期对老芒麦幼苗生长和抗性生理的影响[J].草业学报,2011,20(5):57-65.
Allelopathic effect of aquatic extract ofPinustabulaeformisleaves onFestucaarundinacea
WANG Xiao-ying
(TangshanTeachersCollege,Tangshan,HebeiProvince063000,China)
Abstract:The paper studied the allelopathic effect of the aqueous extracts of living leaf,the withered leaves and withered leaves decaying of Pinus tabulaeformis on germination,growth and physiological indexes of Festuca arundinacea in laboratory.The results showed that the aqueous extracts of 3 kinds of leaves reduced seed germination ratio and seed germination energy of Festuca arundinacea from 6.14% to 69.74% and 3.23% to 96.77%,repectively;the aqueous extracts of 3 kinds of leaves reduced root length and seedling hight from -1.92% to 45.90% and 0.39% to 28.83%,repectively.The rank of sensitivity of Festuca arundinacea to the aqueous extracts of 3 kinds of leaves was aqueous extracts of living leaves > aqueous extracts of withered leaves> aqueous extracts of withered leaves decaying.The aqueous extracts of 3 kinds of leaf materials showed stimulation or inhibition on the activities of superixide dismutase(SOD),peroxidase(POD),catalase(CAT) of Festuca arundinacea seedlings.The content of malondialdehyde(MDA) significantly increased in Festuca arundinacea seedlings with the treatment concentration increasing,whereas the content of soluble protein were reduced,except the 0.075g/mL of aqueous extracts of withered leaves decaying.Hereby,the aqueous extracts of 3 kinds of leaf materials had allelopathic effect on Festuca arundinacea.The allelopathic effect of different leaf materials from stronger to weaker were aqueous extracts of living leaf,aqueous extracts of withered leaves,aqueous extracts of withered leaves decaying.
Key words:Pinus tabulaeformis;aquatic extract;Festuca arundinacea;allelopathy effect
中图分类号:S 791.24;S 688.4
文献标识码:A
文章编号:1009-5500(2016)02-0014-07
作者简介:王晓英(1984-),山西运城人,硕士,实验师,主要从事植物化感作用研究。
基金项目:唐山市科技计划项目(15130264a);唐山师范学院科学研究基金项目(2016C07)资助
收稿日期:2015-12-23; 修回日期:2016-01-26
E-mail:64979385@qq.com

