折光率法测定低温保护剂浓度研究
虞效益 李 威 陈光明, 3 徐美娟
(1浙江大学宁波理工学院 宁波 315100) (2浙江省制冷与低温技术重点实验室 杭州 310027) (3浙江大学制冷与低温研究所 杭州 310027)
折光率法测定低温保护剂浓度研究
虞效益1, 2李 威1陈光明1, 2, 3徐美娟1
(1浙江大学宁波理工学院 宁波 315100) (2浙江省制冷与低温技术重点实验室 杭州 310027) (3浙江大学制冷与低温研究所 杭州 310027)
采用阿贝折射仪测量了不同温度(15、25和35 ℃)和低温保护剂浓度(0—40%wt)下,5种典型低温保护剂溶液(二甲亚砜/氯化钠/水、甘油/氯化钠/水、乙二醇/氯化钠/水、丙二醇/氯化钠/水和海藻糖/氯化钠/水溶液,其中氯化钠浓度为一定值0.9%wt)的折光率,并拟合得到了折光率与低温保护剂浓度和温度之间的关系式。5种低温保护剂溶液的折光率均随低温保护剂浓度的升高而增大,随温度的升高而减小,且呈线性变化关系,但低温保护剂浓度对折光率的影响要远大于温度的影响。本研究表明可以通过测量溶液的折光率确定其中所含低温保护剂的浓度。折光率法所需设备便宜、操作简单快速,且适用于宽浓度范围内低温保护剂的定量分析。
折光率 低温保护剂 二甲亚砜 甘油 乙二醇 丙二醇 海藻糖
1 引 言
低温保存是指将活的生物样品采用特殊的方法冷却至低温(一般为-196 ℃)并长期保存,待需要时,将生物样品按特殊的方法加热至正常温度,仍可获得活的生物样品[1]。到目前为止,人们已经能够将人体血液、精子、胚胎、胰岛、角膜、皮肤等进行成功的低温保存,为细胞和组织器官的移植带来极大的便利;牛、羊等动物精子、胚胎的低温保存和农作物种质的低温储存,为发展农业、畜牧业和挽救濒危动植物带来巨大的经济和社会效益。
低温保存生物样品时,除了极简单的微生物、病毒和细菌等外,一般而言添加低温保护剂是必需的。自1948年发现甘油的低温保护作用[2]之后,多种多样的低温保护剂被陆续发现并广泛使用,比如二甲亚砜、丙二醇、乙二醇以及各种糖类等[1, 3-4]。低温保护剂虽能在低温下对生物样品起保护作用,但同时也极易在载入和取出过程中对生物样品造成各种损伤[1]。因此,无论是在前期加载还是后期洗脱过程中,测定加载溶液和洗脱溶液中低温保护剂的浓度都显得至关重要。
到目前为止,研究者已经提出和采用多种不同的低温保护剂定量分析方法,其中以核磁共振(NMR)[5-7]和高效液相色谱(HPLC)[8-9]应用最多。理论上,NMR和HPLC适用于测定多种低温保护剂,但目前多见于对二甲亚砜的定量,其它低温保护剂的分析方法仍有待摸索。另外,NMR和HPLC方法所需设备昂贵、操作复杂、对分析样品要求高。近来,有研究者提出渗透压仪法,即采用渗透压仪测得低温保护剂溶液的质量渗摩尔浓度(osmolality,指在1 kg溶剂中所溶解的具有渗透作用的微粒的量,单位osm/kg或osmol/kg),再经过换算以得到所要的浓度,该法已成功应用于二甲亚砜、甘油、乙二醇和丙二醇的定量[10-12]。渗透压仪法虽然所需设备便宜、操作简单,但不适用于测定高浓度的溶液[13]。笔者所在研究小组曾依据二甲亚砜含有亚砜基团(—SO—)这一硫基生色团的特性,采用紫外吸收光谱法测定溶液中二甲亚砜的含量[14]。然而,紫外吸收光谱法适用于对稀溶液的定量分析,且该法是否适用于其它低温保护剂也有待研究。
本文采用阿贝折射仪测定了不同温度和低温保护剂浓度下五种典型低温保护剂溶液的折光率,并建立了折光率与温度和低温保护剂浓度之间的关系式。折光率法所需设备便宜、操作简单快速,且适用于宽浓度范围内低温保护剂的定量分析。
2 材料与方法
2.1 样品溶液配制
二甲亚砜、甘油、乙二醇、丙二醇、海藻糖和氯化钠具有分析纯等级。
采用称重法配制一系列低温保护剂浓度分别为0、5 %wt、10 %wt、15 %wt、20 %wt、30 %wt和40 %wt的样品溶液,共35份,每种样品溶液的氯化钠浓度保持一定值(即0.9 %wt)。比如要配制浓度为10 %wt的二甲亚砜/氯化钠/水溶液,可将10 g二甲亚砜和0.9 g氯化钠溶于89.1 g蒸馏水中,搅拌均匀。药品和试剂的称重采用赛多利斯BSA124S电子天平,精度为±0.1 mg。
2.2 折光率测量
折光率测量装置如图1所示,阿贝折射仪(型号2WA-J,含温度计),恒温槽(型号WG-DCX,控温精度±0.1 ℃)。

图1 折光率测量装置Fig.1 Set up for measurement of refractive index
设置恒温槽温度分别为15、25和35 ℃,待温度稳定十分钟后开始测量。在测量样品溶液折光率之前,先用仪器自带标准试样对阿贝折射仪进行校正。每测量一次样品溶液之后将进光棱镜的毛面和折射棱镜的抛光面用无水酒精与乙醚(1∶4)的混合液和脱脂棉花轻擦干净,以免影响下次测量。
2.3 数据拟合
实验所得折光率数据采用如下公式进行拟合:
(1)
式中:n为折光率;t为温度,℃;x为低温保护剂的质量分数,C1、C2、C3和C4为待拟合系数。拟合采用Origin 9.0软件的自定义曲面函数拟合功能,拟合优度评价指标为决定系数R2。由式(1)可推出低温保护剂的质量分数计算式为:
(2)
3 结果与讨论
不同温度和低温保护剂浓度下,测量得到的5种典型低温保护剂溶液的折光率数据如表1—5所示。采用式(1)分别对每种低温保护剂溶液的折光率数据进行拟合,所得公式系数值列于表6中,较高的R2值表明拟合效果优异。从表1—5可以看出,5种低温保护剂溶液的折光率均随低温保护剂浓度的升高而增大,随温度的升高而减小。而公式(1)对实验所得折光率数据优异的拟合效果表明,折光率随低温保护剂浓度和温度的变化均呈线性关系。
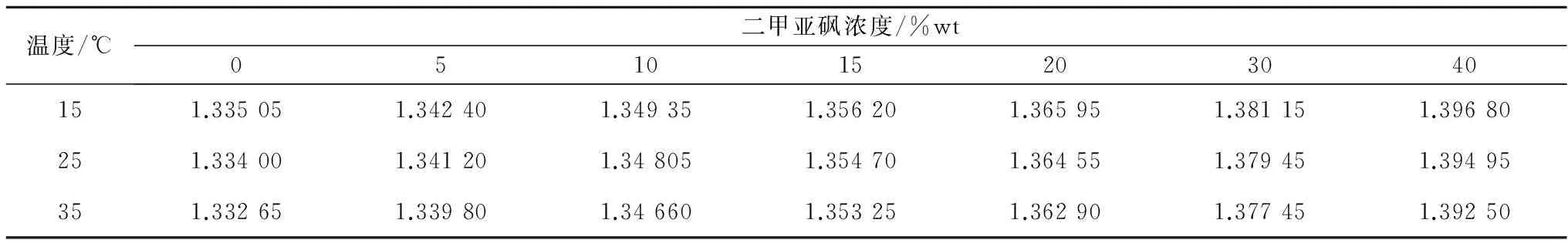
表1 二甲亚砜/氯化钠/水溶液的折光率
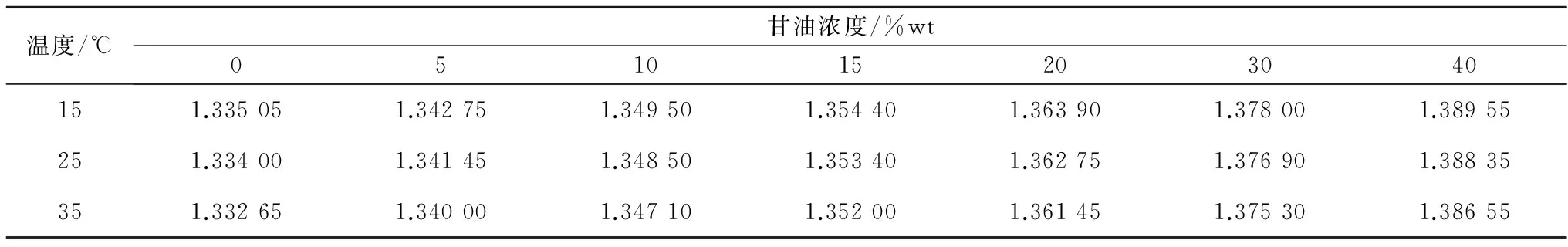
表2 甘油/氯化钠/水溶液的折光率
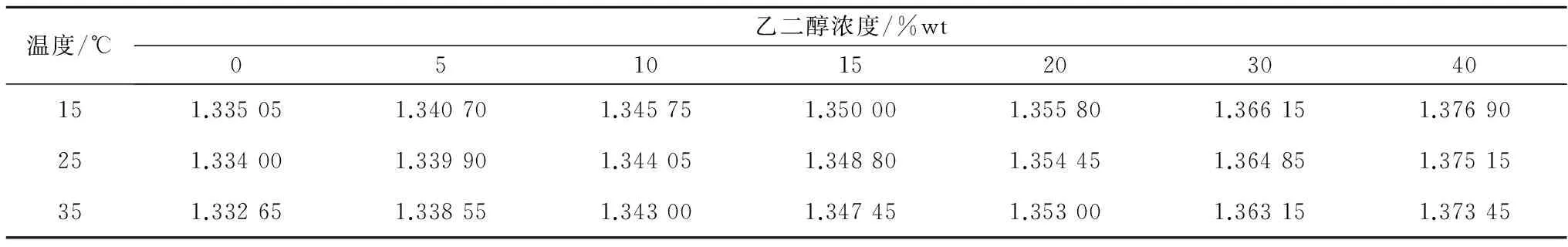
表3 乙二醇/氯化钠/水溶液的折光率
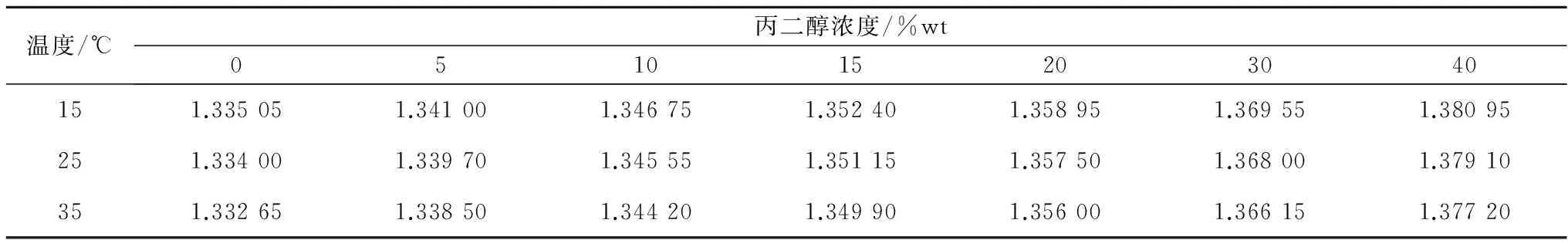
表4 丙二醇/氯化钠/水溶液的折光率
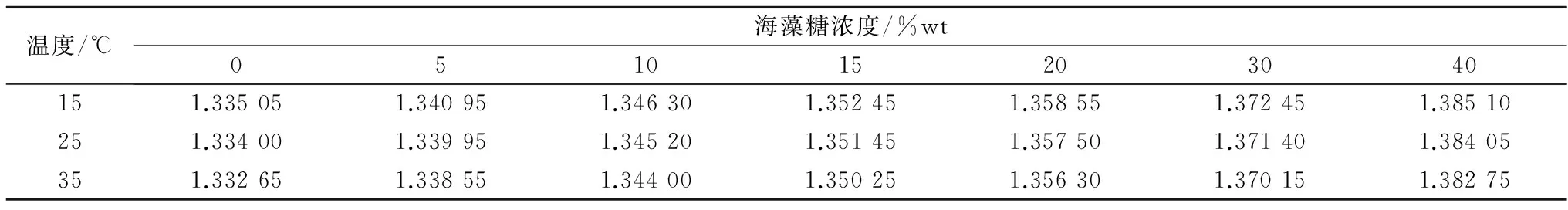
表5 海藻糖/氯化钠/水溶液的折光率
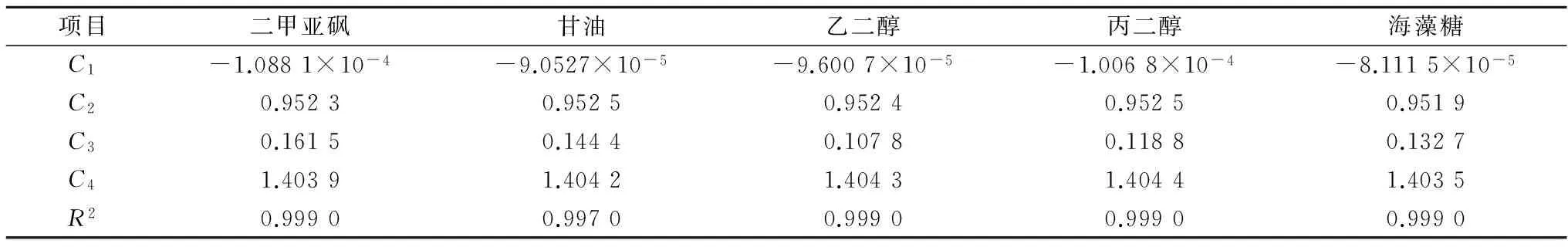
表6 拟合得到的公式系数值及拟合优度
将式(1)分别对t和x求偏导,可得折光率随温度和低温保护剂浓度的变化率关系式为:
(3)
(4)
代入表6所列系数值,可知在当前的温度以及低温保护剂浓度范围内:
(1)∂n/∂t<0,表明折光率随温度的升高而减小。绝对值|∂n/∂t|随低温保护剂浓度的升高而增大,表明低温保护剂浓度越高,温度对折光率的影响越大;
(2)∂n/∂x>0,表明折光率随低温保护剂浓度的升高而增大。∂n/∂x随温度的升高而减小,表明温度越高,低温保护剂浓度对折光率的影响越小;
(3)表7给出了|∂n/∂t|和∂n/∂x的取值范围以及两者之间的关系,表明低温保护剂浓度对折光率的影响要远大于温度的影响。以25 ℃ 、15 %wt的二甲亚砜/氯化钠/水溶液为例,温度变化±5 ℃引起折光率变化±0.000 78,换算成二甲亚砜浓度的变化则仅为±0.5 %wt。因此,在测量低温保护剂溶液的折光率时,温度并不是一个重要的控制参数,当要求不高时,甚至可以不考虑温度的影响。
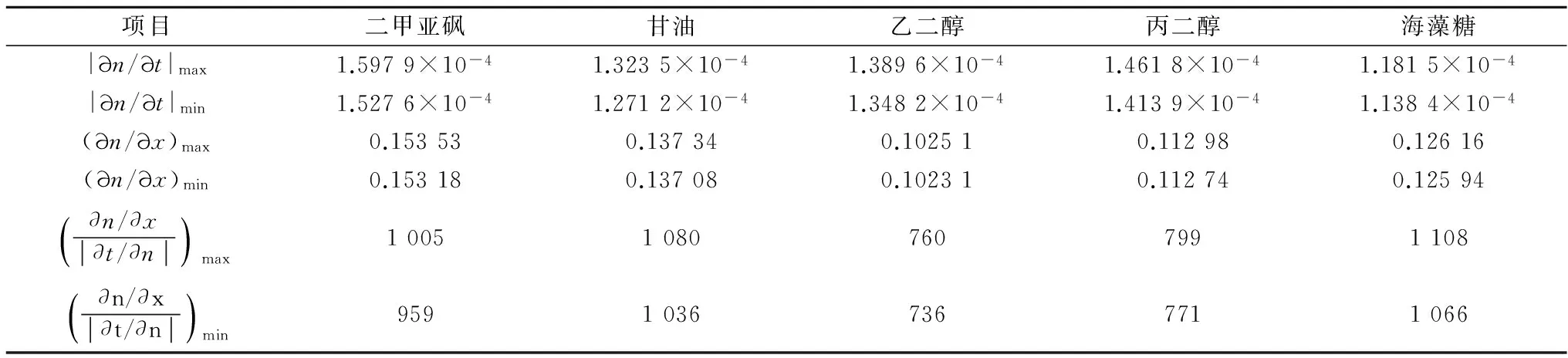
表7 |∂n/∂t|和∂n/∂x的取值范围以及两者之间的关系
注:下标max表示最大值,下标min表示最小值。
4 结 论
采用阿贝折射仪测定了不同温度和低温保护剂浓度下5种典型低温保护剂溶液的折光率,并建立了折光率与温度和低温保护剂浓度之间的关系式。主要结论如下:
(1)低温保护剂溶液的折光率随低温保护剂浓度的升高而增大,随温度的升高而减小,且呈良好的线性变化关系,但低温保护剂浓度对折光率的影响要远大于温度的影响。
(2)当溶液中只含单种低温保护剂时,可以通过测量溶液的折光率确定其中所含低温保护剂的浓度。折光率法所需设备便宜、操作简单快速,且适用于宽浓度范围内低温保护剂的定量分析。
1 华泽钊, 任禾盛. 低温生物医学技术[M]. 北京: 科学出版社, 1994.
Hua Zezhao, Ren Hesheng. Cryo-Biomedicine Technology [M]. Beijing: Science Press, 1994.
2 Polge C, Smith A U, Parkes A S. Revival of spermatozoa after vitrification and dehydration at low temperatures [J]. Nature, 1949, 164:666.
3 Lovelock J E, Bishop M W H. Prevention of freezing damage to living cells by dimethyl sulphoxide [J]. Nature, 1959, 183: 1394-1395.
4 Eroglu A, Russo MJ, Bieganski R, et al. Intracellular trehalose improves the survival of cryopreserved mammalian cells [J]. Nature Biotechnology, 2000, 18(2): 163-167.
5 Bateson E A J, Busza A L, Pegg D E, et al. Permeation of rabbit common carotid arteries with dimethyl sulfoxide [J]. Cryobiology, 1994, 31(4): 393-397.
6 Muldrew K, Sykes B, Schachar N, et al. Permeation kinetics of dimethyl sulfoxide in articular cartilage [J]. CryoLetters, 1996, 17(6): 331-340.
7 Mukherjee I N, Li Y, Song Y C, et al. Cryoprotectant transport through articular cartilage for long-term storage: experimental and modeling studies [J]. Osteoarthritis and Cartilage, 2008, 16(11): 1379-1386.
8 Hu Jianfei, Wolfinbarger L. Dimethyl solfoxide concentration in fresh and cryopreserved porcine valved conduit tissues [J]. Cryobiology, 1994, 31(5): 461-467.
9 Pegg D E, Wang LH, Vaughan D, et al. Cryopreservation of articular cartilage. Part 2: mechanisms of cryoinjury [J]. Cryobiology, 2006, 52(3): 347-359.
10 Sharma R, Law G K, Rehieh K, et al. A novel method to measure cryoprotectant permeation into intact articular cartilage [J]. Cryobiology, 2007, 54(2): 196-203.
11 Jomha N M, Law G K, Abazari A, et al. Permeation of several cryoprotectant agents into porcine articular cartilage [J]. Cryobiology, 2009, 58(1): 110-114.
12 虞效益, 张绍志, 徐梦洁, 等. 二甲亚砜对关节软骨渗透性研究[J]. 工程热物理学报, 2010, 31(8): 1363-1366.
Yu Xiaoyi, Zhang Shaozhi, Xu Mengjie, et al. Study on the permeation of dimethyl sulfoxide into articular cartilage [J]. Journal of Engineering Thermophysics, 2010, 31(8): 1363-1366.
13 Sweeney T E, Beuchat C A. Limitations of methods of osmometry: measuring the osmolality of biological-fluids. American Journal of Physiology, 1993, 264(3): R469-R480.
14 Zhang Shaozhi, Yu Xiaoyi, Chen Guangming. Permeation of dimethyl sulfoxide into articular cartilage at subzero temperatures [J]. Journal of Zhejiang University-Science B, 2012, 13(3): 213-220.
Quantitation of cryoprotective agent by measurement of refractive index
Yu Xiaoyi1,2Li Wei1Chen Guangming1,2,3Xu Meijuan1
(1Ningbo Institute of Technology, Zhejiang University, Ningbo 315100, China) (2Key Laboratory of Refrigeration and Cryogenic Technology of Zhejiang Province, Hangzhou 310027, China) (3Institute of Refrigeration and Cryogenics, Zhejiang University, Hangzhou 310027, China)
In present study, the refractive index of several ternary solutions of cryobiological interests, namely dimethyl sulfoxide/sodium choloride (NaCl)/water, glycerol/NaCl/water, ethylene glycol/NaCl/water, propylene glycol/NaCl/water and trehalose/NaCl/water, were measured at various temperatures (15, 25 and 35 ℃) and concentrations of CPA (0 to 40 %wt), respectively. The concentration of NaCl in solution is fixed at 0.9 %wt. An equation to fit the experimental measurements was devised to characterize the relation among refractive index, CPA concentration and temperature. The concentration of CPA has a positive linear influence on the refractive index of solution, while the temperature has of a negative linear effect. The refractive index of solution is more susceptible to the change of CPA concentration than the temperature change. The existence of CPA can be quantitatively determined by measurement of the refractive index of solution, which is cost-effective, fast, and applicable to solutions with high concentration of CPA.
refractive index;cryoprotective agent; dimethyl sulfoxide;glycerol;ethylene glycol;propylene glycol; trehalose
2017-07-13;
2016-10-08
国家自然科学基金(5140618),宁波市自然科学基金(2016A610214);浙江省制冷与低温技术重点实验室开放基金(2016007AA)。
虞效益,男,32岁,博士,讲师。
徐美娟,女,副教授。
R318.52,TB664
A
1000-6516(2016)05-0011-04

