流化床法制备水飞蓟素纳米结晶微丸
罗开沛, 李小芳, 杨 露, 向志芸, 林 浩, 刘海霞
(成都中医药大学药学院,中药材标准化教育部重点实验室,四川省中药资源系统研究与开发利用重点实验室—国家重点实验室培育基地,四川成都611137)
流化床法制备水飞蓟素纳米结晶微丸
罗开沛, 李小芳*, 杨露, 向志芸, 林浩, 刘海霞
(成都中医药大学药学院,中药材标准化教育部重点实验室,四川省中药资源系统研究与开发利用重点实验室—国家重点实验室培育基地,四川成都611137)
摘要:目的 研究水飞蓟素纳米结晶微丸的最优工艺参数及体外释放度。方法 流化床法制得水飞蓟素纳米结晶微丸。以黏合剂用量、恒流泵转速和雾化压力为考察因素,以微丸的得丸率、上药率和平均再分散粒径为指标,采用星点设计-效应面法优化工艺参数,并进行体外释放度测定。结果 最优工艺参数为羟丙甲基纤维素用量0.16%,恒流泵转速9.5 r/min,雾化压力0.12 MPa。微丸的得丸率(85.74±1.29)%,上药率(86.43±1.52)%,平均再分散粒径(251.6±3.8)nm,30 min内药物累积释放度达90%以上。结论 该方法制成的水飞蓟素纳米结晶微丸兼顾了纳米混悬剂和固体制剂的优点,工艺简单、可行,可为液体制剂固体化提供新的制备方法。
关键词:水飞蓟素;纳米结晶;微丸;流化床法
水飞蓟素(SM)是从水飞蓟Silybum marianum L.种子中提取的黄酮木脂素类化合物,主要包括水飞蓟宾、异水飞蓟宾、水飞蓟宁和水飞蓟亭4种成分,其中以水飞蓟宾含有量最高,而且活性最大[1]。现代研究表明,水飞蓟素具有抗肿瘤、抗肝纤维化、抗炎、抗脂质过氧化、抗癌等药理作用[2-3]。然而,其溶解度仅为40 μg/mL,为难溶于水的药物,不利于人体吸收。有文献报道,德国产水飞蓟素片(利加隆)的口服效果差,体外溶出速率慢,导致体内生物利用度低,而且国产水飞蓟素胶囊及普通片剂同样存在溶出速率慢的问题,影响了其疗效发挥和临床开发应用[4-6]。
纳米混悬剂(NS)是一种亚微米胶体分散体系的新型给药系统,能够增加药物溶解度,提高生物利用度[7]。但由于它以液体形式存在,属于热力学不稳定体系,携带、服用不便,严重制约了其应用和推广。本实验采用溶剂沉淀结合高压均质法制备水飞蓟素纳米混悬剂(SM-NS),再运用流化床喷雾干燥技术将其制成水飞蓟素纳米结晶(SMNC)微丸,以期提高水飞蓟素的溶出度,同时改善其纳米混悬剂的稳定性。
1 仪器与试药
1.1 仪器 AH-100D高压均质机(加拿大ATS工业系统有限公司);Nicomp 380ZLS激光粒度分析仪(美国PSS粒度仪公司);微型流化床(辽宁医联新药研究所);LH-2D定时数显恒流泵(上海沪西分析仪器厂有限公司);UV-6000紫外可见分光光度计(上海美谱达仪器有限公司);ZRS-8G智能溶出试验仪(天津市天大天发科技有限公司);RE-2000B旋转蒸发仪(上海亚荣生化仪器厂);DZG-6020真空干燥箱(上海森信实验仪器有限公司)。
1.2 试药 水飞蓟素对照品(西安小草植物科技有限责任公司,批号LC20150203,含有量为80.0%);水飞蓟宾对照品(成都曼思特生物科技有限公司,批号MUST-15020104)。微晶纤维素丸芯(杭州高成生物营养技术有限公司);羟丙甲基纤维素(HPMC,上海卡乐康包衣有限公司);胃蛋白酶(上海如吉生物科技发展有限公司);聚维酮K30(PVP-K30)、十二烷基硫酸钠(SDS)(成都市科龙化工试剂厂)。
2 方法与结果
2.1 水飞蓟素纳米混悬剂的制备方法 采用溶剂沉淀结合高压均质法[8]制备水飞蓟素纳米混悬剂。取水飞蓟素原料药0.4 g,置于10 mL无水乙醇中,超声溶解,作为油相,再取稳定剂(聚维酮K30∶十二烷基硫酸钠=2∶1)0.2 g溶于100 mL纯水中,作为水相。将油相缓慢注入在一定条件下搅拌的水相中,持续搅拌10 min,旋转蒸发除去乙醇至无醇味,将制得的粗混悬剂于高压均质机1 000 Pa条件下均质12次,得到水飞蓟素纳米混悬剂。
2.2 水飞蓟素纳米混悬剂平均粒径的测定 量取水飞蓟素纳米混悬剂适量,用纯水稀释一定倍数,摇匀,激光粒度分析仪测得其平均粒径为191.4 nm,多分散指数为0.135,见图1。
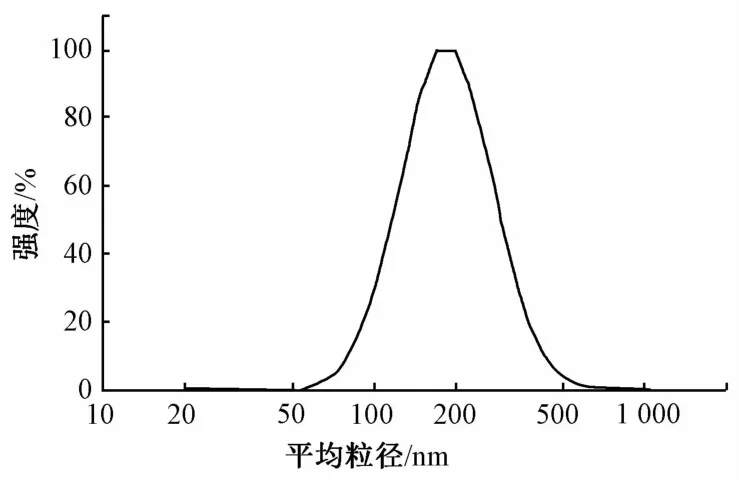
图1 水飞蓟素纳米混悬剂的粒径分布Fig.1 Particle size distribution of silymarin nanosuspension
2.3 水飞蓟素纳米结晶微丸的制备方法 取羟丙甲基纤维素适量溶解于纯水中,作为黏合剂,静置后加到纳米混悬剂中混匀,得到上样液。设定流化床鼓风频率18 Hz,流化温度38~42℃,控制一定的雾化压力,调节恒流泵适宜转速,采用底喷方式喷入上样液,保持连续搅拌。丸芯载药完成后,继续鼓风30 min,取出置于真空干燥箱中,40℃下干燥2 h,即得。
2.4 水飞蓟素纳米结晶微丸得丸率的测定 取出干燥后的载药微丸,称定质量M1,于20~24目筛网过筛后,得到筛分微丸,称定质量M2,计算得丸率。计算公式为得丸率=(M2/M1)×100%。
2.5 水飞蓟素纳米结晶微丸上药率的测定[9]微丸增重减去黏合剂和稳定剂的总重,得到主药实际固含有量,所得值再除以主药理论固含有量,再乘以100%即为上药率。计算公式为上药率=[(载药微丸量-稳定剂量-黏合剂量-空白丸芯量)/理论主药固含有量]×100%。
2.6 水飞蓟素纳米结晶微丸平均再分散粒径的测定 称取微丸适量,溶于蒸馏水中,振摇,0.8 μm微孔滤膜过滤,稀释一定倍数,测定其平均再分散粒径和多分散指数。
2.7 药物标准曲线的制备及含有量测定
2.7.1 对照品溶液及空白辅料溶液的制备 精密称取水飞蓟宾对照品10.0 mg,置于100 mL量瓶中,无水乙醇定容至刻度,超声溶解,制得每1 mL含0.1 mg对照品的溶液。再称取一定量空白辅料,置于25 mL量瓶中,无水乙醇定容至刻度,摇匀,制得空白辅料溶液。
2.7.2 测定波长的选择 精密量取水飞蓟宾对照品溶液1 mL,置于10 mL量瓶中,无水乙醇定容至刻度,紫外分光光度计进行全波长扫描,发现在286 nm波长处有最大吸收。再精密量取空白辅料溶液适量,在286 nm波长处扫描,发现无吸收峰,表明辅料对药物无干扰。
2.7.3 标准曲线的制备 分别精密量取对照品溶液0.4、0.6、0.8、1.0、1.2、1.4 mL,置于10 mL量瓶中,无水乙醇定容至刻度,在286 nm波长处测定吸光度,以水飞蓟宾质量浓度为横坐标(C),吸光度为纵坐标(A)绘制标准曲线,得回归方程A=0.053 1C-0.004 7,r=0.999 5,表明水飞蓟宾在4.00~14.00 μg/mL范围内呈良好的线性关系。
2.7.4 含有量测定 称取微丸(约含水飞蓟宾3 mg)适量,置于100 mL量瓶中,无水乙醇定容至刻度,0.45 μm微孔滤膜过滤,收集滤液,精密量取1 mL,置于10 mL量瓶中,无水乙醇定容至刻度,测定其吸光度,再根据标准曲线计算含药量。
2.8 水飞蓟素纳米结晶微丸工艺参数的优化
2.8.1 星点设计试验 参考文献[9-10]和前期试验,选择黏合剂用量(X1)、恒流泵转速(X2)、雾化压力(X3)作为考察因素,星点设计-效应面法优化工艺参数,因素水平见表1,试验设计及结果见表2。以微丸得丸率(Y1,最大值为优)、上药率(Y2,最大值为优)和平均再分散粒径(Y3,最小值为优)为指标,分别设置权重为30、30、40分,总分为100分,以综合评分值(T)对各项测定结果进行加权。计算公式为Dmax=Yi/Ymax(最大值为优);Dmin=Ymin/Yi(最小值为优);T= DY1×30 +DY2×30 +DY3×40,其中Yi为各项测定值,Ymax为该项最大值,Ymin为该项最小值,D为标准化数据。
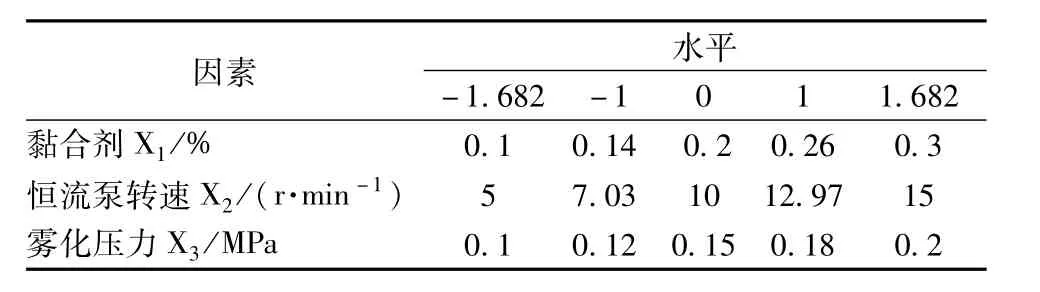
表1 因素水平Tab.1 Factors and levels
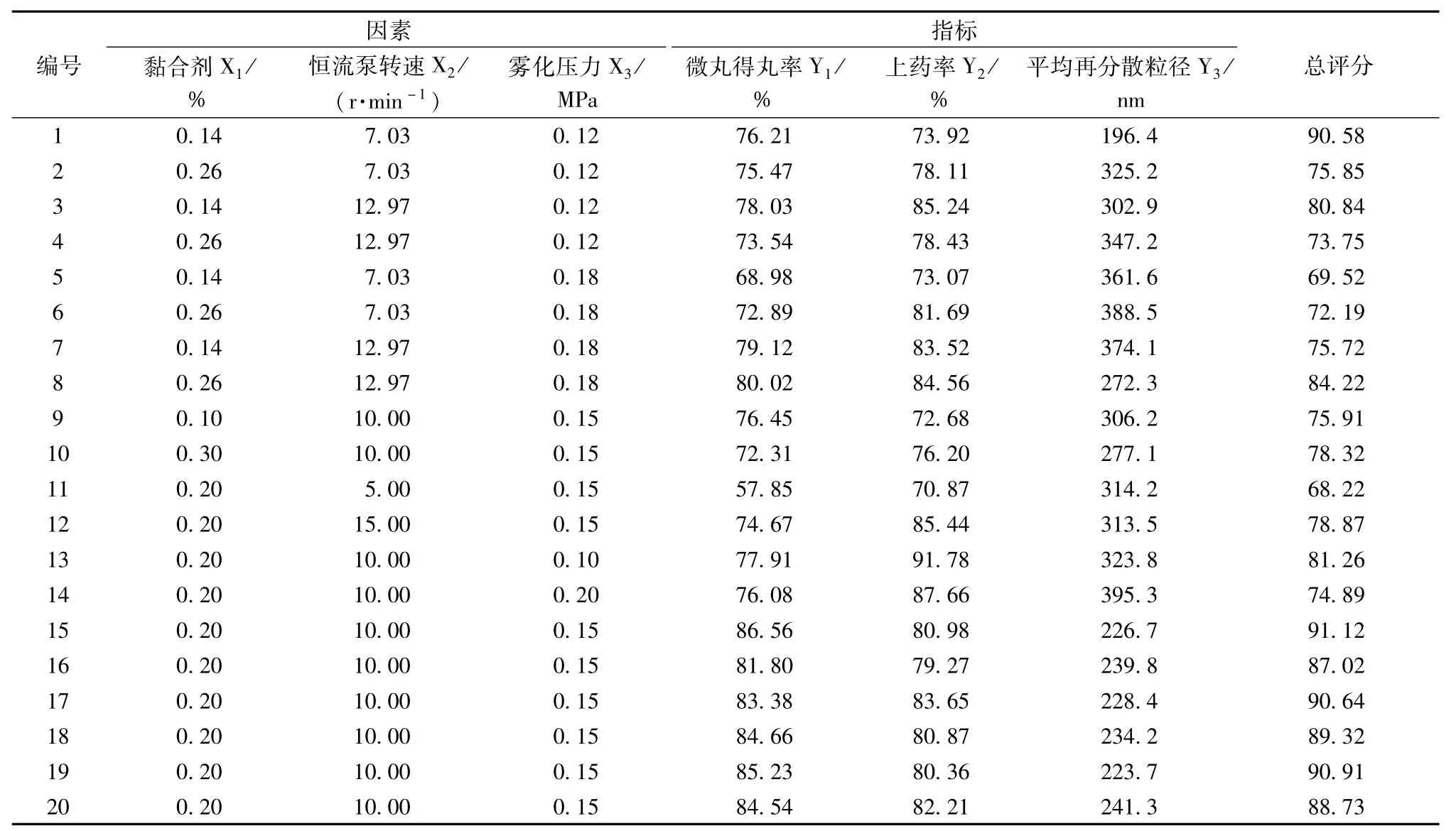
表2 试验设计及结果Tab.2 Design and results of tests
2.8.2 模型拟合 应用Design-Expert软件分析数据,得到多元线性回归方程Y1=77.29 -0.54X1+ 3.33X2-0.39X3,r=0.186 4,p=0.333 9;Y2= 80.53 +0.95X1+3.62X2+0.015X3,r=0.349 4,p=0.069 4;Y3=294.62 +3.61X1+1.73X2+ 25.27X3,r=0.129 1,p=0.516 7;T=80.89 -0.48X1+1.78X2-2.20X3,r=0.101 0,p=0.624 7;拟合二次多项式回归方程Y1=84.24 -0.54X1+ 3.33X2-0.39X3-0.84X1X2+1.26X1X3+2.17X2X3-2.75X21-5.62X22-1.82X23,r=0.894 5,p= 0.000 8;Y2=81.25 +0.95X1+3.62X2+0.015 X3-2.32X1X2+1.54X1X3+0.21X2X3-2.59X21-1.28X22+2.81X23,r=0.935 0,p<0.000 1;Y3= 232.55 +3.61X1+1.73X2+25.27X3-26.65X1X2-31.00X1X3-29.02X2X3+19.68X21+27.53X22+ 43.69X23,r=0.941 9,p<0.000 1;T=89.55 -0.48X1+1.78X2-2.20X3+1.68X1X2+4.12X1X3+ 3.76X2X3-3.92X21-5.18X22-3.58X23,r=0.941 9,p<0.000 1,二次多项式回归方程的p值和相关系数均较大,表明该模型显著性较高,拟合度良好,可进行工艺预测和分析。综合评分方差分析结果见表3,发现失拟项不显著(p>0.05),表明该模型可替代实际试验值来对结果进行分析。

表3 方差分析Tab.3 Analysis of variance
2.8.3 工艺参数优化及预测 根据回归方程,绘制以得丸率、上药率、再分散粒径和综合评分对自变量的三维效应面图,见图2~5。由图可知,随着雾化压力和转速的增大,得丸率呈现先增大后减小的趋势,而转速对其影响较大;上药率随着转速和黏合剂用量的增大而增大;微丸再分散粒径随黏合剂用量的增大而增大,当雾化压力逐渐增大时,其呈先减小后增大的趋势,压力达到0.15 MPa时更明显;综合评分随黏合剂用量、恒流泵转速和雾化压力的增大,呈现先增大后减小的趋势。综上所述,最优工艺参数为羟丙甲基纤维素用量0.16%,恒流泵转速9.46 r/min,雾化压力0.12 MPa,综合评分预测值90.20。另外,由于恒流泵转速精确到0.1 r/min,因此确定转速为9.5 r/min。
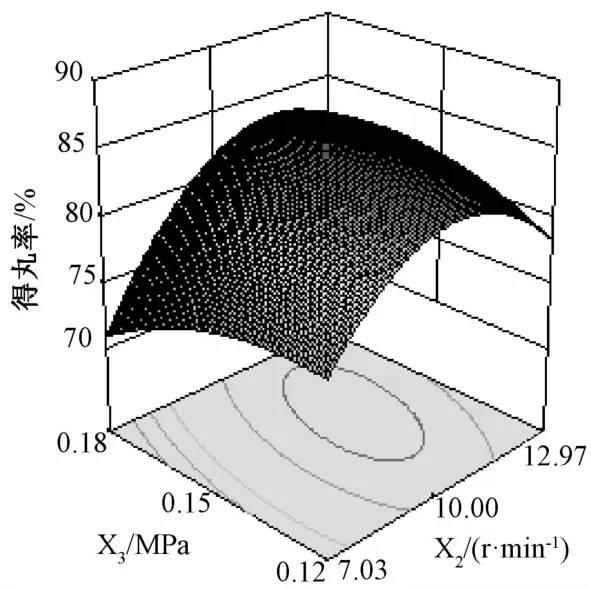
图2 得丸率的三维效应曲面图Fig.2 3D response surface chart of yield of pellets

图3 上药率的三维效应曲面图Fig.3 3D response surface chart of layering efficiency
2.8.4 验证试验 根据筛选的最优工艺参数,制备3批微丸,均为表面均匀、光洁、饱满的黄色小丸,得丸率(85.74±1.29)%,上药率(86.43± 1.52)%,平均再分散粒径(251.6±3.8)nm,多分散指数0.184±0.015(n =3),综合评分实际值89.19,与预测值90.20偏差1.12%,表明该数学模型可信度高,预测性良好。按“2.7.4”项下方法,计算微丸中水飞蓟素的含有量为(35.16± 1.07)%(n =3)。综合考虑,最终拟定微丸含药量为35.00%。
2.9 体外测定方法 按照《中国药典》2010年版二部溶出度测定法中的第二法(桨法),对微丸和原料药进行测定。分别称取微丸150 mg、原料药52.5 mg,以人工胃液为溶出介质,控制转速100 r/min,温度(37±0.5)℃,分别于5、10、20、30、40、50、60 min取样5 mL,0.45 μm微孔滤膜过滤并稀释,同时补充等温等体积的新鲜介质,测定样品溶液吸光度,计算药物的累积溶出度,结果见图6。由图可知,在30 min内,微丸累积释放度达到90%以上,而原料药在60 min内的累积释放度仅为34.87%,表明将水飞蓟素制成微丸能有效提高其溶出度。
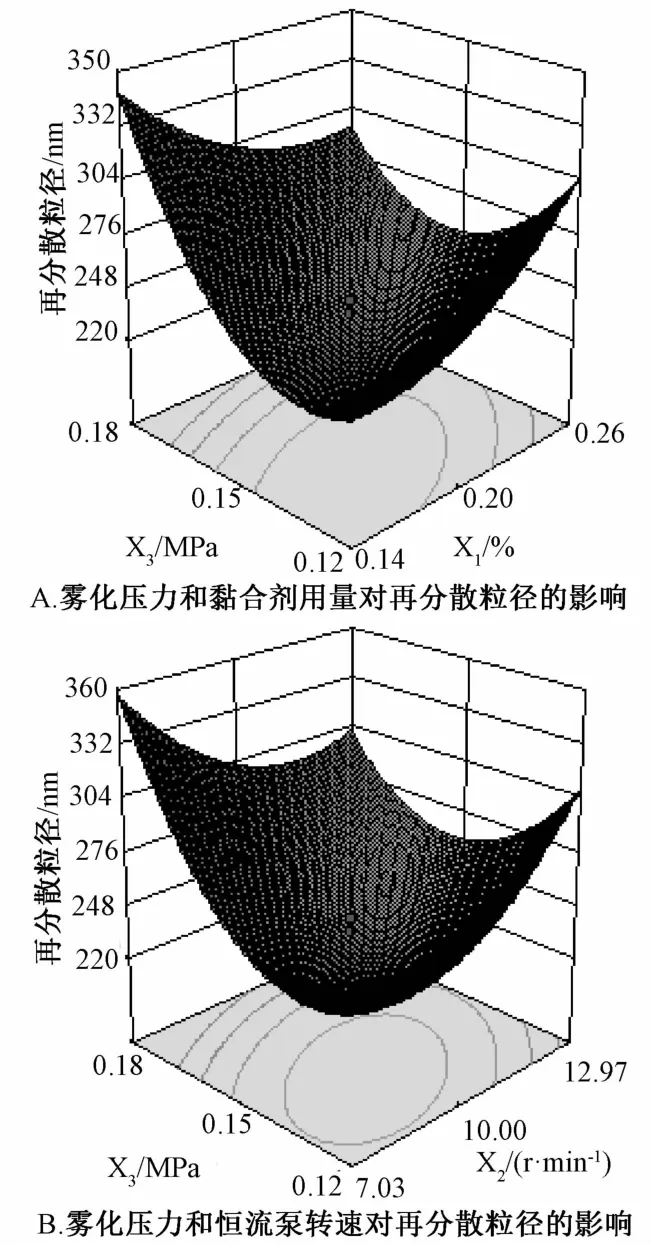
图4 再分散粒径的三维效应曲面图Fig.4 3D response surface charts of particle size of redispersion

图5 响应值的三维效应曲面图Fig.5 3D response surface charts of response value
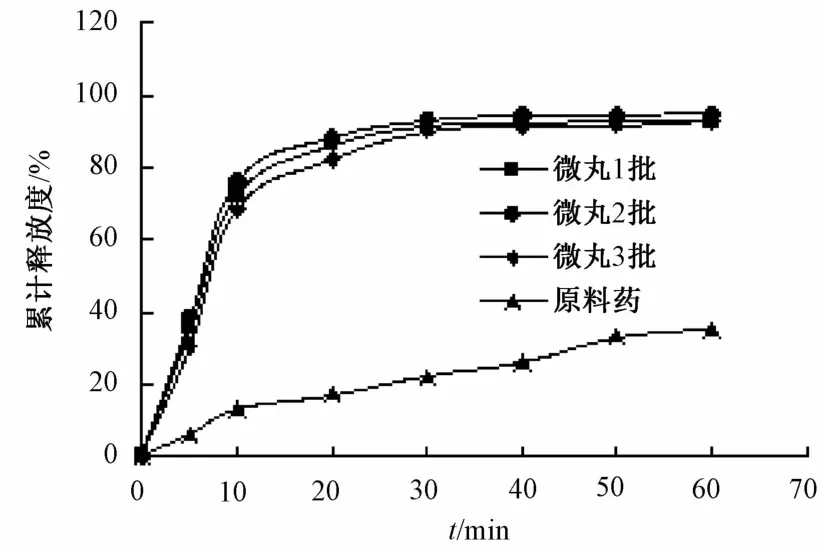
图6 微丸和原料药的累积释放曲线Fig.6 Accumulative release curves of pellets and raw medicine
3 讨论
本实验选择聚维酮K30联合十二烷基硫酸钠作为稳定剂,发现其效果明显优于单独使用。其中,聚维酮K30在处方中作为空间立体稳定剂,提供立体稳定效应;十二烷基硫酸钠作为静电稳定剂,提供电荷排斥效应[11-12]。在前期试验中发现,以吐温-80为稳定剂也能达到较好的效果,但因其是黏稠液体,给干燥固化带来了一定困难,因此不选用该液体辅料。
纳米混悬剂稳定性差一直是限制其应用和开发的瓶颈问题,故将其固体化已成为新的发展方向。目前,固化方法主要有冷冻干燥[13]、喷雾干燥[14]和真空干燥[15]等,但均有一定缺陷,如冷冻干燥成本、能耗较高,干燥周期较长;喷雾干燥工艺复杂,收率较低;真空干燥使成品凝结成块,纳米晶体聚集严重。针对以上问题,流化床喷雾干燥是一种有前途的固化技术,具有喷雾干燥和一步制粒的优点,节省了干燥粉末再制粒的过程,也可进一步制成其他固体制剂。本实验结果显示,所得水飞蓟素纳米结晶微丸的得丸率和上药率均较高,再分散性能较好,平均粒径小且分布较窄,能够快速释药,可为其他液体制剂固体化提供新的制备方法。
纳米混悬剂固化后,较固化前的平均粒径和多分散指数均有所增大,可能是在干燥过程中随着水分散失,形成纳米晶体的同时,存在“固化损伤”,导致部分粒子间发生不可逆的聚集和增长[16]。文献[17]报道,在纳米混悬剂中加入适量的胶体可显著抑制纳米晶体的团聚,有效防止固化时粒径增大,至于能否改善微丸的再分散性能,还在进一步研究中。
参考文献:
[1] 朱 铉,崔京浩,全姬善,等.水飞蓟素混悬剂的制备及稳定性和溶出度考察[J].中国新药杂志,2006,15 (24):2136-2139.
[2] 刘志刚,李雪玲,翁立冬,等.水飞蓟素药理作用研究进展[J].辽宁中医药大学学报,2012,14(10):91-93.
[3] Elmowafy M,Viitala T,Ibrahim H M,et al.Silymarin loaded liposomes for hepatic targeting:In vitro evaluation and HepG2 drug uptake[J].Eur J pharm Sci,2013,50(2):161-171.
[4] 李 钢,盛维强.国产与进口水飞蓟素片的溶出度研究[J].药学实践杂志,2000,18(4):218-220.
[5] 何 军,奉建芳,张乐乐,等.水飞蓟素固体脂质纳米粒体内药代动力学研究[J].中成药,2005,27(1):19-21.
[6] 刘琳婕.水飞蓟素及其磷脂复合物自微乳化胶囊的研究[D].沈阳:沈阳药科大学,2007.
[7] Liu Y,Xie P,Zhang D,et al.A mini review of nanosuspensions development[J].J Drug Target,2012,20(3):209-223.
[8] Keck C M,Müller R H.Drug nanocrystals of poorly soluble drugs produced by high pressure homogenisation[J].Eur J pharm BioPharm,2006,62(1):3-16.
[9] 单 利,史 焱,王玉丽,等.基于流化床包衣工艺的伊曲康唑速释微丸的制备和评价研究[J].中国药学杂志,2013,48(1):54-58.
[10] 蒋志涛,严国俊,潘金火.肝尔舒微丸的流化床制备工艺优选[J].中国实验方剂学杂志,2012,18(11):46-48.
[11] 岳鹏飞,王 勇,万 晶,等.固体纳米晶体给药系统构建方法的研究进展[J].药学学报,2012,47(9):1120-1127.
[12] Van Eerdenbrugh B,Vermant J,Martens JA,etal.A screening study of surface stabilization during the production of drug nanocrystals[J].J pharm Sci,2009,98(6):2091-2103.
[13] Cerdeira A M,Mazzotti M,Gander B.Formulation and drying of miconazole and itraconazole nanosuspensions[J].Int J pharm,2013,443(1-2):209-220.
[14] Kumar S,Gokhale R,Burgess D J.Quality by design approach to spray drying processing of crystalline nanosuspensions[J].Int J pharm,2014,464(1-2):234-242.
[15] Zhang J,Lv H,Jiang K,et al.Enhanced bioavailability after oral and pulmonary administration of baicalein nanocrystal[J]. Int J pharm,2011,420(1):180-188.
[16] 岳鹏飞,万 晶,胡鹏翼,等.中药固体化纳米混悬给药系统的研究进展与思考[J].中草药,2012,43(4):625-629.
[17] Kim S,Lee J.Effective polymeric dispersants for vacuum,convection and freeze drying of drug nanosuspensions[J].Int J pharm,2010,397(1-2):218-224.
网络出版日期:2015-10-23
网络出版地址:http://www.cnki.net/kcms/detail/31.1368.R.20151023.1454.002.html
Preparing silymarin nanocrystal pellets by fluid-bed method
LUO Kai-pei, LIXiao-fang*, YANG Lu, XIANG Zhi-yun, LIN Hao, LIU Hai-xia
(College of pharmacy,Chengdu University of Traditional Chinese Medicine;Ministry of Education Key Laboratory of Standardization of Chinese Herbal Medicine;Key Laboratory of Systematic Research,DeveloPment and Utilization of Chinese Medicine Resources in Sichuan p rovince—State Key Laboratory Breeding Base,Chengdu 611137,China)
ABSTRACT:AIM To study the best technology parameters for silymarin nanocrystal pellets and their in vitro release rate.METHODS Silymarin nanocrystal pelletsweremade by fluid-bed method.Considering the yield of pellets,layering efficiency and average particle size of redispersion as the indices,central composite design-response surfacemethod was applied to investigating the adhesive consumption,speed of constant flow pump and atomizing pressure for optimizing technology parameters and determining release rate in vitro.RESULTS The technology parameterswere thus optimized,viz.,the HPMC consumption was 0.16%,the speed of constant flow pump was 9.5 r/min,and atomization pressurewas0.12 MPa.The yield of pelletswas(85.74±1.29)%,layering efficiency was(86.43±1.52)%,average particle size of redispersion was(251.6±3.8)nm,and the accumulative release rate of drug reached more than 90%within 30 min.CONCLUSION The silymarin nanocrystal pelletsmade by thismethod reveal the superiorities of both nanosuspension and solid preparation.This simple and feasible technology can be applied to solidifying the liquid preparation.
KEY WORDS:silymarin;nanocrystal;pellets;fluid-bed method
*通信作者:李小芳(1964—),女,教授,博士生导师,研究方向为中药新制剂、新剂型、新技术。Tel:13808195110,E-mail:lixiaofang918@163.com
作者简介:罗开沛(1991—),男,硕士,研究方向为中药新制剂、新剂型、新技术。Tel:15351218131,E-mail:luokaipei@126.com
基金项目:四川省教育厅重点项目(15ZA0094)
收稿日期:2015-06-16
doi:10.3969/j.issn.1001-1528.2016.05.012
中图分类号:R944
文献标志码:A
文章编号:1001-1528(2016)05-1024-06

