高糖应激促脂肪变性肝细胞凋亡的线粒体机制*
唐 辉, 肖仔君, 蒋鑫炜, 郭红辉△
(1韶关学院英东食品科学与工程学院,广东 韶关 512005;2中山大学公共卫生学院,广东 广州 510080)
高糖应激促脂肪变性肝细胞凋亡的线粒体机制*
唐 辉1, 肖仔君1, 蒋鑫炜2, 郭红辉1△
(1韶关学院英东食品科学与工程学院,广东 韶关 512005;2中山大学公共卫生学院,广东 广州 510080)
目的: 探讨高糖应激对脂肪变性肝细胞凋亡的作用及其可能机制。方法: C57BL/6J小鼠饲喂高脂饲料6周后,采用肝脏原位灌注技术分离得到脂肪变性原代肝细胞,在含有35 mmol/L葡萄糖的高糖DMEM培养基中孵育12 h,以正常DMEM培养基(添加30 mmol/L甘露醇)孵育的细胞作为对照,观察高糖处理对脂肪变性肝细胞活力、线粒体膜电位、凋亡蛋白酶caspase活性及凋亡相关信号通路的影响。结果: 高糖应激使脂肪变性肝细胞活力下降,凋亡显著增加,而等渗甘露醇处理的对照细胞没有明显变化。高糖组细胞出现较为严重的线粒体去极化,导致线粒体膜电位降低,细胞色素C释放增多。线粒体介导凋亡关键酶caspase-9和caspase-3活性在高糖组有显著升高,抑制凋亡因子Bcl-2和Bcl-xL表达量明显降低,促凋亡蛋白Bax水平显著升高,而感受外源性凋亡信号的caspase-8的活性没有明显变化。结论: 高糖应激会导致脂肪变性肝细胞线粒体膜电位下降,启动线粒体介导的内源性凋亡途径,引起肝细胞凋亡。这可能是高血糖加速非酒精性脂肪性肝病病程进展的一个重要原因。
肝细胞; 线粒体; 高糖应激; 细胞凋亡; 非酒精性脂肪性肝病
非酒精性脂肪性肝病(non-alcoholic fatty liver disease,NAFLD)是目前最为常见的慢性肝病,包括单纯性脂肪肝、脂肪性肝炎(non-alcoholic steatohepatitis,NASH)、NASH相关肝纤维化和肝硬化等4个病程阶段。单纯性脂肪肝患者往往无机体不适症状,预后良好,而一旦进展为NASH,就会出现不可逆的肝损伤,如肝细胞气球样变性、炎症甚至凋亡,加速病程进展[1]。最近的研究表明,糖耐量异常所致的空腹血糖水平升高是单纯性脂肪肝向NASH转变的一个危险因素[2],然而其中的病理生理机制尚未明确。高血糖会促进肝细胞内的脂质合成,干扰脂肪酸进行β氧化,可能引起线粒体功能障碍和细胞凋亡[3]。本研究首先利用高脂饮食喂养建立NAFLD小鼠模型,分离原代脂肪变性肝细胞,观察体外高糖孵育对其活力、线粒体功能和凋亡相关信号通路的影响,以期明确高糖应激引起脂肪变性肝细胞凋亡,促进单纯性脂肪肝向NASH进展的作用机制,为NAFLD的早期干预提供理论依据。
材 料 和 方 法
1 动物和细胞
SPF级C57BL/ 6J小鼠,雄性,6~8周龄,18~20 g,由广东省医学实验动物中心提供,饲养在中山大学公共卫生学院SPF动物房[12 h昼夜交替,温度(22 ± 2)℃]。喂饲小鼠脂肪供能比为45%的高脂饲料(江苏美迪森生物医药有限公司),6周后,采用改良两步原位灌流法分离原代肝细胞[4],油红O染色观察细胞内脂肪积聚情况,台盼蓝染色确认细胞存活率≥95%,按2.5×105密度接种于6孔培养板,低糖DMEM(葡萄糖浓度5 mmol/L)培养基、37 ℃、5% CO2条件下培养24 h后进入实验,细胞分为3组:对照(control)组,低糖DMEM继续培养;甘露醇(mannitol)组,DMEM培养基加入30 mmol/L甘露醇,与高糖组的培养基渗透势相当;高糖(high-glucose, HG)组,培养基葡萄糖浓度调高至35 mmol/L。各组细胞继续培养12 h。
2 主要试剂
低糖DMEM细胞培养基、小牛血清和抗生素混合物购自广州英韦创津生物科技有限公司;I 抗购自Santa Cruz和CST;II抗由武汉博士德生物工程有限公司提供;荧光探针JC-1和Hoechst 33258购自Molecular Probes;胰酶、胶原蛋白酶Ⅰ、台盼蓝购自Sigma;MTT细胞活力检测试剂盒、乳酸脱氢酶(lactate dehydrogenase,LDH)细胞毒性检测试剂盒和BCA蛋白浓度检测试剂盒购自上海碧云天生物技术有限公司;其它试剂均为进口分装或国产分析纯。
3 主要方法
3.1 细胞活力和毒性测定 将细胞移入96孔板,每孔加入MTT(5.0 g/L)50 μL、置入培养箱孵育4 h,离心弃上清,加入二甲基亚砜200 μL,酶标仪测定570 nm处各孔吸光度值,评价细胞存活率。细胞处理期间释放的乳酸脱氢酶作为细胞毒性的标志,将细胞培养板500×g离心5 min,取10 μL到96孔酶标板,加入反应液25 ℃避光反应30 min,终止反应,在酶标仪490 nm处读数。以低糖组细胞作为参照,计算其它2组的细胞相对存活率和毒性。
3.2 细胞凋亡检测 利用能够直接和凋亡细胞DNA结合的荧光染料Hoechst 33258染色区分正常细胞和凋亡细胞。将培养板中的细胞用甲醇/丙酮溶液固定5 min,PBS缓冲液清洗3遍,加入10 μmol/L Hoechst 33258染色30 min,在TE2000荧光显微镜(Nikon)下(激发光350 nm,吸收光460 nm)观察细胞核染色质形态。凋亡细胞染色质高度浓缩,发出较强的蓝色荧光。随机统计5个视野内凋亡细胞占总细胞的比例。
3.3 线粒体膜电位检测 采用JC-1荧光探针在细胞内的红/绿荧光强度比例来衡量线粒体去极化程度[5]。细胞培养基内加入2.0 mg/L JC-1在37 ℃孵育30 min,荧光显微镜下观察拍照,并在荧光酶标仪分别测定红色荧光(激发光580 nm,吸收光590 nm)和绿色荧光(激发光510 nm,吸收光527 nm)强度,计算二者的比值表示线粒体膜电位的变化情况。
3.4 细胞凋亡蛋白酶活性测定 采用Abcam提供的酶法试剂盒分别测定细胞内3种含半胱氨酸的天冬氨酸蛋白水解酶(caspase-3、-8和-9)的活性。取50 μL细胞裂解液,加入5 μL相应四肽标记底物和50 μL反应液于96孔酶标板,37 ℃避光孵育30 min,405 nm处测定对硝基苯胺的生成量来表示酶活性大小,同时测定细胞裂解液蛋白质浓度校准酶活性。
3.5 Western blotting实验 利用Enzo Life Sciences的试剂盒分别提取细胞质和线粒体蛋白质,调整蛋白质浓度后进行电泳、转膜、封闭、孵育I抗和II抗,使用Santa Cruz光化学发光试剂显影,β-actin和细胞色素C氧化酶Ⅳ(cytochrome C oxidase Ⅳ,CoxⅣ)分别作为内参照,Quantity One软件分析蛋白条带灰度值表示蛋白质表达量。
4 统计学处理
用SPSS 19.0统计软件进行分析。数据均采用均数±标准误(mean±SEM)表示,多组间比较采用单因素方差分析(one-way ANOVA),组间两两比较采用SNK-q检验。以P<0.05为差异有统计学意义。
结 果
1 高糖对脂肪变性肝细胞活力的影响
油红O染色结果显示,与普通饲料喂养小鼠肝细胞相比,高脂喂养小鼠肝细胞体积增大,胞内有较多脂滴积聚,符合NAFLD单纯性脂肪肝阶段的病理特征。高脂喂养小鼠分离的肝细胞在经过高糖培养基孵育12 h后,其细胞活力较生理浓度葡萄糖培养基孵育的对照组细胞有明显下降,且细胞释放的LDH增多了1.6倍。甘露醇组细胞的活力与对照组没有显著差异,LDH的释放也没有增多,说明高糖带给细胞的毒性不是由于培养基高渗透势造成的,见图1。

Figure 1.High glucose-induced cytotoxicity in primary hepatocytes isolated from high-fat diet fed mice. Oil red O staining for hepatocytes isolated from chow (A) or high-fat (B) diet fed mice (×200). The cell viability (C) and LDH release (D) were assessed. Mean±SEM.n=4.*P<0.05vscontrol group.
图1 高糖对脂肪变性肝细胞的影响
2 高糖促进细胞凋亡
为明确高糖能否引起脂肪变性肝细胞凋亡,我们利用Hoechst 33258对细胞核进行了染色。高糖组出现了较多的染色质着色亮斑。统计结果显示,高糖组细胞的凋亡率显著高于对照组和甘露醇组(P<0.05),见图2。
3 高糖对细胞线粒体膜电位的影响
正常细胞线粒体膜电位较高,结合的JC-1探针发出红色荧光,当线粒体膜去极化以后,电位降低,绿色荧光增强[5]。合并的荧光图显示,高糖组细胞的红色荧光要弱于对照组和甘露醇组。进一步用荧光酶标仪测定结果确认,高糖处理使细胞线粒体红色荧光与绿色荧光的比值显著降低(P<0.05),说明线粒体膜电位降低,膜的完整性受到破坏,见图3。
4 高糖对细胞凋亡蛋白酶活性的影响
各组细胞感受外源性凋亡信号的caspase-8活性相当,而内源性凋亡途径,即线粒体介导凋亡关键酶caspase-9和caspase-3活性在高糖组有显著升高,见图4。
5 高糖对线粒体介导细胞凋亡相关信号通路的影响
利用Western blotting 技术检测细胞胞浆和线粒体内的细胞色素C相对浓度,可见高糖组细胞线粒体内细胞色素C的浓度仅相当于对照组的39%,而在细胞质中则有显著升高(P<0.01),提示由于线粒体膜完整性受到破坏,线粒体大量的细胞色素C释放到细胞质。与对照细胞相比,高糖组细胞胞浆内促凋亡蛋白Bax的表达量显著升高(P<0.01),相应的2个抑制凋亡蛋白Bcl-2和Bcl-xL的表达量明显降低,见图5。
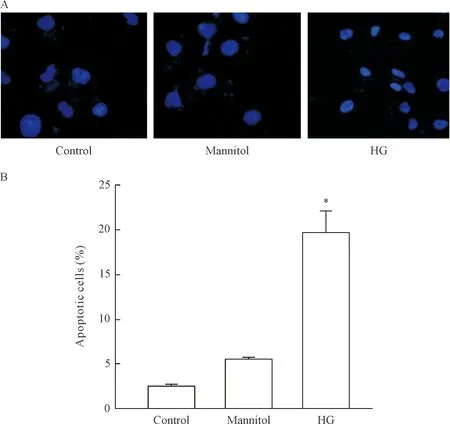
Figure 2.High glucose-induced apoptosis in primary hepatocytes. A: the cells were stained with Hoechst 33258 and visualized on a fluorescent microscope to observe chromatin condensation(×200); B: the apoptotic cells were counted based on morphology, and the number of apoptotic cells was expressed as percentage of total cells. Mean±SEM.n=3.*P<0.05vscontrol group.
图2 高糖诱导脂肪变性肝细胞凋亡

Figure 3.High glucose-induced mitochondrial membrane depolarization in primary hepatocytes. A: the cells were stained with JC-1 and visualized on an inverted fluorescence microscope (×200). Red fluorescence of JC-1 dimers was present in the cell areas with high mitochondrial membrane potential, while green fluorescence of JC-1 monomers was prevalent in the cell areas with low mitochondrial membrane potential. B: the ratio of red/green fluorescence intensity. Mean±SEM.n=3.*P<0.05vscontrol group.
图3 高糖使脂肪变性肝细胞线粒体膜电位降低
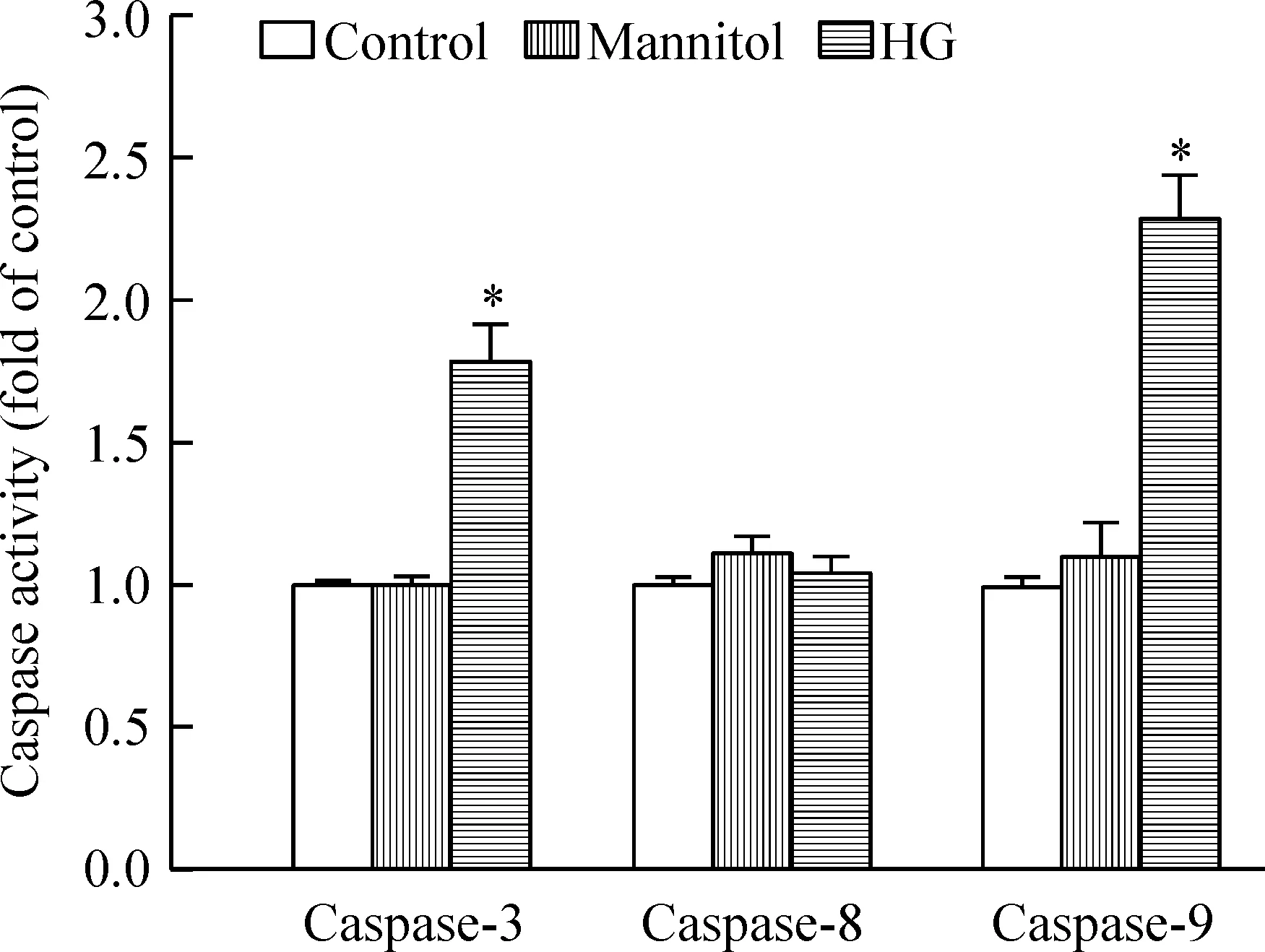
Figure 4.The effect of high-glucose treatment on enzymatic activities of caspases in primary hepatocytes. Aliquots of cell lysate (50 μg protein) were assayed forinvitrocaspase-3, -8, and -9 activity using DEVD-pNA, IETD-pNA, and LEHD-pNA as substrates respectively. Mean±SEM.n=3.*P<0.05vscontrol group.
图4 高糖对细胞凋亡蛋白酶活性的影响
讨 论
高血糖是糖尿病的典型病征,会引起肾病、视网膜病变和神经损伤等多种并发症。实际上,肝脏是糖代谢的主要器官,高糖引起的肝损伤也应当受到高度重视。Wanless等[6]对351名NAFLD患者的肝脏标本进行病理分析后发现,血糖正常组NASH比例为4.7%,而2型糖尿病组NASH比例升高至12.2%。对NASH患者的追踪研究进一步证实,长期高血糖会加速肝纤维化进程[7]。Yin等[8]给高脂喂养小鼠每天腹腔注射葡萄糖诱发血糖波动,发现会加剧小鼠肝脏炎症反应和肝细胞凋亡。之前也有关于高糖促使肝细胞凋亡的体外实验研究报道,但多是选用永生化的细胞系或普通饲料喂养小鼠的原代肝细胞,并且采用了更高的葡萄糖浓度(≥40 μmol/L)[9-10]。本研究利用高脂喂养小鼠的原代肝细胞作为实验模型,采用较为接近糖尿病患者血糖水平的葡萄糖浓度,能够更好地模仿体内环境。对细胞进行12 h高糖孵育处理,发现会引起线粒体功能障碍,天冬氨酸蛋白水解酶caspase-9和caspase-3活性显著升高,导致细胞凋亡,提示脂肪变性细胞可能对高糖应激更为敏感。为排除渗透势对细胞的不利影响,我们设置了甘露醇处理对照,明确了高糖可以直接促进脂肪变性肝细胞的凋亡。
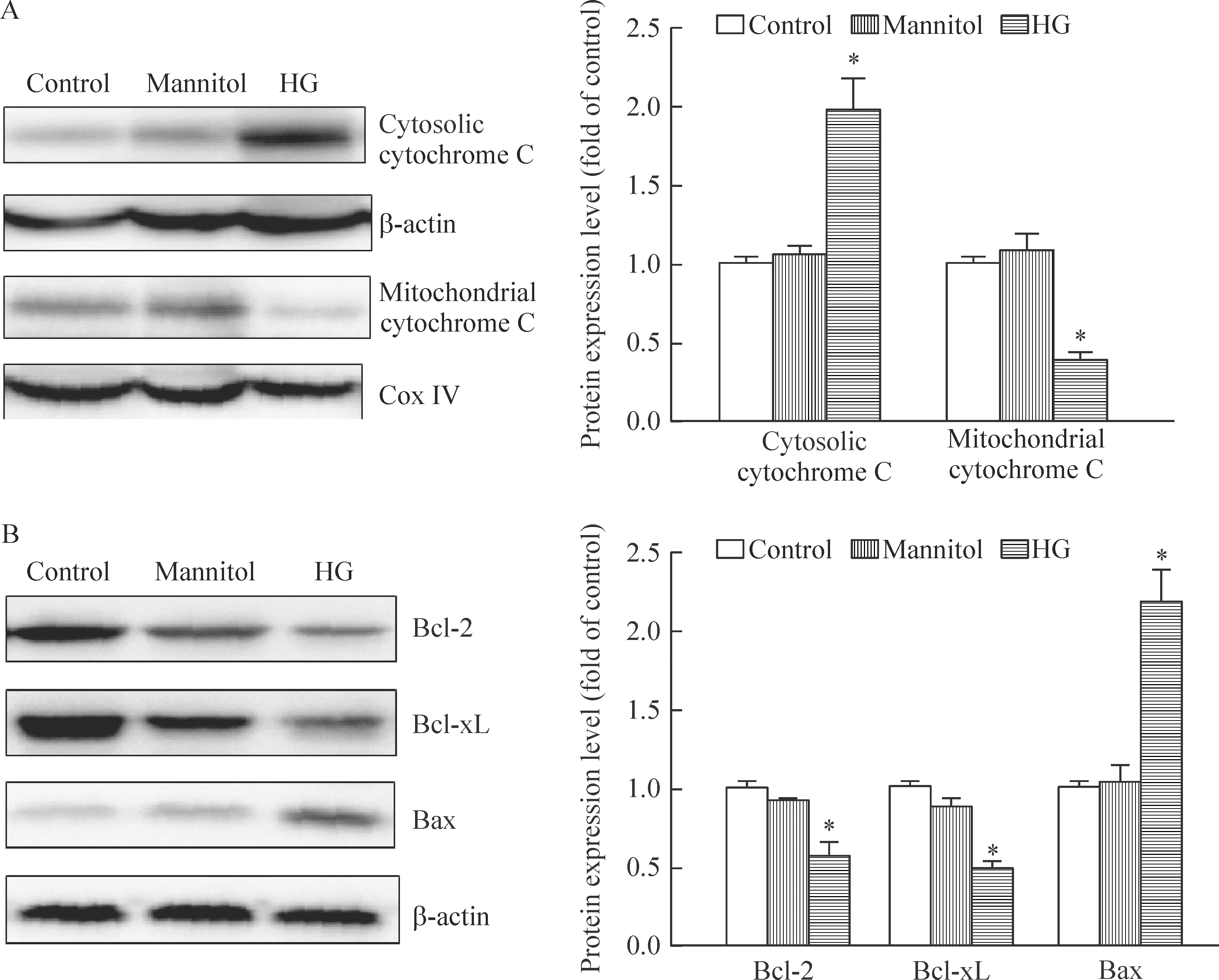
Figure 5.The effects of high-glucose treatment on mitochondria-mediated apoptotic pathways in primary hepatocytes. A: cytosolic and mitochondrial proteins were probed with anti-cytochrome C antibody. β-actin and cytochrome C oxidase (Cox) IV were used as loading controls for the cytosolic and mitochondrial fractions, respectively. B: the cells were lysed and Bcl-2, Bcl-xL, and Bax expression were detected by Western blotting. Representative images and band intensity quantifications were shown. Mean±SEM.n=3.*P<0.05vscontrol group.
图5 高糖对线粒体介导细胞凋亡相关信号通路的影响
细胞凋亡的途径主要包括外源性死亡受体途径和内源性线粒体细胞色素C释放途径,前者是通过胞外信号激活细胞内的凋亡酶caspase-8,后者是指细胞应激反应或凋亡信号引起线粒体细胞色素C释放,作为凋亡诱导因子,细胞色素C能与Apaf-1、caspase-9前体、ATP/dATP形成凋亡体,然后募集并激活caspase-3,进而引发细胞凋亡[11]。本研究发现,高糖条件下细胞的去极化比例显著升高,标志着线粒体膜电位的下降,这与之前的研究报道相一致[5, 12]。此外,细胞线粒体向胞浆释放的细胞色素C增多,caspase-3活性升高,下游的促凋亡蛋白Bax表达水平升高,而抑制凋亡蛋白Bcl-2和Bcl-xL的表达量明显降低,caspase-8活性没有明显变化,说明高糖应激是通过线粒体介导的内源性凋亡途径诱发脂肪变性肝细胞凋亡的。
综上所述,高糖应激会导致脂肪变性肝细胞线粒体膜电位下降,启动线粒体介导的内源性凋亡途径,引起肝细胞凋亡,线粒体功能障碍可能是高血糖加速NAFLD病程进展的一个重要原因。
[1] Levene AP, Goldin RD. The epidemiology, pathogenesis and histopathology of fatty liver disease[J]. Histopathology, 2012, 61(2):141-152.
[2] Smith BW, Adams LA. Nonalcoholic fatty liver disease and diabetes mellitus: pathogenesis and treatment [J]. Nat Rev Endocrinol, 2011, 7(8):456-465.
[3] Dey A, Swaminathan K. Hyperglycemia-induced mitochondrial alterations in liver[J]. Life Sci, 2010, 87(7-8):197-214.
[4] Li WC, Ralphs KL, Tosh D. Isolation and culture of adult mouse hepatocytes[J]. Methods Mol Biol, 2010, 633(1):185-196.
[5] Kim WH, Lee JW, Suh YH, et al. Exposure to chronic high glucose induces beta-cell apoptosis through decreased interaction of glucokinase with mitochondria: downregulation of glucokinase in pancreatic beta-cells[J]. Diabetes, 2005, 54(9):2602-2611.
[6] Wanless IR, Lentz JS. Fatty liver hepatitis (steatohepatitis) and obesity: an autopsy study with analysis of risk factors[J]. Hepatology, 1990, 12(5): 1106-1110.
[7] Adams LA, Sanderson S, Lindor KD, et al. The histological course of nonalcoholic fatty liver disease: a longitudinal study of 103 patients with sequential liver biopsies[J]. J Hepatol, 2005, 42(1):132-138.
[8] Yin X, Zheng F, Pan Q, et al. Glucose fluctuation increased hepatocyte apoptosis under lipotoxicity and the involvement of mitochondrial permeability transition opening[J]. J Mol Endocrinol, 2015, 55(3):169-181.
[9] Chandrasekaran K, Swaminathan K, Chatterjee S, et al. Apoptosis in HepG2 cells exposed to high glucose [J]. Toxicol In Vitro, 2010, 24(2):387-396.
[10]Kapoor R, Rizvi F, Kakkar P. Naringenin prevents high glucose-induced mitochondria-mediated apoptosis involving AIF, Endo-G and caspases[J]. Apoptosis, 2013, 18(1): 9-27.
[11]Alkhouri N, Carter-Kent C, Feldstein AE. Apoptosis in nonalcoholic fatty liver disease: diagnostic and therapeutic implications[J]. Expert Rev Gastroenterol Hepatol, 2011, 5(2):201-212.
[12]Russell JW, Golovoy D, Vincent AM, et al. High glucose-induced oxidative stress and mitochondrial dysfunction in neurons[J]. FASEB J, 2002, 16(13): 1738-1748.
(责任编辑: 陈妙玲, 余小慧)
Mitochondrial mechanism of hyperglycemia-induced apoptosis in primary mouse hepatocytes with steatosis
TANG Hui1, XIAO Zi-jun1, JIANG Xin-wei2, GUO Hong-hui1
(1HenryFokSchoolofFoodScienceandEngineering,ShaoguanUniversity,Shaoguan512005,China;2SchoolofPublicHealth,SunYat-senUniversity,Guangzhou510080,China.E-mail:guohh1999@163.com)
AIM: To investigate the role of high glucose in primary hepatocytes of mice fed with a high fat diet.METHODS: Male C57BL/6J mice were fed a high fat (45% of calories) dietadlibitumfor 6 weeks to induce hepatic steatosis. Primary hepatocytes were isolated from the mouse liver by the 2 step collagenase perfusion method. The cells were incubated in low glucose (5 mmol/L), low glucose plus mannitol (30 mmol/L), or high glucose (35 mmol/L) DMEM medium for 12 h. The cell viability, apoptosis, mitochondrial membrane potential, and caspase enzymatic activities were measured. Furthermore, proteins related to the stress-sensitive signaling pathway of regulating high glucose-induced apoptosis in primary hepatocytes were determined by Western blotting.RESULTS: Incubation with 35 mmol/L glucose resulted in a significant decrease in cell viability and an increase in apoptosis, whereas mannitol had no significant effect on the cell viability or apoptosis. A progressive depolarization of the mitochondria, an increase in cytosol cytochrome C and a dramatic decrease in mitochondrial cytochrome C in high-glucose stressed hepatocytes were observed. The enzymatic activities of caspase-9 and caspase-3, but not caspase-8, were significantly increased in high glucose-stressed hepatocytes (P<0.05). High glucose treatment suppressed the expression of Bcl-2 and Bcl-xL, while it increased the expression of the pro-apoptotic factor Bax.CONCLUSION: High glucose stress reduces mitochondrial membrane potential, initiates mitochondria-mediated apoptotic pathways and promotes apoptosis of hepatocytes with steatosis. This may be an important pathological mechanism of hyperglycemia-induced progression of nonalcoholic fatty liver disease.
Hepatocyte; Mitochondria; High glucose stress; Apoptosis; Nonalcoholic fatty liver disease
1000- 4718(2016)08- 1419- 06
2016- 01- 26
2016- 05- 23
国家自然科学基金资助项目(No. 81372994);广东省扬帆计划高层次人才项目(No. 201434015)
R363.2; R575
A
10.3969/j.issn.1000- 4718.2016.08.013
杂志网址: http://www.cjpp.net
△通讯作者 Tel: 0751-8120167; E-mail: guohh1999@163.com

