甲硝唑口含片的含量测定
吴琼 王丹 杜利月 徐振兴

摘 要: 目的:建立甲硝唑口含片含量的测定方法。方法:采用紫外分光光度法测定甲硝唑口含片的含量,以稀盐酸(9→1000)为对照,在277nm波长测定吸光度,计算甲硝唑的含量。结果:甲硝唑在10.44~
含量实验是评价口服固体制剂内在质量的一种必要手段,对保证药物能从制剂中顺利溶出而发挥疗效起到十分重要的作用,也是新药评审的重要依据[1]。甲硝唑(Metronidazole,MNZ)是在20世纪50年代末人工合成的硝基咪唑类药物,作为治疗厌氧菌的重要药物,目前上市有普通片剂、泡腾片、注射液、栓剂、胶囊剂等制剂用于临床疾病的治疗[2]。但尚未见有甲硝唑口含片上市,为了方便口腔厌氧菌感染的患者用药和疾病的治疗,丰富MNZ的制剂,笔者采用矫味制剂技术,将甲硝唑原料制备成了甲硝唑口含片[3]。笔者参考相关文献[4-8],采用紫外分光光度法,测定了甲硝唑口含片含量,并通过方法学验证了含量测定方法科学性。
关键词: 甲硝唑口含片 含量 测定
中图分类号:R943 文献标识码:A 文章编号:1003-9082(2016)05-0282-01
一、材料
1.仪器 Carry-100紫外可见分光光度计(美国瓦里安仪器有限公司);ZPY1036型旋转式压片机(上海天祺制药机械有限公司);DZF-6020真空干燥箱(上海基玮试验仪器设备有限公司);TE214S型电子分析天平(德国赛多利斯)。
2.药品与试剂 甲硝唑对照品(中国药品生物制品检定所,批号:090806,纯度:99.90%);甲硝唑原料(宜昌长江药业有限公司,批号:20140162);甲硝唑口含片(自制,规格:100mg/片);其他试剂均为分析纯。
二、方法与结果
1.甲硝唑口含片的制备 参照杜利月[3]“甲硝唑口含片制备工艺研究”中制备甲硝唑口含片,取甲硝唑原料和辅料分别粉碎,过100目筛,备用。按处方量称取已粉碎好的甲硝唑200g,蔗糖40g,甘露醇10g,阿斯巴甜20g,混合均匀后加入适量的蒸馏水制软材,20目筛制湿颗粒,60℃减压干燥,16目筛整粒,边搅拌边喷入柠檬香精,密封保存24h,再将其置于混合机中,加入干颗粒重量0.2%的羧甲基淀粉钠和0.5%的硬脂酸镁,混匀后,测定含量,计算片重,压片,备用。重复制备三批,批号编订为:20150501、20150502、20150503。
2.测定波长的选择 精密称取120℃干燥至恒重的甲硝唑对照品26.1mg置于50ml容量瓶中,以0.1mol/L盐酸使其溶解并稀释至刻度,摇匀,即得1 ml含甲硝唑对照品522.0μg的对照品标准溶液。精密量取上述甲硝唑标准溶液2.5ml置于25ml容量瓶中,以0.1mol/L盐酸溶液稀释至刻度,摇匀作为测试液,以溶剂作为空白对照,采用瓦里安Carry-100紫外分光光度计在200~800nm范围内进行扫描,确定最大吸收波长[4,5]。甲硝唑对照品的扫描图见图1。由图可知,甲硝唑在277nm波长处有最大吸收。
图1 甲硝唑对照品紫外吸收扫描图
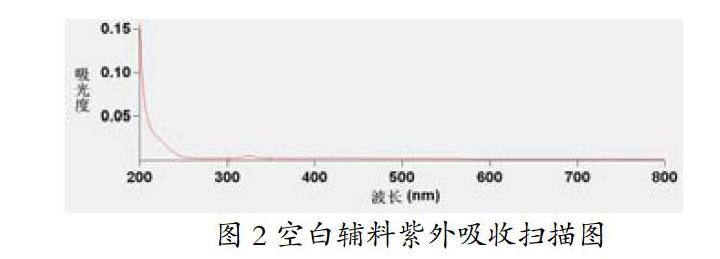
3.干扰性试验 分别按处方比例取辅料加入蒸馏水(润湿剂)适量制备成软材,制湿颗粒,干燥,整粒,加柠檬香精,密闭24h,加入羧甲基淀粉钠和硬脂酸镁混合均匀,压片,制备成不含甲硝唑的空白样品片,备用。以稀盐酸(9→1000)为溶剂、转速为100r/min测定含量。在溶出60min时,取样5ml,滤过,取2ml续滤液置于适宜的容量瓶中,加稀盐酸(9→1000)稀释适宜倍数,备用。取上述混合液,在200~800 nm的波长范围内进行扫描[5,6]。结果表明在制备甲硝唑口含片过程中加入的辅料不干扰在277 nm波长处测定本品的含量,详见图2。
图2 空白辅料紫外吸收扫描图
4.线性关系考察 精密量取本章节“2.2测定波长的选择”项下制备的标准溶液0.5、1.0、1.5、2.0、2.5、3.0ml于25ml容量瓶中,以0.1mol/L盐酸溶液定容,测定吸光度(A),将浓度(C)对吸光度(A)进行线性回归,得:A=5.554×10-3C + 25.377×10-2,相關系数r=0.9995。回归方程在研究的浓度范围10.44~62.64μg/ml,线性关系良好[6]。
5.精密度试验 连续测定“2.4线性关系考察”项下41.76μg/ml的溶液的吸光度,测定6次的平均吸光度为0.35(RSD为0.41%,n=6),表明方法精密度好。
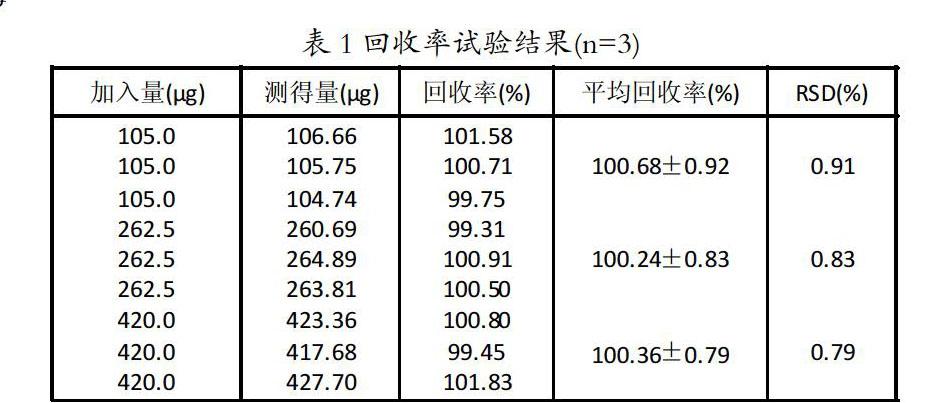
6.回收率试验 精密称定甲硝唑对照品适量,按照处方比加入一定的辅料和盐酸(9→1000),摇匀,配置成高、中、低三种不同浓度的甲硝唑对照品溶液,每种浓度平行配置三份,样品过滤后,在最大波长处测定吸光度,计算回收率[7],结果见表1。
表1回收率试验结果(n=3)
7.稳定性试验 取同一批甲硝唑口含片(批号:20150503)粉末适量,加稀盐酸(9→1000)稀释至适宜倍数,摇匀备用。以稀盐酸(9→1000)为对照,在0、2、4、6、8、10、12h时,取样在最大吸收波长处测定吸光度[5,7-8]。结果显示,甲硝唑在溶出液介质中放置0~8h时吸光度(RSD为0.19%,n=15)基本稳定不变,其在8h之内的稳定性较好。
8.样品的含量测定 分别取三批自制甲硝唑口含片粉末适量,每批取6个样,加稀盐酸(9→1000)稀释至适宜倍数,摇匀,以稀盐酸(9→1000)为对照,在277nm波长处测定吸光度[5,7-8]。三批甲硝唑口含片的测定结果分别为:(99.4±0.22)%(RSD为0.21%,n=6)、(99.9±0.26)% (RSD为0.25%,n=6)、(100.4±0.18)% (RSD为0.23%,n=6)。
三、讨论
此种含量测定方法可以简单、快速的测定出甲硝唑口含片中主药含量,适合于小批量多批次生产时的快速含量测定,含量的成本低,不但设备操作简单易上手,而且相对于高效液相色普法测定含量的设备的投入较少。但是此种含量的定的方法有利于节约生产企业的生产成本。此外,本课题组参照中国药典中甲硝唑片含量测定方法[2],考察了多种含量测定方法的方法学验证,包括检测波长、精密度、回收率、线性方程、干扰实验、稳定性等,优化了甲硝唑口含片含量的测定方法。
综上所述,本试验建立的甲硝唑口含片测定方法科学合理、简便易行、结果准确,可用于甲硝唑口含片的含量测定。
参考文献
[1]王翼,缪娅妮,詹长娟,等. 尼群地平片在不同介质中的溶出度比较[J]. 医药导报,2014,33(12):1639-1641.
[2]國家药典委员会.中华人民共和国药典:二部[S].2010年版.北京:中国医药科技出版社,2010:153-157、附录XC.
[3]杜利月.甲硝唑口含片制备工艺研究[J].中国医药导报,2010,7(3):58-59.
[4]Ibrahim F1, El-Enany N, El-Shaheny RN, Development and Validation of a New HPLC Method for the Simultaneous Determination of Paracetamol, Ascorbic Acid, and Pseudoephedrine HCl in their Co-formulated Tablets. Application to in vitro Dissolution Testing [J]. Anal Sci. 2015,31(9):943-947.
[5]许会,汤卫国,黄春玉,等. HPLC法测定复方氨氯地平缬沙坦氢氯噻嗪片剂溶出度[J]. 药物分析杂志,2015,35(1):46-51.
[6]胡庆梅,彭红,程青正.对氯苯氧异丁酸甲氧基苯丙烯酸酯胶囊的溶出度测定[J].中国药房,2014,25(13):1207-1209.
[7]Momin MM, Kane S, Abhang P. Formulation and evaluation of bilayer tablet for bimodal release of venlafaxine hydrochloride [J]. Front Pharmacol, 2015,6:144.
[8]许婷婷,王宏响,季金玉,等. 复方硫酸氢氯吡格雷阿司匹林双层片的制备和溶出度测定[J]. 沈阳药科大学学报,2015,32(2):85-91.

